Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ingeniería química
versión impresa ISSN 1665-2738
Rev. Mex. Ing. Quím vol.10 no.1 Ciudad de México abr. 2011
Materiales
Síntesis de zeolita NaP–GIS, con diferentes morfologías a partir de dos diatomitas
Synthesis of zeolites NaP–GIS, with different morphologies, from two diatomites
V. Sanhueza*, U. Kelm y G. Alfaro
Instituto de Geología Económica Aplicada, CEA. Edmundo Larenas s/n. Universidad de Concepción–Concepción. Chile. *Autora para la correspondencia. E–mail: vsanhuez@udec.cl Tel. (56–41) 20 48 55
Recibido 8 de Agosto de 2010.
Aceptado 17 de Enero de 2011.
Resumen
El presente trabajo tuvo por objetivo evaluar la reactividad de dos muestras de diatomitas, representativas de dos ambientes geológicos (Quiquel y Terao), localizados en la isla de Chiloé, sur de Chile, en la síntesis de la zeolita NaP–GIS. Esta zeolita cristalizó, con diferentes morfologías, desde los geles preparados a partir de tales diatomitas. Los geles presentaban la siguiente composición química: Na2O= 0.87; Al2O3 = 1.0; SiO2= 8.7; BCTA= 0.87; H2O= 217.5. La síntesis se realizó en condiciones hidrotermales, a 110°C y presión autógena. La activación se llevó a cabo con NaOH, en presencia de bromuro de cetiltrimetilamonio (BCTA). Los cristales de la zeolita NaP–GIS, sintetizados, a partir del gel de la diatomita de Quiquel, constituyen principalmente agregados de cristales aplanados y los sintetizados, a partir del gel de la diatomita de Terao, presentan una morfología con tendencia triangular. Los sólidos obtenidos fueron identificados por Difracción de rayos–X (DRX) y caracterizados por Microscopía electrónica de barrido (MEB) y Espectrometría de energía dispersiva de rayos–X (EDS).
Palabras clave: NaP, GIS, zeolita, diatomita, síntesis.
Abstract
The aim of the present paper was to evaluate the reactivity of two diatomites samples, representative of two distinct geological environments (Quiquel and Terao), localized in the Chiloé Island, southern Chile in the synthesis of the NaP–GIS zeolite. This zeolite crystallized with different morphologies from gels prepared from the diatomites. The analyzed gels had the following chemical composition: Na2O= 0.87; Αl2O3= 1.0; SiO2= 8.7; BCTA= 0.87: H2O= 217.5. The synthesis was carried out under hydrothermal conditions, at 110°C and autogenic pressure. The activation was done with NaOH in presence of cetiltrimetilamonium bromide (CTAB). The zeolite NaP–GIS crystals, synthesized from the Quiquel diatomite gel, are mainly bladed aggregated crystals and those crystallized from the Terao diatomite gel exhibit a triangular like morphology. The synthesized solids were identified by X–ray diffraction (XRD) and characterized by scanning electron microscopy– energy dispersive X–ray spectroscopy (SEM–EDS).
Keywords: NaP, Gismondine, zeolite, diatomite, synthesis.
1 Introducción
El interés por la zeolita NaP y la de su análoga natural, la gismondina, está basado en su excelente capacidad de intercambio iónico, debido a su flexibilidad estructural Nery y col. (2003). Barrer y col. (1959) reportaron que la zeolita NaP tiene tres polimorfos: el pseudocúbico (NaPl), el ortorrómbico (NaP2) y el tetragonal (NaPt). La relación entre la estructura del cristal y la composición química en la zeolita NaP–GIS fue demostrada por Hansen y col. (1993). Ellos sugieren la existencia de tres fases de NaP: una baja en sílice (Pl), que contiene de 8–10 átomos de Si por celda unitaria, una fase media en sílice (P2), ortorrómbica, con 10–12 átomos de Si por celda unitaria y una tetragonal, alta en sílice, con 12–13 átomos de Si por celda unitaria. Esta clasificación de baja, media y alta en sílice de la zeolita NaP es suficiente para describir las ocho variedades de NaP reportada por Beard (1971). También se ha obtenido en la forma calcica, CaP, con una estructura altamente cristalina a partir de aluminato y silicato de sodio Albert y col. (1998).
Se han obtenido varias zeolitas sódicas tales como Na–Pl, analcima, cancrinita e hidroxisodalita a partir de diatomitas naturales y diatomitas modificadas (Chaisena y Rangsriwatananon, 2005; Rangsriwatananon y Chaisena, 2008). Zeolita A se obtuvo desde diatomita calcinada en el rango de temperatura entre 90–100° C en tiempo de reacción entre 8–52 h Ghosh y col. (1994). Jia y col. (2008) zeolitizaron diatomita Aldrich (Celatom FW80) utilizando nanoprecursores de zeolita los cuales fueron depositados sobre la superficie de la diatomita. (Wajima y col., 2006) utilizaron lodo de papel y diatomita como fuente de sílice en la síntesis de zeolitas Na–Pl (Si/Al = 1.67), obteniendo cristales con morfología con tendencia triangular. Con el objeto de disolver la sílice amorfa, en todos los casos, fue necesario tratar, previamente, la diatomita con una solución de NaOH 3M, a 90° C durante 1 h. Wang y col. (2002) demostraron la efectividad del proceso de transporte de la fase–vapor en la zeolitización de diatomita natural, usando nanocristales de semillas de zeolita. Además, aprovechando la uniformidad de los esqueletos de diatomitas utilizaron éstos como plantillas. También se ha utilizado la diatomita natural como fuente de silicio en la síntesis de un silicato sódico hidratado, magadiite, que tiene aplicación como intercambiador iónico, en procesos que no solo involucran a las zeolitas Wang y col. (2009).
Motivado por los buenos resultados obtenidos en la síntesis de las zeolitas ZSM–5 y mordenita y el material mesoporoso MCM–41 (Patentes Sanhueza y col., 2004; 2006; 2009), utilizando como materia prima diatomita de la localidad de Litueche Chile (34º07' S; 71º44' O), se propuso investigar el uso de diatomitas como fuente de silicio de dos muestras de diatomitas, representativas de dos ambientes geológicos diferentes (Quiquel y Terao), localizados en la Isla Chiloé, al sur de Chile.
2 Materiales
Las muestras de diatomitas contienen entre un 55–70% de agua. Las muestras secas están compuestas de caparazones de diatomitas y algunos fragmentos de minerales. La composición química, expresada en porcentaje en peso, de las diatomitas usadas en los experimentos como materias primas, es mostrada en la Tabla 1. La diatomita de Quiquel presenta una superficie específica (BET) de 94 m2g–1 y la diatomita de Terao 11 m 2g–1. La razón molar SiO2/Al2O3 de la diatomita de Quiquel es 5.7 y la de la diatomita de Terao es 5.4. NaOH Merck N° 106498, Na2SiO3 Sigma N°S–3514 fue utilizado para ajuste de la razón molar SiO2/Al2O3.
3 Metodología
Las diatomitas fueron molidas a malla 30 y secadas a 105°C por 15 h. Las reacciones hidrotermales se realizaron a presión autógena en un reactor Parr a 110°C y la variable estudiada fue el tiempo de reacción (5, 24 y 30 h). La solución en el gel inicial de reacción fue ajustada a la siguiente composición molar: Na2O= 0.87: Al2O3 = 1.0; SiO2= 8.7; BCTA= 0.87; Η2O= 217.5. Después de finalizado el tiempo de reacción, los sólidos obtenidos fueron lavados hasta pH 8,0–8,5 y, posteriormente, secados a 120°C durante 15 h como mínimo. La calcinación de los sólidos se realizó en una atmósfera de nitrógeno, a 540° C, durante 1 h y luego en aire sintético. La zeolita NaP fue identificada por DRX, usando un difractómetro Rigaku Geigerflex con goniómetro horizontal. Radiación CuKα fue empleada con filtro de níquel. La morfología de los sólidos fue observada con un microscopio electrónico de barrido JEOL JMS 6380 LV con EDS. Antes del montaje, las muestras fueron dispersadas por ultrasonido en una solución al 40% agua/etanol. La superficie específica fue calculada usando la teoría BET (Brunauer–Emmett–Teller) usando nitrógeno como gas en el proceso de adsorción. Las muestras fueron desgasificadas a 350°C durante 3 h. Los ensayos se realizaron con un equipo Micromeritics TriStar II.
4 Resultados y discusión
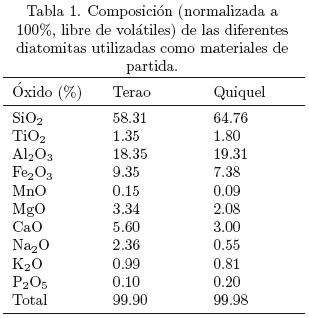
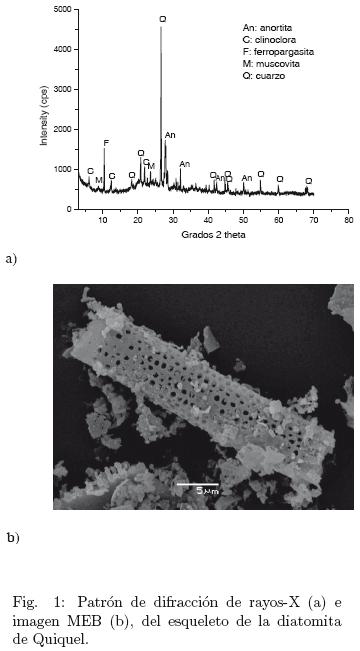
Las figs. 1 y 2 muestran los espectros de DRX e imágenes de los esqueletos de las diatomitas de Quiquel y Terao usadas en los experimentos, respectivamente. Ambos tipos de diatomitas contienen cuarzo (ICDD N° 46–1045), ferropargasita (ICDD N° 26–1372) y anortita (ICDD N° 18–1202). La diatomita de Quiquel contiene además, clinoclora (ICDD N° 46–1323) y moscovita (ICDD N° 07–0025) y la diatomita de Terao tiene albita (ICDD N° 19–1184). La Fig. 3 muestra el difractograma de rayos X de los sólidos 1, 2 y 3 (5, 24 y 30 h de reacción, respectivamente) obtenidos en los experimentos con la diatomita de Quiquel. Las zeolitas hidroxisodalita (ICDD N° 31–1271) y NaP (ICDD N° 39–0219) están presentes a las 5 h de reacción también lo están la ferropargasita y cuarzo. A medida que aumenta el tiempo (24 h de reacción) continúa la desaparición de hidroxisodalita favoreciendo la cristalización de la zeolita NaP, fase mayoritaria a las 30 horas de reacción. La Fig. 4 muestra los difractogramas de rayos X de los sólidos que resultaron de los experimentos 1, 2 y 3 llevados a cabo con la diatomita de Terao. Después de 5 h de reacción hay indicaciones de la cristalización de la zeolita NaP junto a ferropargasita, anortita y cuarzo. La cantidad de zeolita se incrementa con el tiempo de reacción permaneciendo hasta el final (30 h de reacción) la anortita, ferropargasita y cuarzo. Este último, (Rangsriwatananon y col., 2008) también lo señalan como un mineral que a veces puede no involucrarse en el proceso de síntesis. La Fig. 5a muestra cristales de hidroxisodalita, la cual presenta una morfología esferoidal y agregados irregulares de cristales aplanados de NaP, ésta última visible en la parte baja de la figura. A medida que el tiempo de reacción aumenta (Fig. 5b), se aprecian principalmente agregados de cristales de la zeolita NaP. Estos últimos se manifiestan en gran mayoría en la Fig 5c. Se redujo la cristalización de NaP como muestra la Fig. 5d. En la Fig. 5e es posible visualizar cristales de la zeolita NaP con tendencia a una morfología triangular. Abundantes cristales con la última tendencia se observan mejor en la Fig. 5f. Se postula que las diferentes morfologías exhibidas por la zeolita NaP son causadas por la incorporación de diferentes cantidades de aluminio en la estructura de la zeolita. Los cristales observados en la Fig. 5c tienen una relación nSi/nAl= 1,74 (Vinu y col., 2008) reportan un fenómeno similar en materiales mesoporosos (zeolitas con tamaño de poro entre 20 y 500 Á). De acuerdo a estos autores, variando la cantidad de aluminio en la estructura silícica del material A1SBA–15 es posible obtener morfologías diferentes de los cristales. Esto podría demostrar que, aunque todos los experimentos se llevaron a cabo con geles inicial de reacción de igual composición, la morfología de los cristales obtenidos con las diatomitas de Quiquel y de Terao son totalmente diferentes. Dependiendo de la razón M2O/S1O2 en la mezcla de reacción iones silicatados de diferentes grados de oligomerización pueden aparecer Giannetto y col. (2000). Por lo tanto, el grado de incorporación de Si en la estructura zeolítica podría no ser igual con ambas diatomitas, ya que la razón M2O/SiO2 (M = metal) es diferente en cada una de ellas.


Las zeolitas de las figs. 5c y 5f presentan una superficie específica de 25,40 y 24,56 m2g_1 y volumen de poro total 0.0356 y 0.0410 cm3g_1, respectivamente. Esta porosidad es baja, la zeolita NaPl (su forma ideal presenta canales de 0.31 x 0.44 nm y 0.28 x 0.49 nm), es probable que estos resultados estén influenciados por la dimensión de la molécula de N2 (0.36 nm) reduciendo el proceso de adsorción del nitrógeno en las muestras. Derkowski y col. (2006) reportan la síntesis de la zeolita NaP con una superficie específica de 39.00 m2g_1 (usaron Ar como gas de adsorción), obtenida a partir de ceniza volante proveniente de la combustión carbón. La diferencia en la superficie específica de las diatomitas, 94 y 11 m2g_1, al parecer no ha tenido incidencia en la superficie específica de los materiales obtenidos, en ambos casos de aproximadamente 25 m2g–1.
Conclusiones
Se sintetizó la zeolita NaP–GIS con diferentes morfologías. Fue sintetizada, hidrotermalmente, a partir de 2 diatomitas procedentes del sur de Chile. Una que corresponde a agregados de cristales planos con una relación nSi/nAl = 1.74 y la otra con los cristales con tendencia a una morfología triangular con una relación nSi/nAl = 1.40. Esto permite pensar que se favorecería la capacidad de retención de elementos contaminantes, por ejemplo en aguas residuales, sobretodo en ésta última. El coste de síntesis ha sido reducido para el uso en el campo industrial y amplía la utilización comercial de la diatomita.
Agradecimientos
Esta investigación fue financiada por el proyecto DIUC N◦204.320.014–1.0 de la Dirección de Investigación de la Universidad de Concepción. También se agradece el soporte financiero dado por el Instituto GEA de la Universidad de Concepción y la colaboración del Dr. Leopoldo López–Escobar (Instituto GEA) y Dra. Karina Langue (Departamento de Oceanografía). Los autores también agradecen la colaboración de Mónica Uribe por los análisis de DRX y al Laboratorio de Microscopía Electrónica de la Dirección de Investigación de la Universidad de Concepción.
Referencias
Albert, BR., Cheetham AK. y Adams CJ. (1998). Investigations on P zeolites: synthesis and structure of the gismondine analogue, highly crystalline low–silica CaP. Microporous and Mesoporous Materials 21, 127–132. [ Links ]
Barrer, RM., Baynham, JW., Bultitude, FW. y Meier WM. (1959). Hydrothermal chemistry of the silicates. Part VIII. Low temperature growth of aluminosilicates, and of some gallium and germanium analogues. Journal of the Chemical Society 195–208. [ Links ]
Beard, W.C. (1971). Linde Type B zeolites and related mineral and synthetic phases. En: Molecular Sieve Zeolites I, (Adv. Chem. Ser 101 ed), Pp 237–249. [ Links ]
Chaisena, A. y Rangsriwatananon, K. (2005). Synthesis of sodium zeolites from natural and modified diatomite. Materials Letters 59(12), 1474–1479. [ Links ]
Giannetto, G. (2000). Principales factores que intervienen en la síntesis de zeolitas. En: Zeolitas: Características, Propiedades y Aplicaciones Industriales, (G. Giannetto, A. Montes y G. Rodríguez, eds.), Pp. 100–101. Innovación Tecnológica UCV, Caracas. [ Links ]
Ghosh, B., Agrawal, DC. y Bhatia, S. (1994). Synthesis of zeolite a from calcined diatomaceous clay: optimization studies. Industrial & Engineering Chemistry Research 33(9), 2107–2110. [ Links ]
Hansen, S., H˚akansson, U., Landa–Canovas, AR. y Falth, L. (1993). On the crystal chemistry of NaP zeolites. Zeolites 13(4), 276–280. [ Links ]
Jia, Y., Han, W., Xiong, G. y Yang, W. (2008). A method for diatomite zeolitization through steam–assisted crystallization with in–situ seeding. Materials Letters 62, 2400–2403 [ Links ]
Nery, J.G., Mascarenhas, Y.P. y Cheetham, AK. (2003). A study of the highly crystalline, low–silica, fully hydrated zeolite P ion exchanged with (Mn+2, Cd+2, Pb+2, Sr+2, Ba+2) cations. Microporous and Mesoporous Materials 57, 229–248. [ Links ]
Rangsriwatananon, K., Chaisena, A. y Thongkasam, C. (2008). Thermal and acid treatment on natural raw diatomite influencing in synthesis of sodium zeolites. Journal of Porous Materials 15, 499–505. [ Links ]
Sanhueza, V., Kelm, U., Cid, R. (2004). Patente 42218. [ Links ]
Sanhueza, V., Kelm, U., Cid, R. (2006). Patente 43035. [ Links ]
Sanhueza, V., Kelm, U., Cid, R. (2009). Patente 44641. [ Links ]
Sanhueza, V., López–Escobar, L., Kelm, U. y Cid, R. (2006). Synthesis of a mesoporous material from two natural sources. Journal of Chemical Technology and Biotechnology 81, 614–617. [ Links ]
Vinu, A., Justus, J., Anand, C., Sawant, D.P., Ariga, K., Mori, T., Srinivasu, P., Balasubramanian, V., Velmathi, S. y Alam, S. (2008). Hexagonally ordered mesoporous highly acidic AlSBA–15with different morphology: and efficient catalyst for acetylation of aromatics. Microporous and Mesoporous Materials 116, 108–115. [ Links ]
Wajima, T., Hagaa, M., Kuzawa, K., Ishimoto, H., Tamada, O., Ito, K., Nishiyama, T.,Downsd, RT. y Rakovan JF. (2006). Zeolite synthesis from paper sludge ash at low temperature (90◦C) with addition of diatomite. Journal of Hazardous Materials B132, 244–252. [ Links ]
Wang, Y., Shang, Y., Zhu, J., Wu, Jian. y Shouhua, Ji,. (2009). Synthesis of magadiite using a natural diatomite material. Journal of Chemical Technology and Biotechnology 84, 1894–1898. [ Links ]
Wang, Y., Tang, Y., Dong, A., Wang, X., Ren, N. y Gao, Zi. (2002). Zeolitization of diatomite to prepare hierarchical porous zeolite materials through a vapor–phase transport process. Journal of Materials Chemistry 12, 1812–1818. [ Links ]














