Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ingeniería química
versão impressa ISSN 1665-2738
Rev. Mex. Ing. Quím vol.10 no.1 Ciudad de México Abr. 2011
Ingeniería de alimentos
Conservación de nopal verdura 'Milpa Alta' (Opuntia ficus indica Mill.) desespinado en envases con atmósfera modificada
Conservation of cactus stems 'Milpa Alta' (Opuntia ficus indica Mill.) in modified atmosphere packaging
J. Osorio–Córdoba1, C. Pelayo–Zaldívar1*, J.R. Verde–Calvo1, M. Ponce–Valadez2, F. Díaz de León–Sánchez2, E. Bosquez–Molina1 y Ma. E. Rodríguez Huezo3
1 Departamento de Biotecnología, Universidad Autónoma Metropolitana–Iztapalapa. San Rafael Atlixco 186, Colonia Vicentina, México D.F. CP 09340, México. *Autora para la correspondencia. E–mail: cpel@xanum.uam.mx
2 Departamento de Ciencias de la Salud, Universidad Autónoma Metropolitana–Iztapalapa. San Rafael Atlixco 186, Colonia Vicentina, México D.F. CP 09340, México.
3 Tecnológico de Estudios Superiores de Ecatepec Avenida Tecnológico s/n Colonia Valle de Anáhuac CP. 55210 Ecatepec, Edo. de México.
Recibido 11 de Octubre 2010.
Aceptado 14 de Diciembre 2010.
Resumen
Se estudió el efecto del envasado con atmósferas modificadas (EAMs) a 4 °C en la calidad del nopal desespinado variedad Milpa Alta. Se aplicaron atmósferas conteniendo aire, 5 kPa O2 + 4 kPa CO2 y nitrógeno, evaluándose los atributos de calidad y la producción de metabolitos de fermentación durante el almacenamiento. Los resultados indicaron que los nopales tuvieron una reducción significativa de acidez titulable (AT), mientras que la firmeza y el color no tuvieron cambios significativos durante el almacenamiento. La pérdida de peso debida a la transpiración fue mayor en los nopales control (6–8%) que en los conservados en EAMs (0.2–0.8%). Todos los nopales presentaron oscurecimiento de las zonas desespinadas pero el EAM retrasó su aparición y redujo su intensidad. En los nopales en EAM también se encontró un incremento en la producción de acetaldehído y etanol. El EAM con N2 indujo los niveles más bajos de estos metabolitos y conservó una mejor calidad de los nopales 'Milpa Alta' hasta por 20 días.
Palabras clave: calidad, herida, refrigeración, acetaldehído, etanol, cladodios, Milpa Alta.
Abstract
The effect of modified atmosphere packaging (MAP) at 4 °C on the storage life of 'Milpa Alta' cactus stems without spines was studied. Atmospheres containing air, 5 kPa O2 + 4 kPa CO2 and Nitrogen were applied. Quality attributes and the production of fermentation metabolites were evaluated during the storage. Results indicated that 'Milpa Alta' cactus stems had a significant reduction in titratable acidity (TA), but not significant changes were found in firmness and color values in cactus stems during storage. The weight loss was higher in control (6–8 %) than in MAPs stored cactus stems (0.1 to 0.8 %). Control and treated cladodes showed browning symptoms on areas where spines were removed, but MAPs delay the time when they appeared and the damage intensity. Also, cactus stems kept in MAPs showed an increase in acetaldehyde and ethanol production. The MAP with nitrogen induced the lowest levels of fermentation metabolites and preserved the quality of Milpa Alta cactus stems up to 20 days in storage.
Keywords: quality, wounding, refrigeration, acetaldehyde, ethanol, cladodes, cactus stems, Milpa Alta.
1 Introducción
Los nopales (Opuntia spp.) también conocidos como nopal verdura o nopalitos, son consumidos tradicionalmente en México, pero actualmente son demandados por algunas comunidades de los Estados Unidos, Canadá, Japón, Italia y Turquía debido a su bajo valor calórico, alto contenido en fibra y cualidades nutricionales y funcionales (Stintzing y Carie, 2005; Sáenz, 2004). México cuenta con un gran número de especies de nopal, siendo O. ficus–indica la más explotada comercialmente, otras especies como O. streptacantha Lemaire, O. lindhemeiri Engel, O. amyclaea Tenore, O. megacantha Salm–Dick y O. robusta Wendland son importantes como forraje o por su producción de fruta (tuna) (Rodríguez–Felix, 2002). Dentro de O. ficus–indica se encuentra la variedad de nopal verdura Milpa Alta que es una de las más importantes en México por los volúmenes producidos y consumidos (SIAP, 2009).
Los nopales en los primeros estadios de desarrollo presentan un metabolismo C3, el cual cambia al metabolismo ácido de las crasuláceas (CAM) en estados avanzados de desarrollo (Cantwell y col, 1992; Rodríguez, 2009). Los nopales que exhiben el metabolismo CAM presentan cambios en el contenido de ácido málico durante el día, con valores altos en la mañana y más bajos en la tarde, debido a que este ácido se acumula de noche en las vacuolas y en presencia de luz difunde pasivamente de la vacuola al citoplasma, donde es descarboxilado por la enzima málica dependiente de NADP+ y el CO2 así producido ingresa al ciclo de Calvin para la síntesis de carbohidratos (Rodríguez–Félix y Villegas Ochoa, 1998; Corrales–García y Flores–Valdez, 2003; Taiz y Zeiger, 2006). Esto ocasiona que la acidez del nopal fluctúe en el día afectando el sabor, por lo que la cosecha se realiza de 5:00 a 7:00 de la mañana. El corte se efectúa siguiendo el índice propuesto por Rodríguez–Felix y Cantwel (1988) basado en la longitud del cladodio (aproximadamente 20 cm) y número de días de emergencia del brote (35 días) (CODEX STAN 185, 1993). Después de cosechados los nopales, se colocan en canastos, rejas de plástico o se arreglan en forma de pacas cilíndricas para transportarlos al centro de acopio o al mercado de destino; previo a la comercialización se eliminan las espinas junto con pequeñas porciones de tejido y se efectúa el recorte de todo el borde (rebordeado) del cladodio para darle forma. Los nopales así acondicionados deben venderse en menos de tres días para que tengan la calidad adecuada (Rodríguez–Felix y Villegas–Ochoa, 1998).
El daño físico causado durante el procesamiento mínimo del nopal, incrementa procesos metabólicos como la respiración y producción de etileno, la degradación de los lípidos de las membranas, el oscurecimiento oxidativo, la pérdida de firmeza y agua, y la acumulación de metabolitos secundarios, produciendo deterioro y reduciendo la vida de anaquel del producto (Cantwell y col, 1992; Saltveit, 1998). Estos cambios se vuelven más críticos cuando el nopal se comercializa en mercados distantes de la zona de producción. Por lo anterior, después del procesamiento mínimo de los cladodios se recomienda que las superficies cortadas se mantengan limpias y secas, y se almacenen a temperaturas inferiores a 5 °C (Cantwell, 1995), que son las recomendadas para conservar los productos de procesamiento mínimo. Sin embargo, condiciones inferiores a 10 °C causan daño por frío en los nopales, el cual se manifiesta por oscurecimiento y pérdida del color verde original (Ramayo–Ramirez y col, 1978; Nerd y col, 1997). La presencia de los síntomas antes mencionados, así como los cambios en firmeza, el oscurecimiento de las zonas desespinadas, y la producción de olores y sabores desagradables hacen que el producto sea rechazado por el consumidor (Rodríguez–Félix y Cantwell, 1988; Corrales–García y Flores–Valdez, 2003).
Se han aplicado diversas técnicas postcosecha para tratar de conservar los atributos de calidad del nopal verdura con espina. Cantwel y col. (1992) encontraron que estos nopales envasados en bolsas de polietileno y almacenados a 5 °C prolongaron su vida de anaquel hasta por 3 semanas sin observar desarrollo de algún síntoma visual de daño por frío. Asimismo, Guevara y col. (2001) reportaron que el nopal con espinas almacenado a 5 °C en atmósferas modificadas con niveles inferiores a 8.6 kPa de O2 y superiores a 6.9 kPa de CO2, disminuyeron los síntomas de deterioro de la calidad, mostrando una vida de anaquel de 30 días. También, el uso de una atmósfera pasiva y una activa con 20 kPa de CO2 redujeron significativamente las pérdidas en fibra, textura, peso y color en nopal con espinas almacenado a 5 °C (Guevara y col, 2003). Sin embargo, los estudios sobre la conservación de nopal sin espinas son limitados y los concernientes al envasado en atmósferas modificadas (EAMs) y su efecto en los metabolitos de fermentación son nulos. Nuestro grupo de trabajo encontró que el nopal 'Milpa Alta' sin espinas envasado en atmósfera de N2 en bolsa polysweat (Boleo, D.F., México) permeable a O2, H2O y CO2 y almacenado a7°C± 1 °C alargó la vida de anaquel hasta por 20 días, manteniendo su calidad (Robles–Rodríguez y col, 2008).
En condiciones anaeróbicas o bajo la influencia de factores de estrés abiótico como las heridas, baja temperatura, elevadas concentraciones de CO2 y bajas de O2, se altera la actividad de diversas rutas metabólicas de las plantas (Kozlowski y Pallardy, 1997). En estas condiciones se puede inducir en los tejidos la fermentación etanólica y por tanto la acumulación de alcohol y acetaldehído (Kato–Noguchi y Yasuda, 2007; Dangyang y col, 1994; Kimmerer y MacDonald, 1987).
Debido a la riqueza en compuestos funcionales del nopal, a su diversidad de usos (Stintzing y Carie, 2005; Hernández–Zaragoza y col, 2007) y a su gran demanda en México y en otros países se busca ofertar un producto que atienda las necesidades del consumidor y conserve su frescura, aroma y sabor típicos. En este sentido, el nopal verdura desespinado y conservado en atmósferas modificadas en envases de tamaño adecuado para el consumidor, constituye un nicho de mercado que todavía no ha sido explotado. El objetivo del presente trabajo fue evaluar el efecto del envasado con atmósferas modificadas en la conservación del nopal desespinado variedad Milpa Alta determinando parámetros indicadores de las condiciones de estrés provocadas por el daño mecánico del desespinado y la atmósfera modificada.
2 Materiales y métodos
2.1 Material biológico
Se colectó nopal verdura (Opuntia ficus indica L.) variedad Milpa Alta de plantaciones comerciales ubicadas en Milpa Alta, México, D.F. (19°13'25': N; 99°01'47" O). Los cladodios se cosecharon manualmente por la mañana (6–7 a.m.) y se transportaron en rejas de plástico al laboratorio.
2.2 Aplicación de tratamientos y diseño experimental
Los cladodios se seleccionaron por tamaño (20 a 25 cm de longitud), uniformidad de color y ausencia de defectos de acuerdo a la norma oficial de calidad (CODEX STAN 185, 1993), se desinfectaron con una solución de 200 ppm de cloro activo. Los nopales se dividieron aleatoriamente en dos grupos, sólo uno de ellos se desespinó y rebordeó. Se llevaron a cabo dos experimentos, teniendo como factores de estudio las heridas ocasionadas por el desespinado y rebordeado, y el envasado con diversas atmósferas modificadas.
En el primer experimento, los cladodios sin espinas se colocaron en bolsas para EAM fabricadas con una película polysweat (Bolco, D.F., México) permeable al O2, al CO2 y al vapor de agua (260.6 g O2/100 in2/24 h/37.8 ºC y 90% de H.R; 6.58 g H2O/100 in2/24 h a una atmósfera, 23ºC y 0% H.R) de 35 micras de espesor. Los envases fueron primero sometidos a vacío utilizando una máquina empacadora Multivac C100 (Alemania), el cual se liberó después con la aplicación de tres atmósferas: 1) aire, 2) nitrógeno y 3) mezcla de 5 kPa O2 +4 kPa CO2 complementada con N2 y se sellaron. Los nopales envasados se almacenaron a 4 ºC ± 1 ºC.
En el segundo experimento se manejaron nopales con y sin espina y dos tipos de envases: clamshell (25.5 largo x 16.5 ancho x 6 cm alto) y las bolsas para EAMs antes citadas. Los nopales con espinas se colocaron en envases clamshell y fueron almacenados a temperatura ambiente (23 ºC ± 2 ºC) y refrigeración (4 ºC ± 1 ºC), mientras que los cladodios desespinados se almacenaron en envases clamshell y bolsas para EAMs, manteniéndose a 4 ºC ± 1 ºC. En las bolsas para EAMs se aplicaron nuevamente las atmósferas aire, nitrógeno y mezcla de 5 kPa O2 + 4 kPa CO2. En todos los experimentos la unidad experimental fue de cuatro nopales y tres repeticiones por tratamiento y el diseño experimental fue completamente al azar. Inmediatamente después de la cosecha y a los 5, 10, 15, 20 y 25 días de almacenamiento se midieron atributos de calidad y metabolitos de fermentación.
2.3 Atributos de calidad
Color. El color verde de los nopales se evaluó en 10 discos de 2.3 cm de diámetro de las libres de espinas de cada cladodio mediante un colorímetro HunterLab Modelo ColorFlex® (Hunter Associates Laboratory, EUA). Con los valores obtenidos se calculó el valor ΔE (grado de diferencia de color en el tiempo) mediante la ecuación:

En donde ΔL*, Δa* y Δb* son las diferencias en los valores de L*, a*, y b* entre el valor inicial antes del almacenamiento y el de la fecha de muestreo (HunterLab, 2010).
Firmeza. La fuerza necesaria para penetrar 7 mm la base del cladodio se determinó usando un penetrómetro (tr®, Italy) equipado con un punzón de 5 mm de diámetro y los resultados se reportan en Newtons (N) (Reid, 2007).
Acidez titulable (AT). Se midió por titulación ácido–base del jugo de nopal verdura obtenido de cada unidad experimental mediante un extractor de jugos eléctrico, utilizando hidróxido de sodio 0.1 N como titulante y fenolftaleína como indicador. Los resultados se expresan como g de ácido málico/100 g de jugo fresco de nopal (AOAC, 2000).
Pérdida de peso. Se utilizó una balanza digital de precisión explorer (OHAUS Corporation® –USA) para medir el peso inicial y las variaciones de peso durante el almacenamiento. Los resultados se expresan en % del peso perdido con respecto al peso inicial (Burton, 1982).
Índice de oscurecimiento. Para evaluar el oscurecimiento de las zonas desespinadas de los nopales se elaboró una escala porcentual en función del afectada, en donde 0 = ausencia de daño (0% de la superficie afectada); 1= ligero (1–10%); 2 = medio (11 – 20%); 3 = moderado (21–50%); y 4 = severo (> 50 %) (Fig. 1). Con los datos obtenidos se obtuvieron los índices de oscurecimiento aplicando la ecuación:
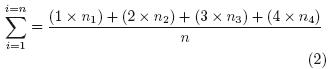

En donde: n1 = número de nopales en el grado 1,..., n4 = número de nopales en el grado 4 y n = número total de nopales.
2.4 Metabolitos de fermentación
El jugo de nopal de cada unidad experimental, obtenido como se indicó previamente para el análisis de AT, se congeló con nitrógeno líquido y almacenó a —20 °C hasta su análisis. Para cuantificar las concentraciones de acetaldehído y etanol en las muestras, se tomaron 6 g del jugo de nopal y se colocaron en un vial de vidrio de 30 mL conteniendo 9 mL de agua destilada y 3.6 g de NaCl para favorecer la liberación de los volátiles de la matriz al espacio de cabeza (Harmon, 1997), el vial se cubrió con un septo de vitón negro, se selló con un aro metálico y agitó en un vórtex Thermolyne 16700 mixer por 90 seg. Para capturar y concentrar los metabolitos de fermentación del espacio de cabeza se utilizó la técnica de microextracción en fase sólida (MEFS), empleando una fibra de silica de 75 μm de espesor recubierta con Carboxen/polidimetilsiloxano (CAR–PDMS) (Supelco, Bellefonte, CA). La fibra se expuso por 10 min al espacio de cabeza, manteniendo el vial durante este periodo en incubación en un baño de agua a 34 ± 1 °C. La fibra se desorbió en un CG Varían 3900 (Varían, Palo Alto, C.A.) equipado con un detector de ionización de flama, utilizando una columna capilar HP–INNOWAX de 0.32 mm I.D., 0.25 μm de espesor y 60 m de longitud (Agilent Technologies, USA). Las temperaturas del inyector y del detector fueron de 150 °C y 260 °C, respectivamente. La temperatura inicial del horno fue de 80 °C la cual aumentó 10 °C por minuto hasta alcanzar 130 °C donde permaneció por 6 minutos. Los metabolitos de fermentación se identificaron comparando los tiempos de retención con los de estándares comerciales extraídos, concentrados y analizados con el mismo procedimiento analítico y las concentraciones se calcularon mediante curvas estándar elaboradas con diluciones acuosas de acetaldehído (Aldrich) y etanol ( J.T. Baker).
2.5 Análisis estadístico
El análisis estadístico se realizó utilizando el programa Statgraphics Centurion XV versión 15.2.14 aplicando ANOVA multifactorial para determinar si había diferencias significativas entre tratamientos para cada una de las variables analizadas e interacción con los días de almacenamiento. Cuando se detectaron diferencias significativas, se efectuó la comparación múltiple de medias por el método de Tukey (α = 0.05). En el caso de pérdida de peso se eliminó la dependencia de los datos del valor inicial y por tanto se analizaron de forma independiente.
3 Resultados y discusión
Se presentan resultados de los dos experimentos realizados; en el caso de atributos de calidad sólo los del segundo experimento dado que el comportamiento fue similar en ambos.
3.1 Atributos de calidad
Durante el almacenamiento, se observó en los cladodios una reducción en la acidez titulable, siendo ésta más notable en los nopales con espina almacenados a temperatura ambiente (Tabla 1). Los EAMs no influyeron significativamente en la reducción de la AT de los nopales. De forma similar, Cantwell y col. (1992) reportaron una reducción de la acidez en nopales con espina almacenados en refrigeración. Probablemente esta disminución se deba a que el ácido málico en los cladodios almacenados en condiciones de oscuridad se emplea como sustrato respiratorio, siendo utilizado en el ciclo de Krebs para generar ATP (Taiz y Zeiger, 2006).
En firmeza no se observó una tendencia clara de cambio durante el almacenamiento y en cuanto al efecto de los tratamientos sólo se encontró que los nopales que se almacenaron a temperatura ambiente y que tenían espinas tuvieron valores significativamente más altos que los que se mantuvieron a 4 °C y en EAMs. El aumento en firmeza se explica por la alta pérdida de peso (6–8%) de los tejidos que generó cambios de textura. Este incremento de firmeza no se presentó en los nopales conservados en EAMs ya que la humedad relativa alta dentro de los envases evitó una pérdida excesiva de agua y peso en los tejidos manteniendo la frescura del producto.
Respecto a la variable de color ΔE, no se observaron cambios significativos en los nopales durante los días de almacenamiento y tampoco por efecto de tratamientos (Tabla 1). Guevara y col. (2001) reportan que los nopales con espinas almacenados en EAMs mantienen su color, mientras que los controles cambian de un color verde brillante a un verde opaco.
La pérdida de peso (PP) de los nopales 'Milpa Alta' sin espinas conservados en aire, N2 y 5 kPa O2 + 4 kPa CO2 fue menor al 1% después de 25 días de almacenamiento (Fig. 2 A, B) y no se registraron diferencias significativas entre tratamientos; en contraste, la PP en los nopales sin espina colocados en envases clamshell a 4 ºC fue superior (aproximadamente 10 %) (Fig. 2B). Guevara y col. (2003) encontraron que los cladodios con espina envasados en atmósferas pasiva y activa, ésta última con una concentración inicial de 20 kPa de CO2, tuvieron menores PPs ( 2 %) que los nopales empacados en cajas de cartón (> 25 %) a los 25 días de almacenamiento a 5 °C. Los nopales con espina almacenados a 4 °C en envases clamshell, mostraron una PP menor que los cladodios sin espina en este tipo de envase, pero mayor cuando se les almacenó a temperatura ambiente (6 — 8% a los 15 días de almacenamiento) (Fig. 2 B). Las pérdidas de peso ocasionan pérdidas económicas importantes por la reducción del peso neto de los envases y los cambios indeseables de calidad (marchitez, arrugamiento, pérdida de brillo) (Wills y col., 1998). Generalmente, los productos que pierden más del 5% de su peso original se ven afectados en su apariencia visual (Kader, 1992).
2 %) que los nopales empacados en cajas de cartón (> 25 %) a los 25 días de almacenamiento a 5 °C. Los nopales con espina almacenados a 4 °C en envases clamshell, mostraron una PP menor que los cladodios sin espina en este tipo de envase, pero mayor cuando se les almacenó a temperatura ambiente (6 — 8% a los 15 días de almacenamiento) (Fig. 2 B). Las pérdidas de peso ocasionan pérdidas económicas importantes por la reducción del peso neto de los envases y los cambios indeseables de calidad (marchitez, arrugamiento, pérdida de brillo) (Wills y col., 1998). Generalmente, los productos que pierden más del 5% de su peso original se ven afectados en su apariencia visual (Kader, 1992).

El oscurecimiento que aparece en los tejidos expuestos donde las espinas se eliminaron, empezó a observarse a los 10 días de almacenamiento a 4 °C en los nopales en envases clamshell y a los 15 días en todos los nopales en EAMs donde el daño fue además menos intenso (Fig. 3). Este resultado es similar al período de conservación encontrado por nuestro grupo de trabajo para nopales envasados en una atmósfera de N2 a 7 °C ± 1 °C (Robles–Rodríguez y col, 2008) y concuerda con Guevara y col. (2001) quienes reportaron que el oscurecimiento en las zonas desespinadas del nopal fue más severo en la muestra control que no estuvo en EAMs. Asimismo, el menor daño se presentó en los nopales envasados en atmósferas con aire y nitrógeno.
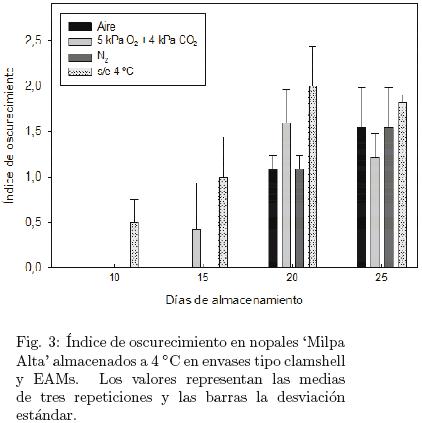
Esta fisiopatía no es considerada daño por frío dado que también se observa en los nopales mantenidos a temperatura ambiente, probablemente se trate de un oscurecimiento enzimático tardío pues no aparece inmediatamente después de que los tejidos se han dañado y expuesto al oxígeno como consecuencia de la eliminación de espinas y rebordeado, sino al cabo de 5 a 10 días, dependiendo de la época de cosecha y de la temperatura de almacenamiento, por la protección debida al ácido ascórbico presente en los tejidos que actúa como antioxidante (Quevedo y col, 2005). Una segunda explicación puede ser la presentada por Aquino–Bolaños y Mercado–Silva (2004), quienes señalan que la aparición de áreas de color rojo ocre en tejidos dañados de jícama se debe a la presencia de ligninas o sus intermediarios derivados de la oxidación de monolignoles (componentes de pared celular) que se sintetizan como parte del proceso normal de reparación de tejidos. Probablemente, esta misma explicación se pueda aplicar al nopal pues por una parte, el daño observado en los cladodios coincide más con este color ocre que con el oscurecimiento típico de oxidación enzimática, y por otra esto justificaría su aparición tardía pues primero han de darse mecanismos de detección y transducción de señales de daño físico a nivel celular con la subsiguiente expresión de genes y respuestas bioquímicas que finalicen con la síntesis y acumulación de los lignanos responsables del color observado (Saltveit, 2000). La aparición de oscurecimiento en un área mayor al 11% de la superficie total del nopal afectó adversamente la apariencia visual de los cladodios, por lo cual se asumió que la vida de anaquel se limita con un índice oscurecimiento mayor a 1.0 (> 11 % de la superficie afectada). Estos resultados indican que las atmósferas modificadas retrasan la aparición de la fisiopatía y apoyan los beneficios (reducción en pérdida de peso debido a una menor transpiración y prevención del oscurecimiento propiciado por el oxígeno del aire) reportados por Kader (1992) para esta tecnología de conservación.
3.2 Metabolitos de fermentación
Cuando los nopales 'Milpa Alta' sin espinas fueron almacenados en EAMs conteniendo aire, 5 kPa O2 + 4 kPa CO2 y nitrógeno se observó la producción tanto de acetaldehído como de etanol (Fig. 4 A y B). La concentración de acetaldehído se elevó notablemente a los 5 días y disminuyó gradualmente durante el almacenamiento hasta alcanzar niveles inferiores a 20 ppm a los 25 días (Fig. 4 A); simultáneamente con el descenso en los niveles de acetaldehído, las concentraciones de etanol aumentaron particularmente en los nopales mantenidos en aire (Fig. 4 B); en los nopales almacenados en 5 kPa O2 + 4 kPa CO2 y nitrógeno las concentraciones de etanol se mantuvieron estables hasta los 15 días para después disminuir al final del almacenamiento (Fig. 4 B). La disminución en los niveles de acetaldehído con la elevación simultánea en la concentración de etanol observada en las tres atmósferas modificadas, indica que en estas condiciones está operando la ruta normal de la fermentación etanólica, en donde el acetaldehído es convertido a etanol por la acción de la ADH. Aún cuando podría pensarse que esta respuesta es la consecuencia lógica de una inducción de la ruta de fermentación por limitaciones en la concentración de oxígeno, no se podría aseverar de manera contundente ya que existen reportes de que no todos los tejidos vegetales responden de esta manera. La inducción de esta ruta de fermentación no solo ocurre por limitaciones en la disponibilidad de oxígeno sino por otros factores de estrés como las heridas, las altas concentraciones de CO2 y la senescencia (Kato–Noguchi, 2001; Kürsteiner y col., 2003), además se conoce que el frío también puede ocasionar un estrés fisiológico capaz de inducir el metabolismo de fermentación (Purvis, 1997: Kato–Nagushi y Yasuda, 2007). De igual manera en ocasiones ni el frío ni las elevadas concentraciones de CO2 provocan incrementos de acetaldehído y etanol en los tejidos (Watkins y col., 2001; Pelayo y col., 2003; Ponce y Watkins, 2008) probablemente debido a que entran en operación rutas metabólicas alternas para disipar las altas cantidades de piruvato que se producen bajo condiciones de estrés, como su conversión en alanina por la acción de la alanina aminotransferasa (Purvis, 1997) o a acetil CoA por la acción de la piruvato deshidrogenasa (Tadege y col., 1999).

Los resultados anteriores fueron corroborados con los obtenidos en el segundo experimento (Fig. 5 A y B). Las concentraciones de acetaldehído se elevaron a los 5 días, excepto en los nopales con espina almacenados a temperatura ambiente (sin estrés por herida, ni estrés por baja temperatura) para después disminuir paulatinamente hasta el final del almacenamiento (Fig. 5 A). Los cladodios con espinas a 4 °C presentaron mayor concentración de acetaldehído que los almacenados a temperatura ambiente: entre los nopales con espina y sin espina a 4 °C, los segundos mantuvieron niveles altos de este metabolito por más tiempo; y las concentraciones de este compuesto también fueron altas en los nopales almacenados en 5 kPa O2 + 4 kPa. Estos resultados sugieren que los nopales perciben el estrés por baja temperatura, el ocasionado por las heridas de la operación de desespinado y el impuesto por las atmósferas modificadas conteniendo aire y 5 kPa O2 + 4 kPa, y responden a ellos activando la ruta de fermentación etanólica.
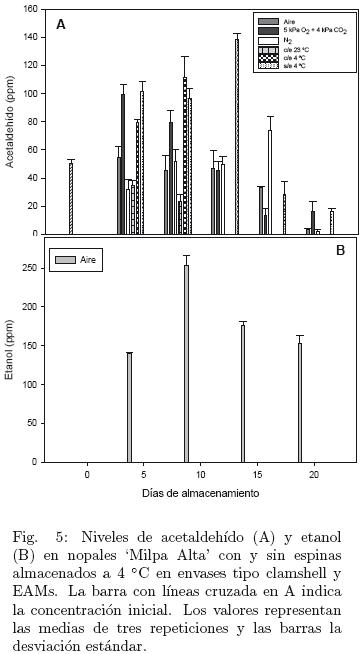
Sin embargo, las concentraciones de etanol fueron más bajas (Fig. 5, 150–250 ppm) que las observadas en el primer experimento (Fig. 4, 100–800 ppm) y probablemente por esta razón el etanol sólo se detectó en los cladodios conservados en la EAM conteniendo aire pues fue la atmósfera modificada que lo indujo en mayor concentración. Las prácticas agrícolas y la fecha de corte son factores adicionales que pudieron estar influyendo en la producción de metabolitos de fermentación por los nopales utilizados en la presente investigación (Pelayo–Zaldívar, 2010) pues los nopales se cosecharon en otoño para el primer experimento y en verano para el segundo, lo que podría explicar estas diferencias en los niveles de etanol.
Resultaría de interés en un trabajo futuro verificar la operación de la fermentación etanólica y de las rutas alternas de disipación del piruvato, empleando técnicas bioquímicas y de biología molecular, así como efectuar un estudio sensorial del efecto que los niveles encontrados de metabolitos de fermentación tienen en el sabor y el aroma del nopal.
Conclusiones
La calidad de los nopales 'Milpa Alta: desespinados conservados sólo en refrigeración a 4 °C se redujo en el almacenamiento debido a que la acidez titulable disminuyó (50% a los 20 días), la pérdida de peso incrementó por la transpiración que normalmente ocurre en los productos vegetales, alcanzando valores del 6% a los 20 días y por el oscurecimiento de las zonas desespinadas que empezó a observarse a los 10 días de almacenamiento. Cuando los nopales desespinados se envasaron con atmósferas modificadas conteniendo aire, nitrógeno y una mezcla de 5 kPa 02 +4 kPa C02 la calidad logró conservarse por un período de 20 días a la misma temperatura, debido a que la pérdida de peso fue sólo del 1%, la aparición del oscurecimiento se retrasó en cinco días y su intensidad se redujo, particularmente en las atmósferas conteniendo aire y nitrógeno (de un índice de oscurecimiento de 2.0 a 1.0). No se observaron síntomas de daño por frío a 4 °C, lo cual indica que los nopales de esta variedad son tolerantes a la baja temperatura. El envasado en atmósfera modificada, las heridas ocasionadas por el desespinado y la baja temperatura del almacenamiento refrigerado indujeron una producción aumentada de metabolitos de fermentación, lo que sugiere que estos tres factores son percibidos como un estrés fisiológico por los tejidos de los nopales 'Milpa Alta'. La atmósfera modificada conteniendo nitrógeno indujo la menor producción de metabolitos de fermentación y, por lo tanto, es la recomendada para conservar la calidad de esta variedad de nopal verdura por un período de 20 días a 4 °C.
Agradecimientos
La presente investigación fue realizada con el apoyo económico complementario del CONACYT (Proyecto 90610, 2008) y de la UAMI. Agradecemos igualmente al CONACYT la beca otorgada a Juliana Osorio Córdoba para la realización de sus estudios de doctorado.
Referencias
Aquino–Bolaños, E.N. y Mercado–Silva, E. (2004). Effects of polyphenol oxidase and peroxidase activity, phenolics and lignin content on the browning of cut jicama. Postharvest Biology and Technology 33, 275–283. [ Links ]
A.O.A.C. (2000). Official Methods of Analysis. Association of Official Analytical Chemists. Gaithersburg, Maryland, EUA. [ Links ]
Burton, W.G. (1982). Post–harvest physiology of food crops. Editorial Longman, New York, E.U.A. Pp.340. [ Links ]
Cantwell, M., Rodríguez–Felix, A. y Robles–Contreras, F. (1992). Postharvest physiology of prickly pear cactus. Scientia Horticulturae 50, 1–9. [ Links ]
Cantwell, M. (1995). Post–Harvest management of fruits and vegetable stems. En: Agro–ecology, cultivation and uses of cactus pear, Paper 132 (Barbera, G., Inglese, P., Pimienta– Barrios, E.), Pp. 120–141. Editorial FAO Plant Production and Protection, Roma. [ Links ]
CODEX STAN 185 (1993). Norma del CODEX para el nopal. Disponible en: http://www.codexalimentarius.net/web/standard list.do?lang=es. Accesado: 20 septiembre 2010. [ Links ]
Corrales–García, J. y Flores–Valdez, C.A. (2003). Nopalitos y tunas: producción, comercialización, poscosecha e industrialización. CIESTAAM– Programa Nopal, Universidad Autónoma de Chapingo México. 225 p. [ Links ]
Dangyang, K., Yahia, E., Mateos, M. y Kader, A.A. (1994). Ethanolic fermentation of 'Bartlett' pears as influenced by ripening stage and atmospheric composition. Journal of the American Society for Horticultural Science 119 (5), 976–982. [ Links ]
Guevara, J.C., Yahia, E.M. y Brito de la Fuente, E. (2001). Modified Atmosphere Packaging of Prickly Pear Cactus Stems (Opuntia spp.). Lebensmittel –Wissenschaft und Technologie 34, 445–451. [ Links ]
Guevara, J.C., Yahia, E.M., Brito de la Fuente, E. y Biserka, S.P. (2003). Effects of elevated concentrations of CO2 in modified atmosphere packaging on the quality of prickly pear cactus stems (Opuntia spp.). Postharvest Biology and Technology 29 (2), 167–176. [ Links ]
Harmon, A.D. (1997). Solid–Phase Microextraction for the analysis of flavors. En: Techniques For Analyzing Food Aroma, (Marsili, R., eds), Pp. 81–112. Marcel Dekker, Inc, Nueva York. [ Links ]
HunterLab (2010). Color Theory. Disponible en: http://www.hunterlab.com/ColorEducation/ColorTheory. Accesado: 24 noviembre 2010. [ Links ]
Hernandez–Zaragoza, J.B., Caballero–Badillo, C.E., Rosas–Juarez, A., López–Lara, T., Hinojosa–Torres, J. y Castano, V.M. (2007). Modification of Portland cement mortars with cactus gum. Chemistry and Chemical Technology 1(3), 175–177. [ Links ]
Kader, A.A. (1992). Postharvest Biology and Technology: An Overview. En: Postharvest Technology of Horticultural Crops, (Kader, A. A.), Pp. 15–20. Editorial University of California, California. [ Links ]
Kato–Naguchi, H. (2001). Wounding stress induces alcohol dehydrogenase in maize and lettuce seedlings. Plant Growth Regulation 35 (3), 285–288. [ Links ]
Kato–Nagushi, H. y Yasuda, Y. (2007). Effect of low temperature on ethanolic fermentation in rice seedlings. Plant Physiology 164 (8), 1013–1018. [ Links ]
Kimmerer, T.W. y MacDonald, R.C. (1987). Acetaldehyde and Ethanol Biosynthesis in Leaves of Plants. Plant Physiology 84 (4), 1204–1209. [ Links ]
Kozlowski, T.T. y Pallardy, S.G. (1997). Physiology of Woody Plants. 2nd edition. Academic Press, New York. 411 p. [ Links ]
Kürsteiner, O., Dupuis, I. y Kuhlemeier, C. (2003). The pyruvate decarboxylase1 gene of Arabidopsis is required during anoxia but not other environmental stresses. Plant Physiology 132 (2), 968–978. [ Links ]
Nerd, A., Dumoutier, M. y Mizrahi, Y. (1997). Properties and postharvest behavior of the vegetable cactus Nopalea coche ni l life ra. Postharvest Biology and Technology 10 (2), 135 –143. [ Links ]
Pelayo, C., Ebeler, S.E. y Kader, A.A. (2003). Postharvest life and flavor quality of three strawberry cultivars kept at 5 °C in air or air + 20 kPa CO2. Postharvest Biology and Technology 27, 171–183. [ Links ]
Pelayo–Zaldívar, C. (2010). Environmental effects on flavor changes. En: Handbook of fruit and vegetable flavors, (Hui Y.H., Chen Feng and Nollet L.M.L.), Pp. 73–91. Editorial John Wiley and Sons, Inc., E.U.A. [ Links ]
Ponce–Valadez y M., Watkins, C.B. (2008). Fermentation and malate metabolism in response to elevated CO2 concentrations in two strawberry cultivars. Physiologia Plantarum 134 (1), 121–133. [ Links ]
Purvis, A.C. (1997). The role of adaptive enzymes in carbohydrate oxidation by stressed and senescing plant tissues. HortScience 32 (7), 1165–1168. [ Links ]
Quevedo–Preciado, K.L., Villegas–Ochoa, M.A., González–Ríos, H. y Rodríguez–Félix, A. (2005). Calidad de nopal verdura mínimamente procesado. Efecto de temperatura e inhibidores del oscurecimiento. Revista Fitotecnia Mexicana 28(3), 261–270. [ Links ]
Ramayo–Ramirez, L., Saucedo–Veloz, C. y Lakshminarayana, S. (1978). Prolongación de la vida de almacenamiento del nopal hortaliza (Opuntia inermis Coulter) por refrigeración. Chapingo, Nueva Epoca 10, (30–32). [ Links ]
Reid, M.S. (2007). Maduración e Indices de Madurez. En: Tecnología Postcosecha de Cultivos Hortofrutícolas (A. A. Kader y C. Pelayo–Zaldivar), Pp. 63–71. Editorial University of California, California. [ Links ]
Robles– Rodríguez, M.B., Rodríguez– Huezo, E., Colina– Irezabal, M.L., Pelayo– Zaldívar, C. y Bósquez– Molina, E. (2008). Efecto del envasado al vacío y en atmósfera de N2 del nopal desespinado (Opuntia ficus indica) var. Milpa Alta. 12–14 Marzo. Tuxtla Gutiérrez, Chiapas, México: V Congreso Internacional y XVI Congreso Nacional de Ingeniería Bioquímica. [ Links ]
Rodríguez–Felix, A. (2002). Postharvest physiology and technology of cactus pear fruits and cactus leaves. Acta Horticulturae 581, 191–199. [ Links ]
Rodríguez–Felix, A. y Cantwell, M. (1988). Developmental changes in composition and quality of prickly pear cactus cladodes (nopalitos). Plant Foods for Human Nutrition 38 (1), 83 – 93. [ Links ]
Rodríguez–Felix, A. y Villegas–Ochoa, M.A. (1998). Postharvest handling of cactus (Opuntia spp.) stems. CACTUSNET–FAO Newsletter. Universita degli Studi di Reggio Calabra. Universidad de Chile 4, 10–13. [ Links ]
Rodríguez Fuentes, H. (2009). Cultivo orgánico del nopal. Editorial Trillas, México. 76 p. [ Links ]
Sáenz, C. (2004). Compuestos funcionales y alimentos derivados de Opuntia spp. En: El Nopal, Tópicos de actualidad, (Esparza, G.,Valdez, R. y Méndez, S.), Pp. 211–222. Editorial Universidad Autónoma de Chapingo, Texcoco. México. [ Links ]
Saltveit, M.E. (1998). Fresh cut product biology. In: Fresh cut product: Maintaining Quality and Safety, (Cantwell, M. eds), Pp. 1–8. California. [ Links ]
Saltveit, M.E. (2000). Wound induced changes in phenolic metabolism and tissue browning are altered by heat shock. Postharvest Biology and Technology 21, 61–69. [ Links ]
Saltveit, M.E. (2001). Chilling injury is reduced in cucumber and rice seedlings and in tomato pericarp discs by heat–shocks applied after chilling. Postharvest Biology and Technology 21, 169–177. [ Links ]
SIAP, 2009. Estacionalidad de nopalitos. Servicio de Información Agroalimentaria y Pesquera. SAGARPA. Disponible en: http://www.siap.gob.mx/. Accesado: 24 noviembre 2010. [ Links ]
Stintzing, F.C. y Carle, R. (2005). Cactus stems (Opuntia spp.): A review on their chemistry, technology, and uses. Molecular Nutrition & Food Research 49 (2), 175 – 194. [ Links ]
Tadege, M., Dupuis, I. y Kuhlemeier, C. (1999). Ethanolic fermentation: new functions for an old pathway. Trends in Plant Science 4 (8), 320–325. [ Links ]
Taiz, L. y Zeiger, E. (2006). Plant Physiology. Sinauer Associates Inc, Massachuset. 623 p. [ Links ]
Watkins, C.B., Manzano–Mendez, J.E., Nock, J., Zhang, J. y Maloney, K.E. (1999). Cultivar variation in response of strawberry fruit to high carbon dioxide treatments. Journal of the Science of Food and Agriculture 79, 886–890. [ Links ]
Wills, R., McGlasson, B., Graham, D.y Joyce, D. (1998). Introducción a la fisiología poscosecha de frutas, hortalizas y plantas ornamentales. Editorial Acribia S.A., Mexico. 240 p. [ Links ]














