Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ingeniería química
versión impresa ISSN 1665-2738
Rev. Mex. Ing. Quím vol.10 no.1 Ciudad de México abr. 2011
Biotecnología
Optimización del proceso de hidrólisis enzimática de una mezcla de pajas de frijol cuatro variedades (Pinto villa, Pinto saltillo, Pinto mestizo y Flor de mayo)
Optimization of the enzymatic hydrolysis process of four straw bean varieties (Pinto villa, Pinto saltillo, Pinto mestizo and Flor de mayo)
S.M. González–Rentería1, N.O. Soto–Cruz1, O.M. Rutiaga–Quiñones1, H. Medrano–Roldán1, J.G. Rutiaga–Quiñones2 y J. López–Miranda1*
1 Instituto Tecnológico de Durango. Departamento de Ingenierías Química y Bioquímica. Boulevard Felipe Pescador 1830 Ote. Col. Nueva Vizcaya. Durango, Dgo., Cp. 34080. México. *Autor para la correspondencia. E–mail: jlopez@itdurango.edu.mx
2 Universidad Michoacana de San Nicolás de Hidalgo, Facultad de Ingeniería en Tecnología de la Madera. Apartado Postal No. 580. Col. Centro. Morelia, Michoacán. C P. 58000. México.
Recibido 22 de Noviembre 2010.
Aceptado 8 de Febrero 2011.
Resumen
Se mezclaron, en igual proporción, pajas de frijol de las variedades Pinto villa, Pinto saltillo, Pinto mestizo y Flor de mayo. Se determinó la composición química de la mezcla y se sometió a pretratamiento con hidróxido de sodio al 0.1, 0.5 y 1.0%, a 121°C durante 30, 60 y 90 min. Las pajas pretratadas se analizaron y sometieron a hidrólisis enzimática durante 10 días a 45°C y pH 4.5, utilizando una carga enzimática de 25 UPF/g de celulosa, de un concentrado enzimático comercial (Celluclast 1.5 L) proporcionado por Novozyme. Los azúcares producidos se determinaron por el método de Miller y los valores obtenidos se utilizaron para calcular el rendimiento de hidrólisis. Las condiciones óptimas de pretratamiento e hidrólisis se obtuvieron utilizando el método de superficie de respuesta. Los resultados muestran que la mezcla de pajas de frijol está compuesta por 31% de celulosa, 23% de hemicelulsa y 9% de lignina, que el pretratamiento afecta significativamente al rendimiento de hidrólisis y que la sacarificación máxima (98.95±8.38%) se obtuvo para un pretratamiento con 0.5% de NaOH durante 90 minutos a 121°C , con un tiempo de hidrólisis de 240h a pH 4.5 y 45°C , utilizando una carga enzimática de 25 UPF/g de celulosa.
Palabras clave: optimización, paja de frijol, hidrólisis enzimática, pretratamiento, celulosa.
Abstract
Pinto villa, Pinto Saltillo, Pinto Mestizo and Flor de mayo straw bean varieties were mixed in equal proportions. The mixture chemistry composition was determined and pretreated with NaOH at 0.1, 0.5 and 1.0% for 30, 60 y 90 minutes. The pretreated straw bean was subject to enzymatic hydrolysis for 10 days at 45°C and a pH of 4.5, using a cellulase enzymatic load of 25 UPF/g of cellulose, from a commercial enzymatic concentrate (Celluclast 1.5 L) provided by Novozyme. The produced sugars were determined using the Miller method, and the obtained values used to calculate the hydrolysis yield. The pretreatment and hydrolysis optimal conditions were calculated using the surface response method. The results shown that the straw bean mixture is composed by: 31% of cellulose, 23% of hemicelluloses and 90% of lignin. The pretreatment affects significantly the hydrolysis yield. The maximum saccharification (98.95 ± 8.38%) was obtained with a pretreatment with 0.5% NaOH for 90 minutes at 121°C and hydrolysis for 240h at pH 4.5 and 45°C , using a cellulose enzymatic charge of 25UPF/g of cellulose.
Keywords: optimization, bean straw, enzymatic hydrolysis, pretreatment, cellulose.
1 Introducción
El etanol es un combustible limpio cuyo uso puede disminuir los efectos negativos del cambio climático ocasionado por la combustión de petróleo, carbón mineral y gas natural (Chang, 2007); se produce por fermentación de los azúcares obtenidos de caña de azúcar, maíz, remolacha y biomasa lignocelulsica. El término biomasa lignocelulsica se refiere a toda la materia orgánica de origen vegetal o animal, que incluye materiales procedentes de su transformación natural o artificial (Dashtban y col., 2009). La producción de etanol a partir de biomasa lignocelulsica se realiza usualmente en tres etapas: hidrólisis, fermentación y separación (Banerjee y col., 2010: Godliving y Mtui 2009; Olofsson y col., 2008; Kristensen y col., 2008; Punsuvon y col., 2008; Galbe y Zacchi, 2002; Philippidis y Hatzis, 1997). La hidrólisis puede realizarse con ácidos minerales o mediante la acción concertada de enzimas (Miller y Hester, 2007; partes I y II; Venkatesh y col., 2010). La hidrólisis acida depende de la temperatura, del tiempo, de la concentración y tipo de ácido utilizado, mientras que la hidrólisis enzimática está influenciada por la especie vegetal, sus contenidos de celulosa, hemicelulosa y lignina, así como por la composición y origen del complejo enzimático (Brethauer y Wyman, 2010; García y col., 2010; Leenakul y Tippayawong, 2010; Lpez–Arenas y col., 2010; Megawati y col., 2010; Taherzadeh y Keikhosro, 1997; Himmel y col., 2007).
La biomasa lignocelulsica está compuesta principalmente por celulosa, hemicelulosa y lignina (Olofsson y col., 2008). La celulosa es una fuente atractiva de glucosa para la producción de etanol por fermentación. En la biomasa lignocelulsica el acceso a las fibras de celulosa se ve impedido por las capas de hemicelulosa y lignina (Venkatesh y col., 2010). Por ello, la hidrólisis enzimática de estos materiales requiere que sean sometidos a un tratamiento previo llamado pretratamiento, el cual puede ser físico, fisicoquímico, químico o biológico (Saha y col., 2005; Tucker y col., 2003; Keller y col., 2003; Schell y col., 2003; Silverstein y col., 2007). El pretratamiento de la biomasa incluye normalmente una reducción de tamaño por picado y/o molido y una humectacin química con álcali o ácido. Un pretratamiento efectivo aumenta la porosidad del material, disminuye la cristalinidad de las fibras de celulosa, remueve la hemicelulosa y reduce la cantidad de lignina presente. El tipo y condiciones del pretratamiento determinan la liberación de azúcares simples durante la hidrólisis enzimática y por consecuencia, el rendimiento de etanol producido; debido a lo anterior, el pretratamiento es la etapa más importante en la producción enzimática de azúcares fermentables. El pretratamiento con ácido sulfúrico diluido a temperatura elevada disuelve la hemicelulosa, redistribuye la lignina e incrementa la cristalinidad y alineamiento de la celulosa, aumentando la digestibilidad del material (Venkatesh y col., 2010). El pretratamiento alcalino rompe los enlaces entre lignina, hemicelulosa y celulosa, evita la fragmentación de los polímeros de hemicelulosa, remueve lignina y hemicelulosa y aumenta la accesibilidad de las enzimas a la celulosa (Hahn–Hagerdal y col., 2006; Gaspar y col., 2007; Taherzadeh y Keikhosro, 2007, II); este pretratamiento es más efectivo sobre residuos agrícolas que sobre recursos maderables (Taherzadeh y Keikhosro, 2007, I). Los rendimientos de etanol a partir de materiales lignocelulósicos dependen del tipo de biomasa utilizada (Ghosh y col., 2000; Sims, 2003; Buffiere y col., 2006; Taherzadeh y Keikhosro, 2007, I y II). Actualmente no se conoce un procedimiento general para el pretratamiento de materiales lignocelulósicos; las distintas especies de biomasa requieren de diferentes procedimientos (Hahn–Hagerdal y col., 2006), por ello, sigue siendo un desafío hacer costeable el proceso industrial de conversión de lignocelulósicos a combustibles biológicos.
En la actualidad, México necesita iniciar con la producción de etanol a gran escala, sin embargo, el costo de la materia prima, el elemento más importante de los costos de producción, es un factor limitante. Este costo puede disminuirse si se utilizan como materias primas a los desechos industriales, municipales y/o a los esquilmos de la producción agrícola, como el rastrojo de maíz, el bagazo de caña y las pajas provenientes del cultivo de cereales y leguminosas.
El cultivo de frijol es una actividad económica muy importante para México; anualmente se producen alrededor de 1000 millones de toneladas de grano (http://faostat.fao.org/site/339/default.aspx) y 1,500 millones de toneladas de paja. Actualmente, la paja de frijol se utiliza como alimento de rumiantes, a pesar de que su digestibilidad in vivo es baja (36.2% del contenido de carbohidratos totales). Por otra parte, el contenido de celulosa y hemicelulosa de las pajas es elevado (60.6% y 14.5%, respectivamente). Comparando estos valores se observa que el uso que se está dando a la paja de frijol provoca que se desperdicie más de la mitad de los carbohidratos utilizables contenidos en ella (Ramírez y col., 2002). Un cálculo rápido muestra que de la paja de frijol es posible obtener alrededor de 400 millones de litros de etanol por año. Considerando que la paja de frijol es un material lignocelulsico con potencial para ser usado como materia prima para la producción de etanol combustible, el objetivo del presente trabajo es determinar las condiciones óptimas de pretratamiento que permitan obtener el máximo rendimiento de azúcares fermentables por hidrólisis enzimática de una mezcla de pajas de frijol de las variedades Flor de mayo, Pinto Villa, Pinto mestizo y Pinto Saltillo.
2 Metodología
2.1 Materia prima
Las pajas de frijol de las variedades: Flor de mayo, Pinto Villa, Pinto mestizo y Pinto Saltillo, fueron proporcionadas por el Instituto Nacional de Investigaciones Agrícolas, Forestales y Pecuarias (INIFAP), delegación Durango. Estas se lavaron y secaron a 110°C durante 24h, se molieron en un molino de cuchillas (RETSCH GM 200) hasta un tamaño de partícula tal, que pasó por la malla 20 y se retuvo en la malla 40 (0.841 mm). Las pajas molidas se mezclaron en igual proporción y la mezcla se conservó a temperatura ambiente en frascos de vidrio cerrados herméticamente. Se determinó su composición química por duplicado (celulosa, hemicelulosa, lignina, humedad, materia seca, grasa, proteína cruda, cenizas y extracto libre de nitrógeno), utilizando los métodos reportados en el manual de métodos analíticos del AOAC (2000).
2.2 Pretratamiento
En esta etapa se mezclaron lOg de la mezcla de pajas con 100 mL de NaOH al 0.1, 0.5 y 1.0%, se calentaron a 121°C durante 30, 60 y 90min, se enfriaron a temperatura ambiente, se lavaron hasta que el pH del agua de lavado se aproximó a la neutralidad, se pesaron en húmedo, se secaron a 70°C durante 24h y se almacenaron a temperatura ambiente en frascos de vidrio cerrados herméticamente. Las pajas pretratadas se analizaron para determinar por duplicado sus contenidos de celulosa, hemicelulosa, lignina, y cenizas, utilizando los métodos reportados en el manual de métodos analíticos del AOAC (2000). Los resultados se expresaron en base seca.
2.3 Hidrólisis enzimática de la mezcla de pajas pretratadas
La hidrólisis de las pajas de frijol pretratadas se realizó utilizando el complejo enzimático Celluclast 1.5 L, proporcionado por NOVOZYME. Para ello, se determinó la actividad enzimática del complejo (potencia requerida para liberar 1 μmol de glucosa por minuto) por el método del papel filtro (Reese y Maguire, 1969; Mandéis y col, 1976). Los azúcares producidos durante la hidrólisis de éste se determinaron por el método de Miller (1959), para utilizarse en el cálculo de la actividad enzimática del complejo (Ec. 1).
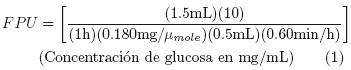
Se determinó la cantidad de muestra pretratada necesaria para proporcionar 0.5 g de celulosa (Ec. 2), el volumen de solución enzimática necesario para lograr 25 UPF por g de celulosa (Ec. 3) y el volumen de buffer de acetatos 0.1M, de pH 4.7, requerido para obtener un volumen de reacción de 10 mL (Ec. 4). La mezcla de estos componentes, adicionada con 1 mL de azida de sodio al 0.1% m/v, se colocó en frascos de plástico de 20 mL y se incubó a 50°C y 80rpm durante 0, 4, 8, 12, 24, 48, 72, 96 y 168h (Se consideró que la densidad de la muestra pretratada es igual a lg/mL).
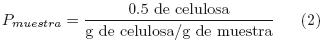

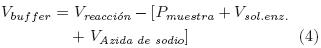
Concluida la hidrólisis, los hidrolizados se aforaron a 100 mL con agua destilada, se determinó su contenido de azúcares reductores por el método de Miller (1959) y se calculó el rendimiento de hidrólisis (Ec. 5).

2.4 Análisis estadístico
Se determinó el efecto de las condiciones de pretratamiento sobre la eficiencia de hidrólisis, sometiendo los resultados a análisis de varianza (ANDEVA). Las condiciones óptimas de pretratamiento (concentración de NaOH y tiempo de pretratamiento e hidrólisis) se determinaron mediante el procedimiento de superficie de respuesta. El análisis estadístico se realizó con el software Stastistica, ver. 5.0.
3 Resultados y discusión
3.1 Composición química de la mezcla de pajas de frijol
En la Tabla 1 se muestran los contenidos de celulosa, hemicelulosa y lignina de la paja de frijol (valores experimentales), de trigo y sorgo dulce (Ballesteros y col., 2004), de arroz (Saha y col, 2005), de madera de álamo (Cantarería y col, 2004), de rastrojo (Olofsson y col, 2008) y mazorcas de maíz (Nabarlatz y col, 2004). La comparación de resultados muestra que los contenidos de celulosa y lignina son más bajo para las pajas de frijol que para el resto de los materiales lignocelulsicos mostrados, en tanto que el contenido de hemicelulosa es menor que las de sorgo dulce, paja de trigo y mazorcas de maíz. El contenido de carbohidratos totales es más alto que el de la paja de arroz, pero más bajo que la de los otros materiales. De lo anterior se desprende que la composición de la mezcla de pajas de frijol {Pinto villa, Pinto saltillo, Pinto mestizo y Flor de mayo) es muy parecida a la de la paja de arroz.
3.2 Efecto de las condiciones de pretratamiento sobre la composición química de la paja de frijol
En la Tabla 2 se muestra la composición química de la mezcla de pajas después someterlas a los diferentes tratamientos. El análisis de varianza dio como resultado, con una p < 0.05, que las cenizas, las proteínas y la lignina no se ven afectadas de manera significativa por las condiciones de pretratamiento utilizadas, que las concentraciones de NaOH influyen significativamente en las proporciones de celulosa, hemicelulosa y extraíbles, en tanto que el tiempo de pretratamiento afecta únicamente a los contenidos de celulosa. El análisis gráfico de los resultados (Fig. 1) muestra que el pretratamiento redujo el peso del material pretratado en un 30%. Ésta disminución ocurrió a expensas de los contenidos de hemicelulosa, cenizas y extraíbles. Los resultados concuerdan con los reportados para maderas latifoliadas (Fengel y Wegener, 1984): para estas, la remoción de lignina es difícil, pero en cambio ocurre una hidrólisis hasta de un 50% de hemicelulosa y un hinchado sustancial de la celulosa, lo que ocasiona que ésta ultima esté más disponible para el ataque hidrolítico de las celulasas. Los pretratamientos alcalinos utilizan temperaturas y presiones más bajas en comparación con otras tecnologías, y aún es posible realizarlos a temperatura ambiente, pero el tiempo aumenta de minutos o segundos a horas o incluso días (Lynd y col., 2002).
3.3 Hidrólisis enzimática de la mezcla de pajas sometida a pretratamiento
El pretratamiento alcalino rompe los enlaces hemicelulosa–lignina, ocasionando que se reduzcan los contenidos de lignina y hemicelulosa en la biomasa pretratada, que se altere la estructura de la lignina residual y que se aumente la porosidad y la superficie interna de la biomasa: que disminuya el grado de cristalinidad de la celulosa y que se facilite la penetración de las moléculas de agua a las capas interiores de la biomasa, facilitando así el ataque enzimático de la celulosa por las celulasas (Silverstein y col., 2007). Los datos reportados en la Tabla 3 muestran el comportamiento de la hidrólisis enzimática de la mezcla de pajas de frijol, en función de la concentración de NaOH y del tiempo de pretratamiento. El análisis de varianza (Tabla 4) muestra que la concentración de NaOH, el tiempo de pretratamiento y su interacción afectan significativamente a los rendimientos de hidrólisis (p ≤ 0.05). La sacarificación máxima (98.95±8.38%) se obtuvo para el pretratamiento con 0.5% de NaOH, a 121°C durante 90 minutos: utilizando 240h para la hidrólisis, con una carga enzimática de 25 UPF/g de celulosa; un pH y una temperatura de hidrólisis de 4.5 y 45°C respectivamente.
En la Fig. 2 se muestra la gráfica de superficie de respuesta, para el rendimiento de sacarificación en función de la concentración de NaOH y del tiempo de hidrólisis. El modelo estadístico que la representa (Ec. 6), permitió obtener las condiciones óptimas de pretratamiento para la hidrólisis enzimática del material pretratado (0.66% de NaOH durante 72 min, a 120°C). De acuerdo al modelo, en las condiciones óptimas es posible obtener un rendimiento máximo de 99% de azúcares reductores.

Este rendimiento es notablemente mayor que el reportado por Saha y Cotta (2006) para la hidrólisis de cascarilla de arroz pretratada con 1% de H2SO4 v/v, durante 60 min, a 121°C (40%, en función del contenido total de carbohidratos) y su posterior hidrólisis con una mezcla de celulasa y β–glucosidasa (Celluclast, Novozyme 188), durante 72h a 121°C (45% en función del contenido total de carbohidrato), lo cual demuestra que la utilización de hidróxido de sodio para el pretratamiento de materiales lignocelulsicos es una alternativa que puede substituir al pretratamiento con ácido sulfúrico (Silverstein y col., 2007).
3.4 Cinética de hidrólisis
Con el propósito de validar el modelo se realizó la cinética de hidrólisis de la mezcla de pajas (Fig. 3), en las condiciones óptimas de pretratamiento previamente encontradas (0.66% de NaOH durante 72 min, a 120°C). Como se observa, el rendimiento máximo (92±5%) fue obtenido después de 168h de hidrólisis. Éste valor es muy parecido al rendimiento predicho por el modelo (99% de azúcares reductores), en las mismas condiciones de hidrólisis, lo que demuestra que el modelo de optimización (Ec. 6), puede ser utilizado para describir el comportamiento de hidrólisis en el rango experimental probado. La Fig. 3 muestra que es posible detener el proceso de hidrólisis a las 48 horas, con una pérdida de rendimiento de 15 % de azúcares reductores, pero con una reducción de 120h en el tiempo de hidrólisis. El rendimiento de azúcar para estas condiciones fue de 83.76% m/m. Este rendimiento es 1.86 veces mayor que el obtenido en 2005 por Saha y col. (45%), para la hidrólisis de cascarilla de arroz pretratada con H2SO4 (1%, v/v), a 121°C , durante 60 min, e hidrolizado con una combinación de celulasa y β–glucosidasa (Celluclast, Novozyme 188), durante 72h. Aunque el tiempo de pretratamiento es 12 minutos mayor, la concentración de NaOH es baja (0.66%) y el tiempo de hidrólisis es 24h menor. Se ha reportado que la utilización de NaOH para el pretratamiento de materiales lignocelulsicos es una alternativa para el pretratamiento con H2S04 (Silverstein y col., 2007). Sin embargo, la utilización de álcalis está limitada porque estos se convierten en sales irrecuperables o se incorporan como sales en la biomasa (Lynd y col., 2002). Cabe destacar que el rendimiento obtenido para la hidrólisis de la mezcla de pajas de frijol sin pretratar fue de 76,37±13.775 (Tabla 3), el cual es comparable con los rendimientos de hidrólisis que se reportan en la literatura (Saha y col., 2005, Silverstein y col., 2007). Lo anterior es particularmente importante, debido a que el costo del pretratamiento es uno de los principales factores que encarecen el proceso de producción de etanol (Balat y col., 2008). Lo anterior muestra que la paja de frijol es una materia prima sumamente atractiva para la producción de etanol combustible.

Los rendimientos de azúcar obtenidos para la hidrólisis enzimática de la mezcla de pajas de frijol pretratada con 0.66% de NaOH durante 60 min (92.5±3.3%) son mayores que los reportados por Hamelink y col., (2005). Sin embargo, el tiempo de hidrólisis (168h), es considerablemente mayor (132h) que el reportado por ellos (36h). No obstante, el rendimiento de azúcares obtenido en 48h de hidrólisis de la mezcla de pajas de frijol es comparable con el reportado por Hamelink y col., (2005) para 1.5 días de hidrólisis con celulasas (Tabla 5).
Conclusiones
El pretratamiento con NaOH reduce los contenidos de hemicelulosa y deja prácticamente intactos los contenidos de celulosa y lignina. El rendimiento máximo de azúcares reductores fue de 92±5% para la hidrólisis enzimática de la paja de frijol pretratada con 0.66% de NaOH a 120°C, durante las 168h de hidrólisis. Es posible detener el proceso de hidrólisis a las 48 horas, a expensas de una pérdida de 15% de rendimiento. El rendimiento obtenido para la hidrólisis de la mezcla de pajas de frijol sin pretratar (76,37±13.775), la sitúa como una materia prima sumamente atractiva para la producción de etanol combustible, toda vez que el costo del pretratamiento es uno de los principales factores de costo de este proceso. Los rendimientos expresados como porcentaje de azúcares reductores, en las condiciones de pretratamiento encontradas, permiten afirmar que la paja de frijol puede ser utilizada como substrato para la producción de azúcares fermentables y por tanto de etanol combustible. Los modelos obtenidos para el pretratamiento y la cinética de hidrólisis pueden ser utilizados para explicar el comportamiento de la misma en el espacio experimental investigado.
Nomenclatura

Agradecimientos
Agradecemos a la Dirección General de Educación Superior Tecnológica (DGEST), por haber apoyado la realización de la presente investigación, a través del proyecto 2458–P, al Consejo Nacional de Ciencia y Tecnología (CONACYT), por la beca otorgada al primer autor del presente reporte, a Novozyme–México, por facilitar el complejo enzimático utilizado y al Instituto Tecnológico de Durango por haber facilitado sus instalaciones para la realización del presente trabajo.
Referencias
AOAC (2000). Official Methods of Analysis (17th ed.). Association of Official Analytical Chemist. Washington, D.C. [ Links ]
Balat, M., Balat, H., Oz, C. (2008). Progress in bioethanol processing. Progress in Energy and Combustion Sciences 34, 551–573. [ Links ]
Ballesteros, M., J.M. Oliva, Negro M.J., Manzanares P., Ballesteros I. (2004). Ethanol from lignocellulosic materials by a simultaneous saccharification and fermentation process (SFS) with Kluyveromyces marxianus CECT 10875. Process Biochemistry 39, 1843–1848. [ Links ]
Banerjee, S., Mudliar, S., Sen, R., Giri, B., Satpute, D., Chakrabarti, T. and Pandey, R.A. (2010). Commercializing lignocellulosic bioethanol: technology bottlenecks and possible remedies. Biofuels, Bioproducts and Biorefinery 4, 77–93. [ Links ]
Brethauer, S., Wyman, C.E. (2010). Continuous hydrolysis and fermentation for cellulosic ethanol production. Bioresource Technology 101, 4862–4874. [ Links ]
Buffiere, P., Loisel, D., Bernet, N., Delgenes, J.P. (2006). Towards new indicators for the prediction of solid waste anaerobic digestion properties. Water Science Technology 53, 233–241. [ Links ]
Cantarella, M., Cantarella, L., Gallifuoco, A., Spera, A., Alfani, F. (2004). Effect of Inhibitors Released during Steam–Explosion Treatment of Poplar Wood on Subsequent Enzymatic Hydrolysis and SSF. Biotechnology Progress 20, 200–206. [ Links ]
Chang, M.CY. (2007). Harnessing energy from plant biomass. Current Opinion in Chemical Biology 11, 677–684. [ Links ]
Dashtban, M., Heidi, S., Wensheng, Q. (2009). Fungal Bioconversion of Lignocellulosic Residues: Opportunities & Perspectives. International Journal of Biological Sciences 6, 578–595. [ Links ]
Fengel, D., Wegener, G. (1984). Wood chemistry, ultrastructure, reactions. Walter de Gruyter & Co. Berlin. [ Links ]
Galbe, M., Zacchi, G. (2002). A review of the production of ethanol from softwood. Applied Microbiology and Biotechnology 59, 618–628. [ Links ]
García, C.M.T., Marcos, M., Bolado, S., Coca, M., González, B.G. (2010). Optimization of Operating Conditions in Enzymatic Hydrolysis of Pretreated Lignocellulosic Materials. Chemical Engineering Transactions 21, 1285–1290. [ Links ]
Gaspar, M., Kalman, G., Reczey, K. (2007). Corn fiber as a raw material for hemicellulose and ethanol production. Process Biochemistry 42, 1135–1139. [ Links ]
Ghosh, S., Henry, M.P., Sajjad, A., Mensinger, M.C., Arora, J.L. (2000). Pilot–scale gasification of municipal solid wastes by high–rate and two–phase anaerobic digestion (TPAD). Water Science and Technology 41, 101–110. [ Links ]
Godliving, Y., Mtui, S. (2009). Recent advances in pretreatment of lignocellulosic wastes and production of value added products. African Journal of Biotechnology 8, 1398–1415. [ Links ]
Hahn–Hagerdal, B., Galbe, M., Gorwa–Grauslund, M.F., Liden, G., Zacchi, G. (2006). Bio–ethanol–the fuel of tomorrow from the residues of today. Trends Biotechnology 24, 549–556. [ Links ]
Hamelinck, C.N., Geertje, V.H., Andre, P., Faaij, C. (2005). Ethanol from lignocellulosic biomass: techno–economic performance in short–, middle– and long–term. Biomass and Bioenergy 28, 384–410. [ Links ]
Himmel, M.E., Ding, S.Y., Johnson, D.K., Adney, W.S., Nimlos, M.R., Brady, J.W., Foust, T.D. (2007). Biomass recalcitrance: Engineering plants and enzymes for biofuels production. Science 315, 804–807. http://faostat.fao.org/site/339/default.aspx, consultada el 22 de Mayo del 2010. [ Links ]
Keller, F.A., Hamilton, J.E., Nguyen, Q.A. (2003). Microbial Pretreatment of Biomass Potential for Reducing Severity of Thermochemical Biomass Pretreatment. Applied Biochemistry and Biotechnology 105, 27–41. [ Links ]
Kristensen, J.B., Thygensen, L.G., felby, C., Jorgensen, H., Elder, T. (2008). Cell–wall structural changes in wheat straw pretreated for bioethanol production. Biotechnology for Biofuels 5, 1–9. [ Links ]
Leenakul, W., Tippayawong, N. (2010). Dilute Acid Pretreatment of Bamboo for Fermentable Sugar Production. Journal of Sustainable Energy & Environment 1, 117–120 [ Links ]
López–Arenas, T., Rathi, P., Ramírez–Jiménez, E., Sales–Cruz, M. (2010). Factors affecting the acid pretreatment of lignocellulosic biomass: Batch and continuous Process. (20th). European Symposium on Computer Aided Process Engineering – ESCAPE20. S. Pierucci and G. Buzzi Ferraris (Editors). [ Links ]
Lynd, L.R., Weimer, P.J., van Zyl, W.H., Pretorius, I.S. (2002). Microbial Cellulose Utilization: Fundamentals and Biotechnology. Microbiology and Molecular Biology Review 66(3), 506–577. [ Links ]
Mandels, M., Andreotti, R., Roche, C. (1976). Measurement of saccharifying cellulase. Biotechnology and Bioengineering 6, 21–33. [ Links ]
Megawati, W.B., Sediawan, H.S., Muslikhin, H. (2010). Pseudo–Homogeneous Kinetic of Dilute–Acid Hydrolysis of Rice Husk for Ethanol Production: Effect of Sugar Degradation. International Journal of Engineering and Applied Sciences 6(1), 64–69. [ Links ]
Miller, G.L. (1959). Use of dinitrosalicylic acid reagent for determination of reducing sugars. Analytical Chemistry 31, 426– 428. [ Links ]
Miller, S., Hester, R. (2007). Concentrated Acid Conversion of Pine Softwood to Sugars. Part I: Use of a Twin–Screw Reactor for Hydrolysis Pretreatment. Chemical Engineering Communications 194, 85–102. [ Links ]
Miller, S., Hester, R. (2007). Concentrated Acid Conversion of Pine Softwood to Sugars. Part II: High–Temperature Batch Reactor Kinetics of Pretreated Pine Sawdust. Chemical Engineering Communications 194, 103–116. [ Links ]
Nabarlatz, D., Farriol, X., and Montane, D. (2004). Kinetic Modeling of the Autohydrolysis of Lignocellulosic Biomass for the Production of Hemicellulose–Derived Oligosaccharides. Industrial & Engineering Chemistry Research 43, 4124–4131. [ Links ]
Olofsson, K., Bertilsson, M., Lidén, G. (2008). A short review on SSF – an interesting process option for ethanol production from lignocellulosic feedstocks. Biotechnology for Biofuels 1,7. [ Links ]
Philippidis, G.P., Hatzis, C. (1997). Biochemical Engineering Analysis of Critical Process Factors in the Biomass–to–Ethanol Technology. Biotechnology Progress 13, 222–231. [ Links ]
Punsuvon, V., Vaithanomsat, P., Iiyama, K. (2008). Simultaneous production of ?–cellulose and furfural from bagasse by steam explosion pretreatment. Maejo International Journal of Science and Technology 2(01), 182–191. [ Links ]
Ramírez, O.R., Ramírez, L.R.G., López, G.F. (2002). Factores estructurales de la pared celular del forraje que afectan su digestibilidad. Ciencia UANL 2, 180–189. [ Links ]
Reese, E.T. and Maguire, A. (1969). Surfactants as Stimulants of Enzyme Production by Microorganisms. Applied Microbiology 17(2), 242–245. [ Links ]
Saha, B.C., Cotta, M.A. (2006). Ethanol Production from Alkaline Peroxide Pretreated Enzymatically Saccharified Wheat Straw. Biotechnology Progress 22, 449–453. [ Links ]
Saha, B.C., Loren, B.I., Michael, A.C., Wu, Y.V. (2005). Dilute Acid Pretreatment, Enzymatic Saccharification, and Fermentation of Rice Hulls to Ethanol. Biotechnology Progress 21, 816–822. [ Links ]
Schell, D.J., Farmer, J., Newman, M., Mcmillan, J.D. (2003). Dilute–Sulfuric Acid Pretreatment of Corn Stover in Pilot–Scale Reactor. Investigation of Yields, Kinetics, and Enzymatic Digestibilities of Solids. Applied Biochemistry and Biotechnology 105, 69–85. [ Links ]
Silverstein, R.A., Ye, Ch., Ratna, R., Sharma–Shivappa, Boyette, D.M., Osborne, J. (2007). A comparison of chemical pretreatment methods for improving saccharification of cotton stalks. Bioresource Technology 98, 3000–3011. [ Links ]
Sims, R. (2003). Biomass and resources bioenergy options for a cleaner environment in developed and developing countries. Elsevier Science, London, UK. [ Links ]
Taherzadeh, M.J., Keikhosro, K. (1997). Enzyme–based hydrolysis processes for ethanol from lignocellulosic materials: a review. BioResources 2(4), 707–738. [ Links ]
Taherzadeh, M.J., Keikhosro, K. (2007). Acid–based hydrolysis processes for ethanol from lignocellulosic materials: A review. BioResources 2, 472–499 (I). [ Links ]
Taherzadeh, M.J., Keikhosro, K. (2007). Enzymatic–based hydrolysis processes for ethanol from lignocellulosic materials: A review. BioResources 2, 707–738 (II). [ Links ]
Tucker, M.P., Kyoung, H.K., Mildred, M.N., Quang, A.N. (2003). Effects of temperature and moisture on dilute–acid steam explosion pretreatment of corn stover and cellulase enzyme digestibility. Applied Biochemistry and Biotechnology 105(3), 165–177. [ Links ]
Venkatesh, P.S., Volker, S.U., Heller, W.T., McGaughey, J., Miller, S., Hester, R. (2010). Concentrated Acid Conversion of Pine Softwood to Sugars. Part I: Use of a Twin–Screw Reactor for Hydrolysis Pretreatment. Chemical Engineering Communications 194, 85–102. [ Links ]














