El calcio (Ca2+) es un catión muy importante en los organismos al fungir como segundo mensajero en diversas cascadas de señalización y mediar muchas funciones dentro de las células. Por ejemplo, participa en el crecimiento celular, se involucra en la comunicación entre distintas células y tiene un papel importante durante la muerte celular, ya sea por apoptosis o necrosis.
Durante las últimas décadas se ha descubierto que la mitocondria juega un papel fundamental en la homeostasis de calcio. La absorción de este ión trae consecuencias fisiológicas de alta importancia para las células, además de que evita que se enciendan cascadas de señalización en determinado momento al reducir la concentración de calcio en el citoplasma.
Además, se sabe que el calcio libre en la matriz mitocondrial aumenta la tasa de síntesis de ATP al modular la actividad de diversas enzimas que tienen como sustrato productos del ciclo de Krebs. De esta manera se controla el flujo de electrones creando un potencial transmembranal muy grande. Éste representa una fuerza neta muy potente que atrae al catión hacia la matriz mitocondrial.
El proceso de captación de calcio por la mitocondria debe ser finamente regulado, debido a que si el calcio entra a la matriz de forma continua se da una sobrecarga que causa pérdidas energéticas, así como alteraciones morfológicas que promueven la liberación de factores apoptóticos o producen necrosis.
Recientemente, los grupos de Rizzuto y Mootha encontraron el sistema que permite la entrada del catión divalente a la matriz mitocondrial y que es conocido como el uniportador mitocondrial de calcio (MCU). Este sistema presenta baja actividad cuando las concentraciones de calcio están en reposo (~100 nM). La actividad de MCU dependiente de la concentración de calcio se regula por los elementos asociados al transportador y que forman un complejo multiproteínico: MICU1 y MICU2. Estos elementos forman heterodímeros que no permiten la apertura de MCU cuando la concentración de calcio es la basal. Sin embargo, cuando aumenta el calcio el dímero presenta cooperatividad y permite el paso de dicho ión hacia la matriz de la mitocondria (Fig. 1).
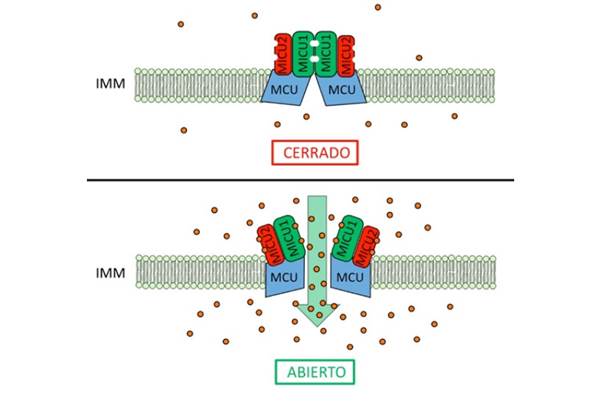
Figura 1 MCU. Imagen editada de Patron et al. (2014) en la que se muestra un modelo de la regulación de la apertura del MCU. a) Cerrado. En concentraciones basales de calcio no se permite la entrada de dicho ión, gracias a la función inhibitoria de MICU2. b) Abierto. Cuando la concentración de calcio aumenta se presenta el fenómeno de cooperatividad, en el que MICU2 deja de funcionar como inhibidor y permite que MICU1 active a MCU.
En el trabajo publicado por Patron et al. (3) se demuestra que MICU1 y MICU2 tienen actividades reguladoras antagónicas. MICU2 es el elemento que regula la función de apertura del complejo y MICU1 es necesario para que MICU2 pueda realizar su función, ya que cuando no se presenta MICU1 el dímero no puede formarse.
En el caso contrario, cuando MICU2 no se expresa, se forman homodímeros de MICU1 que permiten un mayor flujo de Ca2+ al interior debido a que la cooperatividad ahora se manifiesta por los dos elementos activadores.
Este resultado es muy interesante debido a que, al introducir a MICU2 como el elemento responsable de la regulación de la entrada de calcio a la mitocondria, contrasta con la idea previa de que MICU1 es el responsable tanto de la regulación positiva como de la negativa del MCU. Por consiguiente MICU2 se sugiere como un factor importante para el óptimo desempeño celular al prevenir la acumulación continua de calcio en la matriz mitocondrial.











 nueva página del texto (beta)
nueva página del texto (beta)


