Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
REB. Revista de educación bioquímica
versión impresa ISSN 1665-1995
Rev. educ. bioquím vol.32 no.1 Ciudad de México mar. 2013
Artículos
El Papel de la Galectina-3 en el desarrollo del cancer de mama
I. Belem Gallegos1, Blanca Cuevas1, Eduardo Pérez Campos1, Rocío Coutiño2 y Pedro Hernández Cruz1
1 Laboratorio de Glicobiología del cáncer. Centro de Investigaciones en Ciencias Médicas y Biológicas Facultad de Medicina UABJO Oaxaca Méx. C.P. 68020 Tel y Fax: 951 513 9784 correo E: fuegoblanco136@yahoo.com.mx
2 Instituto de Salud Pública. Universidad Veracruzana. Xalapa, Ver.
Recibido: 1 de junio de 2012
Aceptado: 4 de diciembre de 2012
Resumen
El cáncer de mama es la segunda causa de muerte de mujeres en el mundo, sin embargo si es diagnosticado oportunamente puede ser curado. Recientemente se ha observado que cambios en la estructura de los oligosacáridos de las proteínas de membrana, se relacionan con los procesos de transformación y proliferación celular, los cuales pueden originar el cáncer de mama, además, la presencia de receptores para estos carbohidratos, puede potencializar la capacidad metastásica del tumor. En esta revisión se presenta una visión general de los marcadores glicosilados y de sus receptores, especialmente la galectina-3, que se ha asociado al cáncer de mama.
Palabras clave: Canales de Carbohidratos, cáncer de mama, lectinas, galectina-3.
Abstract
Breast cancer is the second cause of death of women in the world and when it is diagnosed opportunely can be cured. Recently it has been observed that changes in the oligosaccharides structures of membrane proteins are related to the transformation processes and cellular proliferation, in addition, the presence of receptor for these carbohydrates, can potentialise the metastatic capacity of the tumor. In this revision a general overview of the glycosylated markers and their receptors, especially galectin-3 that, has been associated to the breast cancer.
Key words: Carbohydrates, breast cancer, lectins, galectin-3.
Introducción
Las neoplasias son crecimientos descontrolados de células en cualquier tipo de tejido. En la actualidad el cáncer de mama es la principal causa de muerte en mujeres en países desarrollados. Las glándulas mamarias se localizan en el tejido subcutáneo, están constituidas de tejido parenquimatoso que se divide en un número de 15 a 20 lóbulos. Cada lóbulo está formado por una serie de conductos intralobulillares que desembocan en los conductos galactóforos que se vierten a nivel del pezón. Los conductos galactóforos tienen un epitelio cilíndrico o cúbico con células que tienen un núcleo redondeado y en el citoplasma contienen pocas mitocondrias y escaso retículo endoplásmico rugoso (Fig. 1).
En 1957, Bloom y Richardson (1) propusieron el sistema de clasificación histológico que actualmente se emplea en la tipificación del grado de avance del cáncer de mama. El cáncer ductal infiltrante se inicia en el sistema de pequeños conductos que llevan la leche de los lóbulos al pezón. Empieza cuando las células epiteliales anormales que recubren los ductos, se dividen, se multiplican y posteriormente, estas células invaden el ducto y en su fase más dañina, llegan a invadir el estroma que rodea a los ductos (Fig. 1). El diagnóstico del cáncer de mama se realiza mediante la correlación de la exploración clínica, la mastografía y la confirmación siempre se hace con el estudio histopatológico. Además de la caracterización histológica mediante la tinción con hematoxilina-eosina, se realizan pruebas de inmunohistoquímica, en donde se utilizan una serie de marcadores tumorales, como por ejemplo: los receptores de estrógenos y progesterona, el antígeno nuclear de proliferación celular, la catepsina D, el c-erb-2, Bcl-2 y P53, entre otros. Sin embargo, el uso de estos marcadores no cubre la posibilidad de que otro tipo de moléculas estén participando activamente en los procesos de proliferación, transformación y metástasis.
Glicosilación y cáncer de mama
Los oligosacáridos son carbohidratos que están formados por cadenas cortas de monosacáridos unidos entre sí por medio de enlaces glicosídicos, los cuales se encuentran formando parte de glicoproteínas y glicolípidos, presentes en las membranas celulares, donde intervienen en funciones celulares al participar en procesos como: tráfico de proteínas, interacciones de ligandos con sus receptores, relación huésped-parásito. Las cadenas oligosacarídicas están constituidas por tres regiones principales: a) el núcleo o "core", es la región en donde se encuentran los carbohidratos más cercanos al sitio de unión con la cadena polipeptídica, b) el esqueleto, que es la región en donde se determina la longitud del oligosacárido y c) la región periférica, donde se encuentran antígenos de importancia biológica, como por ejemplo los antígenos de los grupos sanguíneos.
Las glicoproteínas se clasifican, de acuerdo a la unión entre el azúcar y el aminoácido, en N- y O-glicanos (Fig. 2). Los N-glicanos, generalmente presentan una N-acetil-D-glucosamina (GlcNAc) unida al nitrógeno del aminoácido asparagina (Asn). Los N-glicanos presentes en las proteínas se clasifican en tres grandes grupos: a) con un alto contenido de manosa (Man) en su estructura, b) las estructuras del tipo lactosamínico, las cuales tienen como característica principal, la presencia de Galβ(1-4)GlcNAc y c) las estructuras híbridas, las cuales contienen una mezcla de las estructuras lactosamínicas y de manosas. Hasta el momento no se han encontrados N-glicanos asociados al desarrollo de cáncer de mama. Los O-glicanos poseen una N-acetil-D-galactosamina (GalNAc) unida al hidroxilo del aminoácido serina (Ser) o del aminoácido treonina (Thr) de la cadena polipeptídica. Los O-glicanos muestran una mayor variedad de estructuras, que los N-glicanos, presentan ocho núcleos ("core") de las cuales se derivan el resto de estructuras oligasacarídicas presentes en glicoproteínas (Fig. 3). Por su gran complejidad y diversidad, los O-glicanos se encuentran participando en diversas funciones: pueden participar en la conformación de la estructura secundaria, terciaria e inclusive de la cuaternaria de algunas proteínas como en el caso de las mucinas, también participan evitando la agregación de las proteínas (2). Como consecuencia de la transformación maligna (cáncer) ocurren cambios muy importantes en la glicosilación, sobre todo en la etapa de elongación de los O-glicanos. Esto determina que algunos tipos de núcleos ("cores"), que en las células normales se encuentran enmascarados por la adición de otros azúcares, queden expuestos en la superficie celular, resultando en la formación de nuevos antígenos asociados al cáncer. Los antígenos mejor caracterizados en el cáncer de mama son los antígenos Tn, [GalNAc(α1-O-)Ser/Thr], sialil-Tn [Neu(α2-6)GalNAc(α1-O-)Ser/Thr], T o TF [Gal(α1-3)GalNAc(α1-O-)Ser/Thr] y sialil-T [Neu(α2-6)Neu(α2-3)Gal(β1-3)GalNAc(α1-O-)Ser/Thr] (4) (Fig. 3). La expresión de estos antígenos es el resultado de una glicosilación incompleta, lo que origina que las cadenas oligosacarídicas de las proteínas se acorten, exponiendo carbohidratos que normalmente se encuentran enmascarados por la adición de otros azúcares, queden expuestos en la superficie celular, originando nuevos antígenos. La expresión de estos antígenos suele ser discontinua a lo largo de la cadena polipeptídica. El antígeno Tn es el precursor del antígeno T o TF: por la acción de una β galactosil transferasa, se ha observado que la actividad de la enzima β galactosil transferasa puede estar bloqueada, por un amento en la actividad de las sialil transfersas, lo que provoca una temprana terminación del antígeno Tn, (5), que normalmente se encuentra sustituido con galactosa (Gal) o N-Acetilglucosamina (GlcNAc). La expresión del antígeno sialil-Tn se ha asociado con carcinomas, como por ejemplo: adenocarcinoma gástrico difuso, cáncer de pulmón, cáncer cervico-uterino y cáncer de hígado (6). Al antígeno Tn, también se le puede adicionar N-Acetilglusonamina (GlcNAc) formando los "cores" 3, 4 y 6 (Fig. 4) y N-Acetilgalactosamina (GalNAc) formando los "cores" 5, 7 y 8 (Fig. 3). La expresión de estos "cores", no se ha relacionado con cáncer de mama.

La expresión de antígenos del tipo sialil-Lewis, se ha asociado con la capacidad de las células transformadas para invadir otros tejidos, debido a que son ligandos para moléculas de adhesion, como por ejemplo: la E-selectina y así, poder evadir al sistema inmune. Estos O-glicanos algunas veces están unidos a glicoproteínas que pueden ser expresadas en las membranas celulares, lo que permitiría la búsqueda de nuevos marcadores glicosilados para la detección del cáncer de mama desde sus fases iniciales en donde los métodos histológicos no logran diferenciar la morfología celular.
Lectinas
El termino lectina se aplica a proteínas o glicoproteínas de origen no inmune que reconocen de manera específica carbohidratos de la superficie celular o en suspensión, aglutinan células y precipitan glicoconjugados; las lectinas poseen por los menos dos sitios de reconocimiento a carbohidrato, de ahí su capacidad para aglutinar células, aunque en la actualidad el termino de lectina se ha aplicado a proteínas con un solo sitio de reconocimiento a carbohidrato como es el caso de las selectinas. Las lectinas no poseen actividad enzimática y no son producto de una respuesta inmune. Estas proteínas se encuentran ampliamente distribuidas en la naturaleza y han sido identificadas en diversos organismos como virus, bacterias, hongos, plantas, así como en vertebrados superiores. Aunque varias de estas proteínas poseen especificidad por estructuras sacarídicas semejantes, presentan actividades biológicas diversas, como son: la aglutinación de eritrocitos de diferentes especies, la estimulación mitógenica de linfocitos e inhibición de la fagocitosis. Debido a la capacidad de estas proteínas para interactuar con células de la respuesta inmune, algunas lectinas poseen efectos inmunosupresores, otras también son tóxicas, inhiben el crecimiento de células tumorales y participan en la adhesión celular. Todas las actividades biológicas reportadas para las lectinas tienen en común el reconocimiento de un receptor de carácter oligosacarídico (7). Las lectinas se consideran valiosas herramientas en el campo de la genética, la biomedicina y la inmunología. Su utilidad se basa en la propiedad para enlazarse con varios tipos de glicoconjugados presentes en las superficies celulares y fluidos corporales, así como la actividad mitogénica que poseen que permiten se utilizadas en estudios de proliferación de células como los linfocitos.
Actualmente se han empleado lectinas para investigar el desarrollo de cáncer, como por ejemplo por medio de histoquímica, se ha demostrado que la lectina de Vicia villosa (VVA), (8) y la lectina de Helix pomatia (HPA) (9), ambas con especificidad hacia GalNAc, han sido utilizadas como factor pronóstico en el cáncer de mama. La lectina de Arachis hypogeae (PNA), especifica para el antígeno TF, ha demostrado servir como marcador pronósticos en el cáncer de mama (10), la lectina de Amaranthus leucocarpus (ALL), especifica para los antígenos Tn y TF, se ha empleando en el estudio del cáncer cervicouterino y en fibroadenoma (11, 12). En los tejidos animales, se han aislado lectinas que son receptores potenciales de las estructuras oligosacaridicas, expresadas en las células y que pueden tener participación en diversos fenómenos biológicos, un ejemplo de estas lectinas, son las galectinas.
Galectinas
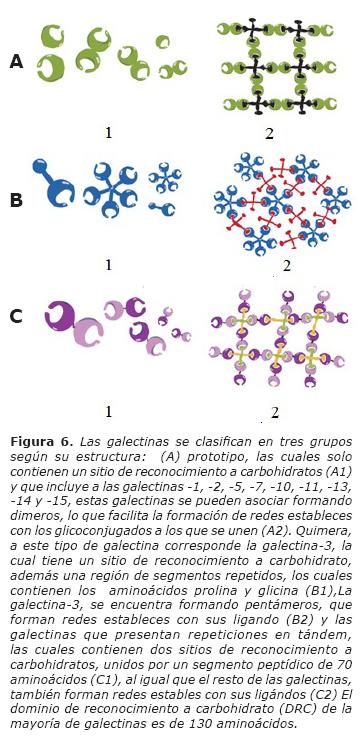
Es una familia de proteínas extremadamente conservadas a través de la evolución; que participan en diversos eventos biológicos. Son capaces de descifrar glicocódigos específicos en macromoléculas complejas situadas en las membranas celulares o en la matriz extracelular (13, 14), a través de un dominio de 130 aminoácidos filogenéticamente conservado desde invertebrados inferiores a mamíferos, denominado dominio de reconocimiento de carbohidratos (DRC), con el cual reconocen β-galactósidos (Fig. 4) (13, 14). Su amplia distribución en la naturaleza y sus secuencias aminoacídicas conservadas a través de la evolución, sugieren que estas proteínas podrían cumplir papeles fisiológicos esenciales (Fig. 5), estas proteínas han sido involucradas en fenómenos de inmunomodulación (13, 14), adhesión celular (13, 14), regulación del crecimiento (13, 14), metástasis (15) y proliferación (16, 17) . Se ha observado que estas proteínas de unión a carbohidratos ejercen sus efectos biológicos a través del reconocimiento de azúcares específicos en ligandos intracelulares, receptores de membrana y glicoproteínas extracelulares. La ejecución de sus funciones varía en forma considerable de acuerdo a su localización subcelular. Las galectinas pueden tener efectos contrarios, así por ejemplo mientras que la galectina-1 inhibe la desgranulación de mastocitos y la migración de los leucocitos, la galectina-3 promueve la migración de los mastocitos y migración leucocitaria. La familia de las galectinas, pueden ser clasificadas en tres grupos: aquellas que tienen un dominio de reconocimiento de carbohidratos (DRC) y son las galectinas -1,-2, -5, -7, -10, -11, -13, -14 y -15, las que tienen dos DRC, uno encima de otro, y se unen por un fragmento peptídico de 70 aminoácidos y corresponden a las galectinas -4, -6, -8, -9 y -12 y las de tipo quimérico que tienen un dominio proteico amino terminal con secuencias repetitivas de glicina y prolina como la galectina-3 (Fig. 6) (18).
Galectina-3
Hallada en el núcleo de los fibroblastos 3T3 de ratón en 1986, utilizando inmunofluorescencia, descrita en un principio como PFC-35 (19), posteriormente llamada también CBP-35 proteína ligante de carbohidratos 35, Mac-2, IgEBP proteína ligante de Ig E, CBP-30, RL-29, L-29, L-31. L-31, L-34 Y LBL. La galectina-3 es una proteína de 26 kDa, cuyo gen que la sintetiza se encuentra en el cromosoma 14q21.3 (20). Funciona como un receptor para ligándos que contienen poli-N-acetil-galactosamina. Normalmente se encuentra en el epitelio de diferentes órganos y en células de respuesta inflamatoria como los macrófagos, células dendríticas y de Kupffer. La galectina-3 tiene funciones tanto intracelulares como extracelulares. En relación con sus funciones intracelulares se le ha identificado como un componente de ribocucleo-proteínas heterogéneas y como un factor en el empalme del RNA mensajero. Así mismo, participa en el control del ciclo celular y reduce la apoptosis de las células T probablemente a través de la interacción con miembros de la familia del Bcl-2. La galectina-3 se secreta por monocitos, macrófagos y células epiteliales. Como molécula extracelular activa a monocitos, macrófagos, mastocitos, neutrófilos y linfocitos e interviene en las interacciones entre célula y célula, así como entre célula y matriz extracelular. Promueve el crecimiento de las neuritas, induce la diferenciación y angiogénesis de las células endoteliales y funciona como una sustancia quimio-atrayente de los monocitos y células endoteliales. La galectina-3, se sintetiza en el citoplasma y habitualmente se localizada en el núcleo, en el líquido extracelular y en la superficie celular, donde la enriquecen y se acoplan a glicoconjugados de la membrana plasmática y de la matriz extracelular aunque también ejercen interacciones homo- y heterotipicas con otras lectinas multivalentes (21). La localización intracelular de la galectina-3 juega un papel importante en la protección contra apoptosis, la regulación de la expresión génica ciclina D1 (22) y la regulación del corte y empalme o "splicing" (23), siendo este un proceso de eliminación de los intrones del transcrito primario y la posterior unión de los exones en el pre-RNA nuclear. Por otra parte, su localización en la superficie celular y en el medio extracelular indica su participación en la interacción célula-célula, adhesión celular, proliferación, angiogénesis, crecimiento celular (Fig. 5).
Participacion de la galectina tres en el desarrollo del cáncer de mama
El papel de la galectina-3 en el desarrollo de cáncer se debe, a su participación en varios mecanismos, como por ejemplo: adhesión célula-célula, interacción matriz extracelular-célula, apoptosis y angiogénesis (24). Existe evidencia que la expresión de la galectina-3 es necesaria para el inicio de la transformación celular, en el desarrollo del tumor (Fig. 7a) (25). El mecanismo por el cual la galectina-3 participa en la trasformación celular, no ha sido esclarecido con certeza, pero puede estar relacionado con su habilidad para interactuar con K-RAS y facilitar la transducción de la señal hacia RAF y fosfatidilinositol 3 cinasa (Fig. 7a). La galectina-3 también puede estimular la producción de ciclina D y c-MYC (Fig. 7b). Estudios en líneas celulares de carcinoma mamario han demostrado que después de inhibir la expresión de la galectina-3, pierden su fenotipo característico en el medio de cultivo celular (26)
La función mas estudiada de la galectina-3, se relaciona con la inhibición de la apoptosis (27). El mecanismo por el cual la galectina-3 lleva a cabo esta función, no ha sido esclarecido, pero se cree que después de un estímulo apoptótico, la galectina-3 puede traslocar del citosol o núcleo hacia la mitocondria, donde bloquea cambios en el potencial de membrana de la mitocondria, previniendo la apoptosis, sin embargo, la galectina-3 presente en el núcleo debe ser fosforilada, para poder emigrar del núcleo, así mismo la galectina-3, regula la vía de la proteína cinasa activada por nitrógeno (MAKP), implicada en la regulación de la apoptosis (fig. 7c).
El papel de la galectina-3 en el desarrollo del cáncer de mama no es muy claro, sin embargo, en estudios in vitro (28) se determino que el bloqueo de la expresión de galectina-3 en el núcleo y el citoplasma de la línea celular cancerígena de alta malignidad MDA-MB-435 inyectada a ratones desnudos suprimía el crecimiento de tumores, sugiriendo que la expresión de galectina-3 es necesaria para la tumoregenidad en el cáncer de mama MDA-MB-435. Más tarde, (29) se proporciono evidencia en la cual la galectina-3 promovía el potencial metastásico en las células de cáncer de mama BT549 quedando sobre entendido que la sobre expresión otorga esta propiedad. Mayoral et al., analizaron diferentes tejidos glandulares de autopsias (30) sometidas a inmunohistoquímica con anticuerpos antigalectina-3, encontrando que no existe reacción hacia galectina-3 en el tejido normal de mama en contraste con la fuerte inmunorreactividad hacia galectina-3 en el cáncer de mama metastásico al cerebro. En estos tejidos se observo la inmunorreactividad ante la galectina-3 tanto intracelular como extracelular se reporta una baja reactivad hacia galectina-3 en el cáncer metastásico hacia el cerebro de origen mamario comparado con la reacción en el tejido de cáncer de mama. En nuestro laboratorio estudios preliminares demuestran que la expresión de antígeno T, no varia según el estadio del cáncer de mama, mientras que la galectina-3 varia según el grado de diferenciación del cáncer ductal infiltrante (Fig. 8). Estudios recientes han correlacionado la presencia del antígeno TF y de la galectina-3 en la adhesion de las células transformadas al endotelio, promoviendo su migración los ganglios localizados en las axilas (31).
El potencial uso de la galectina tres como marcador para el diagnostico de cancer de mama
La galectina-3 es una proteína, que realiza diversas funciones, según el lugar donde se encuentre localizada, en el citosol, se puede transportar al núcleo, puede encontrarse en la superficie de la célula o en algunos casos puede ser secretada. Poco se sabe sobre el papel de la galectina-3 cuando se encuentra en circulación, se ha observado que puede regular la actividad anti-tumoral de los linfocitos T; ya que su unión a la superficie celular provoca la expresión de citosinas inmunosupresoras como el IFγ; y por lo tanto inducir la apoptosis, este fenómeno, se ha observado que no ocurre en las células T vírgenes, lo que sugiere que la activación del receptor de células T, puede inducir cambios en la glicosilación, lo que hace que estas células T, sean blancos potenciales para la galectina-3 soluble (32). También se ha observado que los niveles de la galectina-3 en circulación aumenta en ciertos tipos de canceres, cuando se hace la comparación con pacientes clínicamente sanos, como es el caso del cáncer mama (32). La técnica empleada para la detección de la galectina-3 en circulación es la de ensayo por inmunoabsorción ligado a enzima (ELISA, por sus siglas en inglés), esto hace que la determinación de los niveles séricos de galectina-3, se podría convertir en una prueba de rutina, junto con el ultrasonido y mastografía, para la detección oportuna del cáncer de mama.
Referencias
1. Bloom HJG, Richardson WW (1957) Histologic grading and prognosis in breast cancer: A study of 1.709 cases of which 359 have been followed for 15 years. Br J Cancer 2:353-377. [ Links ]
2. Carraway KL, Hull SR (1991) Cell surface mucin-type glycoprotein and mucin like domains. Glycobiology 1:131-138. [ Links ]
3. Montreuil J (1995) Methods on Glycoconjugates. A Laboratory Manual, Editor: André Verbert. Harwood Academic Publishers. Austria. pp 1-23. [ Links ]
4. Brockhausen I (2006) Mucin-type O-glycans in human colon and breast cancer: glycodynamics and functions. EMBO Rep 7:599-604. [ Links ]
5. Zhuang D, Yousefi S, Dennis JW (1991) Tn antigen and UDP-Gal:GalNAc alpha-R beta1-3Galactosyltransferase expression in human breast carcinoma. Cancer Biochem Biophys. 12:185-98. [ Links ]
6. Cao Y, Karsten U, Otto G, Bannasch P (1999) Expression of MUC1, Thomsen-Friedenreich antigen, Tn, sialosyl-Tn, and alpha2,6-linked sialic acid in hepatocellular carcinomas and preneoplastic hepatocellular lesions. Virchows Arch 434:503-9. [ Links ]
7. Van den Steen P, Rudd MP, Dwek AR, Opdenaker G (1998) Concepts and Principles of O-glycosylation. Crit Rev Biochem Mol Biol 33:151-208. [ Links ]
8. Kawaguchi T, Takazawa H, Imai S, Morimoto J, Watanabe T, Kanno M, Igarashi S (2006) Expression of Vicia villosa agglutinin (VVA)-binding glycoprotein in primary breast cancer cells in relation to lymphatic metastasis: is atypical MUC1 bearing Tn antigen a receptor of VVA? Breast Cancer Res Treat 98:31-43. [ Links ]
9. Brooks S A, Hall D M, Buley I (2001) GalNAc glycoprotein expression by breast cell lines, primary breast cancer and normal breast epithelial membrane. Br J Cancer 28:1014-22. [ Links ]
10. Stanley M W, Kiang D T, Sibley RK (1986). Peanut lectin binding in breast carcinoma. Lack of correlation with estrogen receptor content. Cancer Nov 1;58(9):2046-51. [ Links ]
11. Santaella A, Gallegos B, Perez E, Zenteno E, Hernández P (2007) Use of Amaranthus leucocarpus Lectin to Differentiate Cervical Dysplasia (CIN) Prep Biochem Biotechnol 37:219-228. [ Links ]
12. Gallegos B, Pérez-Campos E, Martinez R, Leyva P, Martinez M, Hernández R, Pina S, Hernández C, Zenteno E, Hernández P (2010) O-glycosilation expression in fibroadenoma. Prep Biochem Biotechnol 40:1-12. [ Links ]
13. Rabinovich GA (1999) Galectins: an evolutionarily conserved family of animal lectins with multifunctional properties; a trip from the gene to clinical therapy. Cell Death Differ 6:711-22. [ Links ]
14. Kasai K, Hirabayashi J (1996) Galectins: a family of animal lectins that decipher glycocodes. J Biochem 119:1-8. [ Links ]
15. Yoshimasa I (2000) Oxidized galectin-1 promotes axonal regeneration in peripheral nerves but does not possess lectin properties. Eur J Biochem 267:2955-64. [ Links ]
16. Dagher SF, Wang JL, Patterson RJ (1995) Identification of galectin-3 as a factor in pre-mRNA splicing. Proc Natl Acad Sci USA 92:1213-7. [ Links ]
17. Gillenwater A, Xu XC, Estrov Y, Sacks PG, Lotan D, Lotan R (1998) Modulation of galectin-1 content in human head and neck squamous carcinoma cells by sodium butyrate. Int J Cancer 75:217-24. [ Links ]
18. Leffler H (1997) Introduction to galectins. Trends Glycosci. Glycotechnol 9:9-19. [ Links ]
19. Moutsatsos IK, Davis JM, Wang J (1986) L. Endogenous lectins from cultured cells: subcellular localization of carbohydrate-binding protein 35 in 3T3 fibroblasts. Journal of Cell Biology 102:477-483. [ Links ]
20. Krzeslak A, Lipinska A (2004) Galectin-3 as a multifunctional protein. Cell Mol Biol Lett 9:305-328. [ Links ]
21. Brewer CF (1997) Cross-linking activities of galectins and other multivalent lectins. Trends Glycotech 9:155-165. [ Links ]
22. Lin HM, Pestell RG, Raz A, Kim HRC (2002) Galectin-3 enhances cyclin D(1) promoter activity through SP1 and Camp-responsive element in human breast epithelial cells. Oncogen 21:8001-8010. [ Links ]
23. Yang R, Hsu D, Liu T (1996) Expression of galectin-3 modulates T-cell growth and apoptosis. Proc Natl Acad Sci USA 93:6737-6742. [ Links ]
24. Roland J Pieters (2006) Inhibition and Detection of Galectins. ChemBioChem 7:721-728. [ Links ]
25. Lu-Gang Yu, Nigel Andrews, Qicheng Zhao, Daniel McKean, Jennifer F. Williams, Lucy J. Connor, Oleg V. Gerasimenko, John Hilkens Jun Hirabayashi, Kenichi Kasai, Jonathan M. Rhodes (2007) Galectin-3 Interaction with Thomsen-Friedenreich Disaccharide on Cancer-associated MUC1 Causes Increased Cancer Cell Endothelial Adhesion Journal of Biological Chemistry 282:773-781. [ Links ]
26. Honjo Y, Nangia-Makker P, Inohara H, Ra A (2001) Downregulation of galectin-3 suppresses tumorigenicity of human breast carcinoma cells. Clin Cancer Res 7:661-668. [ Links ]
27. Liu FT, Rabinovich GA (2005) Galectins as modulators of tumour progression. Nat Rev Cancer 5:29-41. [ Links ]
28. Honjo Y, Nangia-Makker P, Inohara H, Raz A (2001) Down-regulation of galectin-3 suppresses tumorigenecity of human breast carcinoma cells. Clin Cancer Res 7:661-668. [ Links ]
29. Song YK, Billiar TR, Lee YJ (2002) Role of galectin-3 in breast cancer metastasis. Involvement of nitric oxide. Am J Pathol 160:1069-1075. [ Links ]
30. Mayoral MA, Mayoral C, Meneses A, Villalvazo L, Guzman A, Espinosa B, Ochoa JL, Zenteno E, Guevara J (2007) Identification of Mucin-type O-glycans and Galectin-3 in breast cancer and brain metastasis. Cancer Invest 26:615-23. [ Links ]
31. K. Sujathan1, Thara Somanathan1, Nimi GK, Preethi Sara George, Elizabeth K. Abraham y P. Remani. (2011) Down regulation of galectin-3 in primary tumor tissues of breast predict axillary lymph node metastasis. Journal of Cancer Research and Experimental Oncology Vol. 3:37-49. [ Links ]
32. Iurisci I, Tinari N, Natoli C, Angelucci D, Cianchetti E, Iacobelli S (2000) Concentrations of galectin-3 in the sera of normal controls and cancer patients. Clin Cancer Res 6:1389-1393. [ Links ]














