Introducción
La fiebre manchada por Rickettsia rickettsii (FMRR) es una enfermedad reemergente en Sonora. Es un padecimiento transmitido al humano por artrópodos vectores infectados, en México la garrapata Rhipicephalus sanguineus es el principal vector de la enfermedad (Eremeeva et al., 2015). La FMRR constituye una amenaza médica cuando no es tratada oportunamente al asociarse a una elevada letalidad, que oscila en Sonora entre 20 y 40 % (Álvarez et al., 2015). Históricamente, en la región su presencia está ligada a determinantes biológicos y sociales, que explican la ocurrencia de casos y brotes durante todo el año (Álvarez y Contreras, 2013).
La sospecha temprana de FMRR se complica por la poca especificidad del cuadro clínico inicial, que semeja a otros padecimientos endémicos de la región como dengue e influenza (Álvarez et al., 2017). La confirmación diagnóstica puede establecerse hasta cuatro semanas posteriores al inicio sintomático al identificar una cuadruplicación en los títulos de anticuerpos IgM e IgG por inmunofluorescencia indirecta (IFI) (La Scola y Raoult, 1997; Biggs et al., 2016). La IFI es la prueba estándar para confirmar FMRR, pero es menos útil clínicamente, pues cuando los títulos de IgM e IgG son evidencia confirmatoria el paciente se ha recuperado o ha fallecido.
Una técnica alternativa para confirmar FMRR es la reacción en cadena de polimerasa (PCR), pues es un método válido y más temprano para confirmar la sospecha en muestras de sangre total (Bechah et al., 2011; Santibáñez et al., 2013; Oteo et al., 2014). Sin embargo, es menos claro su desempeño en otras muestras biológicas como el hisopado cutáneo y orina, que además de ser menos invasivas, sean oportunas para la toma de decisiones médicas de esta enfermedad, como ha sido documentado en otros padecimientos con similar expresión clínica como fiebre Zika (Gourinat et al., 2015), leptospirosis (Bal et al., 1994) y tuberculosis (Gopinath y Singh, 2009).
La presente investigación explora la confiabilidad clínica del hisopado cutáneo y la orina obtenidos de pacientes sospechosos de FMRR que fueron atendidos en hospitales públicos de Sonora, mediante la técnica de PCR en punto final. El estudio pretende generar resultados que mejoren la capacidad diagnóstica de la FMRR a nivel regional.
Materiales y métodos
Mediante un diseño transversal se estimó la confiabilidad de muestras de hisopado cutáneo y de orina de pacientes hospitalizados por sospecha clínica de FMRR, utilizando la PCR en punto final para identificar Rickettsia rickettsii. Los pacientes fueron atendidos en hospitales públicos de Sonora entre el 20 de septiembre de 2018 y el 31 de octubre de 2019. Para examinar la capacidad diagnóstica de PCR en ambas muestras, se empleó como método estándar la determinación de PCR en muestras sanguíneas obtenidas de los mismos pacientes. El estudio recibió aprobación por parte de un comité de ética en investigación acreditado.
Tipo y tamaño de la muestra
La muestra del estudio constó de 110 sujetos que recibieron atención médica en los sitios de estudio; de ellos, 79 (71.8 %) fueron sospechosos de FMRR (Grupo I), y fueron comparados con 31 (28.2 %) pacientes con cuadro febril infeccioso agudo de al menos de 5 días de evolución, pero sin sospecha del diagnóstico de interés (Grupo II). Para ser elegibles, los pacientes de ambos grupos firmaron una hoja de consentimiento informado o de asentimiento en el caso de menores de edad.
Los procedimientos para obtener las muestras biológicas fueron: para hisopado cutáneo, la lesión maculopapular, vesícula o escara fue humedecida con una gasa embebida en solución salina estéril, y un hisopo de dacrón o rayón estéril se giró vigorosamente, entre cinco y seis veces en un ángulo de 50° a 60°, en la base de la lesión y se retiró la costra cuando fue posible, sin lastimar al paciente; posteriormente el hisopo se colocó en tubo estéril de plástico con solución salina estéril y con tapa (InDRE- Lineamientos Rickettsiosis, 2017). La muestra de orina se tomó directamente del chorro urinario (20 a 30 mL), en un contenedor estéril etiquetado para su identificación. La orina colectada fue examinada durante las primeras 24 h, tal como es recomendado (Salinas, 2008).
Procesamiento de las muestras
Se utilizó el equipo automatizado Magna Pure Compact LC 2.0 de Roche® para la extracción del ADN. Las muestras recibieron pretratamiento: la orina se centrifugó por 30 min a 4,000 rpm para tomar 200 µL del sedimento; se tomaron 200 µL de sangre y se incubó 30 min con 20 µL de proteinasa K. Al final de la extracción de ácidos nucleicos se obtuvieron 200 (µL) de ADN eluído. La integridad del ADN fue examinada mediante la nitidez de las bandas de amplificación derivadas de la electroforesis.
Para confirmar el género Rickettsia se preparó mezcla de reacción para identificar el gen gltA y otra para determinar la especie rickettsii, identificando el gen de la proteína hipotética A1G_04230; se utilizó el termociclador Bio-Rad ICycler. Las mezclas contenían: iniciadores CS-1(F) (5’-GCA-AGTATCGGTGAGGATGTAAT-3) y CS-2(R) (5’-GCTTCCTTAAA-ATTCAATAAATCAGGAT-3) (0.8 μM), diseñados para amplificar un fragmento de 401 pares de bases (pb) del gen citrato sintasa (gltA) para Rickettsia (Labruna et al., 2004) y los iniciadores RRi1(F) (5’-AAATCAACGGAAGAGCAAAAC-3) y RRi2(R) (5’-CCCTCCACTACCTGCATCAT-3) (0.8 μM), para un fragmento de 153 pb de la proteína A1G_04230 para rickettsii (Kato et al., 2012); agregando en ambas reacciones, MgCl2 (3 mM), oligo-nucleótidos (200 μM), buffer 5X, Taq ADN polimerasa (0.5 U) y 5 μL de ADN extraído de la muestra, para una reacción de 25 μL. Se utilizó control positivo (ADN de Rickettsia rickettsii), control negativo (ADN de paciente sin FMMR) y agua destilada estéril para el blanco de PCR (Kato et al., 2013).
Las condiciones de termociclado para género fueron: 1 ciclo a 95 °C por 5 min, 40 ciclos a: 95 °C por 15 s, 52 °C por 30 s, 72 °C por 30 s y un ciclo a 72 °C por 10 min (Labruna et al., 2004). Las condiciones para especie fueron: 1 ciclo a 95 °C por 5 min, 40 ciclos a: 95 °C por 15 s, 58 °C por 30 s, 72 °C por 30 s y un ciclo a 72 °C por 10 min, conservando los productos a - 20 °C (Kato et al., 2013).
Se realizó electroforesis a los productos de amplificación en gel de agarosa al 2 % (p/v) en buffer TBE 1X (Tris 50 mM, ácido bórico 40 mM, EDTA 0.5 M), con el colorante Gel Star dilución 1:10 (Lonza U.S.A.), a 80 V por 60 min. Se utilizó marcador de 100 pares de bases (pb) (Promega, U.S.A.) (Figura 1).
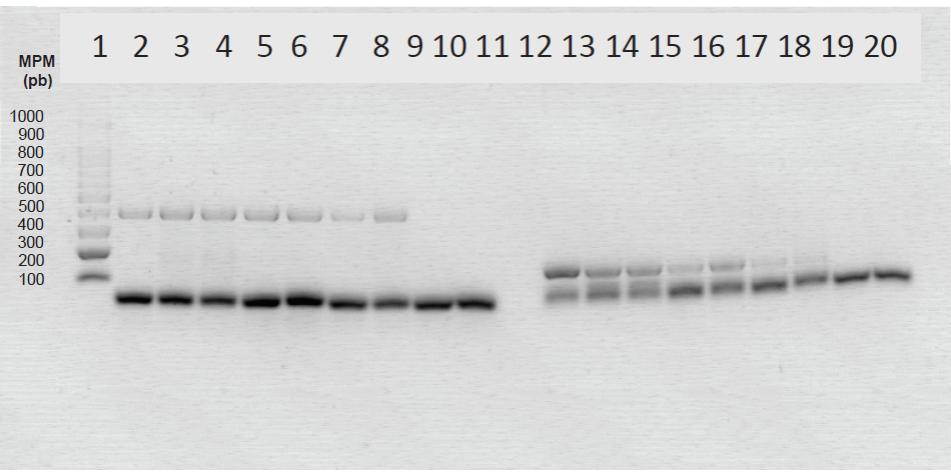
Carril 1: Marcador de 100 pb; carril 2: control positivo a género gen gltA (401 pb); carril 3 y 4: muestra de sangre positiva a género; carril 5 y 6: muestra de orina positiva a género; carril 7 y 8: muestra de hisopado de piel positiva a género; carril 9: control negativo de PCR; carril 10: blanco de PCR; carril 11: sin muestra; carril 12: control positivo a especie gen de la proteína A1G_04230 (153 pb); carril 13 y 14: muestra de sangre positiva a especie; carril 15 y 16: muestra de orina positiva a especie; carril 17 y 18: muestra de hisopado de piel positiva a especie; carril 19: control negativo de PCR; carril 20: blanco de PCR. MPM: marcador de peso molecular.
Figure 1. Amplification bands of the gltA and A1G_04230 protein genes.
Plan de análisis
Se obtuvieron frecuencias relativas de las variables clínicas y sociodemográficas de los sujetos de estudio, y fueron contrastadas de acuerdo con la muestra biológica que se obtuvo: 1) muestras de orina; 2) muestras de hisopado cutáneo; y 3) sujetos sin sospecha de FMRR. Para examinar las diferencias de las variables categóricas se utilizó la prueba de Chi-cuadrada para igualdad de proporciones; para las variables continuas se emplearon las pruebas de análisis de varianza (ANOVA) o U de Mann-Whitney, de acuerdo con su distribución. En todos los casos, se probaron hipótesis de dos colas y valores de p ≤ 0.05 fueron juzgados estadísticamente significativos.
Para estimar la confiabilidad clínica de los resultados de la técnica de PCR en punto final en muestras de hisopado cutáneo y de orina, se contrastaron con los obtenidos en muestras de sangre total de los mismos sujetos de estudio. Se consideró positivo un resultado de PCR cuando se apreció una banda con un número de pares de bases acorde para cada uno de los genes amplificados (Fig. 1). La confiabilidad de la PCR se estimó mediante el coeficiente de Kappa de Cohen (K) (Cohen, 1960; Cerda-Lorca et al., 2008), de acuerdo a la siguiente fórmula:
Donde Pr (a) es el resultado de concordancia observada, y Pr (e) es el resultado de la concordancia ajustando el azar.
Para propósitos de interpretación del coeficiente de Kappa, se empleó la tabla de valores propuesta originalmente por Landis (Landis y Koch, 1977).
Resultados
En total se analizaron 110 muestras biológicas, 79 (71.8 %) de pacientes sospechosos de FMRR, de éstas, 72(65.5 %) fueron orinas y 7 (6.4 %) hisopados cutáneos; en el grupo de comparación hubo 31 muestras de sangre. Entre las variables analizadas, se observó que la edad media de los casos sospechosos de FMRR fue menor que la del grupo de comparación (20.9 ± 15.2) y esta diferencia fue significativa (p = 0.002).
Se observó que los pacientes con sospecha de FMRR tenían un mayor promedio de días transcurridos desde el comienzo de sus síntomas que los sujetos del grupo de comparación, en los pacientes a los que se les tomó muestra de orina, en promedio tenían 6.2 ± 3.3 d, mientras en los de hisopado cutáneo la media fue de 7.3 ± 2.0. La media del grupo de comparación fue de 3.8 ± 2.2, esta diferencia también fue significativa (p < 0.001). Otra variable significativamente diferente (p = 0.009) fue la cuenta plaquetaria (x 103), con los pacientes de hisopado, mostrando los valores más bajos (41.25 ± 30.55) seguidos por los de muestra de orina (94.54 ± 90.00). Los detalles se muestran en la Tabla I.
Table I. Conditions of RRMF-suspected patients by sample type.
| Condicion | Pacientes con orina N (%) [n = 72] | Pacientes con Hisopado N (%) [n = 7] | Pacientes Gpo comparacion N (%) [n = 31] | p 1/ |
|---|---|---|---|---|
| Muestras positivas | 23 (31.94) | 3 (42.85) | 0 (0.0) | 0.557 |
| Edad (Media + DS) & | 11.79 ± 10.34 | 13.11 ± 7.07 | 20.90 ± 15.19 | 0.002* |
| Defunciones | 10 (13.8) | 2 (28.57) | 0 (0.0) | 0.301 |
| Dias de evolucion (media + DS)A/ | 6.16 ± 3.32 | 7.28 ± 1.9 | 3.77 ± 2.21 | < 0.001* |
| Manejo del paciente# Hospitalario | 70 (97.22) | 7 (100.0) | 27 (87.09) | 0.065 |
| Ambulatorio | 2 (2.78) | 0 (0.0) | 4 (12.91) | |
| Cuadro Clinico# Fiebre | 72 (100.0) | 7 (100.0) | 31 (100.0) | 1.000 |
| Exantema | 55 (76.38) | 5 (71.42) | 18 (58.06) | 0.096 |
| Malestar General | 57 (79.16) | 6 (85.71) | 26 (83.87) | 0.565 |
| Cefalea | 65 (90.27) | 7 (100.0) | 29 (93.54) | 0.720 |
| Plaquetas [x103/ μL] (media ± DS)& | 94.54 ± 90.00 | 41.25 ± 30.55 | 137.42 ± 75.58 | 0.009* |
| Leucocitos [x103/ μL] (media ± DS)& | 9.42 ± 5.54 | 10.12 ± 5.71 | 8.44 ± 7.61 | 0.092 |
| Localidad de residencia# Rural | 16 (22.23) | 3 (42.86) | 12 (38.70) | 0.076 |
| Urbana | 56 (77.77) | 4 (57.14) | 19 (61.29) |
& Basado en una prueba de ANOVA; # Basado en una prueba chi cuadrada; *
Estadísticamente significativo a un nivel de confianza del 95 % ;
A/ Días de evolución desde el comienzo de los síntomas hasta la toma de la muestra
Se observó que 23 de las 72 (31.9 %) muestras de orina analizadas tuvieron un resultado confirmatorio a infección por rickettsia y que 7 (30.4 %) de esos sujetos fallecieron, mientras 3 (6.1 %) murieron en el grupo de pacientes (n = 49) negativos a R. rickettsii, lo que fue estadísticamente diferente (p = 0.009). También se encontraron diferencias significativas (p = 0.007) en el conteo de plaquetas (x 103), pues los sujetos positivos tuvieron un promedio inferior (58.82 ± 56.17) al compararlos con los pacientes con orina negativa (111.3 ± 98.17) (Tabla II). No se apreciaron diferencias significativas en las variables analizadas entre los pacientes del grupo de hisopado cutáneo.
Table II. Conditions of RRMF-suspected patients with positive or negative sample.
| Condicion | Pacientes con Orinas Positivas N (%) [n = 23] | Pacientes con Orinas Negativas N (%) [n = 49] | P1/ |
|---|---|---|---|
| Edad (media ± DS) | 11.87 ± 10.08 | 11.73 ± 10.56 | 0.818 |
| Defunciones | 7 (30.43) | 3 (6.12) | 0.009* |
| Dias de evolucion (media ± DS)A/ | 6.86 ± 2.77 | 5.71 ± 3.37 | 0.159 |
| Manejo del paciente# Hospitalario | 23 (100.0) | 47 (95.91) | |
| Ambulatorio | 0 (0.0) | 2 (4.08) | 0.325 |
| Cuadro Clinico# Fiebre | 23 (100.0) | 49 (100.0) | 1.000 |
| - Exantema | 20 (86.95) | 34 (69.38) | 0.147 |
| Malestar General | 18 (78.26) | 38 (77.55) | 1.000 |
| - Cefalea | 20 (86.95) | 43 (87.75) | 1.000 |
| - Plaquetas [x103/ μL] (media ± DS)& | 58.82 ± 56.17 | 111.3 ± 98.17 | 0.007* |
| - Leucocitos [x103/ μL] (media ± DS)& | 10.63 ± 5.60 | 8.97 ± 5.60 | 0.193 |
| Localidad de residencia# Rural | 7 (30.43) | 9 (18.36) | |
| Urbana | 16 (69.56) | 40 (81.63) | 0.361 |
& Basado en una prueba U de Mann- Whitney; # Basado en una prueba chi cuadrada; * Estadísticamente significativo
a un nivel de confianza del 95 %; A/ Días de evolución desde el comienzo de los síntomas hasta la toma de la muestra
Entre las 23 muestras de orina positivas, en 21 se confirmó infección por R. rickettsii y en otras dos se identificó al género Rickettsia, pero no a la especie. Al estimar el coeficiente de Kappa se alcanzó un valor de 0.615, con un IC 95 % (0.386, 0.8436). En cuanto a los 7 hisopados cutáneos analizados, en 3 (42.8 %) pacientes se confirmó infección por R. rickettsii; en este caso el coeficiente de Kappa fue de 0.417, aunque no tuvo significancia estadística.
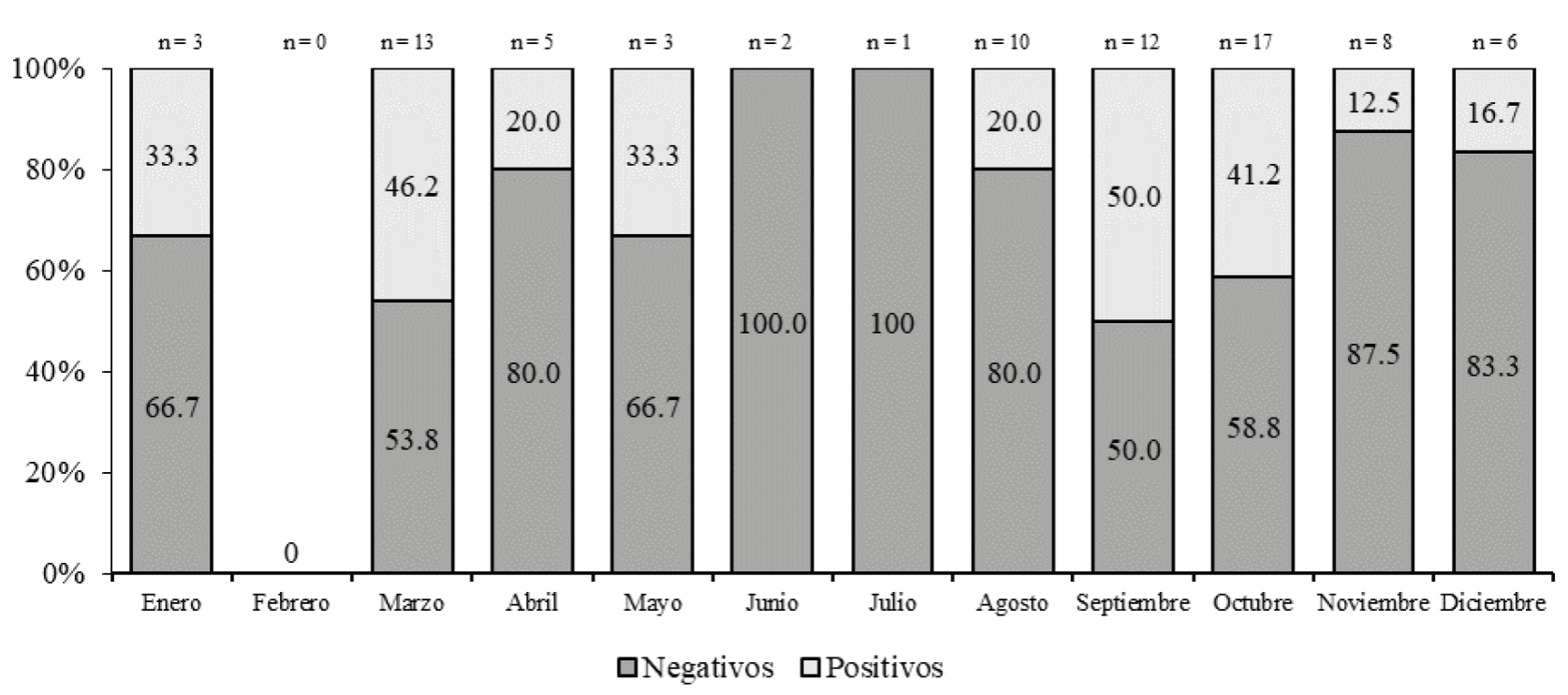
Otra característica analizada fueron las diferencias en cuanto a la época del año en que la muestra fue obtenida, observándose que la mayor proporción (n = 38; 52.7 %) de muestras se alcanzó durante el trimestre agosto-octubre, el de mayor temperatura y humedad ambiental, esta diferencia fue significativa (p < 0.001); en este trimestre, el mayor porcentaje (50.0 %) de positividad ocurrió en septiembre (Figura 2). También apreciamos que la mayor proporción (77.5 %) de muestras correspondió a pacientes menores de 18 años, aunque la tasa de positividad (40.0 %) más elevada se encontró en las muestras de niños menores de 5 años y los adultos jóvenes entre 19 y 30 años.
Finalmente, la mayor proporción de muestras positivas se apreció en los sujetos en quienes se tomó la muestra entre el sexto (70.0 %) y séptimo día (66.7 %) de evolución clínica, aunque el mayor volumen (n = 19; 23.8 %) de muestras fue tomado en el quinto día, detectando en este, una positividad de 31.6 %. No obstante, se detectó infección rickettsial en la muestra de un paciente con 4 d de evolución de los síntomas.
Discusión
Nuestros hallazgos sustentan que la prueba de PCR punto final en muestras de orina es una técnica confiable para confirmar la sospecha clínica de FMRR. Esto al compararse con el desempeño de la misma prueba en muestras de sangre total. También observamos que en orina es posible detectar la infección por R. rickettsii desde el 4° día de evolución clínica, un momento relativamente temprano de la enfermedad. La identificación de la bacteria en orina puede ser explicada por el daño renal que ocurre en pacientes con formas graves de FMRR que ameritan hospitalización, sea por la liberación sistémica de endotoxinas y la activación de la cascada inflamatoria o por la invasión directa de la bacteria al tejido renal (Stevens et al., 2014; Kamath e Iyengar, 2017).
Es importante considerar la potencial ventaja de la muestra de orina sobre la muestra sanguínea para diagnosticar FMRR, pues se ha documentado que la sensibilidad de ensayos de PCR tradicionales en muestras de sangre total es del 80 % (Kato et al., 2013). Es posible inferir que esta capacidad aumentaría a partir del sexto y séptimo días cuando el riñón tiene un mayor daño tisular (Bouatra et al., 2013) y la etapa crítica de la enfermedad ha comenzado. Por ello, recomendamos nuevos estudios sobre el tópico, incrementando el tamaño de la muestra, considerando cuidadosamente los días de evolución clínica e integrando un control interno para incrementar la reproducibilidad y ensayar la técnica de PCR en tiempo real.
No tenemos antecedentes de estudios previos en México para evaluar la confiabilidad de PCR en muestras de orina para confirmar el diagnóstico de FMRR. Los hallazgos de esta investigación pueden ser utilizados como fundamento para incrementar la búsqueda de R. rickettsii en muestras de orina de pacientes con sospecha de FMRR. A la ventaja de que la recolección de la muestra de orina es menos invasiva y dolorosa que la de sangre total, debe considerarse que es superior en términos de oportunidad que la confirmación en muestras sanguíneas por IFI, que requiere que transcurran al menos tres semanas desde el comienzo de síntomas para detectar el incremento en los títulos de anticuerpos IgG (Oteo et al., 2014; Biggs et al., 2016). En el caso de Sonora, la mayor proporción de desenlaces fatales ocurre entre el séptimo y décimo (media 9.3 d) día de evolución (Álvarez et al., 2021) por lo que sigue siendo una necesidad encontrar técnicas confiables para el diagnóstico de la enfermedad en su etapa inicial, pero PCR en muestras de orina parece ser una buena alternativa.
Respecto a la confiabilidad de PCR para confirmar FMRR en muestras de tejido obtenidas mediante hisopado cutáneo, se encontró que, aunque tiene una capacidad moderada de acuerdo con la escala propuesta por Landis (1977) , no fue estadísticamente significativa, probablemente porque tuvimos un reducido número de pacientes que desarrollaron escaras, lo que limitó el poder estadístico de la muestra. A diferencia de otras rickettsiosis del grupo de fiebres manchadas, como en infecciones por R. parkeri o R. massiliae, la presencia de escaras, aunque posible en FMRR, es muy infrecuente (Walker et al., 1981; Argüello et al., 2012).
Por lo anterior, no tenemos evidencia que apoye la colecta rutinaria de tejidos mediante hisopado cutáneo para el diagnóstico de FMRR; sin embargo, en caso de identificarse una escara en pacientes con sospecha, alentamos a que se les tome hisopado cutáneo, pues como hemos documentado se identificó R. rickettsii en 3 hisopados cutáneos, uno de ellos en un paciente con resultado negativo en sangre, quien cursaba su tercer día de tratamiento con doxiciclina. No podemos descartar totalmente la potencial utilidad de PCR en este tipo de muestra biológica, pues ya otros investigadores (Bechah et al., 2011) identificaron la bacteria utilizando esta técnica, especialmente en pacientes con más de seis días de evolución, cuando existe una mayor concentración de bacterias en la lesión o escara. En escenarios similares a Sonora, el hisopado de escaras puede contribuir a identificar otras especies de Rickettsia diferentes de R. rickettsii, como ha sido demostrado en otras regiones (Parola et al., 2013).
Aunque no fue un objetivo del estudio, un hallazgo interesante es que fue más frecuente encontrar un resultado positivo en muestras tomadas entre las 14:00 y las 21:00 h, contrario a la recomendación de que el mejor momento para la toma de estas muestras sea por la mañana, cuando existe mayor carga de la bacteria (Kato et al., 2016). No obstante, recomendamos que se lleven a cabo nuevos estudios regionales para concluir al respecto.
Se reconoce que la ocurrencia de FMRR es mayor cuando la temperatura y humedad ambientales se incrementan, favoreciendo el crecimiento, desarrollo, patrones de alimentación y multiplicación de las garrapatas R. sanguineus ( Chen y Sexton, 2008; Parola et al., 2018), esto es consistente con lo que observamos en nuestro estudio, pues la mayor proporción (21.3 %) de muestras sucedió en octubre y la mayor tasa de positividad (50.0 %) en septiembre, cuando la temperatura media es de 29 °C y el porcentaje de humedad relativa es superior al 30 % (CONAGUA, 2021), condiciones que se asocian a una mayor actividad alimentaria de la garrapata R. sanguineus, a incremento de transmisión e incluso, a la ocurrencia de formas más severas de rickettsiosis del grupo de fiebres manchadas (Dantas-Torres, 2008; Parola et al., 2008). En este sentido, es recomendable efectuar en el corto plazo, investigaciones regionales para secuenciar los fragmentos de amplificación de DNA de R. rickettsii y correlacionarlos con la severidad de las manifestaciones clínicas.
Dada la poca especificidad de sus manifestaciones clínicas y la ventana de tiempo requerida, hasta 21 d, para confirmar mediante la prueba estándar, el diagnóstico de la FMRR permanece como un desafío. En este escenario, los ensayos moleculares de la PCR son la opción más promisoria para confirmar la sospecha diagnóstica de FMRR utilizando una variedad de muestras biológicas, incluyendo el hisopado cutáneo (Parola et al., 2013). Una serie de factores, como la calidad del ADN extraído, la presencia de inhibidores de la PCR, la selección del blanco genético que se amplificará, el desempeño de los iniciadores y el grado de aprovechamiento del ensayo, pueden mermar la sensibilidad y la confiabilidad de la técnica. Por ello, se ha propuesto que el desarrollo de ensayos de PCR en tiempo real puede optimizar la capacidad diagnóstica de los métodos moleculares tradicionales, especialmente su sensibilidad, lo que tendría un impacto clínico muy favorable pues usando muestras de orina e hisopado cutáneo, es posible disminuir a 4 d o menos el periodo para confirmar FMRR (Zemtsova et al., 2015).
Conclusiones
Las muestras de orina analizadas mediante PCR en punto final mostraron una sustancial confiabilidad para detectar infección por Rickettsia rickettsii en pacientes con sospecha clínica de FMRR, cuando se le contrasta con PCR en muestras sanguíneas. Por ello, se plantea que la muestra de orina es una opción útil para confirmar el diagnóstico de FMRR en pacientes hospitalizados, y puede emplearse en pacientes con vasculitis severa o con daño endotelial sistémico como la trombocitopenia, en los que hay dificultad para tomar una muestra sanguínea.
Considerando que la presencia de escaras en FMRR es muy rara, el hisopado cutáneo no parece ser una alternativa que deba emplearse rutinariamente ante este tipo de pacientes. Pero si es una opción que debe considerarse en Sonora cuando se detecten pacientes con sospecha de alguna fiebre manchada acompañada por el desarrollo de escaras, pues es posible identificar la infección por alguna Rickettsia diferente a R. rickettsii, lo que es factible pues hay evidencia de R. parkeri en garrapatas de la región (Delgado-de la Mora et al., 2019).
Nuestros hallazgos pueden representar una línea basal para futuras investigaciones regionales respecto a la capacidad diagnóstica de la PCR en muestras biológicas como la orina y tejido recolectado mediante hisopado cutáneo, lo que es necesario pues la FMRR en Sonora se mantiene como una región de alta endemia y una elevada letalidad.











 nueva página del texto (beta)
nueva página del texto (beta)