Introducción
El Síndrome Metabólico (SM) es un conjunto de alteraciones bioquímicas, fisiológicas y antropométricas que ocurren simultáneamente y son factores de riesgo para el desarrollo y progresión de enfermedades cardiovasculares y diabetes mellitus, dentro de los cuales se incluyen obesidad abdominal, hiperglucemia, dislipidemia e hipertensión arterial (Hernández et al., 2018). De acuerdo con la ENSANUT 2018, a nivel nacional, en 2018 el porcentaje de adultos de 20 años y más con sobrepeso y obesidad es de 75.2 %. El desarrollo de la obesidad se produce por una ingesta excesiva, el bajo gasto de energía asociado con una deficiente actividad física y la acumulación de grasa visceral (Furnes et al., 2009), este estado somete a las células adiposas a un estrés metabólico que induce un proceso oxidativo e inflamatorio que derivan en múltiples alteraciones como, mayor secreción de citocinas, reducción en la secreción de las adipocinas, resistencia a la insulina, aumento en la actividad del receptor de glucocorticoides y cambios en la distribución de la grasa corporal facilitando la lipotoxicidad en órganos como el hígado y el páncreas (Muñoz et al., 2013; Urina et al., 2018). Estas alteraciones metabólicas provocan enfermedades crónico-degenerativas como la obesidad, diabetes mellitus, hipertensión arterial, dislipidemias y enfermedades cardiovasculares (Gutiérrez et al., 2018). Derivado de la pandemia mundial por el virus Sars-CoV 2 (COVID-19) se puso en evidencia que el SM también predispone un sistema inmune deficiente, incapaz de reaccionar adecuadamente contra una infección viral, y fue un factor de riesgo mortal para los pacientes que se contagiaron de COVID-19 (Pasquarellido -Nacimento et al., 2020; Luzi et al., 2021), Para reproducir la patogénesis y la terapia de este trastorno metabólico es necesario contar con modelos in vivo en animales apropiados, el modelo murino ofrece muchas ventajas en relación con otros modelos animales ya que tiene numerosos procesos bioquímicos similares con el hombre, tienen un tiempo generacional muy corto, son muy prolíficos y se adaptan fácilmente a la vida en los bioterios, permitiendo controlar las variables ambientales en las experimentaciones, además su genoma está descrito casi de manera completa y al menos el 80 % del ADN del ratón es idéntico al del ser humano (Perlman, 2016; Breschi et al., 2017; Padilla et al., 2017). Existen diferentes modelos en roedores que pueden desarrollar obesidad y diabetes mellitus, éstos se clasifican en modelos espontáneos como la rata Goto-Kakizaki (GK), el ratón obeso de Nueva Zelanda (NZO), el ratón KK y la rata Zucker (fa/fa) y en modelos inducidos mediante la administración de fármacos como la estreptozotocina (STZ), por inducción hormonal administrando corticoides, somatostatina, glucagón, catecolaminas y tiroxina. Finalmente, están los modelos inducidos por manipulación genética de tres intervenciones, a) sobreexpresión, que origina ratones transgénicos, b) eliminación, genera los ratones “knock-out” y c) reemplazo (con una forma alterada), da origen a los ratones “knock-in” (Lutz y Woods, 2012). Estos modelos son costosos y con fenotipos diferentes, lo cual no reproduce lo que sucede en los humanos ya que se sabe que la obesidad es multifactorial. También existen los modelos de obesidad inducida por dieta (OID) que reproducen mejor la patología en humanos, sin embargo, la multivariedad de dietas existentes y la susceptibilidad específica de algunos roedores, como la rata Sprawe Dawly y el ratón C56BL6/J hacen difícil estandarizar los modelos que reproduzcan la mayoría de las alteraciones del SM, además hay cepas más costosas que otras (Fuchs et al., 2018). En México está disponible el ratón CD1 el cual es menos costoso que el ratón C56BL6/J, en un estudio realizado por Berlinsky et al. (2010), probaron 3 condiciones diferentes para inducir obesidad en ratones macho de esta cepa, y considerando como antecedente el mismo, en el presente trabajo se propone desarrollar un modelo utilizando una dieta hipercalórica para inducir las alteraciones presentes en el síndrome metabólico.
Materiales y métodos
Material biológico
Los animales utilizados fueron tratados de acuerdo con la Guía del cuidado de animales mexicana para el estudio con animales de laboratorio (NOM-062-ZOO-1999) y el protocolo fue aprobado por el Comité de Ética para animales de estudio de la Escuela Nacional de Ciencias Biológicas. Se emplearon 24 ratones CD1 hembras y machos de edad pre púber (obtenidos por el proveedor PROPECUA), los animales se mantuvieron en jaulas metálicas individuales, en una cámara aislada, con ciclos de 12 h luz/obscuridad, temperatura regulada a 22 ± 2 ºC y acceso a agua y alimento ad libitum. Los ratones se distribuyeron en 2 lotes por género, con 6 ratones cada uno, y se asignaron a los tratamientos: a) Testigo hembras, b) Dieta hipercalórica hembras, c) Testigo machos, d) Dieta hipercalórica machos. La duración del tratamiento fue de 10 sem. El peso corporal se registró cada semana y el consumo de agua y alimento diariamente.
Composición de las dietas
a) Testigo: dieta estándar para roedores (Rodent Lab Chow 5001) con una densidad energética de 3.18 Kcal/g, siendo 23 % de proteína, 4.5 % de grasas y 46.5 % de carbohidratos.
b) Dieta hipercalórica: Con una densidad energética de 4.81 Kcal/g, correspondientes a 17.3 % de proteína, 21.2% de grasas y 48.5 % de hidratos de carbono, se le adicionaron vitaminas (AIN-93-NGX) y minerales (AIN-93-VX) para complementar la dieta, la cual fue una adaptación de la dieta TD.88137 (Teklad Global Harlan Laboratories, Inc), se elaboró en el laboratorio de Farmacología del desarrollo del departamento de Fisiología de la Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional (Tabla 1).
Bioensayos
Curva de tolerancia a la glucosa: se realizó al final del tratamiento, a los ratones con 8 h de ayuno se les administró por vía oral una solución de glucosa al 20 % una dosis de 0.2 g/Kg, y se registró la glucemia con el glucómetro (ABBOT) basal y a los tiempos 30, 60, 90 y 120 m después de la solución glucosada.
El perfil lipídico, incluido el colesterol sérico total, los triglicéridos y el col-HDL, se midieron utilizando los kits espectrofotométricos (RANDOX series) y el espectrofotómetro Architect C16000. Para el perfil hormonal se determinaron la insulina y la leptina en suero con la técnica de ELISA específico para ratones (Merck, Darmstadt, Alemania) y el lector de microplacas (Thermo Scientific®).
Presión Arterial
Al final del tratamiento se registró la presión arterial por el método no invasivo con el equipo IITC Life Science® MRBP system. Para el periodo de acondicionamiento los ratones se introdujeron 10 m en un cepo de acrílico durante 3 d previos a la determinación. Posteriormente, el día de la prueba, se introdujeron en el cepo del equipo para inmovilizarlos y registrar la presión arterial sistólica, diastólica y media. El equipo se mantiene a una temperatura de 37 °C y se coloca el transductor de presión en la cola del ratón donde realiza el registro.
Análisis estadístico
Los resultados se analizaron estadísticamente con el programa SigmaPlot ver 12.0. A los resultados bioquímicos y hormonales se analizaron con la prueba análisis de varianza (ANOVA) de una vía. El peso corporal y la ingesta de alimento se analizaron con una prueba ANOVA bifactorial de medidas repetidas, con la prueba post Hoc Tukey, con un nivel de confianza del 95 % (p < 0.05)
Resultados
Peso corporal de ratones CD1 con dieta hipercalórica
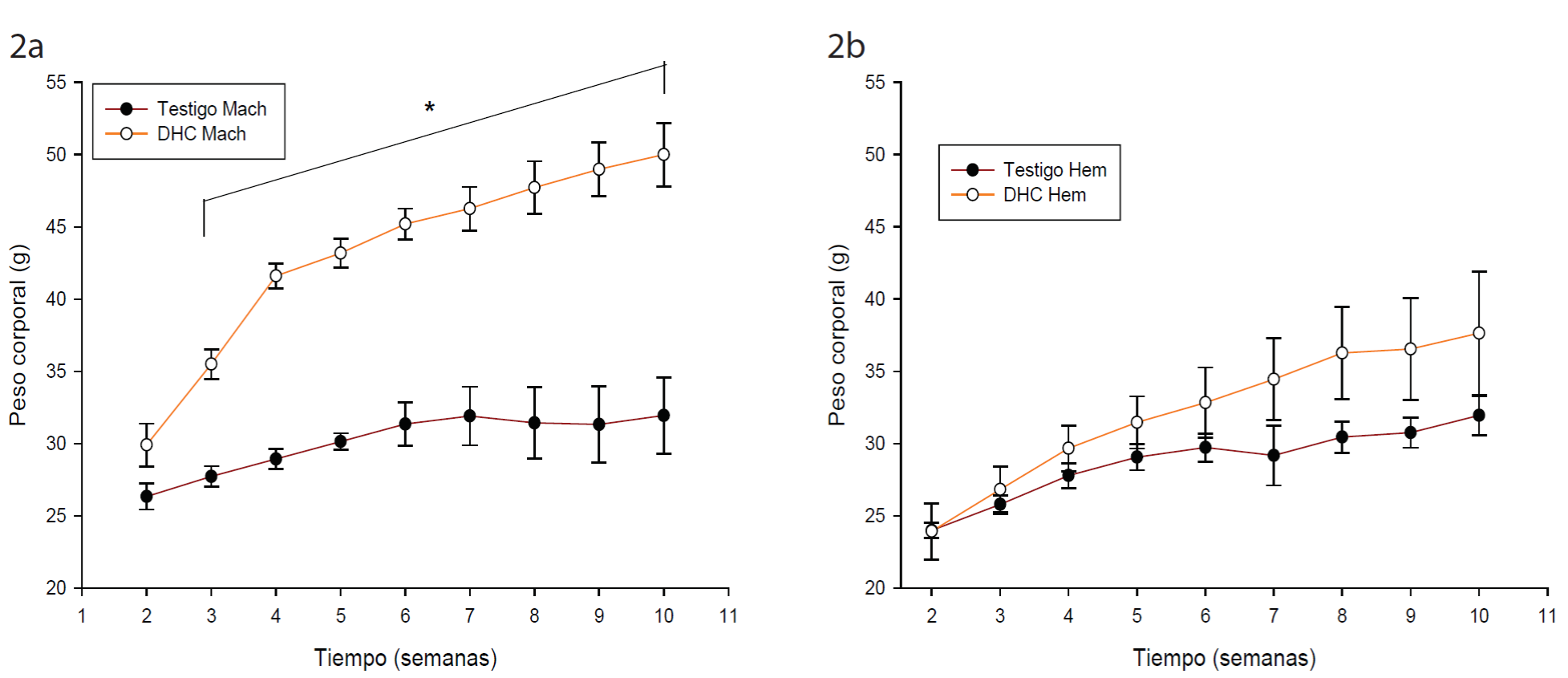
En todos los grupos los ratones aumentaron de peso gradualmente durante el tratamiento. Los ratones macho DHC mostraron un aumento significativo en el peso corporal a partir de la tercera semana (p < 0.005), al final de las 8 semanas aumentaron 68 % de peso, mientras que el grupo control en machos solo incrementó 8 % (Fig. 2a). En cuanto a las hembras no existe diferencia significativa entre los dos grupos (Fig. 2b), sin embargo, las de DHC aumentaron 55 % su peso corporal, mientras que las del grupo control solo el 15 %.
Figura 2 Efecto de la dieta alta en grasa sobre el peso corporal en ratón CD - 1. a) machos; b) hembras. Los datos muestran la media ± error estándar. (*) diferencia significativa contra los testigos. ANOVA bifactorial de medidas repetidas, Tukey post hoc, p ≤ 0.05. Figure 2. Effect of high fat diet on corporal weight of CD - 1 mice. 1a Male; 1b: Female. Data represent mean ± standard error. (*) significant difference against control group. Repetitive measures bifactorial ANOVA, post hoc Tukey, p ≤ 0.05.
El consumo de dieta hipercalórica se cuantificó en gramos y calorías. En la Figura 3a se observa que, en machos en ambos tratamientos, existe diferencia significativa de la primera a la tercera semana de consumo en gramos siendo superior el consumo de la dieta hipercalórica. En cuanto a consumo por kcal (Figura 3b), es mayor en la dieta hipercalórica con diferencia significativa de la primera a la cuarta semana del tratamiento. El consumo en gramos (Figura 3c) en las hembras tiene un comportamiento diferente a los machos, pues se observa que el grupo que se le proporcionó la dieta estándar consumieron más cantidad que los de la dieta hipercalórica con diferencia significativa en la semana 2 y de la 4 a la 7; sin embargo, en la Figura 2d se reporta que, a pesar de consumir menos en cantidad de gramos, el consumo en kcal es mayor en el grupo de la dieta hipercalórica en comparación con la dieta estándar.
Figura 3 Consumo de dieta alta en grasa en diez semanas de ratones CD - 1. a) consumo de alimento de machos; b) consumo de alimento de hembras; c) consumo en calorías de machos; d) consumo en calorías de hembras. Los datos representan la media ± error estándar. (*) diferencia sig-nificativa contra el grupo control. ANOVA bifactorial de medidas repetidas, Tukey post hoc, p ≤ 0.05.

Figure 3. High fat diet consumption for ten weeks, by CD - 1 mice. a) Male consumption; b) Female consumption; c) Male caloric consumption; d) Female caloric consumption. Data represent mean ± standard error. (*) significant difference against control group. Repetitive measures bifactorial ANOVA, post hoc Tukey, p ≤ 0.05.
Curva de tolerancia a la glucosa
En la Figura 4 se presentan los resultados de la curva de tolerancia a la glucosa en machos (4a) y hembras (4b) determinada al final del tratamiento, se observó un aumento significativo (p < 0.005) durante todo el tiempo de la prueba en los ratones DHC, tanto en hembras como en machos, en comparación con el respectivo grupo testigo, por lo que se propone que la dieta hipercalórica desarrolló intolerancia a la glucosa en los ratones.
Figura 4 Curva de tolerancia a la glucosa en ratón CD - 1 con dieta hipercalórica y dieta estándar. a) machos; b) hembras. Los datos muestran la media ± error estándar. (*) diferencia significativa con el testigo en los diferentes tiempos. ANOVA bifactorial de medidas repetidas, post hocTukey, p ≤ 0.05.
Presión arterial
En la figura 5 se muestran los resultados de presión arterial en machos (5a) y hembras (5b). Se observa que los ratones de tratamiento DCH muestran mayor presión arterial tanto sistólica como diastólica y media comparados con los ratones con dieta estándar (p < 0.005) se observa la misma tendencia en ambos sexos.
Figura 5 Efecto de la dieta hipercalórica sobre la presión arterial en ratón CD-1. a) Presión arterial en machos; b) Presión arterial en hembras. Los datos representan las medias ± el error estandar. (*) diferencia significativa contra el grupo control (ANOVA unifactorial, Tukey post hoc, p ≤ 0.05).
Perfil lipídico en ratones CD1 con dieta hipercalórica
Los resultados del perfil lipídico incluido el colesterol total, triglicéridos y col-HDL se muestran en la Tabla 2, el col- LDL se determinó utilizando la ecuación de Friedewal, también se muestra el índice aterogénico. Respecto al colesterol total, existe un aumento significativo en los machos DHC 2.8 veces más que el grupo testigo. En las hembras no existe diferencia significativa (p > 0.005) en ambos grupos. En cuanto a triglicéridos existe diferencia significativa en los machos con dieta hipercalórica (109.27 mg/dL) en comparación con el grupo control (31.91 mg/dL). En las hembras no existe diferencia significativa (p > 0.005) en ambos grupos. Finalmente, respecto a HDL existe diferencia significativa en los machos con dieta hipercalórica (78.12 mg/dL) en comparación con el grupo control (156.24 mg/dL). En las hembras no existe diferencia significativa (p > 0.005) en ambos grupos.
Table 2. Lipidic and hormonal profile in CD1 mice with hypercaloric diet.
| Variable serica | Testigo Macho | DHC macho | Testigo Hembra | DHC Hembra |
|---|---|---|---|---|
| Colesterol total (mg/dL) | 77.1 ± 0.4 | 195.3 ± 11.4* | 85.6 ± 9.8 | 101.2 ± 4.8* |
| Trigliceridos (mg/dL) | 37.3 ± 0.4 | 109.3 ± 18.7* | 71.3 ± 6.3 | 53.7 ± 4.1* |
| Col-HDL (mg/dL) | 62.6 ± 0.3 | 78.1 ± 17.8* | 199.6 ± 17.1 | 217.0 ± 11.7* |
| Col-LDL (mg/dL9 | 7.04 ± 0.4 | 121.5 ± 1.2* | 17.7 ± 3.5 | 39.5 ± 5.0* |
| Indice aterogenico CT/HDL | 1.24 ± 0.1 | 3.81 ± .02* | 1.58 ± 1.6 | 2.0 ± .01 |
| Glucemia (mg/dL) | 96.4 ± 10.5 | 136.7 ± 3.2* | 87.5 ± 5.8 | 116.8 ±3.0* |
| Insulina (ng/mL) | 0.58 ± 0.2 | 1.04 ± 0.5* | 0.61 ± 0.2 | 0.93 ± 0.3 |
| Leptina (pg/mL) | 0.25 ± 0.05 | 2.40 ± 0.9* | 2.41 ± 1.7 | 4.66 ± 1.8* |
| Indice HOMA-IR | 3.0 ± 0.8 | 6.4 ± 0.3* | 3.2 ± 0.9 | 3.6 ± 0.3 |
Col-HDL: Lipoproteína de alta densidad, Col-LDL: Lipoproteína de baja densidad. DHC: Dieta hipercalórica. Los datos representan las medias ± el error estándar. Medias con asterisco por columna son estadísticamente diferente ANOVA de una vía, Tukey post hoc, p ≤ 0.05.
Los triglicéridos en el caso de los machos de DHC incrementaron casi 3 veces más que el grupo testigo, mientras que en las hembras de DHC hubo una disminución significativa respecto al testigo. Con respecto al col-HDL y col-LDL aumentaron 1.2 y 17 veces respectivamente comparados con el control por lo que el índice aterogénico también fue mayor en los ratones macho DHC. En cambio, en las hembras, aunque aumentaron el col-HDL y el col-LDL fue más discreto, por lo que el índice aterogénico no es diferente del grupo testigo.
Perfil hormonal en ratones CD1 con dieta hipercalórica
El perfil hormonal incluye la insulina y la leptina, los resultados se presentan en la Tabla 2. Respecto a la insulina, se encontró que en machos del grupo DHC incrementó 2.5 veces más comparados con el grupo testigo, mientras que en hembras de DHC el incremento fue menor, aunque si es significativo respecto del grupo testigo.
En relación con el perfil hormonal se observó que tanto la insulina como la leptina y la glucemia fueron significativamente mayores en los machos de DHC y el índice HOMA-IR también aumentó comparados con el testigo macho, En las hembras solo se aprecia el incremento de la glucemia y la leptina, pero no hay diferencia con la insulina comparados con el grupo testigo hembras, y el índice HOMA-IR tampoco difiere.
Discusión
La dieta hipercalórica a menudo se ha utilizado para reproducir trastornos metabólicos en roedores, similares en algunos casos, a los que se presentan en humanos con obesidad mórbida. En el presente trabajo se propone que el consumo de la dieta hipercalórica en los ratones CD1 desarrolla un estado metabólico parecido al observado en el Síndrome metabólico en humanos. Existen diferentes asociaciones internacionales que se han dedicado a establecer los criterios para la definición del Síndrome metabólico, entre ellas se encuentran el Panel III del Tratamiento para Adultos del Programa Nacional de Educación sobre el Colesterol (NCEP ATP-III), la Organización Mundial de la Salud (OMS), el Grupo Europeo de Estudio de Resistencia a la Insulina, quienes dieron una definición del síndrome metabólico y que posteriormente fue modificado por la American Association of Clinical Endocrinologists y la International Diabetes Federation Task Force on Epidemiology and Prevention y por la American Heart Association en colaboración con el National Heart, Lung and Blood Institute. Finalmente, en 2009, se llegó a una definición consensuada emitida por la International Diabetes Federation, el National Heart, Lung and Blood Institute, la American Hearth Asociation, El Word Heart Federation, la International Atherosclerosis Society y la International Association for the Study of Obesity.
Dentro de los criterios establecido para determinar el Síndrome metabólico se encuentra la obesidad, la hiperglucemia en ayuno, la presión arterial >130/85 mmHg, una trigliceridemia > 150 mg/dL y el col-HDL < 40 mg/dL (McCraken et al., 2018). Estas alteraciones pueden afectar tanto a hombres como mujeres, los valores de referencia pueden variar según el género, la edad y el tipo de dieta que consumen (Hernández et al., 2018).
La administración de dietas modificadas en especies roedoras ha logrado reproducir algunos de las alteraciones presentes en el síndrome metabólico, pero no todas (de Moura et al, 2021). Unas especies son más susceptibles a desarrollar obesidad, pero no resistencia a la insulina o hipertensión, otras solo reproducen la diabetes, pero sin hiperlipemia (Suleiman et al., 2019). La propuesta del modelo desarrollado en el presente trabajo reproduce al menos 3 de los criterios emitidos en 2009. Se utilizaron los ratones CD - 1 que son de fácil acceso en México y que son más económicos que otras cepas modificadas o específico sensibles, además se comparó el efecto en machos y en hembras para determinar si el género interviene en el desarrollo del síndrome metabólico.
De acuerdo con los resultados, los machos establecieron cambios metabólicos más cercanos a los del síndrome metabólico, incluyendo aumento de peso, la hiperglucemia, intolerancia a la glucosa, hiperlipemia e hipertensión, además de los cambios hormonales de hiperinsulinemia e hiperleptinemia. En cambio, en las hembras solo se reprodujeron algunas de las alteraciones metabólicas e hipertensión, sin cambios hormonales ni obesidad.
Estos resultados son importantes porque el modelo propuesto en machos constituye una herramienta accesible de gran utilidad para evaluar otros posibles cambios que ocurre en el síndrome metabólico, como inflamatorios, inmunológicos, respiratorios y renales, que derivado de la pandemia de COVID-19 dejaron en evidencia que padecer síndrome metabólico incrementó la mortalidad del virus.
El aumento de peso en los machos se debe principalmente a la ingesta mayor de alimento y de consumo calórico, lo que incrementó el tejido adiposo y consecuentemente las alteraciones de la insulina y los lípidos. En 8 sem se lograron observar estos cambios, lo que también es una ventaja sobre otros modelos de obesidad que requieren hasta 12 semanas o más (Fuchs et al., 2018).
La resistencia a la insulina también es un marcador del SM, se relaciona con la obesidad y la diabetes mellitus Tipo 2. La hiperglucemia se genera porque el hígado aumenta la producción de glucosa, y las células β del páncreas incrementan la producción de insulina para regular la glucemia introduciéndola a los tejidos como el músculo esquelético y el tejido adiposo, sin embargo, al presentarse la resistencia a la hormona persiste la hiperglucemia y la hiperinsulinemia (Muñoz, 2013). Se puede relacionar la glucemia con la concentración de insulina en sangre en un índice llamado HOMA-IR (del acrónimo en inglés: Homeostasis Model Assessment-Insulin Resistance), se utiliza como indicador de resistencia a la insulina (Oh et al., 2021). De acuerdo con los resultados obtenidos en esta propuesta de modelo de SM, se encontró incrementado el índice HOMA-IR en los machos de DHC, lo que indica la resistencia a la insulina en los ratones.
La leptina es una hormona que secreta el tejido adiposo y que participa en la regulación de la ingesta de alimento, en la obesidad se presenta resistencia al efecto de esta hormona, lo que conduce a hiperfagia y aumento del tejido adiposo, este puede ser el origen de la resistencia a la insulina. Se relaciona con un nivel mayor de inflamación derivado de factores proinflamatorios que libera el tejido adiposo en exceso, como el TNF alfa y la IL-6, que además incrementan el estado de oxidación en el organismo y el riesgo de generar ateroesclerosis (Lemieux y Després, 2020), y alteraciones cardiovasculares como hipertensión y/o angina de pecho (Rodríguez et al., 2020). Todas las alteraciones metabólicas y hormonales que se observaron en los ratones macho con DHC reproducen el riesgo de desarrollar diabetes, hipertensión y ateroesclerosis, además se pueden evaluar otros variables como inflamación y oxidación tisulares.
Adicionalmente, al igual que en otros modelos, se puede disponer de los órganos para hacer análisis complementarios, como el hígado, el corazón, los pulmones, el mismo tejido adiposo, lo que permite determinar el daño tisular específico por el SM.
En contraste, las hembras no desarrollaron todas las alteraciones de SM, se ha reportado que en las hembras el consumo de alimentos coincide con el ciclo hormonal, pues se ha observado una baja ingesta de alimentos cuando los niveles de estrógeno son altos y una alta ingesta cuando no hay ovulación (Varma et al., 1999). Otro factor importante es el que tienen los estrógenos sobre el metabolismo lipídico, Reyna-Villasmil et al. (2007) reportaron que la administración exógena de estrógenos a mujeres posmenopáusicas con histerectomía y salpingo-ooforectomía bilateral, redujo los niveles de col-LDL e incrementan los niveles de col-HDL. Palmisano et al. (2017) también reportaron que la combinación de varios estrógenos y progestinas en mujeres posmenopáusicas regula los niveles séricos de triglicéridos, pero no disminuye el riesgo cardiovascular. Este efecto de los estrógenos lo observamos con las hembras de DHC, por lo cual no es un modelo adecuado para evaluar alteraciones lipídicas, y no reproduce completamente las complicaciones del SM.
Conclusiones
El modelo de ratón macho CD1 con DHC indujo obesidad, hiperglucemia, hipertensión, hipercolesterolemia e hipertrigliceridemia y aumento de las hormonas leptina e insulina, todas estas alteraciones relacionadas con el SM, por lo que se propone como un modelo murino para el estudio de este padecimiento.











 nova página do texto(beta)
nova página do texto(beta)