Introducción
La creciente demanda por edulcorantes naturales sin calorías sitúa la planta de S. rebaudiana como cultivo potencial en el mercado alimentario y farmacéutico (Ahmad et al., 2020). Las hojas de S. rebaudiana son una parte importante en la planta, presentan una composición única de glucósidos que son biológica y económicamente importantes, su poder edulcorante es mayor a la sacarosa (Tavarini et al., 2015). El rendimiento del cultivo depende en gran medida del crecimiento de las plantas y su producción de hojas (Mandal et al., 2013; Uçar et al., 2018), que, a su vez depende de la eficiencia en la absorción de nutrientes con baja disponibilidad y movilidad en el suelo (Vafadar et al., 2014). El fósforo es un nutriente esencial en la nutrición de la planta (Abdel-Fattah et al., 2014), interviene en procesos de transporte, almacenamiento y transformación de energía, en la fotosíntesis, respiración, división y elongación celular (Dissanayaka et al., 2021). Además, estimula la formación de órganos en las plantas, el crecimiento radicular y la formación de brotes. Sin embargo, en la mayoría de los suelos agrícolas, su disponibilidad es limitada y la producción de los cultivos se ve seriamente restringida (Richardson, 2001).
En las plantas, existen dos formas de absorción de fósforo; una es por medio de los propios transportadores de la planta y la otra ocurre a través de la simbiosis de hongos micorrícicos arbusculares (HMA) (Sarmiento-López et al., 2020). La simbiosis entre HMA y las plantas es una asociación de tipo mutualista, ya que ambos simbiontes se benefician (Waller et al., 2018). Los HMA obtienen fotosintatos de la planta, a cambio, forman un sistema ramificado de hifas extraradicales capaces de explorar el suelo más allá de la zona de influencia de las raíces, esta condición en el suelo favorece la traslocación de agua y nutrientes para la planta (particularmente de fósforo) y mejora la tasa fotosintética, al regular la conductancia estomática, lo que promueve la producción de los cultivos (Nouri et al., 2014; Adolfsson et al., 2015; Tekaya et al., 2017; Kothe y Turnau, 2018). Los HMA representan una herramienta útil en la agricultura moderna, ya que puede reducir los insumos químicos, así como el impacto en el medio ambiente (Giovannini et al., 2020). En los últimos años, los HMA se han utilizado para promover el aumento de la producción en cultivos de importancia económica (Quiñones-Aguilar et al., 2014; Alvarado Carrillo et al., 2014; Díaz Franco et al., 2015). También se han reportado aumentos en la productividad de S. rebaudiana por efecto de la simbiosis micorrícica. Por ejemplo; Tedone et al. (2020) reportaron que la inoculación de HMA en S. rebaudiana influyó significativamente en la producción de biomasa seca aérea. Asimismo, Aguirre-Medina et al. (2020) observaron un aumento en el área foliar y en el número de hojas de S. rebaudiana a los 90 días después de la inoculación con Rhizophagus intraradices. Los beneficios sinérgicos de la inoculación de HMA en S. rebaudiana también han mejorado significativamente el crecimiento de brotes y longitud de raíz (Vafadar et al., 2014). Por su parte, Sarmiento-López et al. (2020) observaron un aumento en el peso fresco de hojas y raíces en plantas de S. rebaudiana inoculadas con R. irregularis y fertilizadas con 200 µM de fósforo. Adicionalmente, Mandal et al. (2013) describen que la mejora en los aumentos en la producción de los cultivos, involucra mecanismos tanto nutricionales como no nutricionales, estos resultados sugieren la importancia del papel del fósforo en la simbiosis de HMA y S. rebaudiana, ya que el fósforo puede inhibir la colonización micorrícica (Tavarini et al., 2018). En este contexto, se desconoce el nivel de fósforo óptimo que permita el desarrollo de la simbiosis de los HMA nativos de suelos de Yucatán con S. rebaudiana. Por otro lado, la mayoría de las especies de HMA utilizados en los sistemas agrícolas corresponden a cepas no nativas, la mayoría de los productos comerciales se centran en una sola especie, lo que limita su efectividad por el hecho de competir con la microbiota local (Kouadio et al., 2017; Giovannini et al., 2020). Se sabe que, la eficiencia de los HMA en las plantas, depende de la riqueza y composición de las especies inoculadas, sin embargo, diferentes cepas de HMA, incluso nativas, pueden tener un efecto diferencial en distintas especies de plantas (Trejo et al., 2011; Vosátka et al., 2012). Por lo tanto, el uso de consorcios nativos de HMA ha demostrado una mayor eficiencia en términos de aumentar el crecimiento y la productividad de las plantas hospederas (Douds et al., 2012; Eun-Hwa et al., 2013; Reyes-Ramírez et al., 2014). Por lo anterior, el objetivo de este estudio fue evaluar la efectividad de consorcios nativos de HMA en interacción con niveles de fósforo en la promoción del crecimiento y tasa fotosintética de S. rebaudiana en condiciones de invernadero.
Materiales y métodos
Sitio experimental
La investigación se realizó dentro de una estructura protegida en el área de investigación del Instituto Tecnológico de Conkal, Yucatán, ubicado en Av. Tecnológico s/n Conkal, Yucatán, al noreste de Mérida a 21º 04’ N y 89º 31’ O, a una altitud de 8 m, el clima predominante es Awo (x´) (i´) g (Márdero et al., 2012).
Consorcios de HMA
Se evaluaron tres consorcios nativos de HMA, que fueron nombrados según su lugar de origen, los cuales provenían de localidades diferentes del estado de Yucatán, en suelos donde predominan comunidades vegetales de selva baja caducifolia tropical y suelo de tipo Leptosol (Durán García y García Contreras, 2010). Los consorcios se determinaron como: 1) Reserva Cuxtal (RC); (integrado por Glomus ambisporum G.S.Sm. y N.C. Schenck, G. pustulatum Koske, Friese,C. Walker y Dalp, Claroideoglomus claroideum C.Walker y A. Schussler, Funneliformis geosporum y Ambispora gerdemannii C. Walker) identificado a nivel morfológico por Herrera-Parra et al. (2021); 2) Tizimín (TZ) (sin identificar) y 3) Colonia Yucatán (CY) (sin identificar). Además, se incluyó un tratamiento testigo sin inocular.
Propagación y extracción de HMA
Los consorcios de HMA se propagaron por la técnica de cultivo trampa (Sieverding, 1990), se utilizaron macetas de 10 kg de capacidad con suelo tamizado y mezclado con arena estéril (1:1 v/v) donde se sembraron semillas de sorgo cv. Criollo (Sorghum bicolor L.) y maíz (Zea mays L.) como macetas de propagación (Herrera-Parra et al., 2021). El cultivo trampa se monitoreó y mantuvo en un vivero a una temperatura de 22 - 38 °C y h: 42 % en las instalaciones del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP)-C.E. Mocochá. Después de 55 días, las plantas trampa se retiraron de la maceta de propagación y se removió el sustrato con las raíces colonizadas, posteriormente, se sembraron nuevas semillas y reinició el ciclo. Se realizaron riegos a capacidad de campo, después de 80 d se suspendió el riego con el fin de estimular la esporulación de los HMA. Después de 112 d se tomó una muestra de 100 g de cada maceta de propagación y se extrajeron los HMA siguiendo el método de tamizado y decantación en húmedo por centrifugación (Gerdemann y Nicolson,1963). El suelo se homogenizó en agua y se agitó, la solución se filtró a través de una serie de tamices con apertura de mallas de 600, 425, 90 y 25 μm, y de las fracciones retenidas se extrajeron las esporas de los HMA mediante filtración a vacío.
Obtención del inóculo
Para la obtención del inóculo, se desinfectaron las esporas adicionando Tween 20 a 0.05 %, se centrifugaron a 500 rpm por 1 minuto, después se eliminó el sobrenadante y se adicionó Cloramina T al 2 %, se centrifugó a 500 rpm durante 15 min, estos dos procedimientos se repitieron en dos ocasiones, finalmente, se retiró el sobrenadante (Bécard y Piché, 1992). Cada consorcio contenía 110 esporas mL-1 con un promedio de cuatro morfoespecies presentes. Los inóculos se mantuvieron a 4 °C hasta su aplicación.
Material vegetal
Se utilizaron plantas de Stevia rebaudiana Bertoni variedad Morita II, propagadas por esqueje, a partir de plantas cultivadas con seis meses de edad. El material vegetal fue proporcionado por el Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), C.E. Mocochá.
Establecimiento del experimento
El trasplante se realizó el 9 de marzo de 2021, cuando las plántulas alcanzaron una altura de 15 cm en promedio. Se utilizaron bolsas de vivero con capacidad de 7 L. Las bolsas se distribuyeron dentro de un invernadero a una distancia de 0.30 y 1.0 m entre plantas e hileras, respectivamente. Se aplicó riego por goteo con el 80 % de la evapotranspiración de referencia, calculado en mm día-1, para ello se utilizaron los registros diarios de la evaporación de un tanque evaporímetro tipo A, instalado dentro del área experimental (Cauich-Cauich et al., 2018). Las temperaturas promedio registradas, en la temporada de crecimiento fueron de 38.8 °C como máxima y 22.5 °C como mínima, mientras que la humedad relativa osciló entre 26 - 91 %.
Propiedades fisicoquímicas del sustrato
El análisis fisicoquímico del sustrato (Tabla 1), se realizó en el laboratorio de análisis de suelos, plantas y agua (LASPA) de la Universidad Autónoma de Yucatán. La muestra correspondió a 1 kg del sustrato compuesto de una mezcla de suelo y bagazo viejo de henequén (2:1 v/v). Se realizaron los siguientes métodos: Textura (Hidrómetro de Bouyucos), pH (Potenciómetro), Conductividad Eléctrica (Conductómetro), Nitrógeno total (Micro-Kjeldahl), Fósforo disponible (Olsen; extracción con bicarbonato de sodio), Potasio intercambiable (Extraído con acetato de amonio, por el método de cobaltonitrito), Materia orgánica (Walkley-Black). El sustrato se esterilizó por flujo de vapor a 126 °C durante 7 h utilizando una caldera generadora de vapor (Sioux corporation, Beresford, USA).
Table 1. Physico-chemical characteristics of the substrate used in the experiment.
| Arena (%) | Limo (%) | Arcilla (%) | Clase textural | Materia | pH | C.E. (dS m-1) | CIC (meq/100g) | N Total (%) | P Disponible (mg kg-1) | K intercambiable (meq/100g) |
|---|---|---|---|---|---|---|---|---|---|---|
| 57.32 | 14 | 28.68 | Franco arcillo-arenoso | 9.58 | 6.3 | 0.007 | 121.23 | 0.83 | 74.335 | 0.19 |
C.E: Conductividad eléctrica, CIC: Capacidad de intercambio catiónico, N: Nitrógeno, P: Fósforo, K: Potasio
Manejo del cultivo
Se realizaron dos podas de formación al cultivo, la primera se realizó a los 10 días después del trasplante (ddt) con la finalidad de eliminar la dominancia apical e inducir brotes y la segunda se realizó a los 20 ddt para eliminar la floración del cultivo, la cual no es recomendable por que disminuye el tamaño de la hoja. La cosecha de hojas se llevó a cabo a los 120 ddt al final de la evaluación (Cauich-Cauich et al., 2018). A partir de 30 ddt se suministró fertilización nitrogenada y potásica vía Drench (con 4.09 g N como nitrato de amonio y 4.50 g K como nitrato de potasio por planta respectivamente), se realizaron aplicaciones foliares a punto de rocío de productos orgánicos: Fungicida BioEquus; 3 mL L-1 e insecticida Neem Higuer; 5 mL L-1 para el control preventivo de plagas y enfermedades.
Diseño experimental
El experimento se estableció bajo un diseño completamente al azar con arreglo bifactorial (4X3) para evaluar el efecto de la interacción entre consorcios nativos de HMA y niveles de fosforo. El factor A correspondió a; consorcios nativos de HMA (RC, TZ, CY más un testigo sin inocular (T)) y como factor B; cinco niveles de fósforo (0, 25, 50, 75 y 100 %) suministrado al inicio de la prueba como; 0, 79, 158, 237 y 316 mg de P205 kg-1 suelo respectivamente, en función de su exigencia nutricional (19 kg ha-1 ciclo) (Ramírez-Jaramillo y Lozano-contreras, 2017). Los consorcios de HMA se aplicaron directamente en la zona radicular con 110 esporas al momento del trasplante. La interacción de los factores totalizó 20 tratamientos, con 4 repeticiones y 80 unidades experimentales.
Determinación de la colonización micorrícica
A los 120 ddt se estimó el porcentaje de colonización por HMA, las raíces se lavaron con agua de la llave, se transportaron al laboratorio y se tiñeron con azul de tripano 0.05 %, siguiendo la técnica de Phillips y Hayman (1970). Con las raíces teñidas se realizaron preparaciones permanentes para observar las estructuras de HMA que indicaban colonización (micelio, esporas, vesículas, arbúsculos y enrollamientos). La colonización micorrícica total se calculó según el método de intersección de líneas (Giovannetti y Mosse, 1980). Para cada tratamiento, se evaluaron 100 segmentos de raíces de cinco plantas.
Parámetros del crecimiento vegetativo
Al final del experimento (120 ddt) se evaluó el crecimiento de la planta mediante las variables; altura final de la planta (cm), medida con un flexómetro desde la base del tallo hasta el último ápice foliar, diámetro del tallo (mm), medido con un vernier digital colocado a 3 cm de la superficie del suelo, número de ramas (n planta-1), longitud de la raíz (cm) con un flexómetro, volumen de raíz (cm3) con base en el principio de Arquímedes, usando una balanza de precisión y un vaso de precipitados con agua, al sumergir las raíces en el agua, sin tocar las paredes del vaso, se registra un aumento de peso en el sistema (medido en g) que equivale al volumen de la raíz en cm3, y área foliar (cm2), con un integrador electrónico de área modelo LICOR LI300 (LI-COR, Inc. Lincoln, NE). Adicionalmente se calculó el índice morfológico; relación raíz a brote (materia seca de raíz / materia seca aérea (tallos y hojas) como indicador de la calidad de la planta (Arizaleta y Pire, 2008).
Se determinó la producción y distribución de biomasa seca (g planta-1), para ello se separaron los órganos de la planta (raíz, tallo y hojas), los cuales se depositaron en bolsas de papel y se secaron en una estufa de aire forzado a 70 °C por 72 h hasta peso constante, posteriormente se pesaron en una balanza analítica.
Determinación de parámetros fisiológicos
El valor relativo de clorofila como índice SPAD, se midió con un medidor de clorofila portátil SPAD-502 plus Minolta según la metodología de Markwell et al. (1995). El intercambio de gases; tasa de asimilación neta de CO2 (fotosíntesis), conductancia estomática, transpiración y uso eficiente del agua a escala foliar, se midieron con un analizador de gases en infrarrojo (LICOR LI-6400, Nebraska, Estados Unidos). Las mediciones de clorofila e intercambio de gases, se realizaron a los 120 ddt en cuatro hojas jóvenes totalmente expandidas ubicadas en el estrato alto de tres plantas por tratamiento, entre las 12:00 y 13:00 horas cuando ocurría la mayor densidad de flujo de fotones (1000 μmol m-2 s-1) (Garruña-Hernández et al., 2014).
Análisis estadístico
Con los datos obtenidos de las variables, se realizaron análisis de varianza y para el caso de los datos relacionados con la colonización de los HMA (porcentaje de colonización total) que no cumplieron con los supuestos de distribución normal, fueron transformados para homogenizar varianzas mediante la función de arco seno; y = arcsin (sqrt (colonización)). Se aplicó como comparador de medias el método de Tukey (P ≤ 0.05) mediante el paquete estadístico InfoStat versión 2014 (Universidad Nacional de Córdova, Argentina).
Resultados y discusión
Colonización micorrícica total en S. rebaudiana
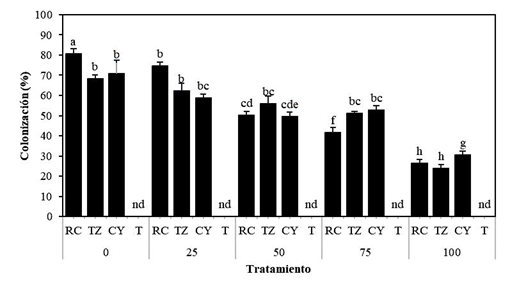
Los consorcios nativos de HMA utilizados en el estudio, colonizaron las raíces de S. rebaudiana a los 120 ddt. La fertilización con fósforo afectó significativamente (P ≤ 0.05) la colonización de los consorcios micorrícicos RC, TZ y CY. El porcentaje de colonización total mostró un comportamiento inversamente proporcional a la concentración de fósforo, es decir, mientras mayor fue la concentración de fosforo aplicado, menor fue el porcentaje de colonización. La interacción entre RC+0 y RC+79 mg de P205 kg-1 suelo, fue superior en el porcentaje de colonización total observada de los consorcios de HMA en S. rebaudiana (80.6 y 74.6% respectivamente), sin embargo, RC+79 mg de P205 kg-1 suelo no se diferenció estadísticamente (P ≤ 0.05) de TZ y CY con la misma concentración de fósforo (62.2 y 58.8 % respectivamente) (Figura 1). Por el contrario, el porcentaje de colonización total disminuyó en los consorcios CY, RC y TZ cuando se fertilizó con 316 mg de P205 kg-1 suelo, registrando 30.4, 26.4 y 23.8 % respectivamente, sin embargo, esta disminución no obstaculizó el efecto que los HMA pudieron tener sobre otras variables. Por otro lado, no se detectó colonización en plantas testigo. Se observaron hifas extra e intraradicales, vesículas y esporas y arbúsculos bajo microscopio compuesto a 10, 40 y 100 X en muestras representativas de cada consorcio con 79 mg de P205 kg-1 suelo (Figura 2). Al respecto, la disponibilidad del fósforo puede influir en la simbiosis HMA-planta y, en consecuencia, en la biomasa de la raíz (Balzergue et al., 2013). Smith et al. (2011) obtuvieron resultados similares, al observar una reducción significativa en el porcentaje de colonización, asociada con aumentos en las dosis de fósforo en el suelo. También son congruentes con los resultados de Mandal et al. (2013), quienes obtuvieron 87 % de colonización total en plantas de S. rebaudiana inoculadas con Rhizophagus fasciculatus, y una reducción al 74 % cuando se aplicó 50 mg de P205 kg-1 suelo. Por su parte, Tavarini et al. (2018) confirmaron que S. rebaudiana es susceptible a la colonización por HMA observando un porcentaje de colonización del 87.6 %; sin embargo, adicionando 50 mg de P205 kg-1 suelo, obtuvieron 75.8 % de raíces colonizadas. Al respecto, se ha reportado que, la presencia de estrigolactonas (hormonas vegetales involucradas en la etapa presimbiótica) se correlaciona negativamente con la concentración de fósforo. Es decir, aumentan en condiciones deficientes de fósforo, favoreciendo la colonización micorrícica (López-Ráez et al., 2011; López-Ráez y Pozo, 2013). En contexto con los hallazgos previos, los consorcios nativos de HMA evaluados en este estudio (RC, TZ y CY), mostraron potencial para colonizar de 65 a 74.8 % las raíces de S. rebaudiana actuando en sinergia con 79 mg de P205 kg-1 suelo.
Figura 2 Raíces de S. rebaudiana colonizadas con consorcios nativos de HMA. A) raíces colonizadas con B) raíces colonizadas con TZ, y C) raíces co-lonizadas con CY, hifas extraradicales (a) (10X), vesículas e hifas intraradica-les (b) (40X), arbusculo (c) (100X), con 25 % de fertilización con fósforo.
Efecto en el crecimiento vegetativo de S. rebaudiana
La respuesta de las plantas de S. rebaudiana en el crecimiento vegetativo, se determinó a los 120 ddt. El efecto principal de los consorcios de HMA, presentó diferencias significativas (P ≤ 0.05) en las variables: número de ramas, área foliar, volumen de raíz y en la relación raíz/brote. El efecto de los niveles de fósforo presentó significancia (P ≤ 0.05) en las variables: área foliar y volumen de raíz, mientras que, la interacción entre los consorcios de HMA y los niveles de fósforo tuvo efectos significativos (P ≤ 0.05) en la altura final, diámetro del tallo y longitud de raíz.
Las plantas más altas se registraron en los tratamientos CY, TZ y RC en interacción con 158 mg de P205 kg-1 suelo, alcanzando una altura final de 31.6, 31.5 y 31.2 cm respectivamente, teniendo un efecto estadísticamente igual (P ≤ 0.05) entre sí, junto con RC y TZ con 79 mg de P205 kg-1 suelo (29.8 y 30.3 respectivamente), pero diferente con el tratamiento T+316 mg de P205 kg-1 suelo (26.8 cm) que representa la fertilización convencional (Tabla 2). Las plantas inoculadas con consorcios nativos de HMA mejoraron la altura incluso sin fertilización con fósforo en comparación con plantas testigo, probablemente a que tuvieron un mayor porcentaje de colonización. Este resultado pone en evidencia la diferencia significativa (P ≤ 0.05) del uso de HMA junto a niveles de fósforo menores a la fertilización convencional, sobre la mejora en altura de las plantas en S. rebaudiana.
Tabla 2 Efecto de la inoculación de consorcios nativos de HMA y la aplicación de fósforo sobre altura final de la planta, diámetro del tallo, número de ramificaciones y área foliar de S. rebaudiana a los 120 ddt.
Table 2. Effect of the inoculation of native AMF consortia and the application of phosphorus, on the final height of the plant, stem diameter, number of branches and leaf area of S. rebaudiana at 120 dat.
| Variable | P (mg de P205 kg-1 suelo) | Consorcio de HMA | ||||
|---|---|---|---|---|---|---|
| RC | TZ | CY | Testigo | Media | ||
| Altura (cm) | 0 | 27.3 ± 2.1 ab | 25.3 ± 1.0 b | 28.4 ± 1.0 ab | 19.9 ± 0.4 cd | 25.2 B |
| 59 | 29.8 ± 1.9 a | 30.3 ± 1.3 a | 27.5 ± 2.0 ab | 20.8 ± 0.8 c | 27.1 AB | |
| 158 | 30.4 ± 1.1 a | 28.0 ± 1.6 ab | 28.0 ± 0.8 ab | 17.7 ± 0.5 e | 26.1 B | |
| 237 | 31.3 ± 0.7 a | 31.5 ± 1.7 a | 31.6 ± 0.9 a | 22.4 ± 1.1 c | 29.2 A | |
| 316 | 29.8 ± 1.4 a | 28.2 ± 1.3 ab | 28.0 ± 1.3 ab | 26.9 ± 0.9 b | 28.2 A | |
| Media | 29.7 A | 28.7 A | 28.8 A | 21.6 B | ||
| Significancia: HMAxP= *; HMA= **; P= * | ||||||
| Diámetro del tallo (mm) | 0 | 2.9 ± 0.2 bc | 3.2 ± 0.2 b | 3.0 ± 0.1 bc | 2.3 ± 0.1 c | 2.8 B |
| 59 | 3.7 ± 0.2 a | 3.2 ± 0.1 b | 3.8 ± 0.1 a | 2.2 ± 0.1 e | 3.2 A | |
| 158 | 3.3 ± 0.1 b | 2.7 ± 0.2 bcd | 3.2 ± 0.1 b | 2.0 ± 0.1 e | 2.8 B | |
| 237 | 3.1 ± 0.1 bc | 3.3 ± 0.2 ab | 3.1 ± 0.1 b | 2.5 ± 0.1 c | 3.0 A | |
| 316 | 3.4 ± 0.1 ab | 3.4 ± 0.1 b | 3.1 ± 0.2 b | 2.6 ± 0.2 c | 3.1 A | |
| Media | 3.3 A | 3.1 A | 3.2 A | 2.3 B | ||
| Significancia: HMAxP= *; HMA= **; P= * | ||||||
| Número de ramificaciones (N° planta-1) | 0 | 12.6 ± 2.3 | 17.0 ± 3.7 | 11.1 ± 1.3 | 8.1 ± 0.7 | 12.2 B |
| 59 | 21.9 ± 1.9 | 20.8 ± 0.8 | 23.3 ± 3.3 | 10.0 ± 0.5 | 19.0 A | |
| 158 | 16.8 ± 1.6 | 13.9 ± 1.9 | 17.9 ± 1.4 | 6.8 ± 1.1 | 13.9 B | |
| 237 | 15.9 ± 1.4 | 14.8 ± 0.8 | 18.3 ± 0.9 | 6.7 ± 1.0 | 13.9 B | |
| 316 | 13.8 ± 3.7 | 14.0 ± 3.9 | 13.5 ± 3.4 | 8.6 ± 2.2 | 12.5 B | |
| Media | 16.2 A | 16.1 A | 16.8 A | 8.0 B | ||
| Significancia: HMAxP= ns; HMA= **; P= * | ||||||
| Área foliar (cm2) | 0 | 608.9 ± 127.9 | 579.9 ± 168.8 | 625.0 ± 67.5 | 401.9 ± 42.4 | 553.9 B |
| 59 | 850.4 ± 42.6 | 561.3 ± 97.6 | 745.9 ± 31.1 | 281 ± 23.5 | 609.7 B | |
| 158 | 839.2 ± 105.3 | 778.8 ± 96.4 | 891.5 ± 120.6 | 193.2 ± 30.0 | 675.7 B | |
| 237 | 1125.4 ± 104.9 | 1045.7 ± 152.5 | 1245.5 ± 101.8 | 393.9 ± 94.1 | 952.6 A | |
| 316 | 1071.6 ± 80.4 | 1003.4 ± 113.6 | 1117.6 ± 289.5 | 738.8 ± 125.4 | 982.9 A | |
| Media | 899.1 A | 793.8 A | 9.25.1 A | 401.8 B | ||
| Significancia: HMAxP= ns; HMA= **; P= * | ||||||
Medias (n = 4) ± desviación estándar. Letras minúsculas indican el efecto de la interacción (HMA*P). Letras mayúsculas en la fila indican el efecto de consorcios (HMA). Letras mayúsculas en la columna indican el efecto de niveles de fósforo (P). La significancia se indica como: ns: no significativo, *: significativo a P ≤ 0.05, **: significativo a P ≤ 0.01, ***: significativo a P ≤ 0.001.
Means (n = 4) ± standard deviation. Lower case letters indicate the effect of the interaction (HMA*P). Capital letters in the row indicate the consortium effect (HMA). Capital letters in the column indicate the effect of phosphorus (P) levels. Significance is indicated as: ns: not significant, *: significant at P ≤ 0.05, **: significant at P ≤ 0.01, ***: significant at P ≤ 0.001.
Diversos estudios destacan la capacidad de los consorcios de HMA para promover el crecimiento de hortalizas de importancia económica como chile serrano y jalapeño (Leos-Escobedo et al., 2022). Por otro lado, Quiñones-Aguilar et al. (2014) reportaron un efecto similar en la dinámica de crecimiento de Carica papaya L., observando mayor altura con niveles bajos de fósforo junto a la inoculación de Glomus spp. Resultados semejantes que involucran fertilización con fósforo fueron los de Alarcón y Ferrera-Cerrato (2003) quienes registraron la mayor altura en plantas de Citrus volkameriana Tan & Pasq., cuando se inocularon con un consorcio micorrícico integrado por tres especies del género Glomus y fertilizadas con 20 mg de P205 kg-1 suelo. Los HMA son útiles para promover el crecimiento de las plantas sin la necesidad de utilizar altas dosis de fertilizantes (Vafadar et al., 2014).
El diámetro de la base del tallo en las plantas de S. rebaudiana fue mayor en los tratamientos CY y RC junto a 79 mg de P205 kg-1 suelo, manteniendo un espesor de 3.8 y 3.7 mm respectivamente, estos valores fueron significativamente diferentes (P ≤ 0.05) a los obtenidos con T+316 mg de P205 kg-1 suelo (manejo convencional) en un 32 %. En este sentido, el diámetro del tallo, representa un parámetro indispensable en el crecimiento y rendimiento de las plantas, a mayor grosor del tallo, mayor es el área del parénquima vascular, lo que implica mayor reserva de asimilados, así como, mayor área de xilema que posibilita un mayor transporte de agua y nutrientes (Holbrook y Zwieniecki, 2011). Los tratamientos RC y TZ+316 mg de P205 kg-1 suelo, junto con TZ+237 mg de P205 kg-1 suelo, superaron en efecto al resto de los tratamientos, incluso con niveles más bajos de fósforo (Tabla 2). Asimismo, de manera similar a la variable altura, se observó un aumento significativo en el grosor del tallo de las plantas inoculadas sin fertilización con fósforo, comparadas con plantas testigo con las mismas condiciones. Tanto en la altura final como en el diámetro del tallo, la inoculación de los consorcios nativos RC y TZ con fósforo, generó mejores resultados frente al efecto de la sola inoculación y la sola fertilización con fósforo, es decir, la sinergia de los factores fue indispensable para promover mayor altura y diámetro en S. rebaudiana.
En el número de ramificaciones por planta, no se encontró diferencias significativas (P ≤ 0.05) por efecto de la interacción de los factores (HMA*P), pero sí por efecto individual tanto de los de los consorcios HMA como de los niveles de fósforo. El efecto de RC, TZ, CY estimulo la formación de 16.9, 16.2 y 16.1 ramificaciones por planta respectivamente, no existiendo diferencias estadísticas entre ellos, pero contrastando su efecto frente a plantas no inoculadas, las cuales registraron en promedio 8.1 ramificaciones por planta, detectando un aumento aproximado del 50 % en plantas inoculadas. Por parte del efecto del factor fósforo, la fertilización con 79 mg de P205 kg-1 suelo, promovió el mayor número de ramificaciones por planta en promedio (19 n planta-1) en comparación al resto de los niveles evaluados (Tabla 2). Los efectos beneficiosos de la simbiosis de HMA sobre el aumento de ramas y adecuada formación de la parte aérea de la planta (hojas y tallos) han sido bien reportados en la familia Asteracea de donde pertenece S. rebaudiana (Rapparini et al., 2008; Aroca et al., 2013). Según Mandal et al. (2015), en S. rebaudiana, la simbiosis de HMA induce un cambio en el flujo de metabolitos hacia la biosíntesis de glucósidos de esteviol, en este sentido, la biosíntesis de glucósidos de esteviol y giberelinas (hormonas de crecimiento vegetal) comparten una misma ruta de síntesis (Brandle y Telmer, 2007; Ceunen y Geuns, 2013; Guleria y Yadav, 2013), en relación con eso, las giberelinas están involucradas en la modulación de la ramificación de brotes y el control de la arquitectura aérea de la planta (hojas y tallos) (Rameau et al., 2015) (Ni et al., 2015), lo que podría explicar el aumento del número de ramificaciones observado en las plantas micorrizadas. Por otro lado, aun cuando no se observaron efectos significativos (P ≤ 0.05) de la interacción HMA*P, aplicar 25 % de P de la fertilización convencional para la región fue idóneo para mejorar el número de ramificaciones en S. rebaudiana. Es bien sabido que la fertilización química podría mejorar el crecimiento de las plantas (altura de las plantas, así como el número de ramas) debido al papel del P como componente esencial de los compuestos de fosfoproteínas y energía (Mostafa, 2019). Sin embargo, lograr esa mejora con dosis menores a las recomendadas, reduce el impacto económico y ambiental de los fertilizantes químicos.
El área foliar a los 120 ddt presentó diferencias significativas (P ≤ 0.05) solo cuando los factores en estudio (HMA y fósforo) se analizaron por separado. A pesar de no encontrarse un efecto significativo de la interacción HMA*P, el análisis de varianza mostró evidencia del efecto individual de cada factor. Asimismo, los consorcios HMA tuvieron diferencias significativas en comparación con plantas testigo, siendo CY y RC los consorcios que marcaron un incremento de 57 y 44 % el área foliar respectivamente. Por su parte, el consorcio TZ tuvo un efecto estadísticamente igual a los anteriores. Sin embargo, los tres consorcios superaron a plantas testigo sin inocular, que generó en promedio 401.8 cm2 (Tabla 2). Estos resultados son similares a los reportados por Aguirre-Medina et al. (2020) a los 90 ddt en plantas de S. rebaudiana inoculadas con la especie R. intraradices y añadidura de estiércol bovino como biofertilizante. En el caso de los niveles del factor fósforo, se observó una tendencia directamente proporcional a la concentración de fósforo suministrado, mientras mayor fue el nivel de fósforo aplicado, el área foliar aumentó (Figura 3). Por lo tanto, este parámetro de crecimiento está directamente relacionado con la capacidad de la planta en la absorción de fósforo (Maniruzzaman et al., 2017). Estos resultados demuestran la influencia de la simbiosis de HMA para expandir la lámina foliar, como se reportó por Sarmiento-López et al. (2021), lo que incrementa el área de captación de luz para la fotosíntesis (Tavarini et al., 2015).
Figura 3 Índice relativo del contenido de clorofila en plantas de S. rebaudiana inoculadas con consorcios de HMA (RC, TZ, CY y T) y fertilizadas con niveles de fósforo (0, 79, 158, 237 y 316 mg de P205 kg-1 suelo) a los 120 ddt. Las letras distintas indican diferencias significativas (P ≤ 0.05, prueba de Tukey), n = 4.
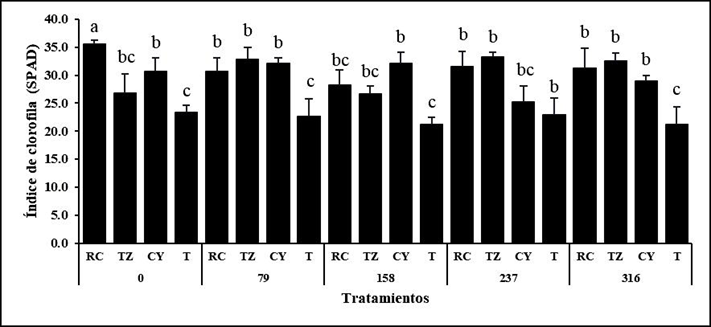
Figure 3. Relative index of chlorophyll content in S. rebaudiana plants inoculated with AMF consortia (RC, TZ, CY and T) and fertilized with phosphorus levels (0, 79, 158, 237 and 316 mg of P205 kg-1 soil) at 120 dat. Different letters indicate significant differences (P ≤ 0.05, Tukey’s test), n = 4.
El factor de interacción entre consorcios de HMA y niveles de fósforo mostró diferencias significativas (P ≤ 0.05) sobre la longitud de raíz. Los tratamientos CY+158 mg de P205 kg-1 suelo y TZ+237 mg de P205 kg-1 suelo, promocionaron la mayor longitud de raíz a los 120 ddt, alcanzando promedios de 12.11 y 11.67 cm respectivamente (Tabla 3). Estos resultados son similares a los reportados por Cauich-Cauich et al. (2018) quienes inocularon una sola especie (R. intraradices) en plantas de S. rebaudiana, por tanto, la inculación de un consorcio micorrícico no causó mayor efecto en la promoción del alargamiento radicular. En cambio, la interacción HMA*P no fue significativa (P ≤ 0.05) sobre el volumen de raíz, sin embargo, los consorcios de HMA y niveles de fosforo por separado, mostraron diferencias estadísticas (P ≤ 0.05). El volumen radicular de las plantas no inoculadas fue en promedio 0.56 cm3, mientras que en las plantas inoculadas con RC, TZ y CY, el volumen de raíz aumentó más del 50 %. Una adecuada arquitectura del sistema radicular en las plantas inoculadas con HMA está relacionada por un estado nutricional favorecido por la simbiosis micorrícica y el estímulo de fitohormonas (Oliveira et al., 2016) aunque, también involucra mecanismos no nutricionales como la capacidad de asimilación de CO2 en la fotosíntesis (Pan et al., 2020). En cuanto a los niveles de fósforo, la aplicación de 59 mg de P205 kg-1 suelo, generó el mayor volumen de raíz con 1.48 cm3 (Tabla 3). Por tanto, la inoculación de consorcios de HMA permite usar dosis de fósforo menores a la convencional y obtener los mismos resultados. Según Smith et al. (2011), la producción de biomasa, también depende de la capacidad de la planta para generar volumen radicular y tener una adecuada absorción de agua y nutrientes. Sin embargo, la simbiosis de HMA no siempre favorece el crecimiento radicular en las plantas, depende de las especies utilizadas y la planta hospedera. Al respecto, Yao et al. (2009) observaron que las especies de HMA Glomus mosseae y G. caledonium redujeron significativamente el crecimiento radicular en plantas de Poncirus trifoliata L. pero, Gigaspora margarita y G. versiforme influyeron positivamente. Este estudio sugiere que tal comportamiento, se atribuye a los mecanismos que las plantas pueden tener sobre la regulación de fitohormonas (Jiang, 2007), sin embargo, también está involucrada la capacidad y eficiencia de la colonización entre los simbiontes (Giovannini et al., 2020).
Tabla 3 Efecto de la inoculación de consorcios nativos de HMA y la aplicación de fósforo, sobre el crecimiento radicular de S. rebaudiana a los 120 ddt.
Table 3. Effect of the inoculation of native AMF consortia and the application of phosphorus, on the root growth of S. rebaudiana at 120 dat.
| Variable | P (mg de P2O5 kg-1 suelo) | Consorcio de HMA | ||||
|---|---|---|---|---|---|---|
| RC | TZ | CY | Testigo | Media | ||
| Longitud de raíz (cm) | 0 | 9.78 ± 0.97 b | 9.48 ± 0.70 bc | 9.13 ± 0.11 bc | 7.29 ± 0.77 d | 8.92 BC |
| 79 | 9.90 ± 0.63 b | 10.53 ± 0.84 ab | 10.63 ± 0.26 b | 6.91 ± 0.62 d | 9.49 B | |
| 158 | 10.97 ± 0.35 ab | 10.21 ± 0.82 b | 12.11 ± 0.32 a | 6.87 ± 1.02 d | 10.04 B | |
| 237 | 10.87 ± 0.52 ab | 11.67 ± 0.43 a | 9.27 ± 0.57 bc | 6.91 ± 0.88 d | 9.68 B | |
| 316 | 11.26 ± 0.19 ab | 10.46 ± 0.20 b | 10.79 ± 0.56 ab | 10.97 ± 0.42 ab | 10.87 A | |
| Media | 10.56 A | 10.47 A | 10.39 A | 7.79 B | ||
| Significancia: HMAxP= *; HMA= ***; P= * | ||||||
| Volumen de raíz (cm3) | 0 | 0.73 ± 0.28 | 0.94 ± 0.23 | 0.84 ± 0.05 | 0.23 ± 0.02 | 0.69 C |
| 79 | 1.87 ± 0.14 | 1.76 ± 0.13 | 1.39 ± 0.41 | 0.92 ± 0.14 | 1.48 A | |
| 158 | 1.33 ± 0.12 | 1.02 ± 0.10 | 1.24 ± 0.07 | 0.65 ± 0.08 | 1.06 B | |
| 237 | 1.31 ± 0.13 | 1.10 ± 0.12 | 1.09 ± 0.12 | 0.47 ± 0.10 | 1.01 B | |
| 316 | 1.20 ± 0.11 | 1.31 ± 0.22 | 1.13 ± 0.15 | 0.56 ± 0.14 | 1.05 B | |
| Media | 1.29 A | 1.23 A | 1.14 A | 0.56 B | ||
| Significancia: HMAxP= ns; HMA= ***; P= ** | ||||||
| Relación raíz/brote g planta-1) | 0 | 0.10 ± 0.03 | 0.14 ± 0.03 | 0.08 ± 0.01 | 0.06 ± 0.03 | |
| 79 | 0.12 ± 0.01 | 0.12 ± 0.01 | 0.10 ± 0.01 | 0.21 ± 0.05 | ||
| 158 | 0.14 ± 0.01 | 0.12 ± 0.01 | 0.10 ± 0.01 | 0.20 ± 0.07 | ||
| 237 | 0.11 ± 0.02 | 0.07 ± 0.01 | 0.10 ± 0.02 | 0.07 ± 0.01 | ||
| 316 | 0.12 ± 0.03 | 0.11 ± 0.03 | 0.07 ± 0.00 | 0.19 ± 0.01 | ||
| Media | 0.12 B | 0.12 B | 0.09 C | 0.15 A | ||
| Significancia: HMAxP= ns; HMA= *; P= ns | ||||||
Medias (n = 4) ± desviación estándar. Letras minúsculas indican el efecto de la interacción (HMA*P). Letras mayúsculas en la fila indican el efecto de consor-cios (HMA). Letras mayúsculas en la columna indican el efecto de niveles de fósforo (P). La significancia se indica como: ns: no significativo, *: significativo a P ≤ 0.05, **: significativo a P ≤ 0.01, ***: significativo a P ≤ 0.001.
Means (n = 4) ± standard deviation. Lower case letters indicate the effect of the interaction (HMA*P). Capital letters in the row indicate the consortium effect (HMA). Capital letters in the column indicate the effect of phosphorus (P) levels. Significance is indicated as: ns: not significant, *: significant at P ≤ 0.05, **: significant at P ≤ 0.01, ***: significant at P ≤ 0.001.
Para evaluar la proporción de biomasa por encima y por debajo del suelo en las plantas de S. rebaudiana, se evaluó la relación raíz/brote, la cual mostró que las plantas inoculadas con consorcios de HMA se diferenciaron (P ≤ 0.05) de las plantas testigo por tener valores bajos en este índice (Tabla 3), lo cual indica, que la simbiosis propició una proporción significativamente mayor de brotes en la parte aérea (hojas y tallo) que de raíces. Al respecto, Smith et al. (2011) observaron que las plantas colonizadas por HMA poseen una relación raíz/brote más baja. Por el contrario, el aumento de la relación raíz/brote en las plantas no inoculadas, sugiere el rechazo de la hipótesis de que las plantas con una mayor proporción de raíz tienen más posibilidad de obtener el mayor beneficio de crecimiento (Maherali, 2014). Es decir, aún con una menor relación raíz/brote, con la ayuda de los HMA, las plantas podrían absorber los nutrientes del suelo de manera más eficiente, ahorrar energía y carbono para aumentar al mismo tiempo el crecimiento de los brotes (Zhu et al., 2017).
Producción de biomasa
La respuesta de las plantas de S. rebaudiana en la producción de biomasa seca, se determinó a los 120 ddt. El efecto individual de los consorcios nativos de HMA y los niveles de fósforo presentaron diferencias estadísticas (P ≤ 0.05) en la biomasa seca de hojas y de raíz, mientras que, la interacción entre los dos factores (HMA*P) produjo diferencias (P ≤ 0.05) en la biomasa seca del tallo y total. El consorcio RC incrementó la biomasa seca de hoja en un 60 % en comparación a plantas testigo, registrando en promedio 21.62 contra 8.60 g planta-1 respectivamente. En cuanto a los niveles de fósforo, la fertilización con 79 mg de P205 kg-1 suelo causó valores ligeramente altos, sin embargo, estadísticamente el efecto fue igual que con 237 y 316 mg de P205 kg-1 suelo (Tabla 4). La biomasa seca del tallo fue mayor en los tratamientos TZ y CY con 79 mg de P205 kg-1 suelo que produjeron 9.81 y 9.46 g planta-1 respectivamente, aunque, estadísticamente, no fueron diferentes con RC y TZ+237 mg de P205 kg-1 suelo y con CY+316 mg de P205 kg-1 suelo, pero si marcaron diferencia frente al Testigo+0 y Testigo+79 mg de P205 kg-1 suelo, que solo generaron 1.50 y 1.89 g planta-1 respectivamente (Tabla 4). Independientemente del nivel de fósforo aplicado, la simbiosis de los HMA impulsó la respuesta en esta variable. En S. rebaudiana, la biomasa de la parte aérea (hojas y tallo) es la parte más importante en el cultivo, ya que es donde se concentra la mayor cantidad de esteviósido y rebaudiosido-A, que le dan la propiedad dulce a la planta (Wolwer-Rieck, 2012). En ese contexto, el uso de HMA se ha relacionado con el aumento de biomasa, y se atribuye a una mejor respuesta al transporte de nutrientes y agua desde lugares donde la raíz no puede explorar (Tarraf et al., 2015). Además, Tavarini et al. (2018) subrayan que, en S. rebaudiana, los HMA y niveles bajos de fósforo crean un ambiente idóneo que beneficia la producción de biomasa, por lo que, los resultados de este estudio pueden ser considerados en estrategias de producción de S. rebaudiana.
Tabla 4 Efecto de consorcios nativos de HMA y fertilización con fósforo sobre la producción y distribución de biomasa seca de S. rebaudiana a los 120 ddt.
Table 4. Effect of native AMF consortia and phosphorus fertilization, on the production and distribution of dry biomass of S. rebaudiana at 120 dat.
| Biomasa seca | P (mg de P2O5 kg-1 suelo) | Consorcios de HMA | ||||
| RC | TZ | CY | Testigo | Media | ||
| Hoja | 0 | 11.60 ± 3.97 | 12.96 ± 3.98 | 15.63 ± 1.82 | 4.55 ± 1.05 | 11.19 C |
| 79 | 27.68 ± 2.15 | 25.85 ± 2.46 | 27.13 ± 3.77 | 5.05 ± 0.85 | 21.43 A | |
| 158 | 19.65 ± 2.54 | 14.44 ± 2.25 | 21.08 ± 1.58 | 10.98 ± 3.14 | 16.54 AB | |
| 237 | 23.59 ± 4.04 | 24.22 ± 3.19 | 18.34 ± 2.55 | 10.48 ± 1.74 | 19.16 A | |
| 316 | 25.57 ± 2.37 | 16.84 ± 1.36 | 20.21 ± 2.40 | 11.94 ± 3.03 | 18.64 A | |
| Media | 21.62 A | 18.86 A | 20.48 A | 8.60 B | ||
| Significancia: HMAxP = ns; HMA = ***; P = ** | ||||||
| Tallo | 0 | 4.62 ± 1.36 abc | 4.58 ± 1.14 abc | 5.41 ± 0.65 abc | 1.50 ± 0.28 e | |
| 79 | 7.22 ± 0.77 a | 9.81 ± 1.13 a | 9.46 ± 2.11 a | 1.89 ± 0.20 e | ||
| 158 | 8.17 ± 1.00 a | 4.42 ± 0.85 abc | 8.10 ± 0.49 a | 3.58 ± 0.88 abcd | ||
| 237 | 8.34 ± 1.59 a | 9.01 ± 1.83 a | 7.10 ± 0.99 a | 4.47 ± 1.33 abc | ||
| 316 | 7.28 ± 0.51 ab | 5.41 ± 1.06 abc | 7.13 ± 0.98 a | 3.98 ± 1.09 abc | ||
| Media | 7.13 A | 6.64 A | 7.44 A | 3.08 B | ||
| Significancia: HMAxP = **; HMA = ***; P = ns | ||||||
| Raíz | 0 | 1.26 ± 0.29 | 2.10 ± 0.49 | 1.62 ± 0.10 | 0.58 ± 0.09 | 1.39 C |
| 79 | 4.04 ± 0.26 | 4.11 ± 0.49 | 3.92 ± 0.86 | 1.38 ± 0.25 | 3.36 A | |
| 158 | 3.79 ± 0.26 | 2.43 ± 0.55 | 2.90 ± 0.06 | 0.97 ± 0.13 | 2.52 AB | |
| 237 | 3.14 ± 0.23 | 2.63 ± 0.14 | 2.27 ± 0.38 | 1.07 ± 0.26 | 2.28 AB | |
| 316 | 4.01 ± 1.27 | 2.98 ± 0.61 | 1.84 ± 0.24 | 2.95 ± 0.75 | 2.95 A | |
| Media | 3.25 A | 2.85 A | 2.51 A | 1.39 B | ||
| Significancia: HMAxP = ns; HMA = ***; P = ** | ||||||
| Total | 0 | 17.47 ± 5.58 b | 19.63 ± 5.58 b | 22.66 ± 2.39 b | 7.01 ± 1.37 d | 16.69 C |
| 79 | 38.39 ± 2.91 a | 42.16 ± 3.97 a | 41.05 ± 6.62 a | 8.32 ± 1.04 d | 32.48 A | |
| 158 | 31.61 ± 3.80 ab | 21.29 ± 3.53 b | 32.08 ± 2.03 ab | 15.13 ± 2.83 bc | 25.03 AB | |
| 237 | 35.07 ± 5.63 a | 38.97 ± 4.60 a | 27.71 ± 3.56 ab | 16.02 ± 4.44 bc | 29.44 A | |
| 316 | 36.86 ± 3.29 a | 25.23 ± 2.18 b | 29.18 ± 3.59 ab | 18.87 ± 4.86 b | 27.54 A | |
| Media | 31.88 A | 29.46 A | 30.54 A | 13.07 B | ||
| Significancia: HMAxP = *; HMA = ***; P = * | ||||||
Medias (n = 4) ± desviación estándar. Letras minúsculas indican el efecto de la interacción (HMA*P). Letras mayúsculas en la fila indican el efecto de consorcios (HMA). Letras mayúsculas en la columna indican el efecto de niveles de fósforo (P). La significancia se indica como: ns: no significativo, *: significativo a P ≤ 0.05, **: significativo a P ≤ 0.01, ***: significativo a P ≤ 0.001.
Means (n = 4) ± standard deviation. Lower case letters indicate the effect of the interaction (HMA*P). Capital letters in the row indicate the consortium effect (HMA). Capital letters in the column indicate the effect of phosphorus (P) levels. Significance is indicated as: ns: not significant, *: significant at P ≤ 0.05, **: significant at P ≤ 0.01, ***: significant at P ≤ 0.001.
La biomasa seca de raíz fue modulada en gran medida por los consorcios RC, TZ y CY, que mostraron efectos similares sobre la variable, pero aumentaron el peso seco de raíz 58 % con respecto a plantas sin HMA (Tabla 4). Por otro lado, el efecto individual del factor fósforo mostró el mayor peso seco de raíz con 316 mg de P205 kg-1 suelo, no obstante, este resultado no fue significativamente diferente al reducir el nivel de fósforo a 79 mg de P205 kg-1 suelo.
El incremento de la biomasa seca de hoja influye sobre el peso de la biomasa seca total. El tratamiento TZ+79 mg de P205 kg-1 suelo, promovió el mayor aumento de biomasa seca total en un 3 % en comparación a CY y 9 % en comparación a RC con el mismo nivel de fósforo, que fueron el segundo y tercer mejor tratamiento en esta variable, respectivamente. En conjunto, estos resultados demostraron que la simbiosis de los consorcios nativos de HMA condujo a una producción mejorada de biomasa seca aérea en S. rebaudiana a los 120 ddt, por lo que, la fertilización convencional (316 mg de P205 kg-1 suelo) resulta en un alto costo de producción y uso desmedido de fertilizantes químicos. En ese marco, estudios han reportado que las aplicaciones de HMA como bioestimulante, presenta incrementos de biomasa seca en cultivos como Cucumis sativus (Reyes-Pérez et al., 2021), sin embargo, Aguirre-Medina et al. (2020) encontraron que en S. rebaudiana, la inoculación de R. intraradices aumentó la biomasa seca total y el rendimiento de hoja seca. Por otra parte, Vafadar et al. (2014) subrayaron la efectividad de la inoculación de HMA para aumentar el peso seco en S. rebaudiana. No obstante, Mandal et al. (2013) observaron que el aumento de la biomasa seca en plantas inoculadas con HMA es mayor que en plantas no inoculadas cuando se fertiliza con 50 mg de P205 kg-1 suelo, por lo que, el aumento observado se atribuye a la capacidad de traslocación tanto de fósforo, como de otros nutrientes a la planta por parte de los HMA.
Parámetros fisiológicosb
El contenido de clorofila (unidades SPAD) en las hojas de S. rebaudiana, se vio influenciado principalmente por efecto de los consorcios de HMA. La inoculación de RC, TZ y CY permitió el aumento de la concentración de clorofila en un 30% con respecto a plantas no colonizadas (Figura 3). Estos resultados son superiores a los reportados por Mostafa (2019) quien observó un aumento del 18 % en el contenido de clorofila (SPAD) en plantas de S. rebaudiana, con fertilización completa de NPK. El contenido relativo de clorofila es un indicador importante en la producción de biomasa y fitoquímicos en la planta, absorbe energía solar y la convierte en energía química a través de la fotosíntesis (Pal et al., 2015), lo que explica la relación con el aumento de biomasa en las plantas colonizadas por HMA en este estudio. En contraste, la baja concentración de clorofila reduce la actividad fotosintética y la producción de biomasa de las plantas (Richardson et al., 2002).
En el intercambio de gases, la interacción entre consorcios de HMA y niveles de fósforo, tuvo efecto significativo (P ≤ 0.05) sobre la tasa de asimilación de CO2 (fotosíntesis). Las plantas tratadas con RC+79 mg de P205 kg-1 suelo, registraron la tasa fotosintética más alta con 6.97 µmol CO2 m-2 s-1, que estuvo por encima del tratamiento convencional (T+316 mg de P205 kg-1 suelo) con 0.18 µmol CO2 m-2 s-1 (Figura 4A). En este contexto, el tratamiento RC+79 mg de P205 kg-1 suelo, también produjo mayor biomasa seca total que T+316 mg de P205 kg-1 suelo, esto podría explicar parcialmente por qué RC+25 % P registró una tasa fotosintética más alta que T+100 % P. Por otra parte, se observó una disminución de la actividad fotosintética en los tratamientos con más del 50 % de fósforo aplicado. Es decir, los altos niveles de fósforo limitaron la tasa de asimilación de CO2 aún con la inoculación de RC, TZ o CY.
Figura 4 A) Fotosíntesis, B) conductancia estomática, C) Transpiración y D) uso eficiente del agua (UEA), en plantas de S. rebaudiana, inoculadas con consorcios de HMA (RC, TZ, CY y T) y fertilizadas con niveles de fósforo (0, 79, 158, 237 y 316 mg de P205 kg-1 suelo) a los 120 ddt. Las letras distintas indican diferencias significativas (P ≤ 0.05, prueba de Tukey), n = 4.
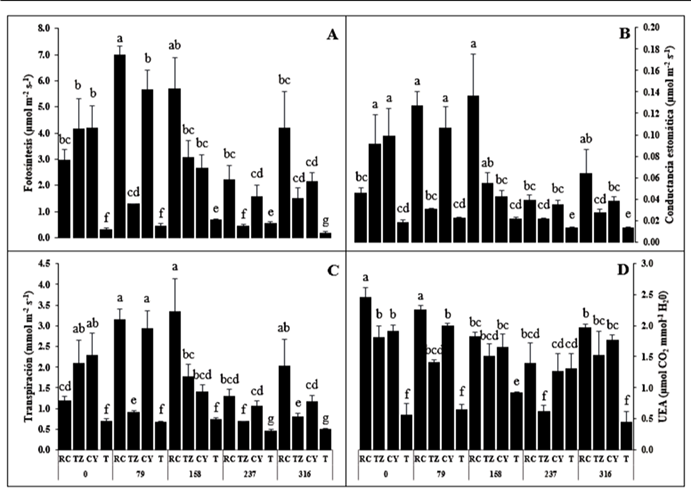
Figure 4. A) Photosynthesis, B) stomatal conductance, C) Transpiration and D) efficient use of water (UEA), in S. rebaudiana plants, inoculated with AMF consortia (RC, TZ, CY and T) and fertilized with phosphorus levels (0, 79, 158, 237 and 316 mg of P205 kg-1 soil) at 120 dat. Different letters indicate significant differences (P ≤ 0.05, Tukey’s test), n = 4.
Estos resultados fueron superiores a los observados por Cauich-Cauich et al. (2018) quienes reportaron 5.41 µmol CO2 m-2 s-1 como la tasa de asimilación de CO2 más alta en plantas de S. rebaudiana inoculadas con Rhizophagus intraradices. En este sentido, es probable que el inóculo compuesto de consorcios nativos de HMA, propicie beneficios múltiples en la fisiología de las plantas. En este estudio, la optimización de la fotosíntesis podría estar relacionada con el área foliar producida, que mejora la intercepción y la utilidad de la luz y beneficia la asimilación fotosintética (Tóth et al., 2002). La conductancia estomática mostró una tendencia similar a la fotosíntesis, es decir, fue menor en los tratamientos con 237 y 316 mg de P205 kg-1 suelo respectivamente (Figura 4B).
Los tratamientos RC+158, RC+79 y CY+79 mg de P205 kg-1 suelo con 0.14, 0.13 y 0.11 mmol H2O m-2 s-1 respectivamente, fueron los que reflejaron los valores más altos de conductancia estomática, e incluso de traspiración con 3.33, 3.15 y 2.92 mmol H2O m-2 s-1 respectivamente (Figura 4C). De acuerdo con Garruña-Hernández et al. (2014), la conductancia estomática tiene un comportamiento directamente proporcional a la transpiración, por lo tanto, esto explica el paralelismo observado entre estas dos variables fisiológicas. Además, se ha reportado que una transpiración más alta en las plantas colonizadas por HMA, es consistente con las tasas de conductancia estomática (Abdel-Fattah et al., 2014). Por otro lado, las plantas testigo no tuvieron relevancia en la actividad de intercambio de gases. Por lo tanto, es evidente que el efecto de RC+79 mg de P205 kg-1 suelo, reguló la apertura estomática y la transpiración, mejorando la utilización de agua por parte de las plantas, mientras ésta, asimilaba la mayor cantidad de CO 2. Al respecto, se ha observado un aumento significativo en el trasporte de fósforo por las hifas hacia la planta, cuando la simbiosis de HMA altera positivamente el comportamiento estomático (Shu et al., 2014).
El uso eficiente del agua instantáneo a escala foliar (UEA), se calculó mediante la relación µmol CO2 (tasa de foto-síntesis) / mmol H2O (tasa de transpiración). Los tratamientos RC+0 y RC+79 mg de P205 kg-1 suelo, mostraron el mejor UEA con 2.45 y 2.25 µmol CO2 mmol-1 H2O respectivamente (Figura 4D). Por lo tanto, resultaron con la capacidad de limitar la pérdida de agua, mientras se mantenía la absorción neta de carbono en las hojas de S. rebaudiana al momento de la medición.
El efecto de la simbiosis sobre el UEA depende en gran medida de la especie de HMA involucrada, sin correlacionar su porcentaje de colonización (Ruiz-Lozano et al., 2010); sin embargo, hay varios parámetros fisiológicos y bioquímicos modulados por los HMA que están involucrados en la regulación del UEA además de la conductancia estomática (Ruiz-Lozano et al., 2010; Augé et al., 2008).
Conclusiones
La fertilización con 79 mg de P205 kg-1 suelo (25 % P de la fertilización convencional) en sinergia con la inoculación del consorcio nativo RC, resultó suficiente para mejorar la arquitectura aérea de las plantas en términos de altura y diámetro del tallo, sin embargo, los tres consorcios (RC, TZ y CY) promovieron mayor número de ramificaciones en comparación con plantas no inoculadas, lo que sugiere mejores resultados en el crecimiento vegetativo de S. rebaudiana. El efecto de la combinación de RC, TZ y CY con 25 % de fósforo sobre la producción de biomasa seca total, fue igual que con 100 %, por lo tanto, la inoculación de consorcios de HMA permite reducir los niveles de fertilización con fósforo en S. rebaudiana. Además, 79 mg de P205 kg-1 suelo, mejoró la colonización micorrícica. Así mismo, RC+79 mg de P205 kg-1 suelo mejoró la tasa de fotosíntesis y el uso eficiente del agua. En conjunto, nuestros resultados demuestran el potencial de los consorcios nativos HMA evaluados. Por lo tanto, pueden considerarse un biofertilizante válido para el cultivo de S. rebaudiana, ya que permite aplicar menor cantidad de fertilizante, lo que conduce a sistemas agrícolas más sostenibles.











 nova página do texto(beta)
nova página do texto(beta)