Introducción
La papaya (Carica papaya L. var. Maradol) es un fruto de elevado valor nutricional (Vieira et al., 2020) y representa una fuente de ácido ascórbico (vitamina C), con valores que oscilan entre 35.4 y 87 mg/100 g de pulpa. Así también, la papaya tiene un alto contenido de carotenoides como el β- caroteno precursor de retinol (vitamina A) (Bautista-Baños et al., 2013). En México, este fruto es de gran importancia económica al ser el tercer mayor productor de papaya en el mundo con 1,039,820 ton/año y el principal exportador de papaya en el mundo (Castillo-Herrera et al., 2020). Sin embargo, la papaya es un fruto climatérico por lo que es altamente perecedero con una corta vida en anaquel (Vela-Gutiérrez et al., 2019). Aunado a esto, la papaya es altamente susceptible al ataque fúngico, principalmente por el hongo Colletotrichum gloesporioides ocasionando pérdidas postcosecha (Maringgal et al., 2019). El uso de tratamiento térmico combinado con fungicidas como tratamiento postcosecha, seguidos de refrigeración durante el almacenamiento y transporte, ayuda a retrasar la maduración y crecimiento de fitopatógenos (Rodrigues et al., 2021). Sin embargo, estos tratamientos no son suficientes para mitigar el problema, especialmente cuando las papayas se mantienen a temperatura ambiente. Por lo anterior, los investigadores buscan tecnologías para prolongar la vida en anaquel de frutos frescos que permita el transporte de los frutos sin refrigeración, explorando nuevos ingredientes. Bajo esa óptica, el desarrollo de películas o recubrimientos es una forma innovadora y efectiva para prolongar la vida útil de frutos frescos además de que esta tecnología permite la incorporación de aditivos antifúngicos. Vieira et al. (2020) estudiaron el efecto del recubrimiento a base de hidoxipropilmetilcelulosa con nanopartículas de plata aplicado a papaya almacenada a 10 °C. Sin embargo, estos autores no reportaron cuanto tiempo se prolonga la vida útil del fruto aunado a que el experimento se llevó a cabo en refrigeración.
Dentro de los polímeros comúnmente utilizados como recubrimientos destacan los alginatos debido a su biocompatibilidad, biodegradabilidad y buena capacidad de formación de película (Barrera et al., 2021). El alginato es principalmente obtenido de algas pardas, siendo las del género Sargassum quienes se han usado como fuente de principal. Las ventajas con respecto a otras fuentes son su abundancia en la naturaleza, el proceso de extracción es fácil y los costos de fabricación son bajos (Borazjani et al., 2017). Particularmente, Sargasum fluitans contiene más de 40 % de alginato según lo reportado por Davis et al. (2003). Esta alga ha arribado a la costa del Caribe Mexicano en cantidades masivas desde el 2014 y su acumulación y descomposición en las playas afecta los ecosistemas costeros y la industria turística (Rodríguez-Martínez et al., 2016). No obstante, el alginato extraído de S. fluitans mezclado con nanopartículas de plata (NpAg) obtenidas por síntesis verde formó películas con atractivas propiedades mecánicas, con baja permeabilidad al vapor de agua y actividad antifúngica contra el hongo C. gloesporioides, así como para un amplio rango de microorganismos (Martínez-Molina et al., 2022). Raut-Rajesh et al. (2009) mencionan que las nanopartículas obtenidas por síntesis verde, usando extractos acuosos de Gliricidia sepium presentan ventajas contra la síntesis química, al ser tecnologías más económicas y amigables con el ambiente. A pesar de ello, el alginato extraído de S. fluitans adicionado o no con NpAg obtenidas mediante síntesis verde aún no ha sido utilizado para el desarrollo de recubrimientos aplicados a frutas.
Por lo anterior el objetivo del presente estudio fue evaluar el efecto del recubrimiento a base de alginato extraído de S. fluitans adicionado con nanopartículas de plata (NpAg) sobre la vida en anaquel de papaya (Carica papaya L.) var. Maradol.
Materiales y métodos
Materiales
Sargassum fluitans (Børgesen) Børgesen fue recolectada en marzo de 2019 en la costa de Puerto Morelos, Quintana Roo, México. El alga fue secada al sol durante dos días, se trituró a un tamaño de partícula < 3 mm y se almacenó en bolsas herméticas hasta su uso. Las hojas de G. sepium fueron colectadas en el Instituto Tecnológico de Tuxtla Gutiérrez (México) en mayo 2021. Las hojas fueron secadas en sombra, trituradas (< 0.8 mm) y preservadas en oscuridad en congelación hasta su uso. Los reactivos usados fueron de la marca Sigma Aldrich (Saint Louis, MO, EU).
Extracción de alginato de Sargassum fluitans y síntesis de NpAg
El extracto de G. sepium fue obtenido utilizando 5 g de hoja seca en polvo los cuales se mezclaron con 100 mL de agua destilada. La mezcla se calentó a ebullición durante 5 min en agitación constante (100 rpm) según lo reportado por Rolim et al. (2019). El extracto se dejó enfriar, se filtró con papel filtro Whatman No. 2 y finalmente se almacenó en frasco ámbar en refrigeración hasta su uso para la síntesis de las nanopartículas.
El alginato fue extraído de Sargassum fluitans de acuerdo al método propuesto por Martínez-Molina et al. (2022). El alga fue digestada en Na2CO3 al 3 % y filtrada al vacío. Este filtrado fue decolorado agregando HO 3 % (1:1 2:2 p/v, g inicial de alga: mL H2O2) y mantenido en agitación a 100 rpm por 20 min. Posteriormente, el filtrado decolorado fue resuspendido en etanol (1:2 v/v) para la recuperación de las fibras de alginato insolubles en etanol, las cuales se dejaron secar en estufa (60 °C, 24 h). Las NpAg se prepararon mezclando el extracto acuoso de G. sepium (1:20 p/v) y solución metálica de AgNO3 (10 mM) en relación 1:4 (extracto acuoso de G. sepium (v): solución metálica de AgNO3 (v)). La mezcla se mantuvo en agitación a 100 rpm por 2 h a 60 °C en oscuridad. El cambio de color de amarillo claro a café oscuro de la solución fue un indicador de la síntesis de NpAg (Martínez-Molina et al., 2022).
Formulación de recubrimientos
Los recubrimientos fueron formulados con alginato de Sargassum fluitans y nanopartículas de plata de la siguiente manera: solución 1 conteniendo alginato al 2.49 % y la solución 2 conteniendo alginato al 2.49 % y 1.11 mg NpAg/ mL, en ambas soluciones se agregó glicerol como plastificante (0.33 g/g alginato). Estas concentraciones fueron elegidas de acuerdo a estudios previos (Martínez-Molina et al., 2022). Estas soluciones fueron mezcladas con un homogenizador Ultra-Turrax (Ika Ultra-Turrax® T25 Basic, Carolina del Norte, EU) a 13,000 rpm por 5 min según lo reportado por Robles-Flores et al. (2018). Para el grupo control se utilizó agua pura. La viscosidad cinemática y densidad de las soluciones 1 (alginato al 2.49 %) y 2 (2.49 % y 1.11 mg NpAg/mL) fueron determinadas con un viscosímetro (Cannon-Fenske) y densímetro a 40 °C.
Aplicación de recubrimiento a papaya fresca
Las papayas (Carica papaya L. var. Maradol), sin ningún tratamiento, fueron cosechadas en el rancho San Juan, ubicado en el municipio de Acala, Chiapas, México (16°30´22” latitud norte, 92°,45´42” latitud oeste), propiedad de la empresa AGROMOD S.A. de C.V. Las papayas seleccionadas fueron las que tuvieron un peso entre 1 y 1.5 kg, un grado de madurez 3 con dos rayas amarillas en el epicarpio, de acuerdo a la escala de Santamaría-Basulto (2009), sin daño mecánico visible, ni manchas en su superficie y sin infecciones fúngicas visibles. Las papayas fueron lavadas con agua purificada y clasificadas al azar en tres grupos (A, B y C) con 21 frutas cada uno. Una capa del recubrimiento fue aplicada a cada papaya mediante la técnica de pincelado. El grupo A fue recubierto con la solución 1 (7.5 mL de solución), el grupo B fue recubierto con la solución 2 (7.5 mL de solución) y el grupo C fue recubierto con 7.5 mL de agua potable (grupo control). Después de aplicar el recubrimiento, las papayas se dejaron secar durante 1 h a 25 °C y HR de 75 %. Las papayas una vez secas se envolvieron hasta la mitad con papel estraza y se colocaron en cajas de cartón con el pedúnculo hacia abajo durante 15 días a 25 ± 1 °C y humedad relativa de 70-75 %. En cada monitoreo, tres papayas fueron retiradas de cada grupo y los índices de maduración de la papaya se midieron a los 0, 2, 4, 6, 9, 12 y 15 días. Es importante mencionar que la aplicación de más de una capa de recubrimiento fue también evaluada preliminarmente, sin embargo, los frutos en donde el alginato con las nanopartículas fue aplicado presentaron una coloración oscura perdiendo complemente el color característico de la papaya (datos no mostrados), por lo que se aplicó una sola capa del recubrimiento. Además, en ese estudio preliminar, un volumen de 7.5 mL de solución formadora de recubrimiento fue adecuada para cubrir a cada papaya (datos no mostrados).
Índices de maduración de la papaya Pérdida de peso y cambios en el color
La pérdida de peso de las papayas fue calculada como el porcentaje de pérdida de peso del fruto en relación con su peso inicial (Barrera et al., 2015). Los cambios de color de la papaya se determinaron en epicarpio analizando tres puntos de referencia en el eje ecuatorial, y en mesocarpio, para lo cual se hizo un corte longitudinal al fruto y se midió el color en tres puntos (centro y extremos). Las mediciones se hicieron con un colorímetro portátil (Konica minolta modelo CM-2500d, Japón). Los resultados del color se reportaron como el cambio de color (∆DC*) calculado con la ecuación 1, usando los valores L*, a* y b* de la escala CIELab (Zhang et al., 2019).
Con:
Donde ∆L* representa el diferencial de luminosidad, L*t representa el valor de luminosidad cada día de muestreo, L*in, el valor de luminosidad al inicio del experimento; ∆a* es el diferencial del valor de a* (que va desde -a* en color verde hasta +a* en color rojo), a*t es el valor de a* cada día de muestreo, a*in representa el valor de a* al inicio del experimento; y ∆b* es el diferencial del valor de b* (que va desde -b* en color azul hasta +b* en color amarillo), b*t representa el valor de b* cada día de muestreo y b*in representa el valor de b* al inicio del experimento.
Determinación de carotenoides en mesocarpio
Los carotenoides totales se determinaron usando la metodología de Carvalho et al. (2012) con ligeras modificaciones. La pulpa (15 g) se trituró con 3 g de célite 454 adicionando 25 mL de acetona hasta obtener una pasta. La muestra se filtró al vacío y la extracción se llevó a cabo tres veces. El extracto fue transferido a un embudo de separación con 40 mL de hexano y se mantuvo en reposo durante 10 min para lograr la separación de las fases. El extracto hexánico se transfirió a un matraz con 15 g de sulfato de sodio anhidro, y finalmente, se determinó la absorbancia en espectrofotómetro (Beckman coulter modelo DU 730, EU) a 450 nm. El contenido de carotenos fue calculado con la ecuación 2.
Donde es Absorbancia media a 450 nm; 104 es la constante de conversión de unidades µg/g; V es el volumen final (mL); 2592 es el coeficiente de extinción molar de β-caroteno en hexano y P(g) es el peso de la muestra en gramos.
Determinación de la firmeza del mesocarpio
La firmeza del mesocarpio de la papaya se determinó en cinco puntos equidistantes en un eje ecuatorial. Para esta prueba se retiró manualmente parte del epicarpio (2 mm de profundidad) y se midió la firmeza en mesocarpio con un penetrómetro (Wagner FT 02, EU) con dos puntas de prueba: 2 y 8 mm de diámetro de cilindro con 3 cm de longitud (Hamzah et al., 2013). Los resultados fueron expresados como el promedio de las cinco medidas de cada uno de los tres frutos.
Sólidos solubles totales, acidez titulable y pH del mesocarpio de la papaya
El contenido de sólidos solubles totales (SST) se determinó con el método del AOAC 932 (AOAC, 2000), el pH con un potenciómetro y la acidez titulable (AT) con el método AOAC 942.15 (AOAC, 2000).
Determinación de ácido ascórbico
El contenido de ácido ascórbico fue determinado por el método de Zhang et al. (2019) con algunas modificaciones. La pulpa (10 g) se trituró en 40 mL de ácido oxálico (2 %; p/v) y se filtró al vacío. El filtrado se aforó a 100 mL con ácido oxálico (2 %) y 10 mL de esta solución fue valorada con 2,6-dicloro-fenol-indol (0.01 %; p/v). Los datos se expresaron como mg de ácido ascórbico por cada 100 g de pulpa.
Determinación de concentración de plata en la pulpa de papaya
La concentración de plata migrada al mesocarpio de la papaya fue determinada en los grupos A y B a los 15 días de almacenamiento usando espectroscopía de emisión atómica con plasma de acoplamiento inductivo (ICP-OES, Perkin Elmer, NexIon 300 D, Shelton, EU). Para lo cual, 150 mg de pulpa fueron digeridos con 5 mL de HNO3 concentrado y 2 mL de H2O2 en microondas (240 °C, 800 psi, 10 min). La muestra digerida fue aforada a 25 mL usando HNO3 1 %. Los resultados se expresaron como concentración de plata metálica (mg Ag/kg de pulpa).
Resultados y discusión
La viscosidad cinemática y densidad de las soluciones 1 (alginato al 2.49 %) y 2 (2.49 % y 1.11 mg NpAg/mL) a 40 °C fueron de 38.5 ± 1.2 y 37.3 ± 1.0 cSt, respectivamente; mientras que la densidad fue de 0.98 ± 0.002 g/mL para ambas soluciones. Estos valores muestran que el alginato promovió el incremento de la viscosidad de la solución con respecto al agua, sin embargo, la adición de nanopartículas no repercutió en dicho valor. Lo anterior es deseado para los fines de tener un recubrimiento que sea fácil de aplicar, que no escurra al momento de ser aplicado y que se adhiera al fruto.
Índices de maduración de papaya Pérdida de peso
La pérdida de peso es considerada como una de las características principales que determinan la vida útil del fruto, debido a que tienden a perder peso continuamente durante la postcosecha. Los resultados de la pérdida de peso de las papayas durante los 15 días de almacenamiento son presentados en la Tabla 1. En esta tabla se observa que la pérdida de peso de las papayas incrementa con el tiempo de almacenamiento, obteniendo un promedio de 13.68, 11.76 y 11.79 % de pérdida de peso en las papayas control, con recubrimiento de alginato (2.49 % alginato) y con recubrimiento de alginato y nanopartículas (2.49 % alginato y 1.11 mg NpAg/mL) respectivamente en los 15 días de almacenamiento, sin mostrar diferencia estadística significativa (p > 0.05) entre tratamientos en cada tiempo de monitoreo. La pérdida de peso de la fruta se debe principalmente al proceso de transpiración que está determinado por el gradiente de presión de vapor de agua entre la fruta y el aire circundante (Monzón-Ortega et al., 2018). Los resultados mostraron que el recubrimiento a base de alginato con o sin nanopartículas no constituyó una barrera a la pérdida de peso de la papaya durante el almacenamiento. Este comportamiento puede ser explicado debido a la naturaleza hidrofílica del alginato y a la elevada permeabilidad al vapor de agua de películas preformadas a base de alginato y NpAg según lo reportado por Martínez-Molina et al. (2022).
Tabla 1 Efecto de los recubrimientos A (2.49 % alginato), B (2.49 % y 1.11 mg NpAg/mL) y grupo control (agua) sobre la pérdida de peso, sólidos solubles totales (SST), acidez titulable, pH, ácido ascórbico de papayas almacenadas a 25 °C durante 15 días.
Table 1 Effect of A (2.49 % alginate), B (2.49 % and 1.11 mg NpAg/mL), and control (water) coatings and control group on weight loss, total soluble solids (SST), titratable acidity, pH and ascorbic acid content of papaya stored at 25 °C for 15 days.
| Parámetro | Tratamiento | Tiempo de almacenamiento (días) | ||||||
| 0 | 2 | 4 | 6 | 9 | 12 | 15 | ||
| Pérdida de peso (%) | Control | 0 a* | 1.63a | 3.0a | 4.69a | 7.37a | 10.17a | 13.68a |
| A | 0 a | 2.09a | 3.38a | 5.25a | 7.07a | 8.72a | 11.76a | |
| B | 0 a | 1.58a | 2.97a | 4.46a | 6.98a | 9.44a | 11.79a | |
| SST (°Brix) | Control | 7.6a | 8.26a | 8.4a | 8.8a | 10.8a | 11.6a | 13.8a |
| A | 7.6a | 7.6a | 8.73a | 8.91a | 9.13b | 10.33ab | 11.1b | |
| B | 7.6a | 8.43a | 8.46a | 8.5a | 8.33c | 9.06c | 11.06b | |
| Acidez titulable (%) | Control | 0.158a | 0.133a | 0.112a | 0.104a | 0.105a | 0.080a | 0.063b |
| A | 0.158a | 0.131a | 0.104a | 0.102a | 0.088b | 0.082a | 0.087a | |
| B | 0.158a | 0.128a | 0.121a | 0.095a | 0.090b | 0.085a | 0.093a | |
| pH | Control | 5.5a | 5.7a | 5.6a | 6.7a | 6.5a | 6.4a | 6.5a |
| A | 5.8a | 5.6a | 5.7a | 6.5a | 6.2a | 6.3a | 6.3a | |
| B | 5.7a | 5.7a | 5.6a | 6.5a | 6.5a | 6.36a | 6.56a | |
| Ácido Ascórbico (mg AA/g pulpa) | Control | 36.97a | 32.41a | 29.57a | 26.57a | 23.87b | 20.17b | 15.47b |
| A | 36.97a | 35.83a | 29.85a | 27.72a | 26.86a | 24.58a | 22.31a | |
| B | 36.97a | 33.69a | 28.85a | 27.86a | 24.16b | 23.45a | 23.02a | |
*Letras diferentes en la misma columna para cada parámetro significa diferencia estadística significativa (p < 0.05) entre tratamientos en cada día de monitoreo según la prueba de Tukey.
Color y contenido de carotenoides
El color es el principal determinante visual de la maduración de la papaya. En la Figura 1 se muestra el efecto de los recubrimientos sobre la variación de color (∆DC*) del epicarpio. Las papayas del tratamiento control presentan mayor diferencial de color a partir del día 2 de monitoreo, en comparación con las papayas con recubrimiento (p < 0.05). Así también, se observa un mayor incremento del ∆DC* de las papayas control a partir del día 4, a diferencia de las papayas de los tratamientos A y B, los cuales presentan incrementos menores. Lo anterior indica que el recubrimiento provoca cambios de color menores del fruto durante el almacenamiento, lo que podría relacionarse con una maduración prolongada. Resultados similares fueron reportados por Zhang et al. (2019) en papayas recubiertas con quitosano. Por su parte, Shen et al. (2019) reportaron, en las primeras etapas de maduración, que el epicarpio presenta un alto contenido de clorofila, lo que le otorga la coloración verde al fruto. Sin embargo, el contenido de clorofila disminuye drásticamente durante la maduración degradándose por acción de la clorofilasa, sintetizándose gradualmente licopeno y β-caroteno dando lugar la formación del color amarillo-anaranjado. A su vez, el mesocarpio en papaya ha sido reportado por su alto contenido de carotenoides en su madurez comercial, a esto se debe la conocida coloración naranja en estos frutos.
Figura 1 >Efecto de los recubrimientos de A (2.49 % alginato), B (2.49 % y 1.11 mg NpAg/mL) y grupo control sobre ∆DC en epicarpio de papayas almacenadas a 25 °C durante 15 días. *Barras verticales muestran la desviación estándar de los promedios. Letras diferentes en cada tiempo indicaron que hay diferencia estadística significativa (p < 0.05) entre tratamientos según la prueba de Tukey.
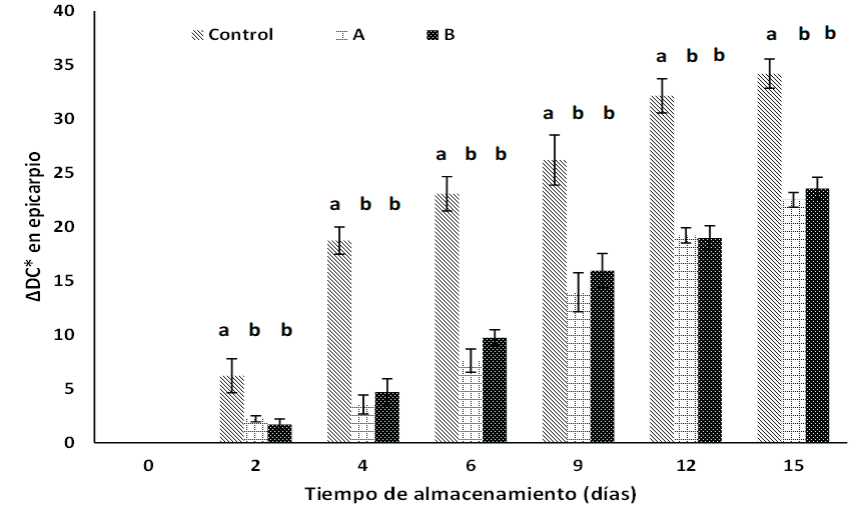
Figure 1 Effect of A (2.49 % alginate), B (2.49 % and 1.11 mg NpAg/mL), and control group coatings on ∆DC in papaya epicarp stored at 25 °C for 15 days. *Vertical bars show the standard deviation of the means. Different letters each time indicated a statistically significant difference (p < 0.05) between treatments according to Tukey´s test.
En la Figura 2 se presentan los resultados de diferencial de color (∆DC*) del mesocarpio de las papayas durante el almacenamiento. Las papayas sometidas a los tratamientos A y B presentan menor diferencial de color en comparación con los frutos control a partir del día 2 (p < 0.05). De acuerdo a Barreto et al. (2011), si la concentración de etileno disminuye en la atmósfera circundante del fruto, podría afectar la actividad de las enzimas fitoeno sintasa (PSY) y fitoeno desaturasa (PDS), dando como resultado una disminución en la síntesis de carotenoides, como ocurrió en los frutos recubiertos. Lo anterior puede observarse en la Figura 3, en donde el contenido de carotenoides totales en los frutos aumentó durante la maduración, pero en los frutos recubiertos, el contenido de carotenoides fue estadísticamente inferior a los frutos control. Fabi y do Prado (2019) reportaron que la disminución de carotenoides, tanto en epicarpio como en mesocarpio, puede ocurrir por la inhibición de la PSY y de la PDS, enzimas involucradas en la síntesis de carotenoides y activadas por el etileno. Lo anterior es un indicativo de la disminución de la velocidad de maduración de los frutos recubiertos.
Figura 2 Efecto de los recubrimientos de A (2.49 % alginato), B (2.49% y 1.11 mg NpAg/mL) y grupo control sobre el ∆DC del mesocarpio de papayas almacenadas a 25 °C durante 15 días. *Barras verticales muestran la desviación estándar de los promedios. Letras diferentes en cada tiempo indicaron que hay diferencia estadística significativa (p < 0.05) entre tratamientos según la prueba de Tukey.
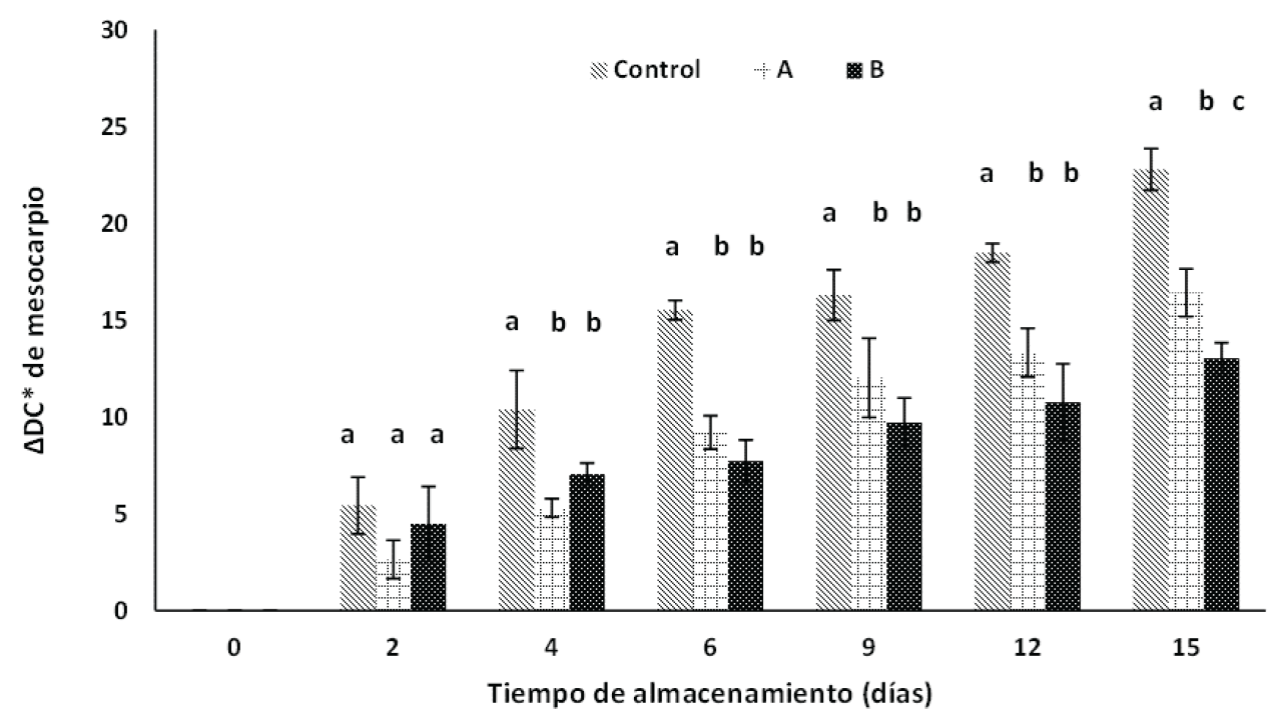
Figure 2 Effect of A (2.49 % alginate), B (2.49 % and 1.11 mg NpAg/mL) and control group coatings on the ∆DC of papaya mesocarp stored at 25 °C for 15 days. *Vertical bars show the standard deviation of the means. Different letters in each time indicated a statistically significant difference (p < 0.05) between treatments ccording to Tukey´s test.
Figura 3 Efecto de los recubrimientos A (2.49 % alginato), B (2.49 % y 1.11 mg NpAg/mL) y grupo control sobre el contenido de carotenoides totales (µg/g) de papayas almacenadas a 25 °C durante 15 días. *Barras verticales muestran la desviación estándar de los promedios. Letras diferentes en cada tiempo indicaron que hay diferencia estadística significativa (p < 0.05) entre tratamientos según la prueba de Tukey.

Figure 3 Effect of A (2.49 % alginate), B (2.49 % and 1.11 mg NpAg/mL) and control group coatings on the content of total carotenoids (µg/g) of papayas stored at 25 °C for 15 days. *Vertical bars show the standard deviation of the means. Different letters in each time indicated statistically significant difference (p < 0.05) between treatments ccording to Tukey´s test.
Firmeza en mesocarpio
La firmeza del fruto es otro de los principales indicadores de calidad que influye en la elección del fruto. Uno de los principales cambios drásticos en la maduración del fruto es el ablandamiento acelerado de la pulpa durante el almacenamiento. Las papayas inicialmente presentaron una firmeza promedio de 16 MPa (Figura 4), la cual se mantuvo constante durante los primeros 6 días de almacenamiento independientemente del tratamiento. Sin embargo, al día 9 la firmeza de las papayas control disminuyó hasta alcanzar un valor de 5.6 MPa, valores estadísticamente inferiores (p < 0.05) a la de los frutos con recubrimientos los cuales presentaron una firmeza de 8.5 MPa y 9.4 MPa para el tratamiento A y B, respectivamente. Zhang et al. (2019) obtuvieron resultados de firmeza superiores a los nuestros al día 14 de monitoreo (12 - 15 MPa) en recubrimientos a base de quitosano y pululano aplicados a papaya, sin embargo, las papayas no alcanzaron los valores de firmeza en madurez de consumo propuesta por Santamaría-Basulto et al. (2009). Estos mismos autores reportaron que las papayas en estado de madurez comercial tienen una firmeza que oscila entre 7 - 4 MPa, sin embargo, aquellas papayas que presentan una firmeza inferior a 4 MPa ya se encuentran en un estado de senescencia. Lo anterior sugiere que las papayas control en el presente estudio entraron en estado de senescencia después del día 9 de almacenamiento, mientras que las papayas recubiertas (tratamiento A y B) se encontraron en su madurez de consumo hasta el día 15 de almacenamiento. El recubrimiento entonces disminuyó probablemente la producción de etileno en las papayas, influyendo así en la firmeza del fruto. El ablandamiento de la pulpa del fruto es causado principalmente por la degradación de la pared vegetal, la cual está compuesta por una matriz de microfibrillas de celulosa unidas entre sí, por hemicelulosas y pectina (Carpita y Giberaut, 1993). Esta degradación se da por acción de las pectinasas: poligalacturonasas, pectato liasas, pectina metil esterasa, así como de hemicelulasa y celulasa (Fabi y do Prado, 2019). La actividad de estas enzimas está asociada a un incremento de etileno durante la maduración (Fabi y do Prado, 2019), lo que sugiere la disminución del etileno en las papayas recubiertas.
Figura 4 Efecto de los recubrimientos A (2.49 % alginato), B (2.49 % y 1.11 mg NpAg/mL) y grupo control sobre la firmeza de papayas almacenadas a 25 °C durante 15 días. *Barras verticales muestran la desviación estándar de los promedios. Letras diferentes en cada tiempo indicaron que hay diferencia estadística significativa (p < 0.05) entre tratamientos según la prueba de Tukey
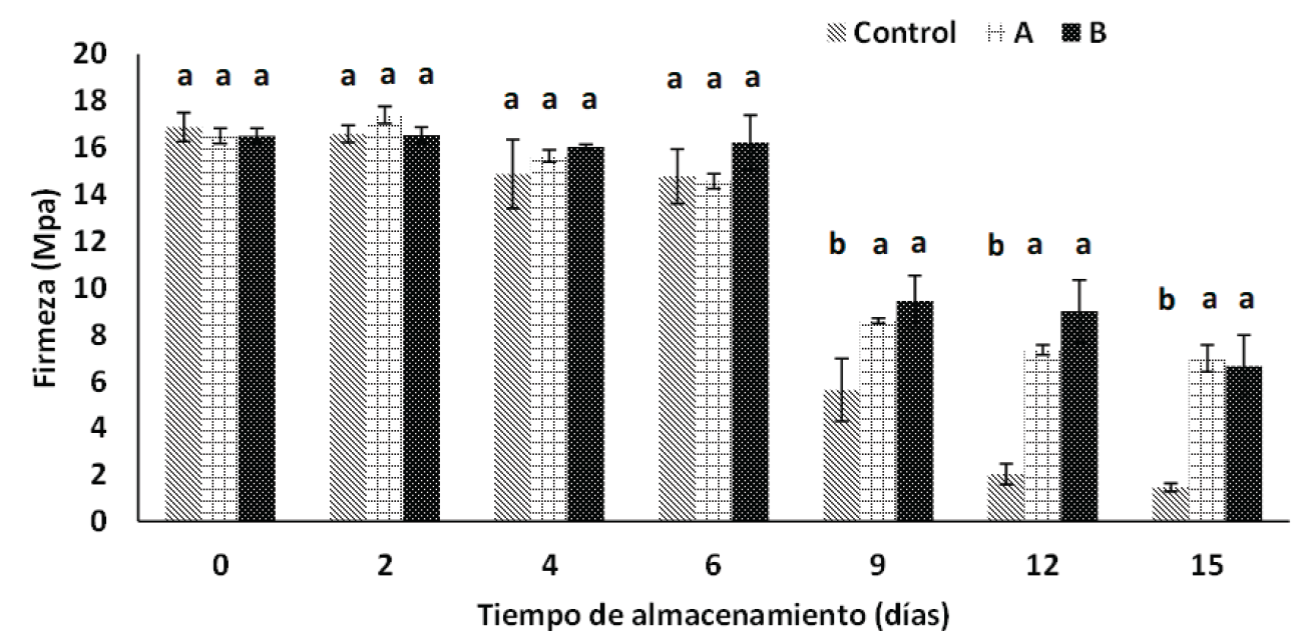
Figure 4 Effect of A (2.49 % alginate), B (2.49 % and 1.11 mg NpAg/mL) and control group coatings on the firmness of papayas stored at 25 °C for 15 days. *Vertical bars show the standard deviation of the means. Different letters in each time indicated statistically significant difference (p < 0.05) between treatments according to Tukey´s test.
Sólidos solubles totales en mesocarpio
La composición primaria de azúcares solubles es crucial e impacta fuertemente en el dulzor de la papaya. En la Tabla 1 se presentan los resultados de SST reportados en °Brix en donde se observa que el contenido de SST de las papayas incrementó con el tiempo de almacenamiento. Lo anterior es debido a que los polisacáridos de la papaya en estado de madurez inicial 3 son hidrolizados a azúcares más simples incrementando los SST durante la maduración. Sin embargo, el contenido de SST en las papayas recubiertas (A y B) fue estadísticamente menor que en las papayas de los tratamientos control (p < 0.05) a partir del día 9 de almacenamiento. Esto indica que el recubrimiento probablemente disminuyó la actividad de enzimas involucradas en la hidrólisis de polisacáridos en el fruto. Zhou y Paull (2001) reportaron que en el metabolismo de los azúcares solubles en papaya influyen diversos factores, principalmente intervienen tres enzimas: la sacarosa fosfato sintasa, la sacarosa sintasa y la ácido invertasa. Estas enzimas además están asociadas a un aumento en la síntesis de etileno durante la maduración (Gómez et al., 1999). A su vez, Yang (1986) mencionó que en la etapa final de la ruta biosintética del etileno interviene la enzima ácido 1-aminociclopropano-1-carboxílico (ACC oxidasa), la cual utiliza oxígeno para completar la reacción, resultando en etileno (C2H4), cianuro de hidrógeno (HCN) y bióxido de carbono (CO2) como productos de la reacción. Por lo que es probable que el recubrimiento a base de alginato, debido a su estructura altamente polar (dada por los grupos carboxilos e hidroxilos), formaron una barrera semipermeable al oxígeno, interfiriendo en este paso final de la síntesis de etileno, disminuyendo así la expresión de enzimas dependientes de la acumulación de etileno en el fruto.
Acidez y pH en mesocarpio
El contenido de ácidos orgánicos en los frutos tiende a disminuir durante el proceso de maduración debido a la oxidación del ácido cítrico en el ciclo de los ácidos tricarboxílicos, es por ello, que la disminución de la acidez en los frutos suele ser un indicador de madurez (Zhang et al., 2019). Sin embargo, los frutos de papaya no se caracterizan por mostrar altos contenidos de acidez en el fruto (Monzón-Ortega et al., 2018), llegando a obtener una acidez titulable inferior al 0.16 % Como se puede observar en la Tabla 1, en todos los tratamientos la acidez de las papayas osciló entre 0.063 y 0.158 % durante el almacenamiento.
El pH de la papaya incrementó con el tiempo de almacenamiento (Tabla 1), lo cual está relacionado con la acidez titulable. Zhang et al. (2019) reportaron que el pH de la papaya en madurez comercial debe ser cercano al neutro, tal como los resultados obtenidos en el presente estudio, cuyos valores oscilaron entre 6.3 y 6.7 a partir del día 6 de almacenamiento (Tabla 1), sin mostrar diferencia estadística significativa entre tratamientos (p > 0.05).
Contenido de ácido ascórbico en mesocarpio
El contenido de ácido ascórbico (AA) de las papayas disminuyó durante el almacenamiento (Tabla 1). Sin embargo, el contenido de ácido ascórbico fue mayor en las papayas recubiertas, presentando un contenido de ácido ascórbico de 15.47, 22.31 y 23.02 mg AA/g pulpa en el tratamiento control, A y B respectivamente, a los 15 d de almacenamiento. El contenido de ácido ascórbico en fruto está asociado con una función protectora, neutralizando las especies reactivas al oxígeno que son generadas durante la maduración (Özkan y Cemeroǧlu, 2004). Resende et al. (2012) reportaron que especies reactivas al oxigeno como el anión superóxido y peróxidos aumentan en el fruto durante la senescencia lo que se relaciona con una disminución de ácido ascórbico en las papayas control durante los últimos días de monitoreo. Por lo anterior, los recubrimientos retrasaron la senescencia en los frutos recubiertos y con ello lograron mantener mayor concentración de ácido ascórbico. Aunado a lo anterior, Pandey y Singh (1999) reportaron que la disminución de ácido ascórbico durante la maduración se atribuye a la oxidación del ácido ascórbico por el enzima ácido ascórbico oxidasa, por lo que una disminución de la transferencia de oxígeno provocado por los recubrimientos mantuvo mayor contenido de ácido ascórbico.
Concentración de plata en la pulpa de papaya
Los resultados mostraron que la plata migró del recubrimiento con alginato y nanopartículas de plata hacia el mesocarpio del fruto con un valor promedio de 0.373 ± 0.13 mg Ag/kg pulpa. Estos resultados son semejantes a los reportados por Pezzuto et al. (2015) quienes reportaron la migración de plata (0.103 mg/kg) de películas preformadas sintéticas a queso durante 24 d de almacenamiento. Diversos autores han reportado la toxicidad de la plata en forma de sal de plata y de nanopartículas de plata, sin embargo, en materia de regulación mundial aún hay controversia. Por ejemplo, la Autoridad Europea de Seguridad Alimentaria (EFSA, 2016) realizó una re-evaluación de la seguridad sobre el uso de la plata (colorante E 174) como aditivo alimentario. Estas autoridades reportaron que la información disponible era insuficiente para evaluar la inocuidad de E 174 como aditivo alimentario. Sin embargo, estos concluyeron que no existe ningún problema de seguridad para el consumidor si la migración del ion plata no supera el límite de migración específica de 0.05 mg Ag/kg de alimento. Por lo anterior, el valor reportado en este trabajo es elevado por lo que es necesario disminuir la concentración de plata en el recubrimiento para evitar la migración de plata en niveles que superen estas recomendaciones. Es importante remarcar que, aunque el uso del recubrimiento adicionado con nanopartículas es controversial, los resultados en este trabajo mostraron que el uso de alginato extraído de Sargassum fluitans (sin la adición de nanopartículas de plata) como recubrimiento fue suficiente para prolongar la vida útil de la papaya a temperatura de 25 °C.
Conclusiones
Los recubrimientos de alginato de sodio extraído de Sargassum fluitans adicionado o no con NpAg, retardaron al menos 6 días la maduración de la papaya almacenada a 25 °C y 75 % HR, manteniendo valores óptimos de firmeza, color, SST y ácido ascórbico durante 15 días de almacenamiento con respecto a las papayas control. Las papayas recubiertas con alginato y nanopartículas de plata presentaron concentraciones de plata superiores a la normatividad europea, por lo que se debe disminuir la concentración de plata en el recubrimiento. Sin embargo, los resultados demostraron que la aplicación de un recubrimiento a base únicamente de alginato prolongó la vida en anaquel de la papaya a temperaturas inferiores a 25 °C, por lo que estos resultados tienen una aplicación industrial.











 nueva página del texto (beta)
nueva página del texto (beta)


