Introducción
El propóleo es una resina elaborada por las abejas (Apis mellifera) a partir de exudados de la vegetación circundante de la colmena, el cual es utilizado con fines desinfectantes y de eliminación de invasores que pueden estar dentro de la misma (Bankova, 2005). Gracias a la protección que genera el propóleo en las colmenas, se mantienen condiciones óptimas de humedad, temperatura y otros factores que garantizan la asepsia, de esta manera se evita la proliferación de microorganismos como bacterias, hongos o virus (Palomino et al., 2010). En los últimos años se han documentado las propiedades beneficiosas del propóleo destacándose la gran actividad antimicrobiana, antiviral, anestésica, antiinflamatoria, anticancerígena y antioxidante (Rivero y Martínez, 2015). En ese sentido los extractos elaborados a base de propóleo se han venido utilizado en el área alimenticia o farmacológica.
Los extractos de propóleo (acuosos, etanólicos o supercríticos) contienen sustancias activas como flavonoides y polifenoles, a dichos compuestos se les ha atribuido actividad farmacológica (Silva et al., 2012). Además, se han demostrado en numerosas investigaciones la complejidad de su composición química, reportándose más de 300 compuestos tales como terpenoides, esteroides, aminoácidos o polifenoles (flavonoides, ácidos fenólicos y sus ésteres) (Mello y Hubinger, 2012). Los flavonoides son ácidos aromáticos diterpenoides y junto con los compuestos fenólicos forman los principales constituyentes químicos responsables de las propiedades biológicas del propóleo (Siripatrawan et al., 2013). Estudios previos en propóleos mexicanos han reportado la presencia de compuestos activos tales como flavonoides, principalmente pinocembrina, pinobanksina y crisina (Hernández et al., 2007), también se han detectado propiedades antibacterianas contra Escherichia coli y Salmonella typhymurium, y Staphylococcus aureus, atribuyéndose esta propiedad biológica a las flavonas presentes en el extracto (Londono et al., 2010; Carrillo et al., 2011). En el estado de Sonora, se han realizado estudios similares, los resultados muestran la identificación y cuantificación de compuestos activos, además de las diversas actividades biológicas de los propóleos, como la actividad antiproliferativa en extractos metanólicos (Li et al., 2010).También se ha observado que las estaciones del año influyen en la actividad biológica de los mismos (Valencia et al., 2012) y que la composición depende de la región donde se recoleta puesto que sus características están relacionadas por factores botánicos, geográficos y por el clima (Mello y Hubinger, 2012). Debido a esto existe una relación estrecha de la composición química del propóleo con la flora disponible para que las abejas produzcan el propóleo (Aguilar et al., 2019).
Los conocimientos que se tienen actualmente sobre la composición del propóleo y sus propiedades biológicas en México son limitados. En la literatura consultada, no se encuentra reporte alguno sobre otras actividades biológicas de propóleos con actividad y antiinflamatoria utilizando células sanguíneas o algún estudio antioxidante donde se evalúe la capacidad protectora del eritrocito humano de propóleos en el sur de Sonora. En ese contexto el objetivo de esta investigación fue evaluar la actividad antioxidante, antiinflamatoria y antibacteriana presente en los extractos etanólicos de propóleos obtenidos del sur de Sonora.
Materiales y métodos
Área de recolección de los propóleos
Las muestras de propóleo de abejas (Appis mellifera) fueron obtenidas en bruto de apiarios y se muestreó de acuerdo con SAGARPA, (2017). La ubicación de los apiarios se muestra en la Tabla 1 y el periodo de recolección fue de octubre de 2019 a enero de 2020. Las muestras se almacenaron en bolsas herméticas y se trasladaron al Laboratorio de Tecnologías Emergentes e Inocuidad Alimentaria del Centro de Investigación e Innovación Biotecnológica, Agropecuaria y Ambiental (CIIBAA) en el Instituto Tecnológico de Sonora (ITSON) unidad centro de Cd. Obregón Sonora, en donde se fraccionaron en trozos de 2 cm aproximadamente y se colocaron en refrigeración a - 20 °C para su posterior análisis. Las claves con las que se identificaron las muestras obtenidas de los diversos apiarios del sur de Sonora México, así como su origen se muestra en la Tabla 1, así mismo, en la Figura 1 se observa en dónde se localizan dichas poblaciones.
Table 1. Location of the apiaries where Sonoran propolis was obtained.
| POBLACIÓN | COORDENADAS | CLAVE |
|---|---|---|
| Ejido Francisco Javier Mina (Campo 60) | (27°27’43’’N) (110°6’53’’W) | EP60 |
| Bácum | (27°30’40’’N) (110°6’32’’W) | EPB |
| Tinajera | (27°33’16’’N) (110°00’47’’W) | EPLT |
| Jusibampo | (27°19’N) (111°16’W) | EPJ |
| Etchojoa | (27°0’12’N) (109°35’0.2’’W) | EPE |
| Ejido Francisco Villa | (27°29’0.9’’N) (110°03’24’’W) | EPFV |
Preparación del extracto etanólico de propóleo
La preparación del extracto etanólico se realizó según la NOM-003 (2017). Se pesaron 50 g de los propóleos en bruto previamente triturado con una licuadora convencional hasta obtener un polvo. Posteriormente, se añadió el pulverizado obtenido a etanol al 70% en una relación muestra: disolvente 1:3 y se colocó en baño ultrasónico durante 20 min a temperatura ambiente. Seguido de esto se filtró al vacío con papel Whatman No. 1. Por último, se concentró el extracto mediante evaporación rotativa a 45 °C (Buchi Heating Bath B-490, Buchi Rotavapor R-200) (Sultana et al., 2009). El extracto fue almacenado a - 20 °C en ausencia de luz para su posterior análisis.
Determinación de fenoles totales
El contenido de fenoles totales se cuantificó mediante el método descrito por Singleton y Rossi (1965) con algunas modificaciones. Se colocaron 150 µL del reactivo Folin-Ciocalteau en una microplaca de 96 pocillos con 30 µL de extracto y 120 µL de Na2CO3. Se dejó reposar 30 min en completa oscuridad y se leyó a una absorbancia de 750 nm en lector de microplacas (Thermo Scientific MultiskanTM Sky). La concentración de fenoles totales se calculó utilizando una curva estándar de ácido gálico y los resultados se expresaron como mg equivalentes de ácido gálico por gramo de peso seco (mg EAG/PS).
Determinación de flavonoides totales
La determinación de flavonoides totales se realizó de acuerdo con el método descrito por Chen et al. (2014) con algunas modificaciones. Primero se tomó 100 µL del extracto y se mezcló con 430 µL de NaNO2 al 5 %, seguido de una incubación por 5 min. Pasado el tiempo se adicionaron 30 µL de AlCl3 al 10 % y 440 µL de NaOH (1 M). Se leyó la absorbancia a 490 nm en un lector de microplaca (Thermo Scientific MultiskanTM Sky). Se realizó una curva estándar de quercetina y los resultados se expresaron como mg EQ/PS.
Determinación de la actividad antioxidante de los propóleos
Inhibición del radical DPPH (2,2 - difenil-1-picrilhidracil)
Se midió la capacidad antioxidante de los extractos para inhibir el radical DPPH según Moein y Moein (2010), con algunas modificaciones. Se tomaron 280 µL de la solución del radical DPPH (0.025 mg/mL en etanol) y se mezcló con 20 µL del extracto. La reacción se dejó reposar por 30 min en completa oscuridad y se leyó la absorbancia a 490 nm en un lector de microplacas (Thermo Scientific MultiskanTM Sky). La actividad antioxidante se calculó usando una curva de calibración de Trolox y los resultados se expresaron como µmol Equivalente Trolox/g de peso seco (µmol ET/PS).
Inhibición del radical ABTS (2,2’ - azinobis (3- etilbenzo-tiazolina-6-sulfonato)
Se determinó de acuerdo con la técnica descrita por Re et al. (1999) con algunas modificaciones. El radical ABTS se preparó al mezclar 19 mg en 5 mL de agua destilada. Por otro lado, se preparó una solución de persulfato de potasio (37.8 mg/mL en agua destilada). Se tomaron 88 µL del radical ABTS preparado y se le añadió a la solución de persulfato de potasio, dicha mezcla se dejó reposar por 12 - 16 h a temperatura ambiente. De esta solución incubada se tomó 500 uL y se diluyó en 30 mL de etanol para posteriormente ajustar la absorbancia a 0.7 ± 0.02 en lector de microplacas a 750 nm. Finalmente se colocaron 295 µL de radical y 5 uL del extracto. La actividad antioxidante se calculó usando una curva de calibración de Trolox y los resultados se expresaron como µmol eq. Trolox/g de peso seco (µmol ET/PS).
Capacidad protectora del eritrocito humano
La hemolisis fue inducida por el radical AAPH (2-2´- Azobis (2-methylpropionamidine) dihydrochloride) de acuerdo con la metodología de Son (2016). Los eritrocitos fueron lavados en 3 tiempos con buffer salino (PBS) a pH de 7.4. Una vez lavados se preparó una suspensión de eritrocitos humanos al 5 % en PBS. Para el ensayo se colocaron en un tubo Eppendorf 50 µL de la suspensión de eritrocitos, 50 µL del extracto a evaluar y 200 µL del radical AAPH, se mezcló e incubó a 37 °C en baño María con agitación (30 rpm) durante 3 h. Una mezcla de reacción similar se preparó sin extracto como control (hemólisis completa). Terminada la incubación se agregó 1 mL de PBS, se centrifugó a 3500 rpm por 10 min y se midió la absorbancia en un lector de microplacas (Thermo Scientific MultiskanTM Sky) a 540 nm. El resultado se expresó en porcentaje de inhibición, mediante la fórmula:
Actividad antiinflamatoria
Estabilidad de la membrana del eritrocito por calor
El ensayo de la estabilidad de la membrana del eritrocito frente al calor se realizó según Sakat et al. (2010) con algunas modificaciones. Se realizaron dos lavados de eritrocitos colocando 1 mL de sangre y 3 mL de solución salina, se centrifugó a 3000 rpm durante 10 min, se eliminó el sobrenadante. Enseguida con los eritrocitos lavados se preparó una solución de eritrocitos, se tomaron 500 µL de la solución en 5 mL de solución salina para obtener una solución de eritrocitos al 5 %. Para el ensayo, en microtubos se colocaron 100 µL de eritrocitos y 100 µL de extracto, se calentó en baño María a 56 °C por 30 min, se dejó enfriar a temperatura ambiente y se agregó 1 mL de solución salina, se centrifugaron a 2500 rpm por 10 min y se leyó a una absorbancia de 560 nm en un lector de microplacas (Thermo Scientific MultiskanTM Sky).
Estabilidad de la membrana del eritrocito mediante la prueba de hipotonicidad
Para la estabilidad de la membrana del eritrocito mediante un medio hipotónico se realizará según Niraimathi et al. (2011) con algunas modificaciones. Se preparó de igual manera que el ensayo de calor una solución de eritrocitos al 5%. El ensayo se realizó de la siguiente manera: Se colocó 200 µL de extracto en 100 µL de la suspensión de eritrocitos y se adicionó 500 µL de solución hipotónica (agua destilada). Se incubó a 37 °C durante 30 min y se colocó 200 µL de solución salina. Posteriormente, se centrifugó a 1500 rpm por 10 min y se tomó el sobrenadante para leer a una absorbancia de 560 nm en un lector de microplacas (Thermo Scientific MultiskanTM Sky).
Evaluación de la capacidad antibacteriana Cepas bacterianas y condiciones de crecimiento
Los microorganismos se obtuvieron del Laboratorio de Tecnologías Emergentes e Inocuidad Alimentaria del Centro de Investigación e Innovación en Biotecnología, Agropecuaria y Ambiental (CIIBAA) de ITSON. Escherichia coli O157: H7 (ATCC 43890), Escherichia coli O157, Staphylococcus aureus (ATCC 65384), Salmonella typhimurium (ATCC 14028).
Ensayos microbiológicos
La actividad antimicrobiana se evaluó mediante la observación de zonas de inhibición de crecimiento bacteriano descrito por Andrews (2001). En placas de agar Müeller Hinton se inocularon con 100 µL de suspensión bacteriana la cual se homogenizó mediante perlas de vidrio estériles, se colocó 40 µL de extracto correspondiente en discos estériles de papel filtro (5 mm de diámetro, Whatman Nº 1). Las placas fueron incubadas a 37 °C por 24 h para su observación.
Concentración mínima inhibitoria
La concentración mínima inhibitoria (CMI) de los extractos que presenten actividad antibacteriana se determinó mediante la técnica de dilución en caldo MuelleHinton. A cada tubo se le agregó 2 mg del extracto a evaluar en 1 mL de caldo Mueller-Hinton. Por último, se agregó 100 µL de inóculo en una concentración 108 UFC/mL, se incubó a 37 °C por 24 h. Se determinó la turbidez de cada tubo, siendo el de menor concentración y sin turbidez el que contiene la CMI (Gil et al., 2008).
Análisis Estadístico
La evaluación de la actividad antioxidante y antimicrobiana de los extractos se realizó a través de experimentos independientes para cada tipo de extracto y de las especies microbianas estudiadas. El diseño estadístico fue asignado completamente al azar con tres repeticiones. En el análisis de los distintos tratamientos se asumió (P < 0.05). Se utilizó el paquete estadístico Stat Graphics versión 15.
Resultados y discusiones
Fenoles totales
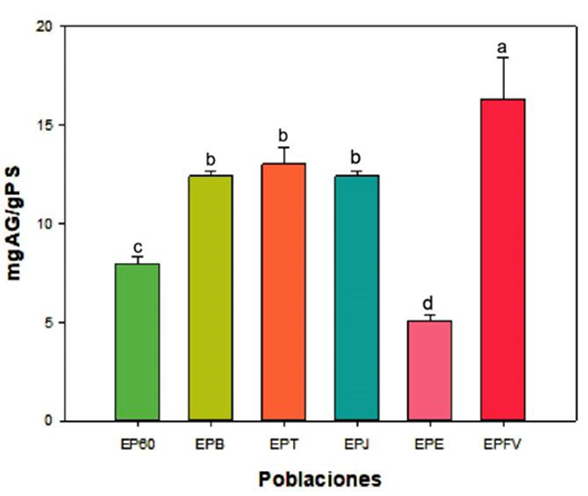
Evaluar el contenido de fenoles y flavonoides totales en los propóleos es uno de los parámetros más importantes ya que de esta manera ayuda a establecer la calidad del material, así como su potencial biológico principalmente para la actividad antioxidante que puede representar (Rodríguez et al., 2012). En la Figura 1 se muestran los resultados obtenidos de las diferentes muestras analizadas, donde se obtuvieron valores que van de 5.06 ± 0.289 a 16.30 ± 1.93 mgEAG/g PS. Se puede observar que en el extracto de propóleo del Ejido Francisco Villa presentó el valor más alto (p < 0.05), seguido del extracto de EPT, EPB y EPJ, los cuales no presentaron diferencia significativa (p < 0.05). La menor cantidad de fenoles totales se observó en el extracto EPE el cual tuvo una diferencia significativa por debajo de las muestras mencionadas anteriormente. Esta variación puede deberse a la vegetación que rodea los apiarios situados en los diferentes sitios muestreados, ya que se ha demostrado la influencia que tiene la región donde las abejas toman el propóleo sobre los compuestos biológicos (Banskota et al., 2001). Sulaeman et al. (2019), utilizaron el mismo proceso de extracción que en este estudio (etanol 75 %) y obtuvieron valores semejantes reportando concentraciones de 10 mg EAG/gPs en los propóleos de Indonesia.
Por otro lado, otros estudios han reportado valores superiores a los encontrados en nuestra investigación, inclusive los propóleos evaluados en México. Esta diferencia posiblemente se deba a los solventes utilizados y métodos de extracción (Bucio y Martínez, 2017; Valencia et al., 2012); así como, a los diversos ecosistemas del país, los cuales son influyentes en la calidad del propoleo. Las muestras evaluadas en nuestro estudio provienen del sur de Sonora, el cual se compone de zonas áridas y semiáridas contrario a las zonas boscosas y selváticas del sur del país quienes han reportado valores superiores (Delgado et al., 2015; Socha et al., 2015; Sulaeman et al., 2019). Estudios previos de propóleos en Sonora han reportado la presencia de polifenoles en concentraciones de 427.9 a 601.8 mg equivalente de pinocembrina-galangina/g extracto, en dicho estudio también han demostrado variaciones en el contenido fenólico en el mismo estado de Sonora México, y que ese contenido también varía en las diferentes estaciones del año (Valencia et al., 2012).
Flavonoides totales
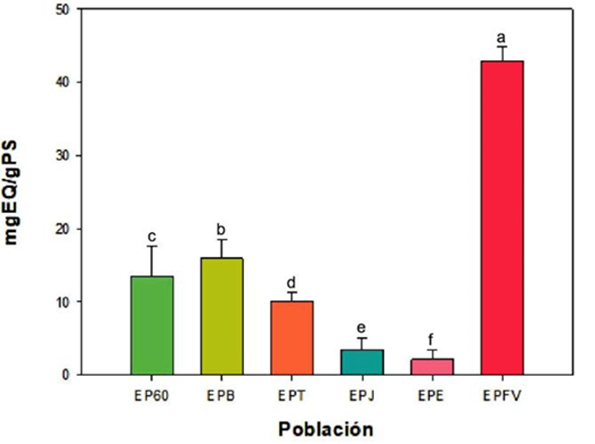
La cuantificación de flavonoides en los extractos etanólicos de propóleos, así como de los polifenoles totales, son considerados como un parámetro de calidad según la NOM-003 (SAGARPA, 2017). Se ha documentado que la concentración de los polifenoles depende del origen de la muestra y la actividad biológica se confiere a los flavonoides, por lo que hay una relación flavonoide-efecto biológico, clasificándose para el propóleo como producto bioactivo (Rivero y Martínez, 2015). En la presente investigación se demostró la presencia de flavonoides totales. La Figura 2 muestra el contenido de flavonoides totales presentes en las diversas muestras evaluadas de propóleo y se puede observar que el extracto EPFV presentó la mayor concentración de estas biomoléculas con un valor de 42.96 ± 1.74 mg EQ/g PS (p < 0.05). Por el contrario, el extracto EPE mostró la menor cantidad de flavonoides totales (2.11 ± 1.13 mg EQ/g PS). Lo anterior demuestra alta variabilidad de resultados dependiente del origen de recolección. Estos resultados se pueden comparar con los obtenidos en los extractos de propóleo de Indonesia y Polonia con valores (0.76 - 3.39 mg/g QE), dichos estudios utilizaron el mismo solvente de extracción (Sulaeman et al., 2019).
En otros estudios realizados en Jalisco, México se ha demostrado también la presencia de estos compuestos en donde se han reportado valores de 130 mg EQ/g mayores que los del presente estudio, sin embargo, son propóleos de regiones donde abunda la vegetación por sus climas húmedos (Delgado et al., 2015). Por otra parte, se encontró un estudio reciente en donde se muestrearon propóleos de 11 zonas del sur de México quienes reportaron concentraciones de flavonoides que oscilaban entre los 0.04 y 4.04 %. En este estudio los métodos realizados fueron según la NOM-003-SAG/GAN-2017 (Rodríguez et al., 2020), estos estudios demuestran también la presencia de flavonoides en los propóleos mexicanos.
Actividad antioxidante
Inhibición del radical DPPH (2,2 - difenil-1-picrilhidracil)
El método de DPPH está basado en la capacidad del radical para reaccionar con donantes de hidrógeno. La interacción de un antioxidante con el radical depende de su formación estructural con la presencia de grupos hidroxilo (Jiménez et al., 2005).
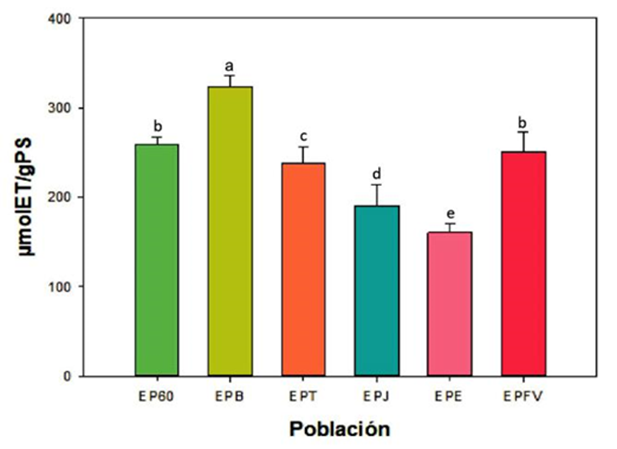
En la Figura 3 se muestran los resultados antioxidantes de los diferentes propóleos medidos en µmol ET/PS en donde el EPB obtuvo la mayor actividad antioxidante con un valor de 295.855 ± 11.432 µmol ET/gPS seguido con diferencias significativas por los extractos EPC60 y EPFV quienes obtuvieron resultados de 259.465 ± 6.892 y 250.681 ± 20.939 µmol ET/gPS respectivamente. El resto de los extractos también presentaron diferencias significativas entre sí en donde el menor valor lo obtuvo EPE con 160.584 ± 9.520 µmol ET/PS. Estos resultados son mayores a los encontrados en propóleos mexicanos provenientes de los estados de Nayarit quienes presentaron valores de 138 µg equivalentes de Trolox (Ibarra et al., 2020) y similares a los de Guanajuato en donde reportan valores de 54.4 mg ET/g PS (Hernández et al., 2018).
Por otro lado, se puede mencionar una posible correlación al comparar estos resultados antioxidantes con la concentración de fenoles, ya que los extractos EPB y EPFV fueron quienes obtuvieron valores superiores en éstas dos determinaciones. Socha et al. (2015), mostraron que hay una correlación significativa entre la mayor actividad antirradical hacia el DPPH en extractos de propóleos de Polonia con el contenido total de fenoles y flavonoides. De igual manera, en estudios de extractos de tomate se documentó una correlación positiva entre la actividad antioxidante y la concentración de compuestos fenólicos utilizando el método de Pearson, en donde estas biomoléculas reducen los niveles de radicales libres (Silva-Beltrán et al., 2015).
Inhibición del radical ABTS (2,2’ - azinobis (3- etilbenzo-tiazolina-6-sulfonato)
El ensayo de ABTS se basa en la transferencia de electrones, los diferentes compuestos antioxidantes presentes en los extractos donan uno o más electrones para reducir el radical a catión. Este método puede realizarse tanto en muestras hidrosolubles como liposolubles, eligiendo el disolvente apropiado (López de Lerma et al., 2013).
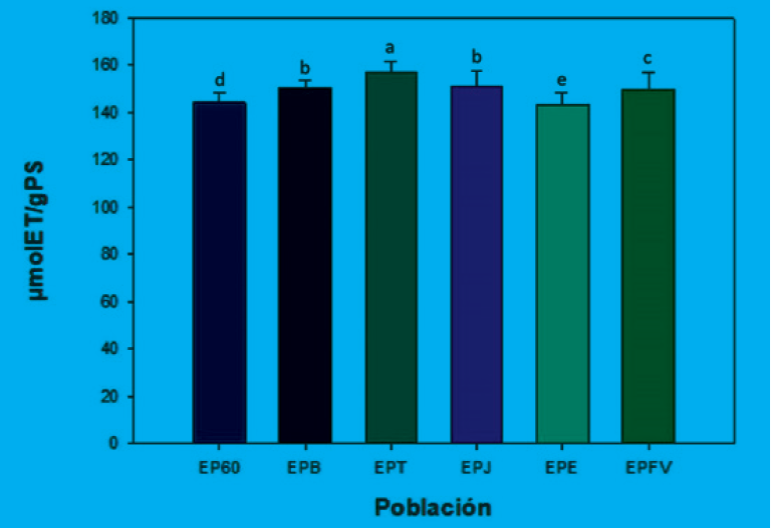
En la Figura 4 se muestra la actividad antioxidante que presentaron los diversos extractos etanólicos, donde se puede observar que el extracto EPT obtuvo el mayor valor con 156.963 ± 4.119 µmol ET/g PS. Todos los resultados obtenidos en el presente estudio oscilan entre los 140 y 160 µmol ET/g PS con diferencias significativas entre sí con excepción de los extractos EPB y EPJ. El extracto que obtuvo el menor valor fue el EPE con 143.280 ± 4.636 µmol ET/gPS. Cabe mencionar que las extracciones etanólicas en propóleos obtienen resultados más favorables en estudios antirradicales en ensayos como ABTS incluso superiores a la extracción supercrítica, esto debido a que el etanol extrae mayores cantidades de polifenoles y flavonoides y, en consecuencia, una mayor capacidad antioxidante (Dantas et al., 2017). Además, los resultados obtenidos en este estudio son menores que los que se presentaron en extractos de propóleos de Colombia, quienes tuvieron valores de 455 a 1091 µmol ET/g PS utilizando como solvente etanol al 96 % (Palomino et al., 2009). Sin embargo, son mayores a los que reportaron Narimane et al. (2017) 5.28± 0.16 µmol ET/g PS quienes documentan una correlación con el contenido total de fenoles y flavonoides en los extractos de propóleo analizados del noroeste de Argelia, donde se menciona que la capacidad de los extractos de propóleos para eliminar estos radicales podría ser por la donación de electrones, ya que esta propiedad conduce a la conversión de radicales libres en productos más estables finalizando la reacción en cadena de éstos radicales (Apak et al., 2007).
Por otro lado, Gregori y Stevanato (2010) reportaron la correlación existente entre la estructura química de algunos componentes del propóleo (ácido cafeico y sus derivados CAPE y DMAC) y su capacidad antioxidante, indicando que la mayor actividad está dada por moléculas que tienen dos grupos hidroxilo en posición orto en el anillo aromático.
Capacidad antioxidante en el eritrocito humano
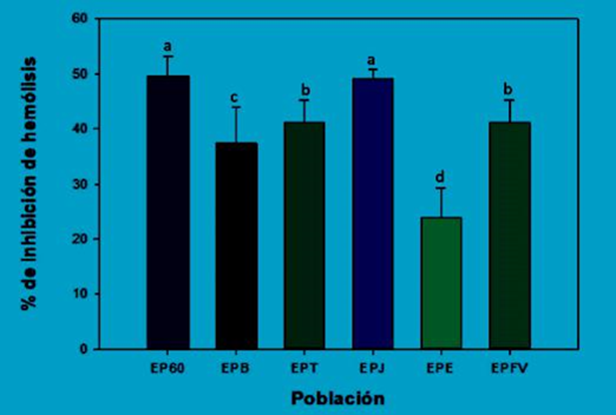
Recientes estudios, han utilizado modelos biológicos como eritrocitos humanos, con la finalidad de determinar la capacidad antioxidante de diversas sustancias bioactivas sobre la peroxidación lipídica de las células (Quihui et al., 2017). Este método está basado en la inducción de hemólisis generada por el radical AAPH (2,2’-Azobis (2-amidinopropane) dihydrochloride). Este radical provoca la liberación del hierro desde la hemoglobina, actuando como pro -oxidante y generando hidroperóxidos provenientes de la reacción del oxígeno y el AAPH (Veiga et al., 1997). Se detectó una protección eficaz de los extractos de propóleos analizados sobre los glóbulos rojos contra la hemólisis inducida por AAPH. La Figura 5 muestra que el extracto EP60 fue quien presentó el mayor porcentaje de inhibición de hemólisis con un 49.56 %, seguido del extracto EPJ, ambos no presentaron diferencias estadísticamente significativas entre sí (p<0.05). EPE fue quién presentó la menor protección al eritrocito con un 23.79 %.
Estudios realizados por Woźniak et al. (2019) en extractos etanólicos de propóleos de Polonia utilizando también este modelo celular, obtuvieron inhibiciones de hemólisis del 46.14 y 48.65% respectivamente, por lo que los resultados de la presente investigación son superiores a los de los extractos de Polonia. En otras investigaciones en donde se utilizó el mismo método se evaluaron extractos de ramas de Ziziphus obtusifolia quienes obtuvieron porcentajes de inhibición de hemólisis del 46.3% y 36.8% (Silva et al., 2019), los cuáles también fueron menores que los de este estudio.
El estrés oxidativo es una causa importante de lesiones celulares durante diversas patologías como la carcinogénesis. Estudios realizados en eritrocitos demostraron que compuestos fenólicos como derivados del ácido cafeico como CAPE y otros ésteres de ácidos polifenólicos relacionados, provocan efectos inhibitorios notables sobre la peroxidación lipídica en la membrana de los eritrocitos, sobre el rompimiento de cadenas de ADN celular y la fragmentación de proteínas (Wang et al., 2008). Adicionalmente, se han realizado investigaciones en propóleos de Sonora en donde se ha detectado la presencia de CAPE (Hernández et al., 2007), por lo que dicho compuesto podría ser el causante de la inhibición de hemólisis inducida en los extractos de propóleos del sur de Sonora.
Actividad antiinflamatoria por medio de la prueba de estabilidad de la membrana del eritrocito mediante las pruebas de hipotonicidad y de calor
Durante la inflamación, hay lisis de lisosomas que liberan componentes enzimáticos, como la enzima fosfolipasa A2 que actúa sobre los fosfolípidos asociados a la membrana liberando lisolecitina. La lisolecitina actúa sobre la membrana de glóbulos rojos lo que causan una hemólisis que produce una variedad de trastornos. Esta lisis lisosomal se puede dar por sustancias nocivas como el medio hipotónico y por el calor (De et al., 2017). La membrana de los glóbulos rojos humanos tiene una similitud con la membrana lisosomal. En este sentido, se trabajó con muestras de sangre, lo que permitió observar la actividad antinflamatoria de los extractos de propóleos sobre los eritrocitos humanos mediante la inhibición hipotónica y la respuesta a la lisis inducida por calor a la membrana de los glóbulos rojos (Anosike et al., 2018).
En la Tabla 2 se pueden observar los porcentajes de estabilización de los eritrocitos a causa de los diferentes extractos de propóleos analizados utilizando los ensayos por hipotonicidad y por calor. Así mismo, se observó alta variación en los resultados utilizando el medio hipotónico quienes mostraron porcentajes de estabilización de 7.74 a 1.77 % para los extractos EPT y EPJ respectivamente; sin embargo, mediante la prueba antiinflamatoria induciendo calor a los eritrocitos, se obtuvieron mejores resultados con valores del 22.01 (EP60) al 37.44 % (EPJ). Estos porcentajes demuestran que los propóleos evaluados son capaces de estabilizar la membrana de los glóbulos rojos, previniendo fugas de proteínas y fluidos séricos en los tejidos durante un periodo de mayor permeabilidad causada por mediadores inflamatorios que en este caso es el calor (Labu et al., 2015).
Tabla 2 Porcentajes de estabilización de la membrana del eritrocito utilizando calor y un medio hipotónico.
Table 2 Erythrocyte membrane stabilization rates using heat and hypotonic medium.
| Extracto | Porcentaje de estabilización (%) | |
|---|---|---|
| Calor | Hipotonicidad | |
| EP60 | 37.19 ± 1.614 a | 7.16 ± 2.416 a |
| EPB | 27.72 ± 0.576 b | 6.79 ± 1.740 a |
| EPT | 24.75 ± 0.724 b | 7.67 ± 0.413 a |
| EPJ | 21.98 ± 0.445 c | 1.74 ± 1.087 c |
| EPE | 37.11 ± 0.623 a | 7.719 ± 0.349 a |
| EPFV | 34.35 ± 1.725 a | 3.10 ± 1.181 b |
Media ± desviación estándar (n=3)
Mean ± standard deviation (n=3)
La acividad antiinflamatoria presentadas en los propóleos se atribuye al alto contenido de compuestos fenólicos, esto debido a que existe un efecto sinérgico de más de un solo componente (Chandra et al., 2012). Así mismo se ha reportado en muestras de propóleo la presencia de diversos compuestos como el ácido cafeico, CAPE, ácido ferúlico, galangina, genisteína, kaempherol, pinocembrina, quercetina y vainillina, entre otros (Castro et al., 2014) confirmando la actividad antiinflamatoria tanto in vivo como in vitro (Valenzuela-Barra et al., 2015). Se puede observar que los propóleos son más efectivos estabilizando a los eritrocitos en medios con temperaturas elevadas que en medios hipotónicos. Anosike et al. (2018) indican que el efecto hemolítico que se produce en una solución hipotónica está relacionado con la acumulación excesiva de líquido dentro de la célula, lo que resulta en la ruptura de su membrana, por lo que la lesión de la membrana de los glóbulos rojos hará que la célula sea más susceptible a algún daño secundario a través de la peroxidación lipídica como la que es inducida por radicales libres.
Actividad antibacteriana
La actividad antibacteriana fue medida por los métodos de susceptibilidad bacteriana mediante la medición de halos de inhibición y por el método de concentración mínima inhibitoria (CMI) donde se realizaron diluciones de los extractos para determinar el porcentaje de inhibición bacteriana. En la Tabla 3 se pueden observar los diferentes extractos evaluados con las diversas bacterias, en donde se muestra que todos los extractos presentaron actividad antibacteriana ante las diversas cepas confrontadas. Los extractos presentaron halos de inhibición con valores de 8 hasta 11.3 mm, siendo efectivas las diluciones de 1 y 2 mg de extracto/mL en la CMI. Así mismo, se observó que la bacteria Gram (+) S. aureus fue más sensible a los propóleos evaluados y los extractos EPB y EPE fueron quienes mostraron los mayores halos de inhibición con valores de 10.6 mm para las diluciones de 1 mg de extracto/mL. Estos resultados coinciden con Torlak y Sert (2013), en donde se evidenció efecto inhibitorio en bacterias Gram positivas al utilizar concentraciones de extractos de propóleos de 2 mg/mL. Otros estudios realizados en propóleos colombianos han comprobado la efectividad para reducir la contaminación por S. aureus con halos de inhibición de hasta 13 mm (Gómez et al., 2014). En ese sentido, se observa que la actividad antibacteriana del propóleo es mayor contra las bacterias Gram positivas, y esto posiblemente se deba a la presencia de flavonoides, ácidos y ésteres aromáticos en la resina. Se ha comprobado que estos compuestos tienen efectos sobre las paredes celulares de estos microorganismos (Bankova et al., 1999).
Table 3 Antibacterial activity of propolis extracts from southern Sonora.
| Muestra | E. coli O157 : H7 | E. coli O157 | S. aureus | S. tiphymurium | ||||
|---|---|---|---|---|---|---|---|---|
| Diámetro de inhibición (mm) | CMI | Diámetro de inhibición (mm) | CMI | Diámetro de inhibición (mm) | CMI | Diámetro de inhibición (mm) | CMI | |
| EP60 | n.d. | 2a | n.d. | 1 a | n.d. | 1 a | n.d. | 1 a |
| EPB | 9 ± 1.15 a | 2a | 8 ± 1.15 a | 2 a | 10.6 ± 1.57 a | 1 a | 9 ± 2.98 a | 2 a |
| EPT | 9 ± 3.46 a | 2a | 9 ± 0.57 a | 2 a | 9.3 ± 0.57 a | 2 a | 8 ± 1.23 a | 1 a |
| EPE | 8 ± 2.68 a | 2a | 9 ± 0.57 a | 2 a | 10.6 ± 2.23 a | 1 a | 9.3 ± 3.34 a | 2 a |
| EPJ | 8 ± 0.57 a | 1a | 8 ± 2.05 a | 2 a | 11.3 ± 0.23 b | 2 a | 8 ± 0.57 a | 2 a |
Medias de tres repeticiones; n.d.: no determinado; CMI: Concentración mínima inhibitoria (mg de extracto/mL);
Means of three replicates; n.d.: not determined; CMI: Minimum inhibitory concentration (mg extract/mL)
Por otro lado, las bacterias Gram negativas E. coli O157:H7, E. coli O157:H7 y S. typhimurium presentaron mayor resistencia ante estos extractos ya que en su mayoría se obtuvieron valores de inhibición de menor diámetro (entre 8 y 9.3 mm) y se necesitó la dilución mayor (2 mg/mL) para inhibir su desarrollo. Además, al igual que en el presente estudio se ha evidenciado la actividad contra S. typhimurium utilizando concentraciones de extractos etanólicos de propóleos de 1 mg/mL (Choi et al., 2006). Dado que las bacterias Gram (-) tienen dos membranas plasmáticas, la exterior que cubre la pared celular, podemos suponer que los ácidos fenólicos no podrían penetrar tan fácilmente la membrana exterior. En cambio, las bacterias Gram (+) no tienen esta membrana externa por lo que puede actuar de manera directa en las paredes celulares (Brown et al., 2015). La mayor inhibición fue registrada por EPB quién a su vez presentó las mayores concentraciones de fenoles y flavonoides. Se observó una correlación de las actividades antibacterianas del propóleo con las concentraciones de fenoles y flavonoides, los cuales eran dependientes del origen de la muestra (Hamasaka et al., 2004). Algunos de los mecanismos antimicrobianos que pueden presentar los flavonoides (compuestos detectados en los propóleos del presente estudio) son la inhibición de la motilidad, inhibición de la síntesis de ácidos nucleicos, inhibición de las funciones de la membrana citoplasmática, inhibición del metabolismo energético, inhibición de la unión y formación de biopelículas, inhibición de las porinas y atenuación de la patogenecidad (Xie et al., 2015).
Conclusiones
La actividad biológica de los extractos etanólicos de los propóleos del sur de Sonora fue dependiente de la zona de origen. Las mejores actividades antioxidantes, anti hemolíticas y antibacterianas fueron dadas por los extractos EPFV y EPB quienes a su vez mostraron la mayor concentración de fenoles y flavonoides totales. La actividad antiinflamatoria de los propóleos fue expresada por la protección térmica que mostraron los diferentes extractos a los eritrocitos para evitar la hemólisis, siendo el EP60 el que presentó el mayor porcentaje de inhibición. Este resultado respalda la base para las formulaciones del propóleo del sur de Sonora y su uso como terapia natural alternativo.











 nueva página del texto (beta)
nueva página del texto (beta)