Introducción
La clamidiosis es una enfermedad infecciosa que afecta a los caprinos a nivel reproductivo, es causada por la bacteria intracelular obligada Chlamydia abortus que presenta una distribución mundial (Cheong et al., 2019); particularmente en países con producciones intensivas de pequeños rumiantes (Van den Brom et al., 2012). En el ganado caprino infectado se presenta aborto durante el último tercio de la gestación (World Organization for Animal Health (OIE), 2018). En algunos casos, las cabras infectadas paren crías prematuras y débiles que generalmente mueren durante los primeros días de vida (Kuo y Stephens, 2011). La infección es transmitida por la inhalación o la ingestión de las bacterias contenidas en las descargas vaginales y placentas de cabras que abortaron o mediante agua y alimentos contaminados (Longbottom y Coulter, 2003; Papp et al., 1993). Adicionalmente, la infección también se transmite a las crías que nacieron de cabras infectadas o que son alimentados por hembras que abortaron (Amin y Wilsmore, 1995). La transmisión sexual de C. abortus aún no está muy estudiada; sin embargo, la detección de la bacteria en hembras durante la ovulación y después del servicio de apareamiento sugieren que se favorece la transmisión venérea de la enfermedad (Livingstone et al., 2009; Papp et al., 1993). El alojamiento de hembras infectadas podría desencadenar en el contagio de sementales (Rodolakis y Souriau, 1986), aunque el papel del macho en la transmision sexual de la enfermedad aún no está clara.
En México, desde el 2016 se incluyó a la clamidiosis dentro del grupo 3 de las enfermedades endémicas y plagas exóticas de reporte obligatorio mensual ante las autoridades zoosanitarias (Secretaría de Agricultura Ganadería Desarrollo Rural Pesca y Alimentación, 2016). De acuerdo a las autoridades de salud animal y sanidad del país, la infección causada por C. abortus se ubica dentro de un grupo de enfermedades de bajo riesgo desde el punto de vista epidemiológico, económico, de salud pública y de comercio (Secretaría de Agricultura Ganadería Desarrollo Rural Pesca y Alimentación, 2016). No obstante, durante una primera infección se pueden producir de 30 al 90 % de abortos en las hembras afectadas (Aitken y Longbottom, 2007, Nietfeld, 2001), con lo cual el impacto productivo y económico es considerable (Longbottom, 2004). Además, las hembras que padecen infecciones crónicas tienen pocas posibilidades de recuperar su potencial productivo (Amin y Wilsmore, 1995, Entrican et al., 2001). La clamidiosis representa también un riesgo zoonótico para las personas que se encuentran en contacto con los caprinos enfermos (Rodolakis y Yousef Mohamad, 2010), principalmente en personas inmunocomprometidas o embarazadas en las cuales se puede producir un aborto espontáneo (Aitken y Longbottom, 2007, Longbottom y Coulter, 2003). En consecuencia, es necesario conocer la distribución y prevalencia de C. abortus en los sistemas de producción para así establecer programas de monitoreo eficientes encaminados a controlar y erradicar la infección.
En el caso específico de los caprinos, el panorama epidemiológico nacional de C. abortus permanece aún incompleto para diferentes estados y zonas geográficas de México. Lo anterior a pesar de que diversos estudios han reportado la presencia de C. abortus en rebaños caprinos de Coahuila, Guanajuato, Jalisco, México, Puebla, Querétaro y Veracruz (Campos-Hernandez et al., 2014, Escalante-Ochoa et al., 1997, Mora et al., 2015, Sánchez-Rocha, 2014, Soriano-Vargas et al., 2011). Sin embargo, en el estado de Sinaloa actualmente se desconoce la presencia de C. abortus en los sistemas de producción caprina. De acuerdo con los datos reportados por el SIAP en 2018, Sinaloa ocupó el 13º lugar dentro del inventario caprino nacional con una población de 180,159 cabezas de ganado (Servicio de Información Agroalimentaria y Pesquera, 2020). A nivel estatal predominan sistemas de producción extensivos; caracterizados principalmente por pequeños rebaños (< 100 cabezas), uso de baja tecnología, mano de obra familiar, alimentación basada en pastoreo de la vegetación nativa del agostadero y nula asistencia técnica (Tovar Luna, 2009). No obstante, también existen algunas explotaciones intensivas donde se produce leche y pie de cría en los que se requiere un manejo zootécnico más estricto, así como dietas específicas para los caprinos durante cada etapa productiva.
Para evitar las perdidas productivas ocasionadas por C. abortus, es necesario conocer a detalle cual es el estado sanitario de los rebaños caprinos del país, principalmente en aquellos estados en los cuales no existe información sobre la presencia y magnitud de la infección provocada por C. abortus. Por lo tanto, el objetivo de la presente investigación consistió en realizar un estudio epidemiológico para determinar la prevalencia de C. abortus en un rebaño de caprinos en el centro de Sinaloa, México.
Materiales y métodos
Lugar de estudio, animales y diseño del estudio
Las condiciones de mantenimiento y manejo de los animales cumplieron con las recomendaciones del Consejo de Organizaciones Internacionales de Ciencias Médicas (Organización Mundial de la Salud, 2002) y la NOM-062-Z00-1999 para el manejo de animales de laboratorio (Norma Oficial Mexicana NOM-062-ZOO-1999, 2001). El estudio se realizó entre 2016 y 2017 en un rebaño caprino localizado en el poblado de Mojolo a una Latitud: 24.885833 y Longitud: -107.417500 a 60 m.s.n.m. dentro del municipio de Culiacán, en la zona centro del estado de Sinaloa. El sitio de estudio se dedica a la producción de pie de cría de registro de las razas Nubia y Boer, cuya población se compone de 250 hembras (87 de raza Boer y 163 de raza Nubia) y siete machos (2 de raza Boer y 5 de raza Nubia). El rebaño cuenta con la certificación de hato libre de brucelosis; sin embargo, se presentó un historial de abortos durante años previos al estudio; principalmente en las hembras de primer parto.
Los animales fueron alimentados con una dieta a base de pasto sudan, alfalfa, maíz, pasta de soya, minerales para caprinos en reproducción (TMP, México), Zeolita, melaza y aceite vegetal (18.8 % de proteína, 3.1 Mcal de EM/kg de MS, 14.2 % de fibra cruda y 80.0 % materia seca). Las épocas de parto del rebaño coinciden con los períodos de estacionalidad reproductiva de las cabras (Diaz et al., 2019). En el sitio en estudio se mantiene una mezcla de hembras, las cuales van desde primalas hasta multíparas con doce partos. Con respecto a su condición corporal, las hembras incluidas en el estudio presentaron una condición corporal entre 3 y 4, de acuerdo con la escala que va de 1 al 5, donde 1 indica un animal desnutrido y 5 un animal obeso (Honhold et al., 1989).
El estudio se dividió en dos etapas. En 2016, durante la primera etapa de la investigación se realizó un estudio observacional descriptivo de tipo transversal (Donis, 2013) para determinar la presencia de C. abortus en las hembras del rebaño que tuvieron un parto o aborto reciente (<30 días) al momento de colección de la muestra. De esta forma, se incluyeron en el estudio 135 de las 250 hembras del rebaño, las cuales cumplieron el criterio de inclusión definido. Adicionalmente, se evaluaron los siete machos del rebaño para confirmar la posibilidad de que estos pudieran ser positivos a la presencia de la bacteria y con ello transmitir la infección de forma venérea a las hembras. La importancia de dicha evaluación se basó en que durante la época reproductiva se utilizó monta natural para gestar a las hembras. Durante la segunda etapa, se realizó un estudio longitudinal durante dos períodos consecutivos de partos/abortos en un grupo de 32 hembras, las cuales fueron seleccionaron aleatoriamente de entre las 135 hembras evaluadas durante la primera etapa. El objetivo consistió en evaluar el posible cambio de la prevalencia de C. abortus entre los períodos de seguimiento. En ambos casos, los estudios se realizaron entre los meses de junio a diciembre debido a la estacionalidad reproductiva de las cabras (Diaz et al., 2019).
Muestras de estudio
En ambos estudios se colectaron muestras de exudado vaginal de cada una de las hembras mediante un hisopo estéril. Las muestras se colectaron de 1-30 días posteriores al evento de parto o aborto. Inmediatamente después de la colección de las muestras, estas fueron transportadas al laboratorio a una temperatura de 4 °C en tubos cónicos de polipropileno de 15 mL adicionado con 2 mL de medio de transporte SPF, que contiene: sacarosa, fosfato y glutamato, suplementado con 10 % de suero fetal bovino (SFB) y 50 µg/mL gentamicina (Sachse et al., 2009). Una vez en el laboratorio, las muestras fueron congeladas a -20 °C hasta su procesamiento siguiendo el protocolo descrito por Mora et al. (2015) . En el caso de los machos, las muestras se obtuvieron de prepucio (n=7) y semen (n=3), el cual fue recolectado mediante vagina artificial.
Aislamiento e identificación de Chlamydia abortus en cultivo celular
El aislamiento de la bacteria patógena en las muestras evaluadas, así como la propagación de la cepa de referencia C. abortus A.22 se realizó dentro de las instalaciones del Centro Nacional de Investigación Disciplinaria (CENID) Microbiología del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP). Para la propagación se utilizaron monoestratos celulares de fibroblastos L929 de ratón, los cuales se cultivaron en botellas de poliestireno de 75 cm2. Las células se cultivaron en Medio Mínimo Esencial de Eagle (MEM-C, GIBCO Life Technologies, Carlsbad, CA, USA) suplementado con 10 % de SFB, 1 % aminoácidos no esenciales, 1 % L-Glutamina y antibióticos (50 µg /mL gentamicina) en condiciones de humedad en incubadora a 37 °C y 5 % de CO2 (Escalante-Ochoa et al., 1996). Se utilizaron placas de poliestireno de 24 pozos (NUNCTM, Thermo Scientific, Waltham, MA, USA), en los cuales se colocaron cubreobjetos de vidrio estériles de 12 mm de diámetro para la identificación de cuerpos clamidiales por inmunofluorescencia. La concentración celular que se empleó fue de 0.9 x 105 células por pozo, dejándose incubar 24 h hasta obtener 80-90 % de confluencia (Mora et al., 2015).
Para el proceso de infección, una vez alcanzada la confluencia de 80-90% se retiró por completo el MEM-C y se agregaron 100 μL por pozo del sobrenadante de las muestras evaluadas. Cada placa contó con un control positivo (cepa C. abortus A22) y un testigo negativo, los cuales se incluyeron por duplicado. Las placas se incubaron con las muestras durante 1 h a 37 °C en una incubadora con rotación orbital a 50 rpm, una vez transcurrido ese tiempo se añadieron 900 µL adicionales de MEM-C por pozo y se incubaron a 37 °C en condiciones de humedad y 5 % CO2 por 72 h. Al concluir el periodo de incubación, se realizó un raspado en los pozos de las placas sin cubreobjetos para obtener el tapete celular, las células junto con el MEM-C se conservaron en microtubos estériles identificados y congelados a -70 °C. A las placas con cubreobjetos se les retiró MEM-C antes de realizar tres lavados de 5 min cada uno con solución salina de fosfatos (PBS). Posteriormente, se retiró el PBS y se fijó la muestra con 1 mL de metanol puro a -20 °C durante 10 min, una vez transcurrido ese tiempo se retiró el metanol y las placas se secaron a temperatura ambiente previo a su congelación a -70 °C.
Determinación de cuerpos de inclusión
Para identificar las inclusiones intracitoplasmáticas producidas por Chlamydia spp. se utilizó el kit comercial IMAGENTM Chlamydia Immunofluorescence test (Thermo Scientific, OXOID, UK). La técnica de detección está basada en identificar el lipopolisacárido (LPS) de la bacteria mediante inmunofluorescencia directa al utilizar anticuerpos monoclonales anti-LPS acoplados a FITC. El procedimiento se realizó de acuerdo a las instrucciones del fabricante y siguiendo el procedimiento descrito por Vanrompay et al. (1994) . Finalmente, la visualización y evaluación de las muestras se realizó de acuerdo a un protocolo previamente publicado (Mora et al., 2015).
Identificación de Chlamydia abortus mediante PCR
Para identificar a C. abortus mediante PCR, se extrajo ADN de las muestras evaluadas. Adicionalmente, se extrajo ADN de fibroblastos infectados con la cepa de referencia (C. abortus A22) para ser utilizados como control positivo y ADN de fibroblastos sin infectar para ser utilizado como control negativo. En todos los casos se utilizó el kit comercial QIAamp DNA Mini de la marca QIAGEN de acuerdo con las especificaciones del fabricante. El cual está diseñado para la rápida purificación de ADN total utilizando la técnica de microcentrifugación. Se emplearon los iniciadores utilizados por Jiménez-Estrada et al. (2008) : CpaX-1, 5’-ACGGTCACTTGGAAACAAGG-3’, y CpaX-2, 3’-AGCAGAGGTTGGGCTCACTA-5’. Estos iniciadores amplifican un fragmento específico de C. abortus de 912 pares de bases del gen de la proteína de membrana externa polimórfica, POMP 90-91-B. El proceso de amplificación inició con 5 min de desnaturalización a 95 °C, seguida de 30 ciclos de amplificación. Cada ciclo consistió en desnaturalización a 95 °C por un minuto, alineación a 60 °C por 30 segundos, extensión a 72 °C por un minuto y extensión final a 72 °C por 10 min. Los fragmentos amplificados fueron separados por electroforesis en gel de agarosa al 2.5 % y visualizados mediante tinción con bromuro de etidio.
Análisis estadístico
Para el análisis de los datos se utilizó una prueba de X 2 a dos colas para comparar la proporción de hembras positivas o negativas al patógeno de acuerdo con su desenlace reproductivo (parto o aborto). Adicionalmente, se realizó un análisis de componentes principales para visualizar el patrón de asociación entre las variables de las hembras: raza, positividad a C. abortus, desenlace reproductivo, edad y número de partos; frente a las características del estudio: positividad a clamidiosis y tiempo de recolección de la muestra. El modelo se construyó utilizando la matriz de covarianza de las variables (Aguirre-Benítez et al., 2017, Pacheco-Velázquez et al., 2019). Finalmente, en las hembras del estudio en seguimiento se realizó un análisis de regresión logística binaria para determinar si la presencia del patógeno (muestras positivas mediante aislamiento) se predice en función de alguna de las siguientes variables categóricas: raza, Nubia o Boer; período de evaluación, primer o segundo período; desenlace reproductivo, parto o aborto; edad, <3, 4-6 o >7 años; período de recolección de la muestra, <6 o >7 días; número de partos, <5, 6-8 o >9 partos. Para resumir los resultados se utilizó la razón de momios (Odds Ratio, OR), el cual en caso de resultar <1 se presentó con su recíproco (1/OR) (Romo-Barron et al., 2019).
Todos los análisis se realizaron en el paquete estadístico SAS University Edition (SAS Institute, Cary, NC, USA). En todos los casos se consideró un valor de p < 0.05 como significativo. Las figuras se construyeron en el paquete estadístico Prism 8.0 (GraphPad, Inc., San Diego, CA, USA).
Resultados y discusión
Primera etapa: estudio de prevalencia
En el estudio se encontró una prevalencia de clamidiosis del 55.6% en las hembras debido a que se detectó C. abortus mediante aislamiento en 75/135 muestras evaluadas (Tabla 1). De las muestras positivas, 92.0 % (69/75) se encontraron en cabras que tuvieron parto normal, mientras que el resto fue encontrado en hembras que presentaron aborto. De las cabras que tuvieron parto normal 55.2 % (69/125) resultaron positivas y 60 % (6/10) de las cabras que tuvieron aborto fueron detectadas como positivas a C. abortus. Por lo tanto, la prevalencia de clamidiosis fue similar (p > 0.05) entre los dos grupos de cabras. Adicionalmente, las 75 muestras que resultaron positivas mediante aislamiento se utilizaron para confirmar la presencia de la bacteria mediante PCR (Figura 1). Los resultados indicaron que en 13.3 % de las muestras (10/75) se detectó molecularmente la presencia de C. abortus (Tabla 2). A pesar de la baja concordancia entre los métodos, se confirmó la presencia del patógeno mediante PCR en 83.3 % (5/6) de las hembras que abortaron y que fueron detectadas como positivas mediante aislamiento. En contraste, la confirmación molecular de clamidiosis resultó menor en las cabras que tuvieron parto normal y que resultaron positivas mediante aislamiento (7.8 %, 5/64; p < 0.05). Es posible que la diferencia en el número de detecciones positivas por PCR se asocie con una menor disponibilidad de material genético debido a la disminución de la carga bacteriana de las muestras evaluadas, la cual se sabe que es mayor durante el parto o el aborto de las hembras infectadas (Longbottom y Coulter, 2003). En nuestro estudio, en algunos casos se obtuvieron las muestras hasta 30 días posteriores al evento de parto/aborto, con lo cual la excreción de bacterias pudo haber disminuido significativamente hasta generar una detección negativa por PCR (World Organization for Animal Health (OIE), 2018). No obstante, se requieren más estudios para evaluar la asociación entre el tiempo de muestreo y el resultado de diagnóstico molecular de la bacteria.
Tabla 1 Resultados del estudio de prevalencia mediante cultivo y aislamiento de
Chlamydia abortus en un rebaño caprino con
problemas de aborto en la zona centro de Sinaloa, México.
Table 1. Microbiological results from the
cross-sectional study to assess the prevalence of Chlamydia
abortus in caprine goats with abortion issues in
Central Sinaloa, Mexico.
| Resultado | ||||
|---|---|---|---|---|
| Técnica | Desenlace | Positiva | Negativa | Totala |
| Aislamiento | Parto | 69 | 56 | 125 |
| Aborto | 6 | 4 | 10 | |
| 75 (55.6%) | 60 (44.4%) | 135 | ||
a La detección de C. abortus se realizó mediante aislamiento en cultivo bacteriano. Se incluyeron 135/250 hembras del total del rebaño caprino, las cuales se seleccionaron debido a que presentaron parto o aborto reciente (<30 días).
aC. abortus was detected by bacterial culture. In total, 135/250 goats from the herd were included in the study based on recent (<30 days) kidding or abortion.
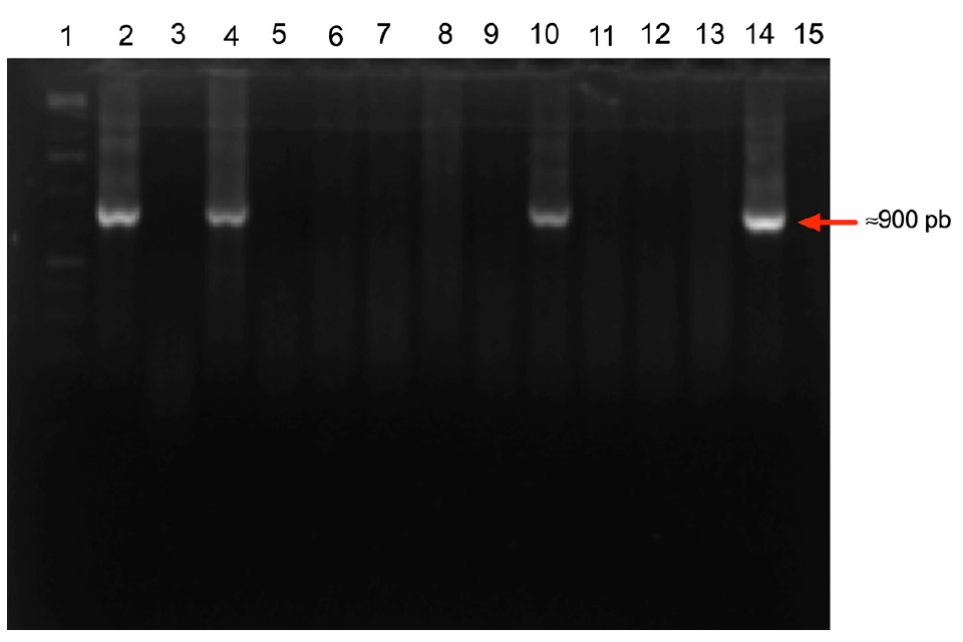
Figura 1 Imagen representativa de la identificación del producto de 912 pb correspondientes al
gen de la proteína POMP 90-91-B de C. abortus en
muestras provenientes de hembras positivas a clamidiosis mediante
aislamiento. El tamaño de los productos de las muestras
identificadas se presenta a la derecha. Carriles: 1) marcador de
peso molecular, 2) control positivo, 3) control negativo, 4-15)
muestras evaluadas.
Figure 1. Representative
image of the 912 bp identification product corresponding to the
C. abortus POMP 90-91-B protein-encoding gene,
found in samples from positive goats detected by bacterial
isolation. The right side shows the relative size of the identified
product. Lines: 1) molecular weight standards, 2) positive control,
3) negative control, 4-15 assessed samples.
Tabla 2 Resultados de la confirmación por PCR de la presencia de Chlamydia abortus en 75 muestras positivas identificadas mediante aislamiento. Table 2. PCR confirmatory results for the presence of Chlamydia abortus in the 75 positive samples identified by bacterial isolation.
| Resultado | |||
|---|---|---|---|
| Desenlace | Positiva | Negativa | Totala |
| Parto | 5 | 64 | 69 |
| Aborto | 5 | 1 | 6 |
| 10 (13.3%) | 65 (86.7%) | 75 | |
A pesar de la discrepancia entre los métodos evaluados, las técnicas moleculares (PCR convencional o PCR en tiempo real) se consideran el método recomendado para la confirmación de casos clínicos de clamidiosis, así como para los estudios de vigilancia epidemiológica (World Organization for Animal Health (OIE), 2018). No obstante, tanto el aislamiento como el PCR se consideran técnicas complementarias de diagnóstico, las cuales además deben de corroborarse mediante análisis patológico para incrementar la precisión del diagnóstico (Borel et al., 2018).
Nuestros resultados demuestran por primera vez la presencia de C. abortus en cabras con problemas de aborto en la región centro del estado de Sinaloa. De esta forma, la detección de clamidiosis en Sinaloa amplia la distribución espacial de C. abortus dentro del territorio de México. Sin embargo, los estudios realizados hasta la fecha han evaluado la presencia de C. abortus en una cantidad muy reducida de estados, por lo cual es muy probable que se subestime la prevalencia real de la clamidiosis a nivel nacional.
En lo referente a ganado caprino, Campos-Hernandez et al. (2014) y Mora et al. (2015) reportaron prevalencias de 4.8 % y 23.8 % en Guanajuato, respectivamente. Mientras que en Querétaro se ha reportado una alta prevalencia de clamidiosis de entre 71.4 % y 100.0 % (Escalante-Ochoa et al., 1997, Sánchez-Rocha, 2014). Por otra parte, Sánchez-Rocha (2014) reportaron una prevalencia heterogénea de 0.0 % hasta 28.0 % en hatos de Veracruz, Jalisco, Coahuila, Puebla. En ovinos, Jiménez-Estrada et al. (2008) reportó la presencia de C. abortus en rebaños del estado de México en donde encontró una prevalencia de 22.6 %, mientras que Escalante-Ochoa et al. (1996) evaluaron la presencia de clamidiosis en cinco regiones del altiplano mexicano, en los cuales encontraron una prevalencia conjunta de 92.8 %. Adicionalmente, en un estudio reciente realizado en los estados de Tlaxcala, Sonora, Chihuahua, Hidalgo, Chiapas, Querétaro y Estado de México, se encontró una prevalencia de C. abortus a nivel de muestra individual de entre 7.1 % y 13.1 % (Reséndiz et al., 2020).
La existencia de un mayor número de estados del país que presentan clamidiosis en los rebaños de pequeños rumiantes sigue la dinámica actual mundial, de acuerdo con la cual en años recientes se ha incrementado el número de países y regiones en los cuales se ha detectado C. abortus. Por ejemplo, en Argentina (Di Paolo et al., 2019, Rojas et al., 2018), China (Hu et al., 2018), Croacia (Spicic et al., 2015), Costa Rica (Villagra-Blanco et al., 2015), España (Tejedor-Junco et al., 2019), Irán (Esmaeili et al., 2015, Heidari et al., 2018) y Palestina (Jalboush et al., 2017), entre otros.
Con respecto a la identificación de C. abortus en los machos evaluados, 2/7 muestras de hisopado prepucial y 1/3 muestras de semen resultaron positivas al patógeno. Los resultados obtenidos concuerdan con el trabajo realizado por Teankum et al. (2007) en donde se demuestra la presencia C. abortus en semen de caprinos. Jalboush et al. (2017) recientemente reportaron que en 53.3 % de las granjas ovinas que evaluaron en su estudio encontraron un macho seropositivo sexualmente activo. Además, a nivel individual en 2,608 machos analizados, encontraron una prevalencia de 13.7 % a C. abortus, con lo cual sugieren un problema potencial de transmisión venérea (Jalboush et al., 2017). Nuestros resultados confirman que en el rebaño caprino evaluado el uso de machos infectados con clamidiosis se debe de considerar un factor de riesgo para la transmisión de la enfermedad por vía sexual hacia las hembras sanas del rebaño. En consecuencia, debido a que la presencia de machos infectados supone un riesgo para mantener e incrementar la prevalencia de clamidiosis, es necesario que en México se apliquen las medidas recomendadas por la Organización Mundial de Salud Animal (World Organization for Animal Health (OIE), 2019) para la importación de semen de pequeños rumiantes y así evitar la diseminación de la infección por esta vía.
Nuestros resultados representan el primer reporte de C. abortus en caprinos en el estado de Sinaloa, por lo cual se recomienda realizar más estudios de vigilancia epidemiológica a nivel estatal para determinar con mayor precisión la prevalencia de clamidiosis dentro del rebaño caprino de Sinaloa. Es posible que en el estado de Sinaloa existan rebaños de caprinos con características similares al que aquí se evaluó, dentro de los cuales al menos una parte de los problemas de aborto se deban a la clamidiosis. No obstante, la falta de pruebas diagnósticas accesibles aunado al desconocimiento de los productores pueden ocultar la prevalencia real de la enfermedad. Es por ello necesario el estudio de la bacteria para poder implementar medidas sanitarias de control y buen manejo sanitario contra la clamidiosis, tal como lo describen las guías de la Organización Mundial de Sanidad Animal (World Organization for Animal Health (OIE), 2019) para la importación de semovientes, embriones o semen con fines reproductivos. De hecho, estas prácticas se deberían de extender dentro de los estados para evitar la propagación de la enfermedad hacia hatos sanos. A pesar de que en diferentes regiones del mundo se utiliza la vacunación como uno de los métodos más eficaces de control de la clamidiosis (Longbottom y Livingstone, 2006, Zhou et al., 2018), en nuestro país no se utiliza dicha medida profiláctica. En consecuencia, sería útil evaluar en futuros estudios el efecto protector que confiere la vacunación en rebaños con alto riesgo de contagio.
Segunda etapa: estudio de seguimiento
Los resultados del estudio de seguimiento demostraron un incremento significativo en la prevalencia de C. abortus en las 32 cabras que fueron evaluadas durante dos períodos de partos consecutivos. En este grupo seleccionado de cabras, el número de hembras positivas se incrementó de 2 a 17 y con ello la prevalencia pasó de 6.3 % a 53.1 % entre los períodos. No obstante, a pesar del incremento sustancial en el número de aislamientos positivos, el número de abortos en las 32 cabras disminuyó al pasar de 5 a 2 entre ambos períodos. Sin embargo, la positividad al patógeno se incrementó entre las hembras que abortaron; todas las hembras que abortaron durante el primer período resultaron negativas a C. abortus, mientras que durante el segundo período de evaluación las dos hembras que abortaron resultaron positivas (Tabla 3).
Tabla 3 Resultados del estudio longitudinal de 32 hembras durante dos períodos consecutivos de
partos.
Table 3. Results from the longitudinal
study of 32 goats during two consecutive kidding periods.
| Período de seguimiento | Desenlace | Positiva | Negativa | Total a |
|---|---|---|---|---|
| Primero | Parto | 2 | 25 | 27 |
| Aborto | 0 | 5 | 5 | |
| 2 (6.3%) | 30 (93.7%) | 32 | ||
| Segundo | Parto | 15 | 15 | 30 |
| Aborto | 2 | 0 | 2 | |
| 17 (53.1%) | 15 (46.9%) | 32 |
a Se seleccionaron y siguieron durante dos épocas de parto a 32/135 hembras positivas mediante aislamiento que se detectaron en el estudio transversal.
a From the original 135 positive goats detected by bacterial isolation, 32 goats were selected and followed during two kidding periods.
En un estudio reciente de Reséndiz et al. (2020) en el cual se evaluaron factores de riesgo asociados a la presencia de clamidiosis en ovinos, los autores reportaron que los sistemas de producción de tipo intensivo y semi-intensivo favorecieron significativamente la presencia de C. abortus con respecto a los sistemas extensivos. En este sentido, se ha encontrado que el contacto entre animales sanos y enfermos en los sistemas intensivos y semi-intensivos acelera la propagación de la bacteria patógena debido al hacinamiento al que son sujetos los animales en estos sistemas de producción (Barkallah et al., 2018, Heidari et al., 2018). De acuerdo con dicha evidencia, es posible que el incremento de la positividad a C. abortus que observamos entre los dos períodos de seguimiento se asocie parcialmente con el hecho de que las hembras evaluadas en los dos períodos compartieron el corral de parto con el resto de las hembras del rebaño; entre las cuales se existieron hembras que abortaron y que resultaron positivas al patógeno. No obstante, es necesario realizar estudios adicionales que evalúen la asociación entre la positividad a clamidiosis y el tipo de manejo que reciben los animales en los sistemas de producción caprina de la región. Adicionalmente, dos ejemplares machos que realizaron empadre con este grupo de cabras resultaron positivos a clamidiosis; en consecuencia, no se descarta que los machos sean una fuente importante para diseminar la enfermedad por vía sexual como se ha demostrado previamente (Teankum et al., 2007).
Si tomamos en cuenta que una elevada carga bacteriana es excretada en fluidos vaginales, placenta y en el recién nacido durante el parto o en el feto durante el aborto (Van den Brom et al., 2012), entonces es posible sugerir que las condiciones en las que se alojan a las cabras durante las épocas de parto en los sistemas productivos de México influyen de forma importante en la diseminación de la enfermedad. Lo anterior debido a que las hembras sanas y las infectadas comparten las instalaciones. Adicionalmente, el potencial infeccioso de C. abortus se incrementa por la contaminación del medio ambiente mediante las descargas bacterianas de las hembras infectadas, con lo cual aumenta el riesgo de que las cabras sanas adquieren la bacteria por vía oral en el alimento o en el agua (Papp et al., 1993).
En la Figura 2A se presenta el patrón de asociación entre las variables incluidas en el análisis de componentes principales. La edad y el número de partos de las cabras contribuyeron a la separación de las hembras que resultaron positivas con respecto a las negativas. En particular, las hembras positivas se asociaron con una menor edad y un menor número de partos, con lo cual se infiere que las hembras del rebaño que principalmente son afectadas por la clamidiosis tienden a ser hembras jóvenes con un número reducido de partos. Nuestro patrón de asociación contrastó con un estudio previo realizado en ovinos, en el cual se encontró que el grupo de hembras de entre 37 y 48 meses de edad presentó un incremento significativo de da probabilidad de resultar positivas a clamidiosis (Reséndiz et al., 2020). En la Figura 2B se aprecia que aquellas hembras que resultaron negativas se separan por presentar un mayor número de partos. Además, también se encontró una asociación entre un mayor número de días en la toma de la muestra y el resultado negativo en las hembras. En este sentido, el intervalo de tiempo entre el evento de parto/aborto y la toma de muestra es importante para asegurar un diagnóstico apropiado mediante aislamiento, lo anterior debido a que se pueden producir diagnósticos falsos negativos a causa de la reducción de la carga bacteriana que expulsan las cabras afectadas (Longbottom y Coulter, 2003).

Figura 2 Patrón de asociación entre las características de las hembras evaluadas durante el
estudio longitudinal y el resultado de clamidiosis. A) Valores de
carga de las variables dentro de los dos componentes principales,
los cuales explican 51.4% de la variación total; B) Puntuaciones
individuales de las cabras evaluadas durante los dos períodos de
seguimiento, las cabras se clasificaron de acuerdo con la presencia
de C. abortus. La edad y el número de partos
contribuyeron a la separación de los animales infectados de aquellos
sanos.
Figure 2. Association pattern between
the characteristics of goats evaluated in the longitudinal study,
and the chlamydiosis test result. A) Loading values for the outcomes
in the two main principal components, which explain 51.4% of the
total variance; B) Individual scores for the goats during two
kidding periods, females were categorized according to the presence
of C. abortus. The goats age and the number of
kidding contributed to the groups separation between infected and
healthy animals.
En la Figura 3 se resumen los resultados del análisis de regresión logística que se utilizó para modelar la asociación entre el aislamiento positivo a C. abortus y las variables categóricas. Únicamente el período de evaluación resultó significativo dentro del modelo ya que la evaluación durante el primer período favoreció un resultado negativo del aislamiento. En consecuencia, durante el segundo período de seguimiento se incrementó en 41.6 veces la posibilidad (OR=0.024, IC 95%: 0.002 a 0.299) de que las hembras tuvieran un diagnóstico positivo de clamidiosis con respecto al primer período. Dicho resultado pone de manifiesto la capacidad infecciosa de la bacteria, ya que el número de cabras positivas pasó de 2 a 17 en tan solo dos épocas consecutivas de partos.

Figura 3 Valores estimados de odds ratio obtenidos mediante análisis de regresión logística
binaria en las 32 hembras evaluadas durante dos períodos de
seguimiento. Se muestran los valores estimados y el intervalo de
confianza al 95% (IC 95%) tomando en cuenta como variable de
modelado el resultado positivo de C. abortus.
Figure 3. Odds ratio values found by binary
logistic regression analysis in the 32 goats included in the
longitudinal study, throughout two kidding periods. Values and 95%
confidence intervals are plotted taking a positive result for
C. abortus as the modelling outcome.
Conclusiones
Los resultados de la presente investigación evidencian la presencia de C. abortus en caprinos con problemas de aborto dentro de la región centro del estado de Sinaloa. La prevalencia encontrada en el presente estudio fue superior al promedio nacional y a los valores encontrados en rebaños caprinos evaluados en otros estados. Ambos resultados sugieren la importancia de realizar estudios epidemiológicos dentro de las zonas caprinas del estado de Sinaloa, para así tener un panorama más completo y preciso de la magnitud de la infección causada por C. abortus. Además, nuestros resultados también demostraron que los machos infectados pueden ser un factor de riesgo para diseminar la infección de forma venérea. Por otro lado, el incremento observado en la prevalencia de clamidiosis en el estudio de seguimiento sugiere que, en caso de no establecer medidas eficientes de detección y control de la enfermedad, la magnitud de la enfermedad puede incrementarse y con ello generar una mayor afectación en la salud y productividad de los animales infectados. Por ello es necesario implementar medidas para reducir la diseminación de la bacteria en los rebaños caprinos para así disminuir las pérdidas ocasionadas por los abortos.











 nova página do texto(beta)
nova página do texto(beta)



