Introduccion
Los Thraustochytridos (TH) son protistas marinos pertenecientes a la clase Labyrinthulomycetes del reino Chromista y se hallan dispersos en diferentes latitudes alrededor del mundo (Mar del Norte, océano índico, océano pacífico, mar de Tasmania y la Antártida). Estos microorganismos se caracterizan por producir aceites microbianos (SOCs) con un alto valor y diversos usos a nivel industrial (Raghukumar, 2008). Dentro de los ácidos grasos poliinsaturados (AGP) que producen destacan los omegas 3 y 6, los cuales tienen una amplia gama de usos en la industria farmacéutica, cosmética y de alimentos principalmente. En esta clasificación sobresalen principalmente ácido araquidónico (AA, C20:4n6), ácido eicosapentaénoico (EPA, C20:5n3), ácido docosapentaénoico (DPA, C22:5n6 y C22:5n3) y el ácido docosahexaénoico (DHA, C22:6n3). Los ácidos grasos omega 3(n3) y omega 6(n6) son componentes importantes de las membranas de las células y los precursores de muchas otras sustancias del organismo, como las que regulan la presión arterial y la respuesta inflamatoria. Cada vez hay más pruebas que indican que los ácidos grasos omega-3 protegen de las enfermedades cardíacas, y también se conoce su efecto antiinflamatorio importante contra estas enfermedades y muchas otras. Para la producción de AGP se han utilizado diversas fuentes de sustrato como glucosa, galactosa, fructosa, manosa, sucrosa (Shene et al., 2010), materia orgánica compleja (Bongiorni et al., 2005), biomasa proveniente de la celulosa (Hong et al., 2012) y últimamente hasta miga de pan (Thyagarajan et al., 2014). Además, con el fin de potenciar la producción de AGP también se han empleado diversos aditivos y/o suplementos como el aceite de linaza (Gaffney et al., 2014) y elementos traza como el hierro y el zinc (Nagano et al., 2013).
Los TH han ganado importancia en los últimos 25 años, ya que han generado beneficios aplicables a la biotecnología dado su potencial uso en la obtención y producción de biodiesel y AGP del tipo omega 3 y 6, particularmente DHA (ácido docosahexaenoico), EPA (ácido eicosapentaénoico) y DPA (ácido docosapentaénoico) (Gupta et al., 2012). Estos son conocidos también por secretar enzimas, polisacáridos, carotenoides, escualeno y coenzimas (Armenta et al., 2006). Una cepa comercial, Schizochytrium limacinum SR21, ha sido empleada por investigadores para producir AGP, utilizando glicerol derivado del biodiesel y licor de maíz; en otros casos cepas han utilizado nutrientes orgánicos provenientes de las aguas residuales de las destilerías, plantas de soya, residuos líquidos de procesos de producción de la cerveza, cáscaras de papa y jugo de sorgo (Zhu et al., 2008; Quilodrán et al., 2009; Ethier et al., 2011). Últimamente, también se están empleando medios a base de algas verdes y pardas (Pino et al., 2015).
En forma general, la glucosa ha sido la mayor fuente de carbono utilizada en los procesos fermentativos, obteniéndose altos rendimientos de biomasa y productividad de lípidos en comparación con otras fuentes de carbono (Burja et al., 2006; Beopoulos et al., 2009; Gupta et al., 2012). Sin embargo, en los últimos 10 años el glicerol crudo (GC) está siendo usado como una fuente alterna de carbono en lugar de la glucosa, debido a que es un compuesto abundante, de menor costo comparado con la glucosa y que se genera como subproducto en una gran variedad de procesos productivos. Justamente en la producción de biodiesel se obtiene GC, el cual puede ser utilizado como fuente de carbono para obtener metabolitos primarios, dando de esta forma un valor agregado al subproducto obtenido en la refinación del biodiesel (Abad, 2012; Chang et al., 2015; Silva et al., 2015).
En este estudio, se utilizaron 2 cepas de TH (VAL-B1 y EMA-T5) pertenecientes a la misma especie (Thraustochytrium kinnei) pero aisladas de dos zonas costeras diferentes (centro y Antártida chilena), y se produjeron en GC y GP con el fin de comparar y ver si hay alguna influencia significativa en su crecimiento y producción de AGP. Se analizaron tres concentraciones de GC, se obtuvo la producción de biomasa y omega 3 y 6, y los resultados obtenidos se compararon contra muestras crecidas en glicerol puro (GP) a los mismos valores de concentración.
Materiales y metodos
El glicerol usado de 99,9 % pureza (GP) fue obtenido de Sigma-Aldrich (USA) y el glicerol crudo (GC) se obtuvo de la producción de biodiesel a partir de aceite de soya. Glutamato de sodio y extracto de levadura se obtuvieron de Becton, Dic- kinson and Co. (USA), el agar y peptona fueron conseguidos comercialmente de Oxoid (UK). Estreptomicina y penicilina fueron adquiridas a Calbiochem (Canadá). La ADN polimerasa fue obtenida de Biotools B&M Labs (SA, España). El polen de pino fue recolectado de Pinus radiata, autoclavado y almacenado a condiciones de oscuridad y sequedad. El estándar de ácidos grasos empleado fue Supelco 37 Component FAME Mix, Varied conc. en diclorometano (Supelco, Sigma-Aldrich, USA). Todas las muestras trabajadas fueron preparadas con agua natural de mar filtrada (ANM) ajustada a un pH de 6,8.
Cepas de TH
Thraustochytrium kinnei VAL-B1 y EMA-T5 fueron aisladas de agua marina en la costa chilena de la ciudad de Valparaíso (Centro, 33°03′47″S) y la antártica chilena (Sur, 75°00′30″S). Durante el período de muestreo la salinidad y temperatura del agua fue de 34,4 ppm y 16°C en Valparaíso y 33 ppm y 3°C en la antártica, lo cual muestra condiciones de adaptación diferenciada para cada cepa aislada. El aislamiento se llevó a cabo empleando el método de polen de pino (Gaertner, 1968; Bremer, 2000), con el cual se obtienen buenos resultados. Se toman 10 mg de polen de pino y se añaden a la muestra de agua (10 mL) manteniéndose por un período de 7 días a una temperatura de 25°C. Los granos de polen con los microorganismos adheridos son separados por filtración (filtro de nailon, 20 μm) y esparcidos sobre una placa de Petri con agar B: extracto de levadura (EL) 2 g/L, peptona (PEP) 2 g/L, agar 10 g/L, glucosa 5 g/L y sales en agua ANM preparada a una concentración final de 70 % p/v que contiene 300 mg/L de antibióticos (sulfato de estreptomicina y penicilina G) respectivamente, para evitar la proliferación de bacterias. Las placas fueron incubadas a 25°C hasta obtener colonias visibles. Luego colonias individuales fueron subcultivadas de nuevo en placas con agar B hasta obtener aislados puros, los cuales fueron comprobados por inspección en microscopio óptico (Zeiss, Estándar 20, Alemania), tal y como se aprecian en la figura 1.
Identificación genética
Las células colectadas desde las placas de agar fueron suspendidas en agua destilada (200 μL) y centrifugadas (8000 xg, 5 min. a 4°C). El precipitado fue re suspendido con buffer de lisis (200 μL; 0,25 MTris-Cl; 0,1 M Na2-EDTA; 2 % p/v SDS; 0,1M NaCl a pH 8,2). El ADN fue extraído con fenol/cloroformo/alcohol isoamílico y precipitado con etanol. Los fragmentos de ADN secuenciados (ABI-3100, Applied Biosystem, California, USA) con números de acceso KF718865 y KF709393 fueron comparados con los disponibles en la base de datos de GenBank (Nacional Center for Biotechnology Information, USA: NCBI página http://www.ncbi). Las secuencias determinadas en este trabajo fueron alineadas con otras secuencias del gen que codifica para el ARN de la subunidad pequeña ribosomal 18S rRNA de organismos relacionados, obtenidas desde el Banco de Genes NCBI, utilizando el programa Clustal X (http://www-igbmc.u-strasbg.fr/BioInfo/). Para las dos cepas identificadas, hubo un 99 % de coincidencia con Thraustochytrium kinnei de los fragmentos secuenciados.
Condiciones de cultivo
El inóculo se preparó transfiriendo células de la placa de agar en 50 mL de medio estéril B2 (para 1 L: glicerol, 10 g, EL, 2 g, glutamato de sodio (GS), 2 g y ANM filtrada a una concentración final de 70 % p/v). Se incubaron matraces de 250 mL por 48 h a 25°C con agitación orbital a 180 rpm. El material obtenido se utilizó para inocular (10 % v/v, densidad óptica del inóculo 0,4 a 600 nm) los fermentadores de 1 L que contenían 900 mL de medio, durante 7 días. Los experimentos con el GP y GC se trabajaron con valores de concentración de 1,10 y 20 g/L, empleándose un control. Las soluciones con la fuente de carbono y nitrógeno fueron esterilizadas separadamente (121 °C, 15 min.) y mezcladas para obtener la concentración requerida. Después de la esterilización, el pH del medio fue ajustado (con HCl o NaOH) a 6,8. Los datos empleados para realizar la curva de crecimiento se obtuvieron de cada fermentador utilizado cada 24 h. Los resultados corresponden al promedio de experimentos realizados por triplicado.
Cuantificación de biomasa
La biomasa fue separada por centrifugación (6000 xg, 15 min a 4 °C); el precipitado fue lavado tres veces con agua des ionizada y liofilizado, determinándose gravimétricamente la concentración de biomasa seca. Las muestras se guardaron a -20 °C para posteriormente extraer los AGP. Los resultados obtenidos fueron el promedio de experimentos realizados por triplicado.
Cuantificación de AGP
Las muestras de biomasa liofilizada (30 a 50 mg) fueron empleadas para extraer los AGP por transesterificación directa. Los AGP extraídos con hexano fueron separados por centrifugación (4000 g y 20 °C) y cuantificados por cromatografía gaseosa (Agilent, 7890A) equipado con columna capilar DB-23 (60 m de largo, 0,25 mm de diámetro y 0,25 μm de espesor) empleando el software ChemStation. La temperatura de la columna fue programada desde 50 °C hasta 260 °C con una velocidad de incremento de 10 °C/min. Se utilizó detector de ionización de llama (FID) con gas helio como transportador (200 °C). El inyector se mantuvo a 250 °C y el volumen de inyección fue de 1 μL. Los picos de los metil esteres ácidos grasos (FAMEs) fueron identificados y cuantificados utilizando un estándar de ácidos grasos (Supelco 37 Component FAME Mix, Sigma Aldrich, USA). De igual forma se empleó como estándar interno en la muestra, metil éster ácido tricosiánoico, C23:0 (Sigma Aldrich, USA).
Análisis estadístico
Los datos fueron sometidos en un análisis de varianza (ANOVA) y las diferencias significativas se identificaron mediante la prueba de comparación entre las medias con un nivel de significación del 5 % (p ˂ 0.05). Antes de realizar ANOVA fue necesario comprobar si los datos tenían correlación y sus variaciones tendieran a ser igual. Muestras por triplicado se realizaron a lo largo de toda la experimentación. Los análisis estadísticos se llevaron a cabo empleando el software SigmaPlot 10.0 (Systat Software Inc., Chicago, IL). Los resultados fueron expresados como medias ± SD (desviación estándar) para cada experimento.
Resultados y discusión
Producción de biomasa
Los resultados para los cultivos de VAL-B1 y EMA-T5 empleando GP y GC se pueden apreciar en la Figura 2. En ambos casos se ve que los mayores valores de producción de biomasa se obtienen al usar GC como sustrato con una concentración de 20 g/L, siendo el quinto día el de mayor crecimiento (VAL-B1: 6,033 g/L y EMA-T5: 6,984 g/L). Al comparar estos resultados con los obtenidos usando GP a 20 g/L, se nota que la producción de biomasa es mayor en más de 400 %, representando una diferencia significativa en la transformación de la fuente de carbono. También se aprecia, que a medida que aumenta la concentración del sustrato en cada una de las fuentes de glicerol, el crecimiento celular de los microorganismos también tiende a incrementarse. La razón de este comportamiento está dada por el hecho de que los TH aprovechan de mejor forma la mayor presencia de nutrientes en los residuos, como es el caso del GC, versus lo que pueden transformar al emplear el GP. Scott et al. (2011), generaron 31,66 g/L de biomasa al quinto día de cultivo, usando GC con la cepa Thraustochytrium sp. ONCT18. Pyle et al. (2008), obtuvieron 8,1 g/L de masa celular al emplear la cepa S. limacinum SR-21 (ATCCMYA-1381) usando GC obtenido a partir de biodiesel del aceite de soya. Raghukumar (2008), usando A. limacinum obtuvo 22,1 g/L empleando GC en un cultivo batch y Silva et al. (2015), obtuvieron 14,1 g/L al emplear la cepa AS4-A1 Ulkenia sp. de la misma fuente anterior. Por tal razón, se corrobora que al utilizar GC como sustrato residual y fuente de crecimiento para los TH, se obtienen mayores valores de producción de biomasa que al emplear como fuente pura de carbono GP, donde los TH sólo se valen del único componente presente en el sustrato, versus la variedad que se puede encontrar en un componente residual.
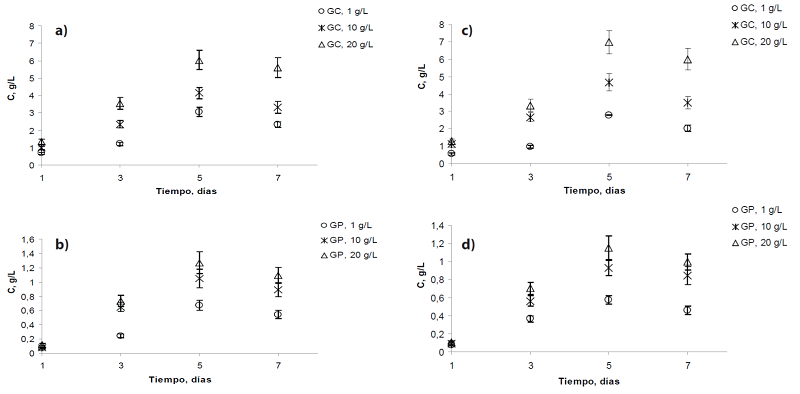
Figura 2 Crecimiento de biomasa para cepas de TH en función del tiempo (a) VAL-B1 en GC; (b)
VAL-B1 en GP; (c) EMA-T5 en GC y (d) EMA-T5 en GP. C: concentración
de biomasa, GC: glicerol crudo y GP: glicerol puro. Datos expresados
son medidas de tres réplicas ± desviación estándar para cada
experimento (p ˂ 0.05).
Figure 2. TH strains biomass growth as a function of
time (a) VAL-B1 in GC; (b) VAL-B1 in GP; (c) EMA-T5 in GC and (d)
EMA-T5 in GP. C: biomass concentration, GC: crude glycerol and GP:
pure glycerol. Data expressed are measures of three replicates ±
standard deviation for each experiment (p ˂ 0.05).
Perfil de AGP
Los perfiles de AGP para cada una de las cepas crecidas tanto en GP como para GC se pueden ver en la Tabla 1. Los mayores valores en porcentaje de ácidos grasos totales (AGT) para ambas cepas, se obtuvieron para DHA y EPA, al hacer crecer los cultivos en GP y empleando una concentración de 20 g/L. En el caso de VAL-B1 los valores de los perfiles de DHA y EPA estuvieron por encima del 50 % y 8 % respectivamente y para EMA-T5 se obtuvo valores superiores al 43 % y 8 % para los mismos AGP. Algo importante es la presencia del DPAn6 en ambos casos con valores por encima de 1 %, dado que este ácido graso poliinsaturado de cadena muy larga es un precursor en la generación del DHA y por tal razón podría estar aportando en los valores finales de la obtención del DHA (Gupta et al., 2012; Armenta y Valentine, 2013). Al usar GC como sustrato en el crecimiento de las dos cepas de Thraustochytrium kinnei, se aprecia al igual que cuando se emplea GP, que a medida que aumenta la concentración en el medio de cultivo también se incrementa el perfil de los AGP. Al respecto, se puede decir que los mayores valores en porcentaje en p/p base seca de AGT para DHA y EPA se dan al usar 20 g/L de GP. En este caso, se observa que tanto para VAL-B1 como para EMA-T5 los valores de composición para DHA y EPA están por encima del 8 % y 40 % respectivamente, no habiendo diferencias significativas entre ambas cepas. Tanto para los cultivos crecidos en GP como en GC se nota que existe una correlación directa en el aumento de la producción de los AGP, a medida que se aumenta la concentración de sustrato en los respectivos cultivos (Pérez-García et al., 2011; Chang et al., 2013). Esto demuestra que los TH son capaces de aprovechar en forma eficiente el glicerol, tanto puro como crudo, con el fin de transformarlo en AGP con una alta importancia a nivel de procesos industriales (Beligon et al., 2016; Shene et al., 2018).
Tabla 1 Perfil de AGP para cepas VAL-B1 y EMA-T5 usando como sustrato GP y GC.
Cs: concentración de sustrato
Table 1. AGP profile for VAL-B1 and EMA-T5 strains
using GP and GC as substrate. Cs: substrate
concentration
| AGP | |||||||
|---|---|---|---|---|---|---|---|
| ARA | EPA | DPAn6 | DPAn3 | DHA | |||
| Cepas | Sustrato | Cs (g/L) | (% p/p base seca) | ||||
| 1 | 0,51±0,053 | 6,30±0,52 | 1,03±0,15 | 0,52±0,044 | 37,56±2,64 | ||
| GP | 10 | 0,61±0,067 | 7,73±0,59 | 1,09±0,19 | 0,63±0,056 | 41,99±3,92 | |
| 20 | 0,80±0,077 | 8,75±0,78b | 1,33±0,14 | 0,69±0,061 | 44,84±4,01 | ||
| EMA-T5 | |||||||
| 1 | 0,087±0,007a,A | 1,12±0,10 | 0,23±0,021 | 0,11±0,013 | 8,53±0,75 | ||
| GC | 10 | 0,23±0,016 | 2,14±0,23 | 0,54±0,047 | 0,43±0,045 | 9,34±0,83 | |
| 20 | 0,39±0,041 | 4,15±0,35B | 0,83±0,071 | 0,55±0,044 | 10,71±0,95 | ||
| 1 | 0,52±0,045 | 7,31±0,63 | 1,32±0,14 | 0,59±0,063 | 43,35±3,73 | ||
| GP | 10 | 0,77±0,053 | 7,73±0,59 | 1,66±0,17 | 0,74±0,086 | 48,47±4,90 | |
| 20 | 1,13±0,102a | 8,47±0,74b | 1,59±0,15 | 0,88±0,090 | 52,72±4,94d | ||
| VAL-B1 | |||||||
| 1 | 0,103±0,011 | 1,77±0,19 | 0,46±0,05 | 0,40±0,051 | 8,01±0,84d | ||
| GC | 10 | 0,33±0,034 | 2,16±0,34 | 0,62±0,07 | 0,50±0,063 | 9,10±0,94 | |
| 20 | 0,43±0,045 | 4,55±0,47B | 0,70±0,05 | 0,59±0,052 | 9,90±0,74 | ||
Datos expresados son medidas de tres réplicas ± desviación estándar para cada experimento (p˂.05). a-c Diferencias estadísticamente significativas para cada AGP (vertical). A-D Diferencias estadísticamente significativas entre Cs (horizontal).
Data expressed are measures of three replicates ± standard deviation for each experiment (p˂.05). a-c Statistically significant differences for each AGP (vertical). A-D Statistically significant differences between Cs (horizontal).
Otro aspecto tiene que ver con el hecho de que, aunque ambas cepas pertenecen a la misma especie, Thraus- tochytrium kinnei, provienen de habitas con condiciones climáticas muy diferentes. VAL-B1 fue aislada de la zona cen- tral chilena y EMA-T5 de la zona subantártica, donde existe una diferencia apreciable en la temperatura de sus aguas. No obstante, los valores obtenidos en el perfil de AGT para los diferentes AGP al usar GC como sustrato, no muestran diferencias significativas. Al usar GP tampoco existen diferencias apreciables en el caso del AA, EPA, DPAn6 y DPAn3, sin embargo al analizar el DHA se nota que hay un aumento en el % p/p base seca de la cepa VAL-B1 versus la EMA-T5, lo que podría explicarse en parte a que VAL-B1 tiene mejores condiciones ambientales de temperatura, salinidad, suministro de nutrientes y oxígeno en las aguas de la zona central versus las que puede tener EMA-T5 en las gélidas aguas de la zona subantártica (Rosa et al., 2011; Loperena et al., 2012; Caamaño et al., 2017).
Rendimiento y producción de omega 3 y 6
El rendimiento de ácidos grasos omega 3 y 6, aumenta al emplear GP como sustrato tanto en VAL-B1 como en EMA-T5 (Tabla 2). Para ambas cepas se obtienen los mayores valores de omega 3 en EPA y DHA. Sin embargo, el mayor rendimiento se da para DHA, donde con VAL-B1 se producen 91,80±8,78 mg/g siendo superior un 13,28 % con respecto a lo que se obtiene con EMA-T5. Es interesante indicar que, aunque ambas cepas pertenecen al mismo género y que su producción de biomasa en GP es muy similar, ya que no hay diferencia significativa, los valores de producción tanto en omega 3 y 6 favorecen más a VAL-B1. Por tanto, se puede decir que la biotransformación que realiza VAL-B1 del GP, presenta mayor afinidad de condiciones que las que tiene EMA-T5, dado que ella no se halla en su entorno habitual de condiciones extremas, y por esta razón sus valores de producción de AGP son menores a los que se pudiesen encontrar, si efectivamente estuviera produciendo en las condiciones naturales de su hábitat. Estudios precedentes indican que cuando TH están sometidos a condiciones extremas, sean bajas temperaturas o altas concentraciones de salinidad, la forma en que ellos reaccionan a dicho estrés es produciendo más metabolitos primarios, en este caso AGP (Rosa et al., 2011; Loperena et al., 2012; Wang et al., 2019). No obstante, como los cultivos de EMA-T5 fueron trabajados en condiciones de temperatura de 25 °C y salinidad de 29 ppm, con una fuente de ANM enriquecida con sales específicas, esta puede ser la explicación de que los ácidos grasos omega 3 y 6 sean menores en comparación con lo producido por VAL-B1, que crece y está adaptada a las condiciones que se emplearon para los experimentos. Sin embargo, es de destacar, que el aprovechamiento que hacen tanto VAL-B1 como EMA-T5 de las dos fuentes de glicerol (GP y GC), presentan a lo menos valores similares o mayores rendimientos cuando se les compara con otras cepas de TH en la producción del EPA y DHA. Por ejemplo, con A. limacinum SR21 que usa GC, y que produce 22,1 g/L de biomasa y 32,2 mg/g, las dos cepas aquí estudiadas tienen un rendimiento mayor al 55 % para producir omega 3, con una cantidad de biomasa tres veces menor que la indicada (Raghukumar et al., 2008). Chang et al. (2015), uso 50 g/L de glicerol crudo con Aurantochytrium sp. y obtuvo un rendimiento de 91 mg/g de DHA, valor que no está muy lejos del máximo obtenido con VAL-B1 que fue de 82,68 mg/g. En el caso de EPA, Thraustochytrium sp ONCT18 produce con GR 31,66 g/L de biomasa y tiene un rendimiento de 8,52 mg/g según lo indicado en el estudio de Scott et al. (2011); y las dos cepas estudiadas aquí con 4 veces menos de cantidad de biomasa tienen un rendimiento por encima de 80 % al producir este omega 3. Cuando se compara la producción de ácidos grasos omega 6 de EMA-T5 con las de otras especies de TH, se aprecian valores similares de rendimiento (10-13 mg/g) al usar GP como fuente de carbono en los cultivos (Adarme-Vega et al., 2014; Gupta et al., 2015; Singh et al., 2015).
Tabla 2 Rendimiento y producción de omega 3 y 6 con GP y GC, empleando 20 g/L de
Cs al 5to día de cultivo.
Table 2. Omega 3 and 6 yield and production with GP and
GC, using 20 g / L of Cs at day 5 of culture.
| Omega 3 y 6 | VAL-B1 | VAL-B1 | EMA-T5 | EMA-T5 |
|---|---|---|---|---|
| GC | GP | GC | GP | |
| Rendimiento (mg a. graso / g biomasa) | ||||
| DPAn6 | 9,24±0,75 | 35,34±2,02b | 7,32±0,83 | 10,15±1,12d |
| DPAn3 | 6,12±0,56 | 20,31±1,84b | 5,76±0,79 | 6,01±0,98d |
| AA | 9,36±1,23 | 26,77±1,93b,c | 7,92±0,91 | 13,2±2,24d |
| EPA | 61,2±5,12a | 71,14±6,73 | 34,68±4,46c | 53,63±3,34 |
| DHA | 82,68±5,68 | 91,80±8,78b | 66,6±7,54c,d | 79,6±4,96 |
| Producción (mg a. graso / L cultivo) | ||||
| DPAn6 | 55,74±3,34 | 44,96±2,12 | 51,12±7,11 | 38,48±2,92D |
| DPAn3 | 36,92±2,48 | 25,83±1,63 | 40,23±5,02 | 28,91±3,89 |
| AA | 56,47±3,23 | 34,06±2,46B | 55,31±6,34 | 15,22±1,76D |
| EPA | 369,22±18,46A | 217,7±10,23 | 242,21±23,22 | 121,48±12,15D |
| DHA | 498,81±34,94 | 1167,71±70,88B | 465,13±41,57 | 633,39±73,33D |
Datos expresados son medidas de tres réplicas ± desviación estándar para cada experimento (p˂.05).
a-d Diferencias estadísticamente significativas para el rendimiento de cada omega 3 y 6. A-D Diferencias estadísticamente significativas para la producción de cada omega 3 y 6.
Data expressed are measures of three replicates ± standard deviation for each experiment (p˂.05). a-d Statistically significant differences for the performance of each omega 3 and 6. A-D Statistically significant differences to produce each omega 3 and 6.
La producción de omegas 3 y 6, presenta un comportamiento diferente al hallado en los datos de rendimiento. Al comparar el GC versus el GP en las dos cepas estudiadas, los valores tienden a disminuir en la mayor parte de los omegas (contrario a lo que presento el rendimiento), excepto en el caso de la omega 3 DHA donde se nota una alta producción comparado con el GC, obteniéndose un valor máximo de producción de 1167,71 ± 70,88 mg/L con VAL-B1 al utilizar GP como sustrato. En el caso de EMA-T5 hay un aumento del 26,56 % al comparar el GP con el GC, sin embargo, aunque el valor de producción de DHA es alto - 633,39 ± 73,33 mg/L- con GP, este valor es menor al compararlo con el de VAL- B1 (ver Tabla 2). Un estudio realizado por Ethier et al. (2011), empleando S. limacinum SR21 con una concentración de GP de 90 g/L en un cultivo continuo, produjo 1740 mg/L de DHA, un valor cercano a lo reportado por Pyle et al. (2008) quién obtuvo 1630 mg/L de DHA usando la misma cepa con GC obtenido de la producción de biodiesel a partir de aceite de soya como sustrato y mayor un 49 % que lo reportado en este estudio con VAL-B1 creciendo en GP.
No obstante, la alta producción de DHA que obtuvieron Ethier et al. (2011), difiere significativamente de los máximos valores que reportaron Huang et al., 2012, en donde A. limacinum SR21 produjo 20300 mg/L empleando 50 g/L de GP y usando un cultivo continuo.
Porcentaje total de AGP omega 3 y 6
Las cepas al crecer en GP generaron mayores cantidades de omega 3 y 6, destacándose el DHA producido por VAL-B1 con valores por encima del 52 % de AGT (ver Figura 3). En el caso de la omega 6, el DPAn6 obtenido en GP con la cepa anterior fue el más alto con un valor de 1,59 % de AGT. Al tomar en conjunto el contenido total de omega 3, tanto VAL-B1 como EMA-T5 presentan valores de porcentaje total de ácidos grasos por encima del 50 %, destacando que VAL- B1 produce 62,07 % lo cual es un valor representativo cuando se compara con otras cepas usando el mismo sustrato. Chang et al. (2015), reportó un valor total de omega 3 de 53 % AGT usando Aurantochytrium sp. con GP a una concentración de 4 % (p/v), obtuvo además 49 % AGT omega 3 empleando Thraustochytrium sp a la misma concentración de GP y 20 % AGT omega 3 con Ulkenia sp. a las mismas condiciones de GP. Singh et al. (2015), empleo GP al 3 % (p/v) y obtuvo 47 % DHA en cultivos con Schizochytrium sp. S31 al séptimo día, valor superior 3 veces al obtenido con EMA-T5 en este estudio para omega 3 DHA con 15,41 % AGT (ver Figura 3). Caso contrario a lo anterior, Chang et al. (2015), obtuvo con GC y empleando Aurantochytrium sp. mayores valores para omega 3 que los que reportó Singh et al. (2015), por encima del 50 % para dos cepas de la misma familia. En este caso, dichas cepas de TH presentaron condiciones de adaptación distintas, ya que fueron aisladas y crecidas con otros valores de temperatura y salinidad.

Figura 3 Contenido total de omegas 3 y 6 en cepas de VAL-B1 y EMA-T5 en concentración de
sustrato de 20 g/L para GP y GC. Omega 3: DHA, EPA y DPAn3, y Omega
6: AA y DPAn6.
Figure 3. Total content of omegas 3 and 6 in VAL-B1 and
EMA-T5 strains at a substrate concentration of 20 g / L for GP and
GC. Omega 3: DHA, EPA and DPAn3, and Omega 6: AA and DPAn6.
Además de lo anterior, Chi et al. (2007), reportó con Schizochytrium limacinum un contenido de DHA de 33,6 % empleando GC obtenido de biodiesel industrial, siendo superior al reportado por Pyle et al. (2008), quién obtuvo 24,5% de DHA con la misma cepa y sustrato. No obstante, Singh et al. (2015), empleo GP al 3 % (p/v) con Schizochytrium sp. S31 suplementado con hidroxitolueno butilado, y obtuvo un 54,76 % más de DHA que Chi et al. (2007), y el mismo valor obtenido en este estudio con VAL-B1 y GP (52 % AGT de DHA).
Los porcentajes totales de AGP omega 3 en esta investigación, empleando GP son muy similares a los obtenidos en otros estudios, lo cual indica que dicho sustrato es aprovechado de igual forma por varias especies de TH y que efectivamente hay una afinidad importante por esta fuente de carbono. GC es una alternativa interesante, ya que es un subproducto que puede emplearse para obtener omega 3 y 6 de una fuente que no sea pura y aprovechar el menor costo que podría tener en un proceso productivo.
Conclusiones
Las dos cepas de Thraustochytriumkinnei analizadas en este estudio produjeron mayor cantidad de biomasa cuando utilizaron GC como su fuente de sustrato en comparación con el GP. EMA-T5 destaco al generar 6,984 ± 0,66 g/L al día 5 de crecimiento y con una concentración de GC de 20 g/L. El perfil de AGP en GP en ambos casos indico que el ácido graso más abundante fue el DHA, donde VAL-B1 obtuvo un 52,72 ± 4,94 % AGT en base seca, siendo igualmente el omega 3 presente mayoritariamente cuando se emplea GC. Tanto el rendimiento como producción de omega 3 y 6 obtuvo sus mejores resultados con VAL-B1 y empleando GP, donde los mayores valores arrojaron 91,80 ± 8,78 mg DHA / g biomasa y 1167,71 ± 70,88 mg DHA / L de cultivo, siendo en general los omegas 3 los más abundantes. Respecto al porcentaje total de AGP de igual manera los omegas 3 son los que están presentes en mayor proporción cuando se compara las dos cepas, donde VAL-B1 destaca con 62,07 % al emplear GP.
Estos resultados permiten concluir que las dos cepas del género Thraustochytrium kinnei emplean eficientemente la fuente pura (GP) y cruda (GC), para producir omega 3, pero destaca principalmente la biotransformación que realiza VAL-B1 al usar de mejor manera el GP sobre el GC.











 nueva página del texto (beta)
nueva página del texto (beta)



