Introducción
Las infecciones fúngicas invasivas han aumentado desde la década de los 80´s en pacientes inmunosuprimidos por trasplante o portadores del virus de inmunodeficiencia humana, personas con tratamiento de quimioterapia, y aquellos que reciben terapias prolongadas con antibióticos de amplio espectro son vulnerables al desarrollo de este tipo de micosis (Santos et al., 2018).
Los microorganismos causantes de estas infecciones son las especies del género Candida, que forman parte de la microbiota y se localizan en la mucosa del tracto gastrointestinal, vagina e incluso la piel (Underhill y Iliev, 2014). Al presentarse las condiciones que favorecen su desarrollo, pueden pasar de causar una infección mucocutánea a ocasionar una candidemia debido a su adaptabilidad a los diferentes microambientes del huésped (Eggimann et al., 2003; da Silva et al., 2016).
Se han identificado más de 200 especies del género Candida, aunque alrededor de 31 producen enfermedades en el humano, de éstas más del 90% de las infecciones son causadas por C. albicans, C. glabrata, C. parapsilosis, C. kruzei y C. tropicalis (Eggimann et al., 2003). C. albicans es la especie que se aísla con mayor frecuencia en pacientes, pero en los últimos años se incrementó el número de infecciones por Candida spp. (Magalhães et al., 2015).
En Islandia, Finlandia, Noruega, Dinamarca, Estados Unidos de América y España C. glabrata se aísla de enfermos con candidemia en segundo lugar de frecuencia (Guinea, 2014). Un reporte en 2015 de la Secretaria de Salud sobre las Infecciones Asociadas a la Atención en la Salud (IAAS) de 378 unidades notificantes, reportó a C. glabrata dentro de los 20 principales agentes etiológicos de IAAS con 203 casos (SSA, 2015). Aunque, en México se carece de estudios epidemiológicos recientes y detallados que indiquen la prevalencia de C. glabrata en pacientes con candidemia (Pineda-Díaz et al., 2017).
C. glabrata es un patógeno emergente que tiene un mayor nivel de resistencia a los medicamentos para su tratamiento a base de azoles y equinocandinas en comparación con C. albicans (Horn et al., 2009). Las infecciones por C. glabrata se asocian con aumento en los días de estancia hospitalaria y por consecuencia a un mayor costo por su atención (Moran et al., 2010).
Debido a la resistencia que tiene C. glabrata a los medicamentos, se ha propuesto el uso de plantas medicinales que se han utilizado para diferentes padecimientos (Mahilrajan et al., 2014). Entre los países que utilizan la medicina tradicional se encuentran China, Brasil, Cuba, India, Jordania y México, por la riqueza y diversidad de su flora la cual puede tener diversas aplicaciones biológicas (Bakkali et al., 2008).
Existen reportes en plantas de la familia Asteraceae sobre la actividad biológica de los aceites esenciales extraídos de éstas. Un ejemplo es Chrysactinia mexicana A. Gray a quien se le han atribuido efectos como: afrodisiaco, antiespasmódico, antidiarreico, diurético, tónico, antipirético, antiinflamatorio y antifúngico (Cárdenas-Ortega et al., 2005; García-López et al., 2017). Sobre la actividad antifúngica del aceite esencial de C. mexicana fue utilizado por Cárdenas-Ortega et al. (2005) sobre Aspergillus flavus, microorganismo fitopatógeno que afecta al maíz. También existen reportes de extractos acuosos y metanólicos de C. mexicana sobre aislados clínicos de Escherichia coli, Shigella, Salmonella, Mycobacterium tuberculosis (Alanis et al., 2005: García-López et al., 2017).
Sin embargo, no hay reportes del aceite esencial de C. mexicana sobre hongos patógenos como C. glabrata, además es poco lo que se conoce sobre su posible mecanismo de acción, por lo tanto, es de interés evaluar el efecto del aceite esencial de esta planta sobre aislados clínicos de C. glabrata y de un hongo no patógeno de humanos como Saccharomyces cerevisiae, que es filogenéticamente más relacionado a C. glabrata (Castaño et al., 2006).
Materiales y métodos
Microorganismos utilizados
Las cepas empleadas en este estudio se presentan en la Tabla1. La identificación molecular de los aislados clínicos de C. glabrata se realizó por PCR de acuerdo a lo reportado en 2015 (Castaño et al., 2015).
Tabla 1 Cepas de levaduras empleadas en este estudio.
Table 1. Yeast
strains used in this study.
| Cepa | Microorganismo | Origen/Descripción | Referencia |
| BY4741 | S. cerevisiae | MATa his3Δ1 leu2Δ0 met15Δ0 ura3Δ0 | (Baker-Brachmann et al., 1998) |
| CBS138 | C. glabrata | ATCC2001 | (Dujon et al., 2004) |
| AN400 | C. glabrata | Aislado clínico de hemocultivo | Este estudio |
| NY62 | C. glabrata | Aislado clínico de urocultivo | Este estudio |
| NY66 | C. glabrata | Aislado clínico de exudado vaginal | Este estudio |
Medios de cultivo
Las células se cultivaron en medio de levadura estándar YPD (del inglés Yeast extract-Peptone-Dextrose). El medio líquido contenía 1% de extracto de levadura (BD Bioxon), 2% peptona (BD Bioxon) y 2% de glucosa (Fermont), el medio sólido se preparó al adicionar 2% agar (BD Bioxon).
Recolección de C. mexicana
C. mexicana (Asteraceae) en etapa de floración se recolectó en el mes de Julio del año 2016 en el camino a Guadalcázar municipio de San Luis Potosí en las coordenadas 22°36´30.2”N 100°26´50.2”O. El material vegetal fue autenticado con el código SLPM37571 y depositado en el herbario del Instituto de Zonas Desérticas de la Universidad Autónoma de San Luis Potosí.
Obtención del aceite esencial de C. mexicana
El material vegetal se secó a temperatura ambiente por 72 h, se separaron las flores, las hojas y las ramas secundarias; se trituraron y se realizó la molienda en seco para obtener una partícula de 1.75 mm para la homogenización de la muestra. El aceite esencial se extrajo por la técnica de destilación por arrastre de vapor, la técnica para separar el aceite esencial del agua floral fue la separación por densidades con un embudo de decantación (Cárdenas-Ortega et al., 2005).
Cromatografía de gases y espectrometría de masas
Para el análisis de la composición química del aceite esencial de C. mexicana extraídos de una mezcla de flores, las hojas y las ramas secundarias por destilación, se utilizó un cromatógrafo de gases (Agilent 7890B) equipado con una columna ZB-5MSi (30 m X 0.25 mm ID X 0.25 µm) y acoplado a un analizador de masas TQ 7000D Agilent Technologies. Como gas de arrastre se empleó helio a un flujo constante de 1.2 mL/min. Se inyectó 1 µL de una dilución de la muestra (1 µL de muestra en 199 µL diclorometano grado HPLC, Sigma-Aldrich) en modo “split” (16.7 mL/min) con el inyector a 250°C.
Las condiciones cromatográficas iniciaron con una temperatura de 50°C por 2 min, y se incrementó la temperatura 15°C por min hasta alcanzar 280°C, manteniendo ésta temperatura por 10 min. La temperatura de la interfase y fuente del EM fueron 250°C y 230°C, respectivamente. La detección de analitos se hizo en modo de barrido total del espectro (scan) de 30 a 500- m/z con un detector de IE. La identificación de los analitos fue realizada con la librería NIST (National Institute of Standards and Technology) versión 2.0D, NIST/EPA/NIH (NIST05) y con el uso de estándares sintéticos.
Determinación de la concentración mínima inhibitoria en la fase logarítmica o estacionaria de crecimiento del microorganismo con aceite esencial de C. mexicana
La CMI se determinó como la concentración más baja del aceite esencial de C. mexicana requerida para la inhibición completa del crecimiento de C. glabrata (Zore et al., 2011). A partir de un precultivo de C. glabrata de 48 h, se inocularon tubos falcon con 10 mL de medio YPD a una OD600nm 0.5. El control contenía o no dimetilsulfoxido (DMSO) al 1.25 % del volumen final (D8418 Sigma-Aldrich) del diluyente del aceite esencial, y se adicionaron las diferentes concentraciones del aceite esencial de C. mexicana que fueron desde 0.92mg/mL hasta 18.5mg/mL (ρ=0.9290 g/cm3) dependiendo de la cepa.
Los cultivos se incubaron a 28°C con agitación continua a 120 rpm durante 7 h en medio nuevo (fase logarítmica de crecimiento) o durante 3 h en medio recuperado de fase estacionaria (fase estacionaria de crecimiento), transcurrido el tiempo de incubación se determinó la densidad óptica y se ajustó a OD 600nm 0.5 en 1 mL de agua destilada estéril, posteriormente se lavaron las células y se centrifugaron a 13,000 rpm durante 30 s y se realizaron ensayos de microdilución (Cuéllar-Cruz et al., 2008) en placas de 96 pocillos y una alícuota de 180 µL se colocaron en cajas de petri con medio YPD agar durante 48 h.
Conteo de unidades formadoras de colonias
A partir del crecimiento observado de S. cerevisiae y C. glabrata en los ensayos de microdilución sobre YPD sólido fueron seleccionadas las diluciones donde el número de colonias eran contables y posteriormente de cada una de ellas se espatularon 25 µL sobre el medio YPD sólido. Se incubaron durante 48 h a 28°C para posteriormente realizar el conteo de las Unidades Formadoras de Colonias (UFC).
Análisis estadísticos
Se utilizó el programa estadístico GraphPad Prism V.5. Para la comparación de los diferentes tratamientos en cada cepa se hizo la prueba estadística de Shapiro-Wilk para después realizar la prueba ANOVA de una vía considerando el conteo de UFC como la variable de respuesta. Para evaluar la diferencia entre las medias de los grupos (IC=95 % y p=0.05) se utilizaron análisis post-hoc con la prueba de Tukey los cuales se presentan en las respectivas gráficas.
Predicción de los espectros de actividad para las sustancias
Se realizó un análisis in silico para la predicción de los espectros de actividad para las sustancias con los principales compuestos del aceite esencial para conocer el posible mecanismo de acción, con el software gratuitamente http://www.way2drug.com/RA . La estructura química se cargó con la herramienta de Marvin. Los resultados de la predicción muestran la estructura con los átomos numerados y una tabla con el espectro probable de la reacción de biotransformación. Este espectro se calcula mediante el software PASS, basado en el análisis SAR. La precisión promedio de la predicción en validación cruzada de LOO (IAP) es 0.86 mientras el valor este más cercano a 1 más posibilidad tiene de actuar de esa manera.
Resultados
Composición del aceite esencial de C. mexicana
La composición química del aceite esencial de C. mexicana se muestra en la Tabla 2, en donde se identificaron 26 compuestos. El aceite se caracterizó por la presencia mayoritaria de cinco compuestos: piperitona (29.58 %), eucaliptol (26.86 %), α-terpineol (14.65 %), delta-3-careno (12.37 %) y linalool (3.56 %).
Tabla 2 Compuestos identificados mediante CG-EM en el aceite esencial de C.
mexicana.
Table 2. Compounds
identified by GC-MS in the C. mexicana essential
oil.
| No. | Compuestos | Tiempo de Retención (min) | Abundancia Área del pico (٪) |
| 1 | alfa-pinene* | 4.980 | 0.058 |
| 2 | alfa-felandreno* | 5.257 | 1.393 |
| 3 | Camfeno | 5.438 | 0.820 |
| 4 | Benzaldehído | 5.589 | 0.025 |
| 5 | Sabineno | 5.745 | 0.528 |
| 6 | beta-pineno | 5.820 | 0.473 |
| 7 | Mirceno | 5.949 | 0.474 |
| 8 | alfa-terpineno | 6.301 | 0.678 |
| 9 | p-cimeno* | 6.379 | 2.349 |
| 10 | Eucaliptol* | 6.497 | 26.863 |
| 11 | Delta-3-careno | 6.611 | 12.368 |
| 12 | gamma-terpineno | 6.762 | 0.469 |
| 13 | Terpinoleno | 7.138 | 0.198 |
| 14 | Linalool* | 7.210 | 3.564 |
| 15 | Fenil acetato de metilo | 8.072 | 0.209 |
| 16 | Terpinen-4-ol | 8.117 | 0.229 |
| 17 | Alfa-terpineol* | 8.236 | 14.654 |
| 18 | Cis-3-hexenil isovalerato | 8.639 | 0.064 |
| 19 | Piperitona* | 8.925 | 29.576 |
| 20 | Indole | 9.255 | 0.243 |
| 21 | Metil antranilato | 9.641 | 0.162 |
| 22 | Eugenol | 9.849 | 0.538 |
| 23 | Cis-jasmone | 10.142 | 0.412 |
| 24 | beta-cariofileno | 10.448 | 1.153 |
| 25 | Valenceno | 10.838 | 1.190 |
| 26 | Acetato de guayilo | 11.646 | 1.629 |
*Compuestos verificados con estándares
Efecto del aceite esencial de C. mexicana sobre S. cerevisiae y C. glabrata en la fase logarítmica de su crecimiento
Para la cepa de S. cerevisiae la CMI fue de 3.71 mg/mL, esta concentración es menor respecto a la utilizada en las cepas de C. glabrata. Para las cepas CBS138, NY66, AN400 y NY62 la CMI fue de 4.64 mg/mL, 6.5 mg/mL, 8.36 mg/mL y 18.5 mg/mL respectivamente (Figura 1).
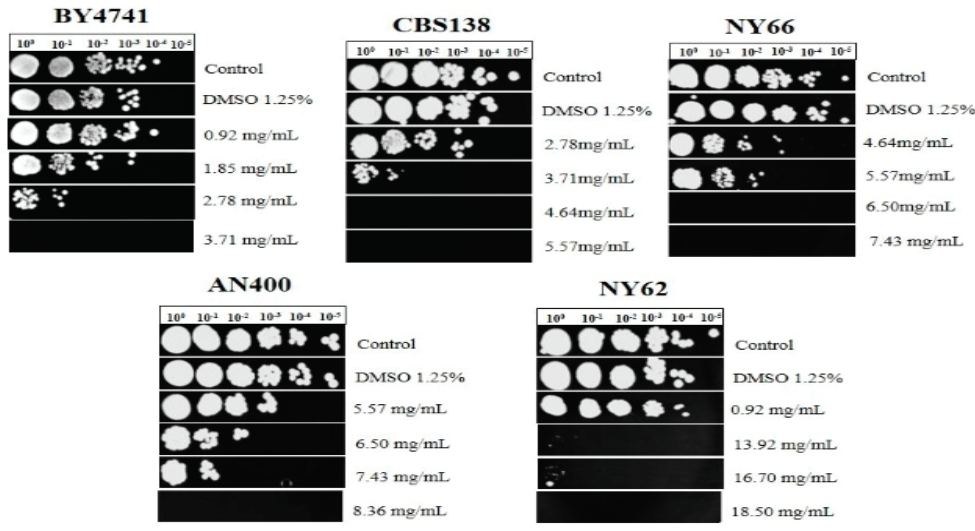
Figura 1 Efecto del aceite esencial de C. mexicana sobre S.
cerevisiae y C. glabrata en la fase
logarítmica de crecimiento. Ensayo de microdilución (100 a la 10-5).
BY4741: cepa de S. cerevisiae. Cepas de C.
glabrata; CBS138: Cepa ATCC. NY66: aislado clínico de
exudado vaginal. AN400: aislado clínico de hemocultivo. NY62:
aislado clínico de urocultivo. Líneas: crecimiento de la cepa sin
diluyente y sin aceite esencial (control), con diluyente (DMSO 1.25
%) y sin aceite esencial [controles]; con las diferentes
concentraciones del aceite esencial (mg/mL). Incubación de 48 h
sobre medio YPD agar a 28°C. Los ensayos se realizaron 5 veces.
Figure 1. Effect of C.
mexicana essential oil on S.
cerevisiae and C. glabrata growth at
the logarithmic phase.
Con base en el conteo de UFC, se realizó la prueba estadística de ANOVA para determinar la diferencia de las medias de las cepas utilizadas con las distintas concentraciones de aceite esencial en la fase logarítmica de crecimiento. Se observa que en todas las cepas utilizadas hay una diferencia estadísticamente significativa (p=0.001) entre los controles con la CMI determinada por el crecimiento sobre agar sólido. En los controles sin y con diluyente no hay diferencia estadística (Figura 2).

Figura 2 Análisis de ANOVA del efecto del aceite esencial de C. mexicana sobre
S. cerevisiae y C. glabrata en
fase logarítmica de crecimiento. BY4741: cepa de S.
cerevisiae. Cepas de C. glabrata;
CBS138: Cepa ATCC. NY66: aislado clínico de exudado vaginal. AN400:
aislado clínico de hemocultivo. NY62: aislado clínico de urocultivo.
En el eje de las X se observa las diferentes concentraciones del
aceite esencial probadas, mientras que en el eje de las Y las
Unidades Formadoras de Colonias (UFC). Los ensayos se realizaron 5
veces. Los corchetes con asteriscos arriba de las barras se muestran
solo en las comparaciones entre tratamientos que tuvieron
diferencias significativas (**p=0.01) o altamente significativa
(***p=0.001).
Figure 2. ANOVA analysis of
the effect of C. mexicana essential oil on
S. cerevisiae and C. glabrata
growth at the logarithmic phase.
Efecto del aceite esencial de C. mexicana sobre S. cerevisiae y C. glabrata en la fase estacionaria de su crecimiento
En la fase estacionaria de crecimiento se encontró que en S. cerevisiae la CMI fue 2.78 mg/mL, para la cepa CBS138 la CMI fue de 6.50 mg/mL esta concentración fue la misma que para la cepa NY66 y la cepa AN400, sin embargo, para el aislado clínico NY62 la CMI fue mayor con 9.29 mg/mL (Figura 3).
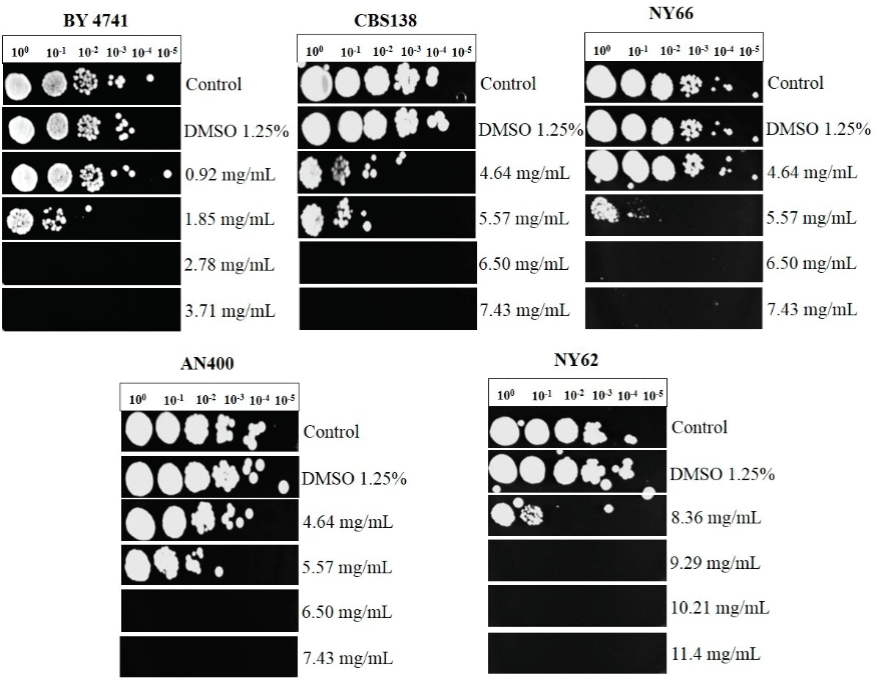
Figura 3 Efecto del aceite esencial de C. mexicana sobre S.
cerevisiae y C. glabrata en fase
estacionaria de crecimiento. Ensayo de microdilución (100 a la
10-5). BY4741: cepa de S. cerevisiae. Cepas de
C. glabrata; CBS138: Cepa ATCC. NY66: aislado
clínico de exudado vaginal. AN400: aislado clínico de hemocultivo.
NY62: aislado clínico de urocultivo. Líneas: crecimiento de la cepa
sin diluyente y sin aceite esencial (control), con diluyente (DMSO
1.25 %) y sin aceite esencial [controles]; con las diferentes
concentraciones del aceite esencial (mg/mL). Incubación de 48 h
sobre medio YPD agar a 28°C. Los ensayos se realizaron 5 veces.
Figure 3. Effect of C.
mexicana essential oil on S.
cerevisiae and C. glabrata growth at
the stationary phase.
Los análisis estadísticos indican que entre el control sin diluyente y el que tenía DMSO al 1.25 % no hay una diferencia estadísticamente significativa, por lo cual, el diluyente no afecta el crecimiento de las células. Un dato importante es que en todas las cepas hubo diferencia entre los controles y las concentraciones de aceite esencial de C. mexicana probados. Aunque para la cepa de S. cerevisiae, el aislado NY66 y el aislado NY62, la segunda concentración utilizada, ya no muestra diferencias estadísticas respecto a la concentración anterior probada (Figura 4).

Figura 4 Análisis de ANOVA del efecto del aceite esencial de C. mexicana sobre
S. cerevisiae y C. glabrata en
fase estacionaria de crecimiento. BY4741: cepa de S.
cerevisiae. Cepas de C. glabrata;
CBS138: Cepa ATCC. NY66: aislado clínico de exudado vaginal. AN400:
aislado clínico de hemocultivo. NY62: aislado clínico de urocultivo.
En el eje de las X se observa las diferentes concentraciones del
aceite esencial probadas, mientras que en el eje de las Y las
Unidades Formadoras de Colonias (UFC). Los ensayos se realizaron 5
veces. Los corchetes con asteriscos arriba de las barras se muestran
solo en las comparaciones entre tratamientos que tuvieron
diferencias significativas (**p=0.01) o altamente significativa
(***p=0.001).
Figure 4. ANOVA analysis of the
effect of C. mexicana essential oil on S.
cerevisiae and C. glabrata in the
stationary growth phase.
Predicción de los espectros de actividad para las sustancias
Con base a la predicción de los espectros, se propone el siguiente mecanismo de acción con los compuestos mayoritarios (Figura 5). La piperitona fue el compuesto en mayor porcentaje en el aceite esencial que se encontró y que inhibe la actividad de la fosfatasa con un valor (Potencial Inhibidor) PI=0.783, y que también tiene un efecto como probable inhibidor de la ubiquinol-citocromo-c reductasa con PI=0.873, al igual que el eucaliptol con un valor PI=0.760.

Figura 5 Mecanismo de acción propuesto de los principales compuestos del aceite esencial de
C. mexicana. Se muestran los principales
componentes piperitona, eucaliptol, linalool, delta-3-careno,
α-terpineol y su posible efecto sobre las células de C.
glabrata al pasar la pared celular. Como inhibidor de
la enzima acido grasa sintasa se encuentra el linalool. Como
inhibidor de la enzima fosfatasa el compuesto piperitona y el
delta-3-careno. Como inhibidor de la Ubiquinol-citocromo-c-
reductasa se encuentran la piperitona, eucaliptol, delta-3-careno y
el α-terpineol. Elaboración propia con el programa biorender.
Figure 5. Proposed mechanism of action of
the main essential oil compounds of C.
Mexicana.
El linalool tiene un valor de PI=0.868 como inhibidor de la ácido grasa sintasa, el delta-3-careno también inhibe la ubiquinol-citocromo-c reductasa con PI=0.800 al igual que el compuesto α-terpineol con un PI=0.775.
Discusión
Se ha demostrado que aislados clínicos de C. glabrata presentan resistencia moderada a los azoles y equinocandinas, estos pueden volverse más resistentes después del uso de los fármacos (Jiang et al., 2013). Aunque la información del mecanismo de acción de los aceites esenciales en hongos es limitada en comparación con los reportes en bacterias, se ha señalado que la actividad de los aceites esenciales en levaduras se debe al daño ocasionado en alguno de los sistemas enzimáticos involucrados en la producción de energía y síntesis de componentes de la estructura celular (Hyldgaard et al., 2012; Nazzaro et al., 2013).
Las concentraciones del aceite esencial de C. mexicana para inhibir el crecimiento de S. cerevisiae y C. glabrata son mayores que las reportadas por Cárdenas-Ortega et al. (2005) para Aspergillus flavus, una posible explicación es que la metodología utilizada es diferente ya que en ese estudio utilizaron el método de difusión en agar. Además, se ha planteado que los mamíferos como el ser humano son altamente resistentes a enfermedades fúngicas invasivas como la provocada por C. glabrata de allí que los microorganismos fúngicos patógenos del ser humano sean más resistentes a los medicamentos que los fitopatógenos ya que deben cumplir cuatro criterios: 1) poder crecer a altas temperaturas (>37°C); 2) penetrar las barreras de los tejidos del huésped; 3) digerir y absorber componentes de los tejidos humanos y la más importante 4) evadir y resistir el sistema inmune humano (Köler et al., 2015). Es importante mencionar que S. cerevisiae es una levadura que no ocasiona enfermedades en el ser humano, sin embargo, es más cercana filogenéticamente a C. glabrata que a C. albicans.
La CMI de aceite esencial de C. mexicana en la cepa CBS138 durante la fase estacionaria fue más elevada que en fase logarítmica, lo anterior coincide con lo reportado por Jakubowski et al. (2000) quienes determinaron que las bacterias y hongos en la fase estacionaria son más resistentes al estrés oxidativo. Lo anterior se debe a que utilizan diferentes mecanismos enzimáticos en comparación con la fase logarítmica, ya que una vez que la célula entra en fase estacionaria deja de dividirse y la actividad metabólica se reduce, además de que activa distintas rutas metabólicas mediante genes que codifican para enzimas antioxidantes como catalasas, super-oxido dismutasa y síntesis de glutatión (Jakubowski et al., 2000).
La concentración del aceite esencial utilizada en los aislados clínicos AN400, NY62 y NY66 fue diferente con relación a las cepas de referencia (laboratorio), ya que las CMIs en los aislados fue mayor en fase logarítmica que en fase estacionaria de su crecimiento, una posible explicación es que al utilizar cepas de Candida adaptadas al laboratorio estas se han subcultivado en varias ocasiones e incluso por décadas en algunos casos desde su primer aislamiento, por lo tanto, pueden ser un no representante adecuado para las cepas clínicamente relevantes en la actualidad esto se ha observado en la formación de biofilms (Alnuaimi et al., 2013). Se ha demostrado también que la microevolución de los hongos como C. glabrata puede ocurrir bajo condiciones de crecimiento in vitro e in vivo y de esta manera afectar los principales factores de virulencia (Franzot et al., 1998; Brunke et al., 2014).
Otra posible respuesta es que los aislados clínicos de C. glabrata muestran cariotipos variables porque su genoma se reorganiza con frecuencia y se considera que éstos reordenamientos son el principal mecanismo de adaptación de este microorganismo (Ahmad et al., 2014). Las aneuploidías en estos aislados clínicos sugieren variaciones en la organización de los cromosomas y el número de copias de éstos son un mecanismo utilizado para generar rápidamente una respuesta a condiciones estresantes de crecimiento como la exposición a los antifúngicos, en este caso al aceite esencial (Selmecki et al., 2010).
Entre aislados clínicos existe variación en el tamaño de los cromosomas, sin dejar de lado la capacidad que posee C. glabrata para formar nuevos cromosomas cuyo origen son las duplicaciones segmentarias; éstos nuevos cromosomas llevan genes duplicados en su mayoría de la familia de transportadores ABC que desempeñan un papel importante en la resistencia a múltiples fármacos (Poláková et al., 2009). Esto pudiera ser una posible explicación de por qué los aislados clínicos probados en este experimento son susceptibles a diferentes concentraciones del aceite esencial, aunque se deben realizar más investigaciones para poder determinarlo.
López-Fuentes et al. (2018) mencionan que la variabilidad del genoma de C. glabrata le confiere un patrón único de expresión de proteínas que se encuentran asociadas a la pared celular. Aislados clínicos de un paciente a menudo muestran 2 o 3 cariotipos diferentes y durante la infección el patrón cromosómico puede sufrir cambios en varios días. En C. glabrata las duplicaciones segmentarias, los reordenamientos cromosómicos y los cromosomas adicionales ocurren y persisten con alta frecuencia, así la elevada dinámica cromosómica no es compatible con el estilo de vida sexual y la meiosis, pero beneficia la adaptación a las condiciones ambientales cambiantes.
Algunas propuestas del mecanismo de acción de aceites esenciales son: 1) El sinergismo que producen todas las moléculas de los aceites, produce el efecto fungicida, aunque algunos investigadores como Ipek et al. (2005) debaten que esto solo refleja el efecto de las principales moléculas que lo componen; 2) otro grupo de investigadores como Santana-Rios et al. (2001) y Hoet et al. (2006) sugieren que la actividad de los componentes mayoritarios está modulada por moléculas que se encuentran en un menor porcentaje y que es posible que varios componentes del aceite esencial le otorguen diferentes funciones: como el olor, la densidad, la textura, el color y sobre todo la capacidad de penetración celular y la forma en que se distribuye intracelularmente. Por lo tanto, habría que probar los compuestos por separado para poder confirmar alguna de las hipótesis.
Al realizar la predicción de los espectros de actividad para el eucaliptol, piperitona, delta-3-careno y el α-terpineol, se encontró que funcionan como posibles inhibidores de la ubiquinol-citocromo-c reductasa, la alteración de este gran complejo altera el estado redox de las células. Hoehamer et al. (2010) observaron que para C. albicans en interacción con agentes antifúngicos como azoles, polienos y equinocandinas muestran un cambio en el proteoma, por su interacción con éstos compuestos algunas proteínas se ven alteradas como la ubiquinona-citocromo-C-reductasa y comprometen el adecuado funcionamiento de las células.
La piperitona se encontró que actúa como un inhibidor de la enzima fosfatasa, la vía de transducción del fosfato en C. glabrata es similar que la de S. cerevisiae, esta ruta es esencial para sobrepasar la inanición (Orkwis et al., 2010). El linalool funciona como un posible inhibidor de la ácido grasa sintasa, la cual es muy importante porque está implicada en la síntesis de ácidos grasos de la pared celular. La cantidad de ácidos grasos sintetizados varía de acuerdo a las condiciones de crecimiento del microorganismo, además, en los hongos la síntesis de novo de ácidos grasos sucede en el citosol o en las mitocondrias (Roche et al., 2013).
Freisleben y Jäger proponen que el efecto antifúngico de los aceites esenciales puede ser por que alteran la estructura y función de la pared celular, así como las membranas de algunos organelos y la inhibición de proteínas o material nuclear (Freisleben y Jäger, 2014). Por otro lado, se ha demostrado que algunos aceites esenciales como el del árbol de té, Litsea cubeba y Anethum graveolens, actúan sobre C. albicans al alterar la permeabilidad y la fluidez de la pared celular, de esta manera se comprometen funciones asociadas a esta como la inhibición de ergosterol; esto los convierte en un posible potencial tratamiento. También pueden alterar el ciclo Krebs y la inhibición de la síntesis del ATP en las mitocondrias (Nazzaro et al., 2013).











 nueva página del texto (beta)
nueva página del texto (beta)


