Introducción
En el devenir del tiempo, el trigo, desde su domesticación, ha jugado un papel muy importante en la cultura alimentaria, brindando diferentes opciones de alimentos, entre ellos el pan (Shewry, 2009; Campbell et. al., 2007). La harina de trigo que se utiliza para la elaboración de productos de panificación se produce a través de un proceso de molienda que consiste en la separación del endospermo del germen y el pericarpio, seguido por una reducción gradual del tamaño de partícula. Los componentes anatómicos del grano de trigo tienen diferente composición, así como también el endospermo muestra un gradiente en sus componentes, principalmente de la proteína. El contenido de proteína se incrementa del centro del grano hacia la capa aleurona (Tosi et. al., 2011; Tosi et. al., 2018). Se han encontrado gradientes del 8 al 43 % en el contenido de proteínas (Kent, 1966). Con estudios especializados de inmunolocalización, también se han encontrado diferencias en la distribución del tipo de proteínas; las gliadinas gamma y las subunidades de masa molecular alta se encuentran en mayor proporción en el centro del grano (Tosi, et. al., 2011) y como consecuencia un mayor contenido de proteína polimérica insoluble (Tosi et. al., 2011). Así, el centro del grano de trigo tiene menor contenido de proteínas, pero mejor calidad panadera. Durante el proceso de molienda, el grano de trigo sufre el rompimiento y reducción y la harina se purifica, dando como resultado, harinas de calidad diferente, y esto se ve afectado por el flujo de los productos y subproductos de la molienda, también por la calidad del grano o su mezcla; a su vez, esto afecta el contenido y tipo de proteína que determina la funcionalidad final de cada harina (Pomeranz, 1988; Nelson y McDonald, 1977). La genética de los granos es un factor determinante en su calidad; hasta el momento, las subuniades de gluteninas de masa molecular alta Dx5+Dy10 han mostrado una calidad superior, correlacionando de forma positiva con los volúmenes de panificación (Payne, et. al., 1980; Wang et. al., 2007). Además, la cantidad y distribución de proteínas a favor de las proteínas del gluten (gluteninas y gliadinas), en contraposición a proteínas solubles, albúminas y globulinas, han mostrado tener un potencial reológico superior en productos de panificación (Okrajková et. al., 2007; Wang et. al. 2007; Sakhare et. al. 2015).
Actualmente, la industria comercializa harina, producto de la mezcla de diferentes variedades de grano de trigo, de calidades diferentes; mezclando además las corrientes del molino, con el fin de producir harina de calidad aceptable. La cantidad de harina producida es el parámetro más importante, pero existe en el mercado una necesidad de harinas de calidad superior para productos específicos (Campbell et. al., 2007; Brütsch et. al., 2017). Se puede emplear un método poco utilizado llamado “división de corrientes” (stream-splitting), que consiste en mezclar harinas con características similares, complementar la ausencia o cantidad de componentes de las que algunas harinas carecen para un uso específico (Dube et. al., 1987). Para poder emplear este método en la industria moderna, es necesario conocer la calidad proteica de cada una de las corrientes, el flujo de productos y subproductos en el proceso de molienda y el tipo de trigo a utilizar (Phrabhansankar et. al., 2000). La mayoría de los estudios de la distribución de las proteínas en las diferentes corrientes de molienda se ha hecho en molinos experimentales y se han encontrado concentraciones de proteína en las corrientes de molienda tan diferentes como 11 y 25 % (Nelson y McDonald, 1977). Además, se ha relacionado el contenido de proteínas con calidad de panificación recientemente, usando métodos multivariados (Pojic et. al., 2014; Suresh y Neethirajan, 2015; Brütsch et. al., 2017), mostrando las diferencias de calidad que existen en las harinas de las diferentes corrientes de molienda.
El objetivo de esta investigación es identificar los componentes proteicos en las harinas de las corrientes de molienda en un molino comercial, usando técnicas de cromatografía y electroforesis, relacionándolo además con indicadores de calidad panadera.
Materiales y métodos
Muestreo
El estudio se llevó a cabo en un molino comercial del grupo MUNSA, S.A de C.V. Se muestrearon por triplicado cada una de las 23 corrientes productoras de harina y la mezcla como producto final. Las muestras se llevaron al laboratorio de Química de Cereales de la Universidad de Sonora, para ser analizadas.
Proceso de molienda
Al recibir el grano de trigo, se limpia en cribas industriales y se almacena en silos. Se hacen mezclas de las variedades para la obtención de una harina en particular. En este caso, se mezclaron tres variedades de trigo panadero que contienen las subunidades de gluteninas de masa molecular alta Dx5+Dy10 (resultado del análisis de subunidades de gluteninas, usando SDS-PAGE), relacionadas con una buena calidad panadera (Payne 1980).
Se hace un primer acondicionamiento a 14.0 - 14.5 % de humedad, posteriormente se termina el proceso de limpieza del grano, removiendo piedras e impurezas pequeñas. Se continúa con el proceso de acondicionamiento hasta llegar a un 16 - 16.5 % de humedad. Después del acondicionamiento, se pasa al primer sistema de rompimiento y se continua con el proceso de molienda. Este proceso de molienda seca se compone de tres sistemas básicos: rompimiento a través del uso de rodillos corrugados; reducción, con el uso de rodillos lisos; y purificación, usando purificadores y centrífugas. A través de un proceso complejo, se busca obtener la mayor cantidad de harina, separando el endospermo del pericarpio y germen y reduciendo el tamaño de partícula. Se obtiene harina de los diferentes pasajes, con características fisico-químicas y nutricionales diferentes; además, se obtienen productos intermedios que son sometidos a otro pasaje de molienda. El salvado y germen se remueven. Al final, la harina blanca se mezcla, se fortifica con vitaminas y opcionalmente se agregan aditivos.
Análisis de componentes químicos
El contenido de cenizas en cada una de las muestras de harina de trigo proveniente de las corrientes y producto final se determinó con el método de AACC 08-01.01; la temperatura y tiempo del procedimiento fueron 550º C por 24 h. El contenido de humedad se determinó por diferencia de pesos, después del calentamiento a 100º C por 12 horas, usando el método AACC 44 - 40. El contenido de proteína de las harinas fue determinado con un analizador de nitrógeno (LECO FP - 528, St. Joseph, MI). Para la conversión de los valores de nitrógeno se uso un factor de conversión de 5.7.
Contenido de proteína polimérica insoluble (PPI)
Se determinó el contenido de PPI en las harinas, cuantificando el contenido de proteínas en el pellet resultante de la extracción exhaustiva de las proteínas solubles en propanol al 50 % (Bean et. al., 1998). El procedimiento para la determinación de proteínas en el pellet fue el mismo que el usado para la determinación de proteínas en las harinas.
Índice de sedimentación
Se determinó el índice de sedimentación, que re-presenta la capacidad de hidratación y de expansión de las proteínas del gluten en un medio ligeramente ácido (AACCI 56-60.01).
Cromatografía liquida de exclusión molecular de alta resolución (SE-HPLC)
Se realizó el análisis cromatográfico de acuerdo con el método de Bean et. al. (1998), con algunas modificaciones. Se tomaron 250 mg de harina, que fueron mezcladas con un 1 mL de propanol al 50 %, en un agitador (Vortex Genie2, Scientific Industries, Bohemia, NY) durante 15 min, de manera continua. Después, las muestras se centrifugaron (Eppendorf AG, 5415 Hamburg) a 8000 x g durante 5 min, y el sobrenadante fue recuperado. El sobrenadante fue centrifugado a 14,000 x g durante 15 min y fue analizado por la cromatografía liquida de exclusión molecular de alta resolución. El sistema consiste en una bomba cuaternaria y un detector de arreglo de diodos (Agilent Technologies, Model 1260, Pittsburgh PA, USA), con una columna Biosep-SEC-S 4000 column (Phenomex, Torrence, CA). La fase móvil fue de agua-acetonitrilo (50:50 v/v) con 0.1 % de ácido trifluoracético a un flujo de 0.8 mL min-1. Las proteínas se detectaron a 280 nm. El perfil cromatográfico fue analizado usando el software Open Lab Software (Agilent Technologies, Palo Alto, CA). Se realizó el análisis por triplicado, determinando el área bajo la curva de diferentes picos, se comparó con datos publicados (Bean et. al., 1998) para obtener la información de proteína polimérica soluble (PPS), gliadinas, albúminas y globulinas.
SDS-PAGE
Se realizó la electroforesis desnaturalizante y reductora en extractos de las harinas para estudiar todas las proteínas presentes, también se realizó la electroforesis en las proteínas remanentes en los pellets después de la extracción de las proteínas solubles en propanol al 50 % con el fin de estudiar a las subunidades de las gluteninas. La extracción se realizó en 300 mg de muestra con 1 mL de buffer (SDS 10 %, 2 mercaptoetanol 0.05 %, 0.1 azul de bromofenol 0.1 %, agua deionizada y 0.05 Tris-HCI con un pH de 6.8). La electroforesis, SDS-PAGE, se realizó de acuerdo con el método de Laemmli (1970), con algunas modificaciones. La corrida se realizó en un sistema de gel vertical, mini-protean 3 (Bio-Rad Corpora-tion, Hercules, CA), usando geles de acrilamida al 10%, a 100 V por aproximadamente 3 h. Después el gel fue teñido con azul brillante de coomassie G-250 a temperatura ambiente (25 °C) con agitación y desteñido con metanol, 10 % y de ácido acético glacial, 7%.
Diseño experimental y análisis estadístico
El diseño experimental fue completamente aleatorio de un solo factor (corriente de molienda) con las variables respuesta: contenido de humedad, contenido de proteína, contenido de cenizas, contenido de PPI, índice de sedimentación, área bajo la curva cromatográfica en cada uno de los picos de las proteínas correspondientes a proteína polimérica soluble (PPS), gliadinas, albuminas, y globulinas.
Se llevaron a cabo análisis de varianza (ANOVA) y la diferencia entre medias se analizó con la prueba de Tukey, ambos procedimientos con un nivel de significancia del 95%. Para reducir la dimensionalidad y poder observar gráficamente la relación de las variables y las corrientes de molienda, se hizo un análisis multivariado de componentes principales. Se usó XLstat 2019 para hacer los análisis estadísticos.
Resultados y discusión
Distribución de cenizas y proteínas
Como se muestra en la tabla 1, existen diferencias significativas (p<0.05) en cada uno de los componentes químicos de las harinas de las corrientes o fracciones de molienda. El contenido de ceniza se encuentra entre 0.46-2.65 %, su variación dependió del sistema al que pertenece la harina, y el mayor contenido se encuentra en el sistema de purificación (Div 1, Div 2, Div C, CDF, Centrifugo 2) y la harina de las últimas corrientes de reducción (C6 H1, C7, C8, C9). Este componente presentó una tendencia de aumento desde el inicio hasta el final en cada uno de los pasajes de cada sistema; este último resultado coincide con lo reportado hasta el momento (Every et. al., 2002; Liu et. al., 2011). El incremento de ceniza indica contaminación con tejido no endospérmico y presencia de parte de la capa aleurona en la harina, lo que reduce su calidad panadera. El mayor contenido de proteínas de la harina se encontró en el sistema de purificación (Div C., Div 1, Div 2, CDF, Centrifugo 2), en el T3 y en los últimos rodillos de purificación (C6 H1, C7, C8, C9), esta proteína proviene de la parte externa del endospermo cercana al pericarpio donde predominan las fracciones proteicas de albuminas y globulinas (Tosi et. al. 2011). El proceso progresivo de la molienda tiene un efecto de aumento en el nivel de extracción de harina y con ello aumento en las proteínas más cercanas al pericarpio, siendo esta harina de una calidad panadera menor, mientras que en los primeros rodillos del sistema de reducción (D1, C1 H1, C2 H1, C2 H3, C3 H1, C3 H2, C3 H3, C4, C5 H1, C5 H2) con un menor porcentaje de extracción de harina y un contenido menor de proteínas, se logran extraer los componentes provenientes de la parte interna del endospermo con una calidad panadera superior, y menor contaminación de ceniza (Brütsch et. al., 2017).
Tabla 1 Principales componentes fisicoquímicos de las harinas de trigo.
Table
1. Main physicochemical components of wheat
flour.
| Corrientes | HUM (%) | PPI (%) b.s. |
PT (%) b.s. |
CEN (%) b.s. |
SED (ml) |
|---|---|---|---|---|---|
| T1 | 14.01 a | 5.77 i | 13.20 k | 0.64 ij | 14.0 k |
| T2 | 14.0 a | 6.59 h | 14.44 i | 0.55 lm | 18.0 i |
| T3 | 13.91 a | 7.87 ef | 16.21 e | 0.81 h | 18.8 h |
| C1 H1 | 13.47 b | 5.32 i | 12.66 m | 0.56 klm | 19.9 g |
| C2 H1 | 12.85 c | 6.72 h | 12.31 no | 0.56 klm | 12.7 m |
| C2 H3 | 12.7 cd | 6.76 gh | 12.12 p | 0.62 ijkl | 12.7 m |
| C3 H1 | 12.37 ef | 8.13 de | 11.87 q | 0.54 klm | 13.9 l |
| C3 H2 | 13.53 b | 10.08 ab | 12.24 op | 0.53 mn | 13.9 l |
| C3 H3 | 10.78 k | 9.72 bc | 12.42 n | 0.56 jklm | 14.0 k |
| C4 | 11.10 j | 9.81 bc | 15.38 f | 1.51 d | 30.0 d |
| C5 H1 | 12.42 def | 5.88 i | 11.68 r | 0.54 lmn | 11.8 p |
| C5 H2 | 11.75 gh | 6.85 gh | 11.56 r | 0.52 mn | 11.8 p |
| C6 H1 | 11.47 hi | 7.07 gh | 18.84 a | 2.04 b | 26.7 e |
| C6 H2 | 12.12 f | 8.51 d | 12.32 no | 0.62 ijkl | 26.5 f |
| C7 U.C. | 12.86 c | 7.38 fg | 14.44 i | 0.98 g | 10.8 r |
| C8 U.C. | 11.25 ij | 8.33 de | 13.79 j | 1.04 fg | 11.0 q |
| C9 U.C. | 10.99 jk | 8.33 de | 14.64 h | 1.52 d | 30.3 c |
| CDF | 11.22 ij | 6.59 h | 15.15 g | 1.90 c | 41.0 a |
| Centrifugo 2 | 10.23 l | 10.54 a | 16.55 d | 1.08 f | 30.9 b |
| Div 1 | 13.87 a | 8.17 de | 12.94 l | 0.63 ijk | 11.9 o |
| Div 2 | 11.81 a | 7.00 gh | 17.62 b | 1.33 e | 8.9 s |
| Div C. | 12.64 cde | 6.68 h | 16.89 c | 2.65 a | 4.9 t |
| D1 | 14.13 a | 9.35 c | 12.13 p | 0.46 n | 17.0 j |
| Producto final | 11.7 gh | 10.03 ab | 12.65 m | 0.67 i | 12.0 n |
*Nota: b.s., base seca; PPI: proteína polimérica insoluble; PT: proteína total; CEN: ceniza; SED: índice de sedimentación; T1: triturador 1; T2: triturador 2; T3: triturador 3; C1 H1: corriente1, harina 1; C2 H1: corriente 2, harina 1; C2 H3: corriente 3, harina 3; C3 H1: corriente 3, harina 1; C3 H2: corriente 3, harina 2; C3 H3: corriente 3, harina 3; C4 U.C: corriente 4; C5 H1: corriente 5, harina 1; C5 H2: corriente 5, harina 2; C6 H1: corriente 6, harina 1; C6 H2: corriente 6, harina 2; C7 U.C: corriente 7; C8 U.C: corriente 8; C9 U.C: Corriente 9; CDF: Centrífugo de fuerza; Div 1: divisor 1; Div 2: divisor 2; Div C: divisor cepillador; D1: reductor 1; Producto final, harina comercial. Dentro de una columna, promedios con la misma letra no muestran diferencias significativas (p>0.05).
Variación de los indicadores de calidad de panificación
El contenido de PPI en las harinas de trigo se muestra en la tabla 1, los resultados presentan diferencias significativas (p<0.05). La harina con un contenido de PPI mayor, es la del centrífugo 2 (10.54 %); probablemente en este pasaje se llega a la parte interna del grano, al centro del endospermo, con un contenido de PPI mayor. Este contenido es similar al del producto final (10.03 %), seguido de las corrientes del sistema de reducción C3 H1, C3 H2, C3 H3, C4 (8.13-10.08 %). En los rodillos de trituración T1 (5.77 %), T2 (6.59 %), T3 (7.87 %) se observa una tendencia al aumento del contenido de PPI; resultados similares obtuvieron Prabhansankar et. al. (2000), debido al rompimiento gradual del grano de trigo acercándose más a la parte central del endospermo, hasta llegar a los rodillos de reducción, donde la extracción de PPI es superior (Tosi et. al., 2011). Wang et. al. (2007) reportaron que la relación de PPI a monomérica es mayor en los rodillos de rompimiento, teniendo una harina con mejor calidad de panificación, con un contenido mayor de gluteninas.
Los resultados del volumen o índice de sedimentación se encuentran en la tabla 1, mostrando diferencias significativas y valores que van de 4.9 a 41 mL. Se hace evidente al observar los valores, la gran variación en calidad de las harinas de las diferentes corrientes. En general, esta evaluación fisicoquímica se utiliza para evaluar la calidad proteica (Pomeranz, 1988). Se observa que la cantidad y calidad de proteínas tienen una influencia importante, tal es el caso de las harinas CDF (41 mL), Centrifugo 2 (30.9 mL), C4 (30 mL) y C6 H1 (26.73 mL) que muestran cantidad de PT de 15.14- 18.84 %; además, son harinas con un contenido de PPI de 7.07 - 10.54 % (tabla 1). Estos resultados sugieren que el tipo y la cantidad de proteína son importantes para la calidad de panificación. Resultados similares mostró Sakhare y col. (2015), donde se obtuvieron índices de sedimentación de 41-61 mL en 12 corrientes de trigo provenientes del sistema de rompimiento, purificación y reducción; el valor más alto fue el del triturador 4 y este resultado se relacionó directamente con el gluten seco encontrado en esa harina.
Distribución de los componentes proteicos
En la tabla 2 se presentan los resultados de SE-HPLC, se muestra el área bajo la curva en cada fracción proteica. Se observan diferencias significativas (p<0.05) para cada una de las fracciones. También, claramente se puede ver en la figura 1, la diferencias en la distribución proteica en cada sistema de molienda; se identificaron 4 fracciones diferentes: proteína polimérica soluble (PPS), gliadinas, albuminas y globulinas (Bean et. al., 1998). Sutton y Simmons (2006) reportaron un análisis de proteínas de trigo suave por cromatografía liquida de exclusión molecular a corrientes de un molino harinero, planta piloto, donde se tomaron muestras de 14 corrientes, 4 de ellos de rodillos de trituración. En ese estudio (Sutton y Simmons, 2006), se demostró que la distribución proteica es diferente y que la fracción soluble de la glutenina y gliadinas es mayor en los rodillos de trituración, específicamente en el T1 y T2, y entre el T3 y T4 se reporto un descenso, en cambio en nuestro estudio la corriente con la fracción soluble de glutenina mayor fue la T3, mientras que en T1 y T2 fueron resultados similares, como se observa en la tabla 2. Esto debido al tipo de molino empleado, además de la variedad de los granos de características proteicas diferentes (Shewry, 2009).
Tabla 2 Área bajo la curva de las fracciones identificadas a través de la cromatografía
liquida de exclusión molecular de alto rendimiento.
Table 2. Area under the curve of the
fractions identified through high performance molecular exclusion
liquid chromatography.
| Corrientes | PPS (10-7
UA) |
Gliadinas (10-7 UA) |
Albuminas (10-6 UA) |
Globulinas (10-6 UA) |
|---|---|---|---|---|
| T1 U.C. | 15.6 efg | 35.86 abcd | 23.47 g | 16.59 def |
| T2 U.C. | 15.81 cde | 35.17 bcdef | 21.49 gh | 18.34 cdef |
| T3 U.C | 18.03 a | 36.73 abc | 22.66 g | 13.55 def |
| C1 H1 | 13.28 hij | 34.88 cdefg | 19.46 hi | 13.14 def |
| C2 H1 | 13.83 fghij | 32.66 fgh | 20.03 hi | 18.78 cdef |
| C2 H3 | 13.67 ghij | 33.81 defg | 20.23 h | 13.97 def |
| C3 H1 | 13.22 hijk | 35.68 abcd | 21.36 gh | 19.05 cdef |
| C3 H2 | 13.46 ghij | 35.35 abcde | 19.66 hi | 13.49 def |
| C3 H3 | 13.90 fghij | 35.72 abcd | 20.36 h | 14.44 def |
| C4 U.C. | 11.92 kl | 29.61 i | 32.15 d | 38.08 cde |
| C5 H1 | 13.93 fghij | 35.99 abcd | 18.00 i | 11.80 def |
| C5 H2 | 13.19 ijk | 32.46 gh | 20.33 h | 75.95 ab |
| C6 H1 | 14.50 efgh | 35.52 abcd | 41.08 b | 51.01 abc |
| C6 H2 | 5.67 m | 12.99 k | 9.93 k | 4.53 f |
| C7 | 15.05 def | 37.64 ab | 29.34 e | 34.59 cdef |
| C8 U.C. | 12.85 jk | 32.86 efgh | 28.39 ef | 43.42 bcd |
| C9 U.C. | 11.45 l | 32.68 fgh | 33.59 cd | 50.89 abc |
| Div 1 | 14.17 fghi | 36.17 abcd | 22.94 g | 15.62 def |
| Div 2 | 17.1 abc | 37.94 a | 32.74 cd | 29.46 cdef |
| Div C | 16.1 bcd | 36.20 abcd | 34.87 c | 27.36 cdef |
| Centrifugo 2 | 17.26 ab | 29.21 i | 26.33 f | 21.21 cdef |
| CDF | 11.01 l | 31.06 hi | 44.27 a | 78.16 a |
| D1 U.C. | 13.42 ghij | 34.59 cdefg | 19.85 hi | 12.81 def |
| Producto final | 11. 311 | 21. 03 j | 14. 36 j | 7.54 ef |
Nota: UA: Unidades de Absorbancia. T1: triturador 1; T2: triturador 2; T3: triturador 3; C1 H1: corriente1, harina 1; C2 H1: corriente 2, harina 1; C2 H3: corriente 3, harina 3; C3 H1: corriente 3, harina 1; C3 H2: corriente 3, harina 2; C3 H3: corriente 3, harina 3; C4 U.C: corriente 4; C5 H1: corriente 5, harina 1; C5 H2: corriente 5, harina 2; C6 H1: corriente 6, harina 1; C6 H2: corriente 6, harina 2; C7 U.C: corriente 7; C8 U.C: corriente 8; C9 U.C: Corriente 9; CDF: Centrífugo de fuerza; Div 1: divisor 1; Div 2: divisor 2; Div C: divisor cepillador; D1: reductor 1; Producto final, harina comercial. Dentro de una columna, promedios con la misma letra no muestran diferencias significativas (p>0.05).
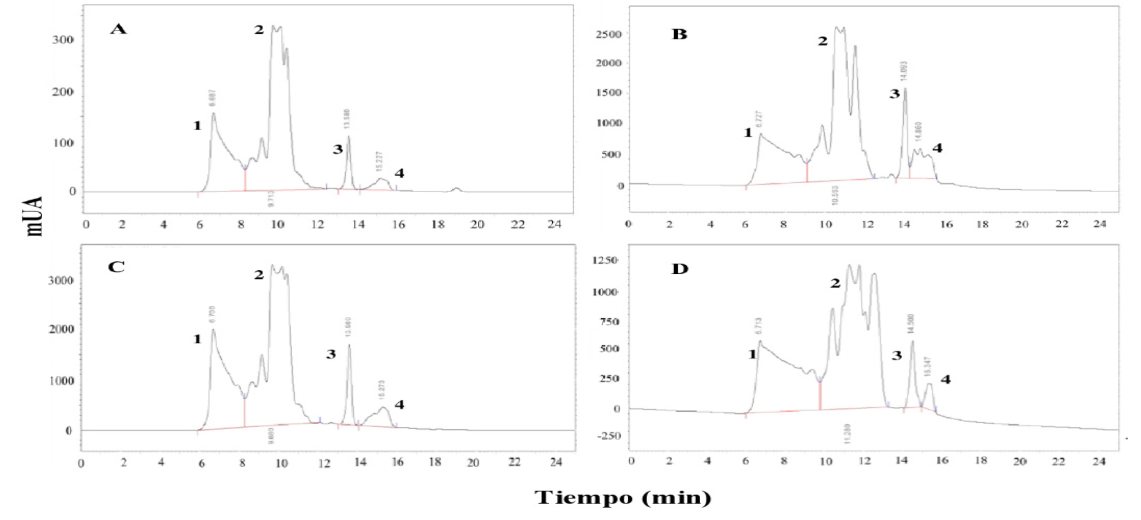
Figure 1.Chromatograms of high performance molecular exclusion liquid chromatography on wheat millstreams: A: break roll 1; B: stream 4; C: divider 2: D: final product. Peak1: soluble polymeric protein (PPS); peak 2: gliadins; peak 3: albumins; 4: globulins.
Figura 1 Gráficas de la cromatografía liquida de exclusión molecular de las corrientes de trigo; A: triturador 1; B: corriente 4; C: divisor 2; D: producto final; pico 1: proteína polimérica soluble (PPS); 2: gliadinas; 3: albuminas; 4: globulinas.
La corriente C6H2 presentó un valor muy bajo de PPS (tabla 2), acompañado de un valor relativamente alto de PPI (tabla 1) y un valor intermedio en el contenido de proteínas (tabla 1). Se observan además valores muy bajos de las otras proteínas solubles en esta muestra. El centrífugo 2 presentó un valor alto de PPS, un valor alto de PPI (10.54 %) y un valor alto en el contenido de proteínas (16.55 %). Los valores de PPS dependen del contenido de proteínas de la harina y del contenido de PPI. En harinas con contenidos equivalentes de proteínas, valores bajos de PPS, pueden in dicar un mayor contenido de PPI y una buena calidad panadera. Aunque la homogeneidad en el contenido de proteínas no es el caso del presente estudio y no se pueden ver claramente estas relaciones al observar únicamente los valores de las tablas, si se puede observar al analizar los datos con estadística multivariada. Los valores de gliadinas siguieron un patrón muy parecido a la PPS; de hecho, mostraron un a correlación (r2 = 0.72) muy significativa (p<0.001). El contenido de albúminas mostró una correlación positiva (r2 = 0.69) muy significativa (p<0.001) con el contenido de proteínas. Las harinas de las corrientes o fracciones de molienda con mayor contenido de proteínas tuvieron un mayor contenido de albúminas.
En la figura 2A se muestran los patrones de separación en electroforesis desnaturalizante y reductora (SDS-PAGE) de las proteínas totales de las harinas de las corrientes de molienda. La región del gel donde se identifican las bandas que corresponden a las subunidades de gluteninas de peso molecular bajo tipo D (G-BPM) y las gliadinas ω, muestra claras diferencias entre las corrientes. Las corrientes presentadas en el electroferograma provienen del sistema de purificación, de reducción y el producto final. Se pueden observar diferencias en la presencia de estas bandas, así como en la intensidad, relacionada con la concentración de estas proteínas en la solución estudiada. Estos resultados, sugieren una segregación proteica en el proceso de molienda, por lo que la fracción proteica de G-BPM tipo D y gliadinas ω varia cualitativamente en las corrientes de harina de trigo. También se realizó la separación por electroforesis desnaturalizante y reductora (SDS-PAGE) de las proteínas a las cuales se le extrajeron las proteínas de la fracción soluble en propanol al 50 %, en donde se incluyen las gliadinas. El electroferograma de la figura 2B, muestra la separación de las subunidades de gluteninas; no se encontraron diferencias tan notorias en cuanto a la presencia de las subunidades tipo D, pero si en la intensidad, y estos resultados confirman que la diferencia cualitativa más importante entre las proteínas de las harinas de las diferentes corrientes se da en la subclase de las gliadinas omega.
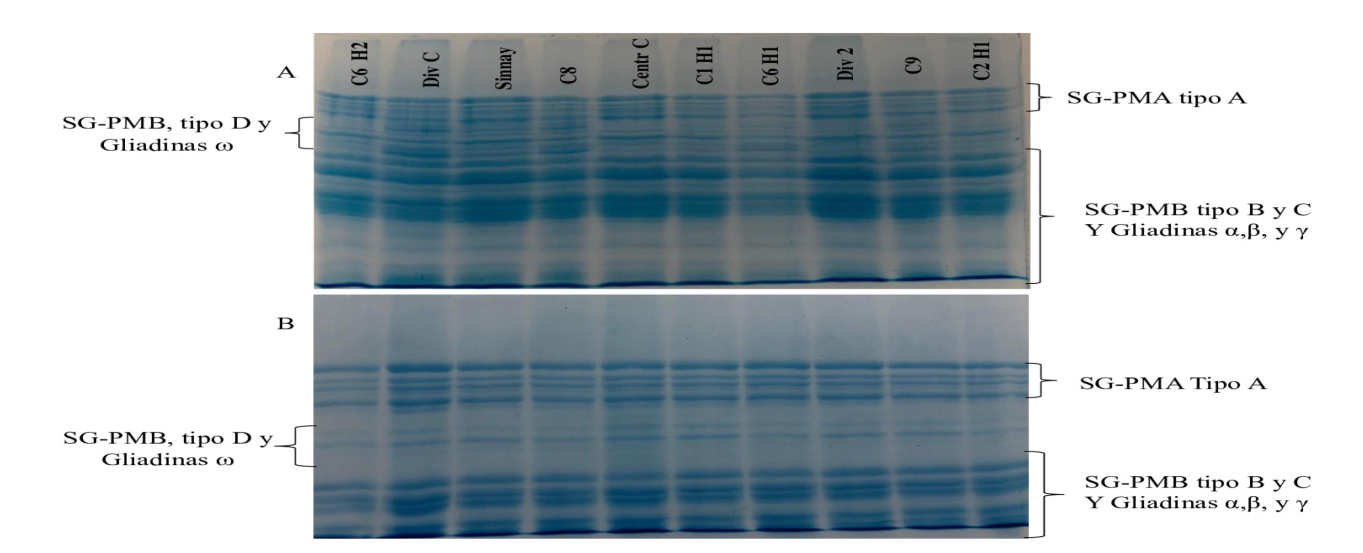
Figure 2.A: SDS-PAGE of total flour proteins on millstreams. B: SDS-PAGE of flour proteins on millstreams, where albumin, globulins and gliadins were removed. C6 H2: stream 6, flour 2; Div C: Brusher divider; Sinnay: final product; C8: stream 8; Centr 2: centrifuge 2; C1 H1: stream 1, flour 1, C6 H1: stream 6, flour 1, Divisor 2: Divider 2, C9: Stream 9, C2 H1: Stream 2 Flour 1. SG-PMA, High molecular weight glutenin subunits; SG-PMB: low molecular weight glutenin subunits.
Figura 2 A: SDS-PAGE de proteínas totales, de harinas de corrientes de molienda. B: SDS-PAGE de proteínas de harinas de las mismas corrientes, en donde se removieron albúmins, globulinas y gliadinas. C6 H2: corriente 6, harina 2; Div C: divisor cepillador; Sinnay: producto final; C8: corriente 8; Centrifugo 2; C1 H1: corriente 1, harina 1, C6 H1: corriente 6, harina 1, Div 2, divisor 2, C9: corriente 9, C2 H1: corriente 2, harina 1. SG-PMA, subunidades de gluteninas de peso molecular alto; SG-PMB, subunidades de gluteninas de peso molecular bajo.
Relación de componentes e indicadores de calidad
Los resultados obtenidos del análisis multivariado de componentes principales, se muestra en la figura 3; se observa que dos factores son los que explican el 63.8% de la variabilidad. Se observa una correlación positiva de las dimensiones de PT, contenidos de albuminas, globulinas y ceniza, con el factor 1 (F1), mientras que se muestra una correlación negativa en las dimensiones de PPI e índice de sedimentación y una correlación positiva de PPS, gliadinas y contenido de humedad en el factor 2 (F2). Se puede observar que las variables PPI e índice de sedimentación se relacionan en forma positiva, pero, aunque las dos son índices de calidad de panificación, obviamente miden cosas diferentes.
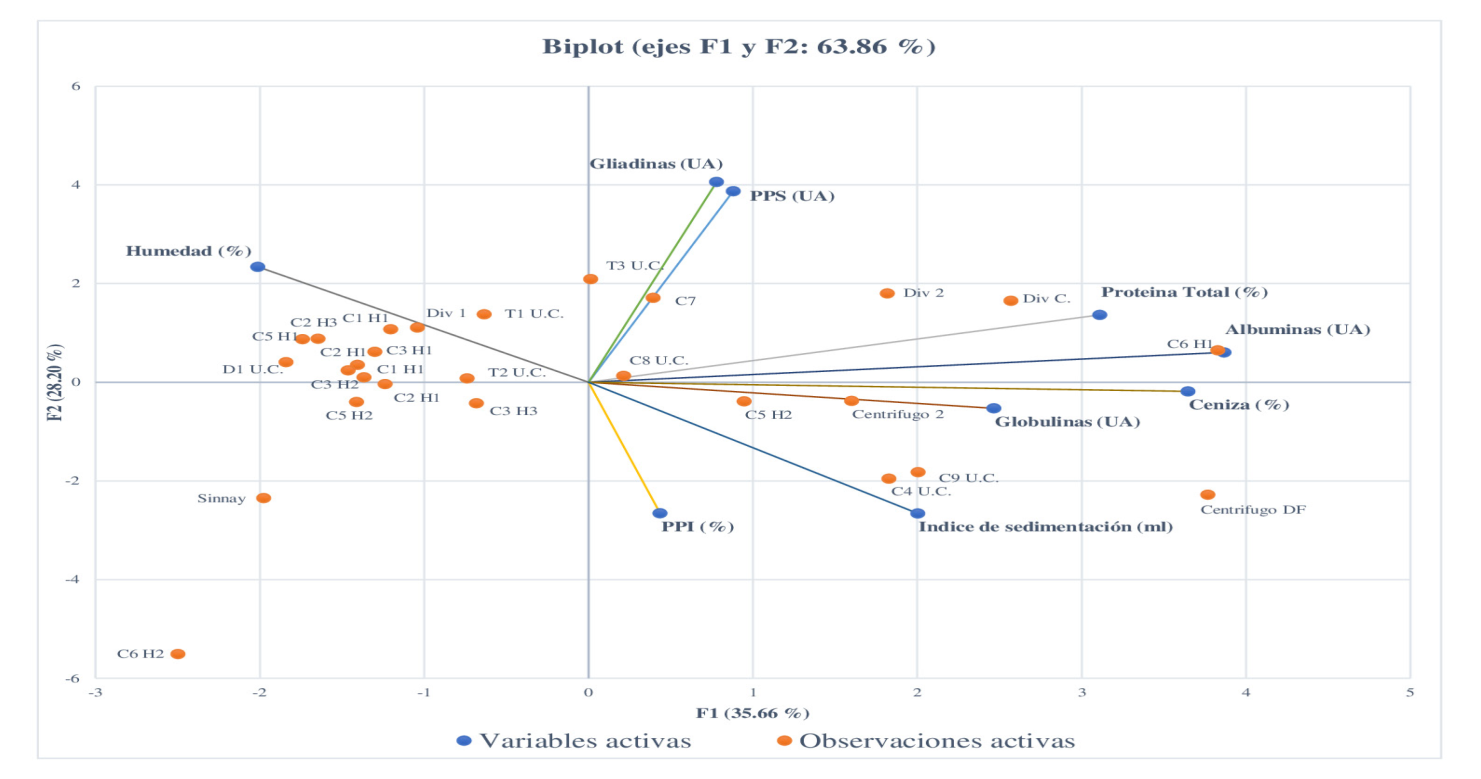
Figure 3.Principal component analysis. The dimensions of the analysis are: moisture (%), SPP soluble polymeric protein (UA), gliadins (UA), total protein (%), albumins (UA), ceniza (%), globulinas (UA), sedimentation index (mL) y PPI (Insoluble polymeric protein %). Centrifugo DF: Centrifuge, Centrífugo 2, C9 U.C.: Stream 9 unique stream; C4: Stream 4 unique stream; C6 H1: stream 6 flour 1, C6 H2: stream 6 flour 2, C1 H1: stream 1 flour 1, T3 U.C.: Break roll 3 unique stream, T2: Break roll 2; D1: Reduction roll; C3 H3: stream 3 flour 3; T1: Break roll 1; C3 H2: stream 3 flour 2; C3 H1: stream 3 flour 1; C2 H1: stream 2 flour 1; C2 H3: stream 2 flour 3; Sinnay: Final product; Div. 1: Divider 1; C5 H2: stream 5 flour 2; C5 H1: stream 5 flour 1; C8 U.C.: stream 8 unique stream; C7: Stream 7; Div 2: Divider 2; Div C: Divider brusher; (UA): Absorbance units.
Figura 3 Análisis de componentes principales. Las dimensiones del análisis son: Humedad (%), PPS (proteína polimérica soluble UA), gliadinas (UA), proteína total (%), albuminas (UA), ceniza (%), globulinas (UA), índice de sedimentación (mL) y PPI (proteína polimérica insoluble %). Centrifugo DF: Centrifuga de fuerza, Centrifugo 2, C9 U.C.: Corriente 9 Única Corriente; C4: Corriente 4 única corriente; C6 H1: Corriente 6 Harina 1, C6 H2: Corriente 6 Harina 2, C1 H1: Corriente 1 Harina 1, T3 U.C.: Triturador 3 Única Corriente, T2: Triturador 2; D1: Reductor; C3 H3: Corriente 3 Harina 3; T1: Triturador 1; C3 H2: Corriente 3 Harina 2; C3 H1: Corriente 3 Harina 1; C2 H1: Corriente 2 Harina 1; C2 H3: Corriente Harina 3; Sinnay: Producto final; Div. 1: Divisor 1; C5 H2: Corriente 5 Harina 2; C5 H1: Corriente 5 Harina 1; C8 U.C.: Corriente 8 Única corriente; C7: Corriente 7; Div 2: Divisor 2; Div C: Divisor Cepillador; (UA): Unidades de Absorbancia.
Estos resultados confirman que las proteínas provenientes de la parte externa del endospermo son de menor calidad (albuminas y globulinas) y se encuentran en mayor cantidad cercanas al pericarpio, mientras que en la parte nuclear del endospermo podemos encontrar la PPI, la cual se correlaciona de forma positiva con el parámetro fisicoquímico de índice de sedimentación.
El grano trigo presenta una distribución no homogénea de sus componentes, debido a las diferencias de composición de las estructuras anatómicas y también a la distribución no homogénea de los componentes del endospermo, especialmente el contenido de proteína. La parte más externa del endospermo presenta un mayor contenido de proteína, pero no necesariamente de mejor calidad panadera, ya que tiene mayor proporción de albúminas, globulinas y gliadinas (Tosi et. al., 2011; Tosi et. al., 2018). Además, el proceso de molienda de rodillos se basa en la separación de los componentes anatómicos, por lo que podemos esperar una gran variación en la composición y calidad de las harinas obtenidas de las diferentes corrientes de molienda.
Las harinas obtenidas en los pasos de reducción de los trozos de endospermo y dependiendo de la localización inicial en el grano, producen harinas de mejor calidad panadera, ya que se encuentran con menos contaminación con partículas provenientes de las capas más externas del grano, de la capa aleurona principalmente y mayor contenido de gluteninas insolubles (PPI).
Debido a la variación tan marcada en el contenido y calidad de las proteínas, se pueden esperar, también una variación muy importante en la calidad panadera. En este caso se usaron dos indicadores de calidad: proteína polimérica insoluble (PPI) que es el porcentaje de proteína que no se extrae con la solución alcohólica de propanol al 50%, y el volumen de sedimentación. La proteína polimérica insoluble se relaciona con la fuerza de la masa (Gupta et. al. 1993; Bean et. al. 1998) y el volumen de sedimentación con la calidad de proteína que redunda en un mayor volumen de pan. Estos dos indicadores se relacionaron positivamente entre si, pero no en forma muy estrecha o cercana. Podemos decir de los resultados obtenidos, que para obtener una estimación de la calidad panadera de una harina, cuando no se utiliza la prueba definitiva de panificación, es necesario evaluar los dos indicadores. Debido a la complejidad del sistema de panificación, desde el punto de vista de las interacciones proteicas responsables de la fuerza y la extensibilidad de las masas, se hace necesario para obtener una correcta predicción de la calidad de panificación, el uso de los dos indicadores.
Conclusiones
El estudio del contenido y calidad proteica en las harinas de corrientes de un molino de trigo panadero comercial, mostró que en el sistema de reducción y centrifugas se encuentran las harinas con mejor distribución de las fracciones proteicas. El índice de sedimentación mostró una relación positiva con la PPI sugiriendo corrientes de estas características con potencial panificador.
Las diferencias cualitativas más importantes en la composición proteica de las harinas provenientes de las diferentes corrientes, se encuentra en la fracción de las gliadinas omega. Se confirma además el aumento gradual de las proteínas albuminas y globulinas en las ultimas corrientes de cada proceso y la fuerte correlación con el contenido de ceniza y con contenido de proteína (PT). La proteína de mayor calidad se encuentra en las primeras harinas de cada sistema, a las que se le llama harinas de primera calidad.











 nueva página del texto (beta)
nueva página del texto (beta)


