Introducción
Los metales pesados son productos generados a partir de diferentes actividades antropogénicas que con el tiempo han aumentado sus usos y su acumulación, causando diferentes tipos de problemas en los ecosistemas. Existen metales pesados como el Pb y Cr (VI) que no tienen utilidad biológica y que además son tóxicos y no biodegradables (Adriano 2003; Yadav et al., 2012; Maceda-Veiga et al., 2013). Al ambiente se liberan 91,000 toneladas métricas de Cr (VI) por año en agua, aire y suelo, donde su concentración puede variar en agua dulce (0.1 a 117 µg L-1), agua marina (0.2 a 0.5 µg L-1) y suelo (5 a 1000 mg kg-1) (Pawlisz et al., 1997; ATSDR, 2012). Mientras que las concentraciones de Pb, por emisiones naturales alcanzan 19 000 ton/año debido a los desgastes geológicos y emisiones volcánicas y por actividades antropogénicas se estiman 120 000 ton/año (Lima et al., 2005). El Pb en el ecosistema puede estar presente en agua para beber (15 mg L-1), agua marina (2 a 30 pg L-1), agua de ríos (3 a 30 ng L-1), fitoplancton (5 a 10 mg L-1), peces de agua dulce (0.5 a 1000 ng L-1), ostras (500 ng L-1), sedimentos ( 500 mg L-1), suelo (30 a 300 mg kg-1) y aire (0.5 a 0.1 µg m-3) (Frank et al., 2019; EPA, 2018). La interacción química del metal en suelo y agua está regulada por la especiación química del mismo, la toxicidad, la concentración, el pH, el contenido de materia orgánica y la capacidad de intercambio catiónico que en algunos escenarios producen biomagnificación (Devallois et al., 2008; Yadav et al., 2010; Li et al., 2017).
El rápido crecimiento, tasa alta de generación de biomasa y capacidad de acumulación de contaminantes en partes cosechables son algunas de las características más deseables que tienen las plantas empleadas en biorremediación (Seth, 2011). La bioacumulación de metales pesados en plantas ha sido evaluada ampliamente (Marchand et al., 2010), pero debido a la gran diversidad que existe, aún faltan muchas especies por estudiar. El berro (Nasturtium officinale) es una planta fácil de cultivar en ambientes acuáticos y terrestres, siendo considerado como una especie con alta actividad antioxidante, antiinflamatoria, antialérgenica, cardioprotectora, antidiabética y de gran utilidad en el sector cosmetológico y ambiental (Rose et al., 2005; Klimek-Szczykutowicz et al., 2018). En estudios de biorremediación se ha demostrado su capacidad acumuladora de metales (Cr, Cu, Cd, Co, Zn y Ni), metaloides (As) y compuestos radiactivos (Zurayk et al., 2001a; Zurayk et al., 2001b; Aslan et al., 2003; Kara, 2005; Saygideger y Dogan, 2005; Duman et al., 2009; Ozturk et al., 2010; Cordeiro et al., 2016). Lin et al. (2015) evaluaron el berro para acumular Cd a diferentes concentraciones, encontrando que el contenido del metal aumentó en la planta al incrementarse la concentración en la solución. Las raíces y tallos del berro pueden acumular más Cd cuando están en combinación con otras especies vegetales y sustratos sólidos (Huang et al., 2017; Li et al., 2017).
Para determinar la capacidad de remediación que tiene una planta es necesario estimar los factores de bioconcentración, traslocación e índice de tolerancia. Estos indican el lugar y la capacidad de acumulación de contaminantes en la planta; así como su nivel de tolerancia a los contaminantes (Wang et al., 2019). De acuerdo a los factores e índices determinados, las especies vegetales pueden clasificarse como bioacumuladoras e hiperacumuladoras. Existen pocos estudios en la literatura que evalúen la sinergia entre metales pesados y los factores de bioconcentración, traslocación e índice de tolerancia (Ng et al., 2016; Favas et al., 2018; Vidal del Campos et al., 2019).
Los objetivos del presente trabajo fueron: (1) evaluar la acumulación de Pb y Cr (VI) en berro; (2) evaluar la sinergia de acumulación entre Pb y Cr (VI) en berro estimando el factor de bioconcentración, traslocación e índice de tolerancia y (3) evaluar en un humedal construido alimentado con agua sintética, el porcentaje de remoción de Pb y Cr (VI).
Materiales y métodos
Efecto de Pb y Cr (VI)
La solución nutritiva de trabajo (L-C) estaba compuesta por KNO3 (101.0 g L-1); KH2PO4 (27.2 g L-1); MgSO4·7H2O (98.6 g L-1); Ca(NO3)2·4H2O (295.0 g L-1); NH4Cl (1.0 g L-1); Na2SO4 (4.5 g L-1); CaCl2 (0.06 g L-1); FeSO4·7H2O (1.3 g L-1); ZnSO4·7H2O (0.2 g L-1); CuSO4·7H2O (0.08 g L-1) a pH 5 ± 0.2. Para los experimentos monometálicos se utilizaron recipientes de plástico de 1 L con solución nutritiva L-C y tres plantas previamente pesadas (10 cm de longitud) se adicionaron concentraciones conocidas (3, 6, 12, 15 y 20 mg L-1) de Pb y Cr (VI), los recipientes fueron colocados dentro de una cámara climática (Lab-Line Instruments, INC, biotonette Mark III) con una iluminación de 270 µmol m-2 s-2, un fotoperíodo de luz: oscuridad 16 h : 8 h y 25 ± 3°C durante 18 y 20 días, respectivamente.
Para evaluar la sinergia entre metales se establecieron las mismas condiciones de iluminación y fotoperiodo, al igual que el número de plantas por recipiente durante 15 días. Los tratamientos mezcla fueron: Pb 5 mg L-1 - Cr (VI) 5 mg L-1, Pb 10 mg L-1 - Cr (VI) 5 mg L-1 y Pb 5 mg L-1 - Cr (VI) 10 mg L-1. Las soluciones nutritivas se reemplazaron completamente cada 4 días para evitar la fluctuación de las concentraciones debido a evaporación y evapotranspiración.
Después del período experimental, las plantas se retiraron y enjuagaron con agua destilada. Todo el material vegetal fue secado a 50 °C durante 30 h. Para la cuantificación del metal en la planta de todos los experimentos, se tomaron 200 mg de biomasa seca (raíces, brotes y hojas), se le adicionaron 15 mL de una mezcla de H2O2 / HNO3 (3:10 v/v) y se mantuvo a 85 °C durante 10 min. Posteriormente, el material fue filtrado y analizado por espectrometría de absorción atómica (EAA, GBC Mod. 932AA); se utilizó una lámpara de cátodo hueco específica para Pb (217 nm) y Cr (357.9 nm), una lámpara de deuterio para la corrección de fondo y un flujo de la mezcla de aire-acetileno para Pb (13.50 - 1.60 L min-1) y Cr (13.50 - 3.05 L min-1) diferente.
Índice de tolerancia, factor de bioconcentración y traslocación
El índice de tolerancia (IT) se estimó considerando la biomasa vegetal expuesta al metal Bt (g planta) y la biomasa vegetal control Bc (g planta), y se calculó empleando la ecuación (1). A valores mayores de IT, mayor tolerancia tiene la planta al metal (Shi et al., 2011).
El factor de bioconcentración (FBC) indica la relación entre la concentración (mg kg-1) del metal en los tallos (Ctallos) y la concentración (mg kg-1) del metal en la solución (Csolución). El FBC evalúa la capacidad (ecuación (2)) que tiene la planta para absorber el metal de la solución y trasladarlo a los tejidos superiores (Liu et al., 2008).
Mientras que el factor de translocación (FT), proporciona una estimación de la capacidad que tiene la planta en transportar el metal entre las raíces y los tallos (RibeIro De Souza et al., 2012). Se calcula con la ecuación (3), en donde Atallos (mg kg-1) es la concentración del metal total acumulado en brotes y Araíces (mg kg-1) la concentración del metal acumulado en raíces.
Humedal construido (HCs)
Para simular las condiciones naturales del crecimiento del berro, se utilizó un tanque rectangular con dimensiones de 85 × 44 × 13 cm (largo x ancho x alto), con una pendiente del 2% y grava como sustrato (5 cm de profundidad). La porosidad establecida dentro del HCs fue de 24% y con ayuda de una bomba peristáltica se alimentó el influente manteniendo un tiempo de residencia hidráulico de 2 días con 24 min. Las condiciones ambientales fueron las mismas ya reportadas en la sección anterior. Dentro del HCs se sembraron 50 plantas de berro de aproximadamente 8 cm de longitud y se estableció una fase de acondicionamiento por 12 días, los primeros 10 días se hizo circular solución nutritiva L- C y los restantes 2 días se agregó Pb y Cr (VI) a la solución 100 mg L-1 y 30 mg L-1, respectivamente; esto último con la finalidad de minimizar la interacción de los metales con el sustrato rocoso y evaluar el comportamiento del berro a concentraciones más elevadas a las evaluadas en las etapas experimentales previas. Posteriormente se renovó la solución y se mantuvo el experimento por 11 días. Se tomaron plantas (n = 12) a distintos tiempos de operación del humedal (2 y 11 días), las cuales fueron tratadas como se mencionó anteriormente para cuantificar los metales pesados en raíces, tallos y hojas. Diariamente se tomaron muestras del efluente para determinar el pH (APHA, 2005) y la concentración total de metales por EAA (GBC Mod. 932 AA).
Balance de masa y especiación de Pb y Cr
Se estableció un control para evaluar las interacciones del metal con la grava, colocando 200 mL de solución a 100 mg L-1 y 30 mg L-1 de Pb y Cr (VI), respectivamente con 200 g de grava. Se dejaron interactuar por 48 h y se tomó una alícuota para cuantificar la concentración del metal en la solución y por diferencia conocer la concentración que dejó de estar soluble. La ecuación general de balance de masa establecida en el sistema considera la concentración inicial de cada metal en el influente, la concentración total de metal en el efluente, la concentración retenida en el berro y la grava y la concentración remanente no cuantificada en el estudio (ecuación 4).
Donde Me es la concentración del metal pesado cuantificado en diferentes partes del humedal artificial (influente, efluente, berro y grava) o el remanente no cuantificado.
Para evaluar la especiación química de los metales se utilizó el software Visual MINTEQ 3.0. Se consideraron dos escenarios; los metales en presencia de grava y los metales en ausencia de grava, para ambos escenarios se mantuvieron las mismas características químicas de la solución, fuerza iónica, pH y temperatura.
Análisis estadístico
Todos los experimentos se realizaron por triplicado en las distintas fases experimentales. Los datos obtenidos fueron sometidos a un análisis de varianza de una vía y una prueba de comparación de medias (Tukey) cuando se encontró significancia entre los tratamientos (P<0.05). Se utilizó el paquete estadístico SPSS 17.0 (Inc., EE. UU.) y OriginPro 6.0.
Resultados y discusión
Acumulación de metales en berro
En las fracciones analizadas de berro se encontraron diferencias estadísticas entre las concentraciones cuantificadas en los tratamientos. La mayor acumulación de Pb en hojas, tallos y raíces fue en los tratamientos de 15, 12 y 3 mg L-1, con valores 2, 0.97 y 31 g kg-1, respectivamente. De acuerdo a los resultados obtenidos el berro tiene la capacidad de acumular Pb en raíces> hojas> tallos (Fig. 1). Keser y Saygideger (2010), reportaron el mismo comportamiento de acumulación y cuantificación similar en hojas y tallos de berro. En los resultados obtenidos no se observó una correlación directa entre la concentración de Pb acumulada en berro y la concentración de Pb en solución. Esto difiere con los reportado por Lin et al. (2015), cuando evaluaron la acumulación de Cd en berro, mostrando que a mayor concentración del metal mayor acumulación en la planta. Lo anterior puede deberse a las interacciones químicas que se puedan dar en la solución que limiten en algunas situaciones la disponibilidad del Pb hacia el berro. Sin embargo, para Cr (VI) se observó que conforme aumenta la concentración de metal en la solución, aumenta la acumulación en raíces<tallos<hojas (Fig. 1). Duman et al. (2009), reportaron resultados similares al presente al cuantificar Cr en raíces> tallos> hojas de berro. De igual manera en plantas de trigo, avena y sorgo la mayor acumulación de Cr fue en raíces (López-Luna et al., 2009). De acuerdo a los resultados obtenidos, el berro presenta distintas afinidades entre metales y se clasifica como rizofiltradora. Huang et al. (2017), la clasifica de dicha manera por acumular metales en raíces y Li et al. (2017), la considera una especie hiperacumuladora de cadmio.
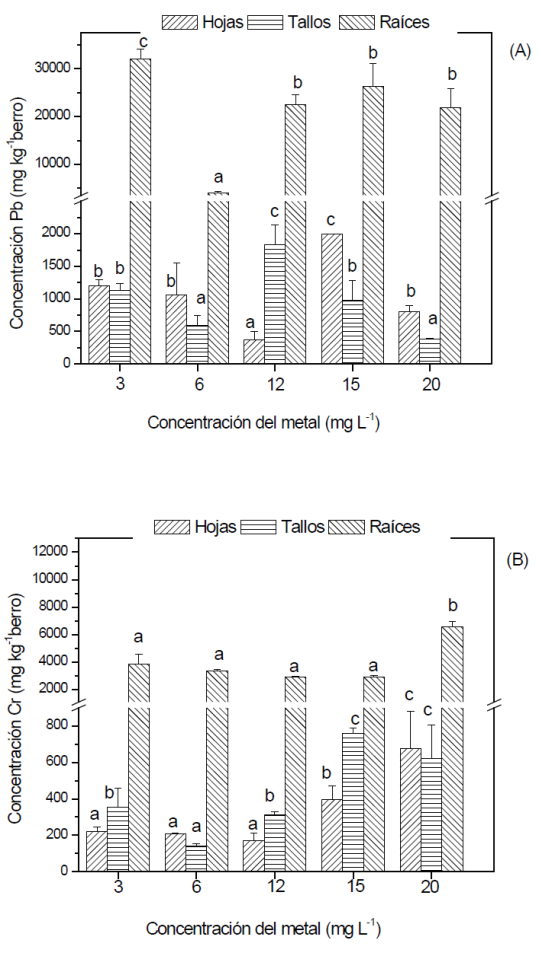
Figura 1 Cuantificación de plomo (A) y cromo (B) en hojas, tallos y raíces de berro expuesto a
distintas concentraciones del metal. Los datos son promedio de tres
replicas con su respectiva desviación estándar. Las diferentes
letras a, b, c indican diferencias significativas (P≤0.05)
Figure 1. Lead (A) and chromium (B) quantification in
leaves, stems and roots of watercress exposed to different
concentrations of the metal. The data is an average of three
replicas with their respective standard deviation. Different letters
a, b, c indicates significant differences (P≤0.05).
Sinergia en la acumulación de metales
Entre los distintos tratamientos evaluados se encontraron diferencias estadísticas (P≤0.05) en la acumulación de ambos metales en las distintas fracciones del berro analizado. El berro acumuló más Pb en hojas y raíces cuando ambos metales se encontraban a la misma concentración. Mientras en los tallos la mayor cuantificación ocurrió en la concentración más alta de Pb. Se obtuvo el mismo comportamiento observado en el experimento monometálico, la mayor acumulación de Pb fue raíces> hojas> tallos. La presencia de Cr en hojas ocurrió cuando ambos metales tenían la misma concentración. Mientras que la mayor cuantificación de Cr en tallos fue en la mayor concentración de Pb. En las raíces se acumula más Cr cuando la concentración del mismo es mayor. Una mayor concentración de Pb favorece la acumulación de Cr en tallos. Lin et al. (2015), reportaron que la mayor concentración de Cd en berro se acumuló en raíces < tallos. Está mayor afinidad a acumular Cr se puede deber a que la planta expresa mecanismos metabólicos que contrarrestan el efecto tóxico del metal por acción enzimática o actividad bacteriana, modificando la forma química de Cr (VI) a Cr (III), transformándolo en una forma química asimilable para la planta y no tóxica (Jin et al., 2017).
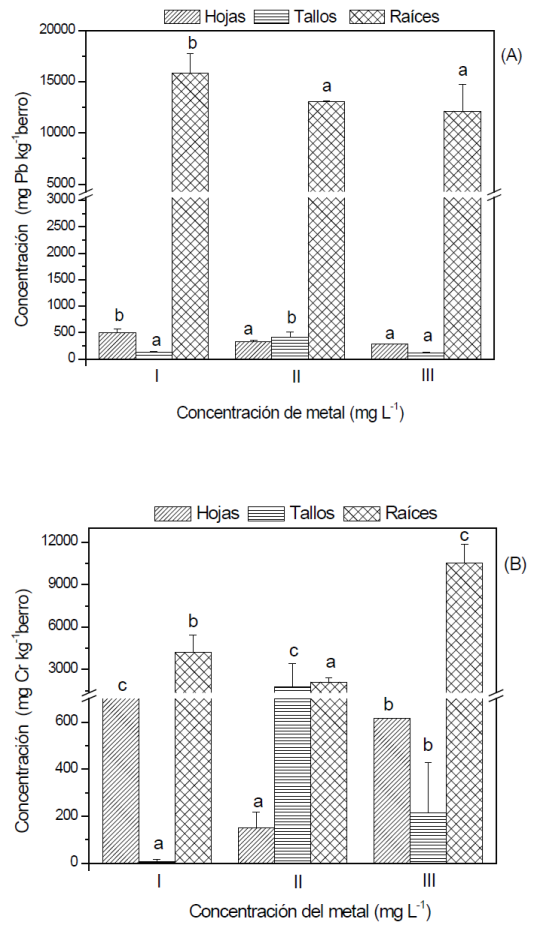
Figura 2 Cuantificación de plomo (A) y cromo (B) en hojas, tallos y raíces de berro expuesto a
(I): Pb 5 mg L-1 - Cr 5 mg L-1, (II): Pb 10 mg L-1 - Cr 5 mg L-1 y
(III): Pb 5 mg L-1 - Cr 10 mg L-1. Los datos son promedio de tres
replicas con su respectiva desviación estándar. Las diferentes
letras a, b, c indican diferencias significativas (P≤0.05)
Figure 2. Lead (A) and chromium (B) quantification in
leaves, stems and roots of watercress exposed to (I): Pb 5 mg L-1 -
Cr 5 mg L-1, (II): Pb 10 mg L-1 - Cr 5 mg L-1 and (III): Pb 5 mg L-1
- Cr 10 mg L-1. The data is an average of three replicas with their
respective standard deviation. Different letters a, b, c indicates
significant differences (P≤0.05).
Las interacciones físicas, químicas y biológicas entre Pb y Cr (VI), resultan en una disminución general de la capacidad del berro en acumular los metales. Las concentraciones promedio cuantificadas en la planta en presencia de ambos metales indican una disminución en la acumulación de Pb del 56, 85 y 20 % en hojas, tallos y raíces, respectivamente. Mientras que, para Cr total la capacidad disminuyó 73 y 76% en tallos y raíces, respectivamente. La concentración de Cr total en hojas aumentó 128 %, a mayor concentración de Cr (VI) en la mezcla, este comportamiento se presenta probablemente por una sobre expresión de genes que codifican para transportadores de membranas que incrementan el translocamiento de los metales a las vacuolas como medida de detoxificación (Rascio y NavariIzzo, 2011).
Índice de tolerancia, factor de bioconcentración y factor de translocación
El índice de translocación y el factor de bioconcentración cuantificados en ambos metales fueron disminuyendo conforme se incrementó la concentración del metal en la solución (Tabla 1). A pesar de su alta toxicidad para la mayoría de las especies vegetales, algunas plantas tienen la capacidad de absorber, acumular y tolerar altas concentraciones de metal, la acumulación es generalmente proporcional a la concentración del elemento en el medio (Jasrotia et al., 2017), donde valores >1000 de FBC y >1 FT las clasifica como plantas hiperacumuladoras (Islam et al., 2015). Por lo anterior, el berro es clasificado con baja capacidad para acumular altas concentraciones de Pb y Cr (VI) en sus órganos subterráneos, resultados similares están reportados para Plantago major L., Fontinalis squamosa, Brachythecium rivulare, Platyhypnidium riparioides, Thamnobryum alopecurum, Lemanea fluviatilis y Pistia stratiotis (Galal y Shehata, 2015; Favas et al., 2018; Vidal de Campos et al., 2019).
Tabla 1 Índice de tolerancia, factor de bioconcentración y factor translocación de berro en
presencia de plomo, cromo y mezclas metálicas.
Table
1. Tolerance index, bioconcentration factor and
translocation factor the watercress in presence of lead, chromium
and metal mixtures.
| Concentración (mg L-1) | Pb | Cr | ||||
|---|---|---|---|---|---|---|
| Metal | IT | FBC (mg kg-1) | FT (mg kg-1) | IT | FBC (mg kg-1) | FT (mg kg-1) |
| 3 | 0.39 ± 0.01d | 0.71 ± 0.1d | 0.63 ± 0.01a | 0.18 ± 0.01c | 0.34 ± 0.1d | 0.19 ± 0.06a |
| 6 | 0.25 ± 0.02c | 0.48 ± 0.2c | 0.15 ± 0.01b | 0.16 ± 0.08c | 0.23 ± 0.01c | 0.41 ± 0.03b |
| 12 | 0.21 ± 0.01b | 0.17 ± 0.01b | 0.09 ± 0.03a | 0.13 ± 0.01b | 0.17 ± 0.01b | 0.40 ± 0.07b |
| 15 | 0.20 ± 0.01b | 0.26 ± 0.02b | 0.06 ± 0.02 a | 0.11 ± 0.02b | 0.10 ± 0.01a | 0.55 ± 0.01c |
| 20 | 0.02 ± 0.01a | 0.09 ± 0.01a | 0.08 ± 0.005a | 0.04 ± 0.001a | 0.10 ± 0.01a | 0.53 ± 0.03c |
| Mezcla Pb-Cr(VI) | ||||||
| 5 - 5 | 0.32 ± 0.02b | 0.17 ± 0.1b | 0.23 ± 0.01b | 0.30 ± 0.02b | 0.10 ± 0.06a | 0.03 ± 0.01a |
| 10-5 | 0.26 ± 0.03a | 0.03 ± 0.001a | 0.09 ± 0.02a | 0.27 ± 0.03a | 0.43 ± 0.01b | 0.03 ± 0.01a |
| 5-10 | 0.37 ± 0.03c | 0.61 ± 0.02c | 0.06 ± 0007a | 0.31 ± 0.03b | 0.08 ± 0.007a | 0.04 ± 0.01a |
Los valores representan la media y la desviación estándar para tres muestras independientes.
Diferentes letras en una misma columna indican diferencias significativas (P≤0.05).
Values represent the mean and standard deviation from three independent samples.
Different letters in the same column indicate significant differences (P≤0.05).
El FT en presencia de Pb fue mayor en concentraciones bajas y disminuyó al incrementarse la concentración. A altas concentraciones de Cr (VI) en la solución, mayor FT, este comportamiento puede ser consecuencia del daño de la membrana plasmática, que interfiere con la funcionalidad de los transportadores e impide los mecanismos normales de captación celular (Shri et al., 2009). Los valores obtenidos de FT, indican una baja eficacia de trasladar el metal en raíces a partes aéreas. Duman y Ozturk (2010), trabajaron con Nasturtium officinale exponiéndolo a níquel obteniendo resultados similares a los encontrados en este estudio. En otros estudios se ha observado el mismo comportamiento tal es el caso de Pistia stratiotis (Das et al., 2014), Eichhornia crassipes (Souza et al., 2018), Elodea canadensis (Picco et al., 2019) Typha latifolia y Juncus effusus (Favas et al., 2012). Shi et al. (2011), sugieren que plantas con características similares a las encontradas en el presente estudio sean consideradas especies estabilizadoras de metales pesados o rizofiltradoras (Olmos-Márquez et al., 2012).
Para las mezclas metálicas el IT y FBC en Pb, fue mayor a concentraciones superiores de Cr (VI) en solución. El valor mayor de FT se estimó cuando ambos metales se encontraron a la misma concentración (Tabla 1). El IT evaluado para Cr (VI), fue menor a altas concentraciones de Pb, los demás tratamientos no mostraron diferencias significativas. Mientras el FBC para Cr (VI) se incrementó a mayor concentración de Pb y el FT no mostró diferencias significativas entre los tratamientos. Los resultados obtenidos de las mezclas de metales indican que ambos metales a concentraciones similares favorecen la translocación de Pb; cuando alguno de los metales se encuentra en mayor concentración en la solución, se promueve la acumulación del otro. Los valores obtenidos de IT y FBC en las mezclas se pueden comparar en magnitud a los obtenidos individualmente en los tratamientos de 3 y 6 mg L-1 de cada metal. Mientras que, el FT es menor en mezcla en comparación con lo cuantificado por metal individual. Lo anterior indica que existen interacciones químicas entre metales que pueden modificar la toxicidad, la disponibilidad y su acumulación en berro. Se sugiere para futuros trabajos evaluar un mayor número de variables dentro del sistema para establecer las interacciones que puede favorecer la bioacumulación de algún metal en particular.
Humedal construido
Durante la operación del HCs solo fue posible cuantificar la concentración de Pb (5.6 mg L-1) en el efluente las primeras 48 h ya que posteriormente la concentración se encontraba por debajo del límite de cuantificación (0.5 mg L-1) del equipo de EAA. Este comportamiento se pudo deber a la interacción del Pb con la grava, ya que está compuesta por caliza, granito, dolomita, arenisca, cuarcita y minerales de cuarzo, los cuales reaccionan para formar hidróxidos metálicos y modificar el pH del medio (Naiya et al., 2009), promoviendo la precipitación del Pb. Dentro del HCs el pH se incrementó a 5.6, precipitándose el metal y haciéndose menos disponible para la planta. La cuantificación de Pb en berro al principio y final del experimento (330 mg kg-1) no indicó diferencias estadísticas.
Sin embargo, se cuantificaron 3.4 mg L- de Cr total en el efluente los primeros cuatro días y posteriormente 1.3 mg L-1 (Figura 3). Al día 2 la cuantificación de Cr total en berro fue de 360 mg kg-1 y 606 mg kg-1 para el final del experimento. La acumulación de Cr en berro fue incrementándose a lo largo del tiempo. Esto se relaciona con los resultados obtenidos en la sección anterior, donde probablemente la toxicidad del Cr (VI) fue modificada, debido a una reducción química a Cr (III) y a la interacción superficial con la grava la cual modifica el pH del medio. Además, no se descarta la generación de exudados radiculares como agentes reductores o quelantes (Hellerich et al., 2008; Ovecka y Takac, 2014).
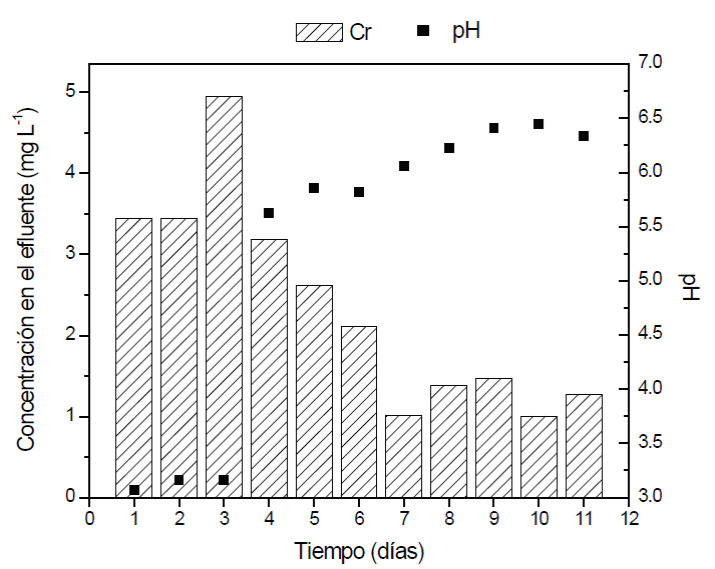
Figura 3 Comportamiento del pH y concentración de cromo en el efluente del humedal
Figure 3. pH behavior and chromium concentration in the
wetland effluent.
El humedal diseñado en este estudio logró remover 95 y >99.9% de Cr total y Pb, respectivamente. Los resultados observados indican que la acumulación de los metales depende de su disponibilidad hacia el área radicular y que esta puede modificarse por variables ambientales como pH, temperatura, potencial óxido - reducción, concentración de iones, entre otros parámetros (Liu et al., 2019).
Balance de masa para metales dentro del humedal
La masa total de cada metal disponible para berro, se estimó con la masa de entrada menos el porcentaje precipitado de cada metal en el experimento control, el cual indicó un 80 y 50 % de precipitación para Pb y Cr, respectivamente. Los balances totales de masa para Pb (2 días) y Cr total (11 días) se muestran en las ecuaciones cinco y seis, respectivamente. Donde cada variable se encuentra relacionada con la fracción total de metal cuantificado.
En ambas ecuaciones se observa que la fracción de metal acumulada en berro es baja comparada con el resto de las variables estimadas. Los fenómenos de precipitación generaron mayor retención del metal dentro del HCs y otros fenómenos fisicoquímicos y biológicos no evaluados en el presente estudio retuvieron el 44 y 19 % de Cr total y Pb, respectivamente. Algunos fenómenos no evaluados en el presente estudio pero que pudieron influir en el resultado, involucran la presencia de microorganismos anaerobios que generan condiciones reductoras en zonas anóxicas que modifican la biodisponibilidad de los metales en solución (Ye et al., 2013; Pedescoll et al., 2015), y la presencia de compuestos orgánicos e inorgánicos que están presentes en los ecosistemas que modifican la movilidad del metal (Azouzi et al., 2019), tal es el caso de los exudados radiculares (Ovecka y Takac, 2014).
Las simulaciones realizadas para conocer la especiación de Pb y Cr (VI) sin presencia de grava mostró formaciones de Pb(NO3)2, PbNO3 + y CrO3HPO4 2- correspondientes al 58, 31 y 96 %, de la masa total precipitada de los metales, respectivamente. Mientras los productos formados en presencia de grava son PbHCO3 + y PbCO3 para Pb que representan el 95 % de la masa total precipitada. Así mismo, el CaCrO4 representa el 89 % del Cr precipitado.
Conclusiones
El berro tiene la capacidad de acumular Cr y Pb en raíces, considerándose una especie rizofiltradora y estabilizadora. Las interacciones químicas entre los metales influyen en su acumulación. Al aumentar las concentraciones individuales de cada metal en la solución, se incrementa su acumulación, pero disminuye el índice de tolerancia y el factor de bioconcentración para ambos metales. El factor de translocación aumenta a mayor concentración de cromo en solución. Las mezclas de metales favorecen la acumulación de un metal con respecto a otro e incrementan el índice de tolerancia del berro. La mayor remoción de los metales dentro del humedal fue causada por interacciones entre ambos metales y la grava. De acuerdo con el balance de masa realizado en el humedal artificial, se removió el 95 y >99.9 % de Cr (VI) y Pb de la solución.











 nueva página del texto (beta)
nueva página del texto (beta)


