Introducción
A nivel mundial, la producción de tilapia se ha incrementado considerablemente, tan sólo en el año 2017, su producción total fue de aproximadamente de 6.5 millones de t (Mapfumo, 2019). Actualmente, el consumo de estos peces de agua dulce ha tenido una amplia aceptación por parte de los consumidores. Además, no solamente son consideradoscomo una excelente fuente de alimento, sino que también representan un gran potencial como fuente de ingresos, por lo que se ha llevado a la tilapia a los puestos de liderazgo en la comercialización en los mercados nacionales e internacionales (Fitzsimmons, 2010).
En la literatura se ha descrito que en los productos de la pesca se llevan a cabo una serie de cambios bioquímicos posmortem, de los cuales, el rigor mortis ha sido considerado como uno de los de mayor importancia (Wang et al., 1998), debido a la influencia que ejerce sobre la apariencia, estructura y calidad del músculo (Roth et al., 2007). El rigor mortis es un fenómeno que inicia inmediatamente después de la muerte del animal y durante esta etapa, el músculo pasa de un estado relajado a otro rígido e inflexible, debido a que las reservas de energía presentes en él se han agotado (Gornik et al., 2009). De igual forma, involucra una serie de reacciones y cambios posmortem en la textura, pH, la capacidad de retención de agua, entre otros, los cuales a su vez ejercen un impacto sobre la calidad del producto final (Durán et al., 2008).
Uno de los principales factores que afecta el rigor mortis es la temperatura de almacenamiento (Llerena y Nué, 2002; Jiménez-Ruiz et al., 2013). Además de esto, se ha observado que retardar el inicio y velocidad del rigor mortis promueve una mejor calidad y mayor vida de anaquel (Tomé et al., 2000; Llerena y Nué, 2002). En consecuencia, es importante el estudio de los aspectos y eventos relacionados con el proceso del rigor mortis, para determinar las condiciones apropiadas de manejo pre y poscaptura de las especies, lo cual a su vez podría resultar en un mejor aprovechamiento de las mismas. En base a lo anterior, en el presente estudio se evaluó el efecto de la temperatura (0 y 5ºC) y tiempo de almacenamiento sobre el rigor mortis del músculo de tilapia (Oreochromis niloticus).
Materiales Y Métodos
Colecta y toma de muestra
Los organismos de tilapia (Oreochromis niloticus) fueron obtenidos directamente del sitio de cultivo localizado en la presa “El Novillo” de Sonora, México. Los especímenes con un peso y talla promedio de 961.00 ± 0.15 g y 33.60 ± 1.69 cm de longitud, respectivamente, fueron sacrificados por choque térmico en un contenedor con agua y hielo. Una vez sacrificados, se tomaron 20 especímenes al azar para monitorear el índice de rigor desde el inicio del experimento. Seguidamente, fueron colocados en camas alternas de hielo-pescado-hielo dentro de una hielera hermética para su transporte al Laboratorio de Investigación en Alimentos de la Universidad de Sonora. El tiempo transcurrido entre la poscosecha y el arribo de los organismos a las instalaciones de la universidad no excedió las 3 h.
Una vez en el laboratorio, los organismos se dividieron en cuatro lotes: dos se almacenaron enteros durante 266 horas a 0 y 5°C, respectivamente y los otros dos se filetearon y empacaron en bolsas de polietileno y se almacenaron durante 48 horas a 0 y 5°C, respectivamente. El IR se determinó en organismos enteros, mientras que el ATP, el glucógeno, el ácido láctico, el pH y la textura se determinaron en los filetes durante el almacenamiento. Para cada tiempo de muestreo se tomaron 6 filetes. En el caso de la evaluación de ATP, ácido láctico y glucógeno, los filetes se congelaron y almacenaron a -80°C hasta su análisis.
Índice de Rigor (IR)
La medición del rigor mortis se basó en la curvatura de la cola (Bito et al., 1983). Los peces se colocaron en una mesa plana para que el cuerpo detrás del extremo posterior de la aleta dorsal colgara sobre el borde. El IR se determinó mediante la siguiente fórmula IR = [(Lo- Lt) / Lo] x 100, donde L representa la distancia vertical que separa la base de la aleta caudal y la superficie de la mesa, medida inmediatamente después de la muerte (Lo) y durante el almacenamiento (Lt) (Figura 1).
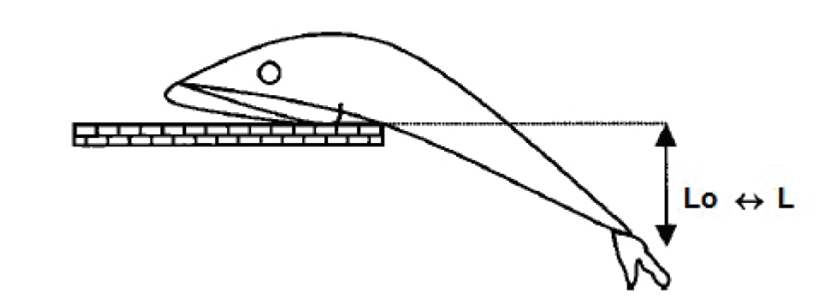
Figura 1 Medición del índice de rigor (Bito et
al., 1983).
Figure 1.
Measurement of the rigor index (Bito
et al., 1983).
Atp
La cuantificación de ATP se llevó a cabo por cromatografía líquida de alta presión (HPLC) de acuerdo a la metodología descrita por Ryder (1985). Se inyectaron 20 µL de un extracto de músculo en un cromatógrafo Varian Prostar 240 (Varian Inc, Lake Forest, CA), usando una columna de fase reversa C-18, 4.6 x 150 mm (Varian Inc., Lake Forest, CA). La fase móvil consistió en un amortiguador de fosfatos (0.04 M KH2PO4 y 0.06 M K2HPO4) con un flujo de 1 mL/min. La detección se realizó a 254 nm en un detector UV-Vis Varian Prostar 325 (Varian Inc., Lake Forest, CA).
Glucógeno
El contenido de glucógeno se determinó en 2 g de músculo utilizando el método de antrona descrito por Racotta et al. (2003). La absorbancia se midió en un espectrofotómetro Varian Inc., Cary Model 100 UV-Visible Bio (Varian Australia Pty Ltd.).
Ácido láctico
La cuantificación del ácido láctico se llevó a cabo en un extracto de músculo de tilapia. El extracto se obtuvo homogeneizando 3 g de músculo con 15 mL de ácido perclórico 0.6 M a 0°C, en un homogeneizador Ultra-turrax T18 Basic (IKA Woeks Inc., Wilminaton, NC) a 18,000 rpm durante 1 min. El homogeneizado se centrifugó a 5500 x g a 0°C en una centrífuga refrigerada Thermo Electron Modelo IEC-MULTI RF (Thermo Fisher Scientific Asheville, NC 28804), por 10 min. Posteriormente, una alícuota de 7 mL del sobrenadante se neutralizó a un pH de 6.5-6.8 con KOH 1 M, dejándose reposar por 30 min a 0°C. Inmediatamente, el perclorato de potasio se removió por filtración con papel Whatman No. 4. El sobrenadante se diluyó a 15 mL con agua destilada y las muestras se almacenaron a -80°C hasta su utilización. Se utilizó un kit comercial (Randox, Antrim, Reino Unido, LC2389), siguiendo el protocolo especificado por el proveedor.
pH
La determinación de pH se llevó a cabo por la metodología descrita por Woyewoda et al. (1986) y fue monitoreado usando un potenciómetro Thermo Electron Co. (Orion 420 A).
Textura
Se midió el esfuerzo al corte para evaluar la textura del músculo de tilapia usando una celda Warner-Bratzler en un texturómetro (Modelo EZ-S Shimadzu Corp) equipado con una celda de comprensión de 50 kg. La velocidad de cabezal fue de 20 cm/min y el esfuerzo al corte fue aplicado transversalmente en dirección de las fibras del músculo. Se realizaron secciones de geometría uniforme (10 mm de ancho x 10 mm de grosor x 20 mm de largo), los cuales se colocaron perpendicularmente al sentido de la ranura de corte.
Diseño experimental y análisis estadístico
Se aplicó estadística descriptiva (media y desviación estándar) previo al análisis de varianza (ANOVA) de una sola vía con un nivel de significancia de 0.05. Se empleó un diseño completamente al azar, teniendo como variables la temperatura de almacenamiento con dos niveles (0 y 5ºC) y el tiempo de almacenamiento. Para el índice de rigor se tomaron muestras de diez organismos (n = 10) y para el resto de las determinaciones analíticas se tomaron muestras de seis organismos (n = 6). En los casos donde se detectaron diferencias significativas, se aplicó la prueba de Tukey y se empleó el paquete estadístico NCSS 2001.
Resultados Y Discusiones
Índice de rigor (IR)
El rigor mortis es el parámetro más notable de los cambios posmortem que afectan las propiedades físicas del músculo. Este inicia en el pescado pocas horas después de su muerte y se manifiesta por la rigidez e inflexibilidad de los músculos (Tomé et al., 2000). En la Figura 2, se presentan los resultados del índice de rigor en organismos de tilapia almacenados a 0 y 5ºC durante 266 h. En ella se puede observar que el inicio del rigor mortis se desarrolló inmediatamente después de la muerte del pez; luego de 24 h de almacenamiento a 5ºC se alcanzó el 100 ± 0.0% de IR, mientras que a 0ºC se alcanzó a las 48 h. Posteriormente, se presentó una disminución significativa (p<0.05) a partir de las 99 h y se observaron diferencias tanto en la temperatura como en el tiempo del almacenamiento. Esta disminución del rigor podría ser resultado de la hidrólisis de algunas proteínas estructurales del músculo (Tomé et al., 2000). En el caso de la temperatura de 5ºC, Ando et al. (1991) reportaron los mismos valores de IR a las 24 h en trucha arcoíris (Oncorhynchus mykiss). En la literatura se ha descrito que la temperatura de almacenamiento es uno de los principales factores que influyen en el desarrollo del rigor mortis (Abe y Okuma, 1991; Watabe et al., 1989). Erikson y Misimi (2008) observaron que este fenómeno se promueve más rápido a temperaturas de almacenamiento mayores a 0ºC y con contracciones más fuertes.
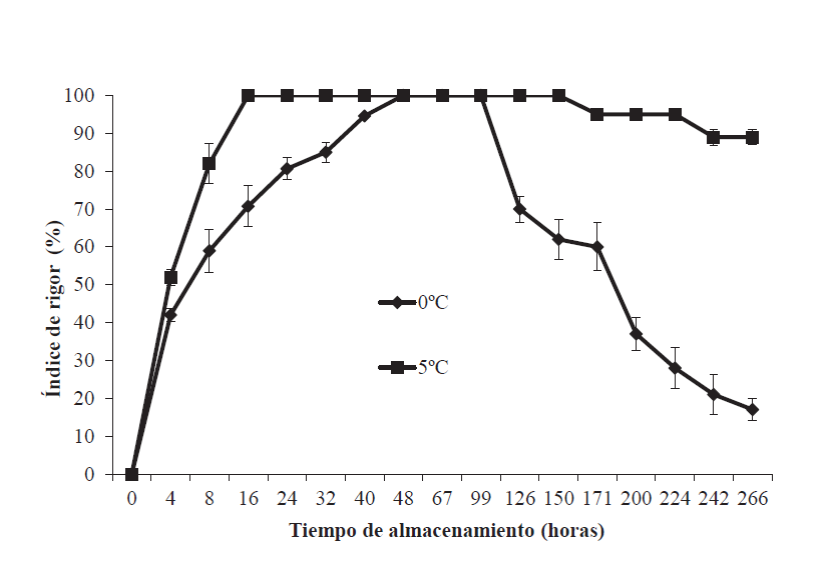
Figura 2 Índice de rigor en tilapia (Oreochromis niloticus) almacenada a 0 y
5ºC durante 266 h. Los puntos de datos son la media de n = 10. Las
barras representan la desviación estándar.
Figure 2. Rigor index in tilapia (Oreochromis
niloticus) stored at 0 and 5°C for 266 h. The data points are the
average of n = 10. The bars represent the standard
deviation.
Atp
El ATP es el nucleótido más abundante en el músculo de los organismos vivos. Se ha observado que los niveles de ATP en productos pesqueros disminuyen significativamente durante las primeras 24 h postmortem, además, la velocidad y nivel de degradación se relaciona con la especie y el tipo de músculo (Sikorski et al., 1990). En la Figura 3 se presentan los resultados de ATP en el músculo de tilapia almacenado a 0 y 5ºC durante las primeras 48 h posmortem. En ella se puede observar que los organismos presentaron un valor inicial de ATP de 0.26 ± 0.01 µmol/g de músculo. Posteriormente, este valor disminuyó (p<0.05) después de 48 h hasta 0.24 ± 0.02 y 0.20 ± 0.01 µmol/g para 0 y 5°C, respectivamente.
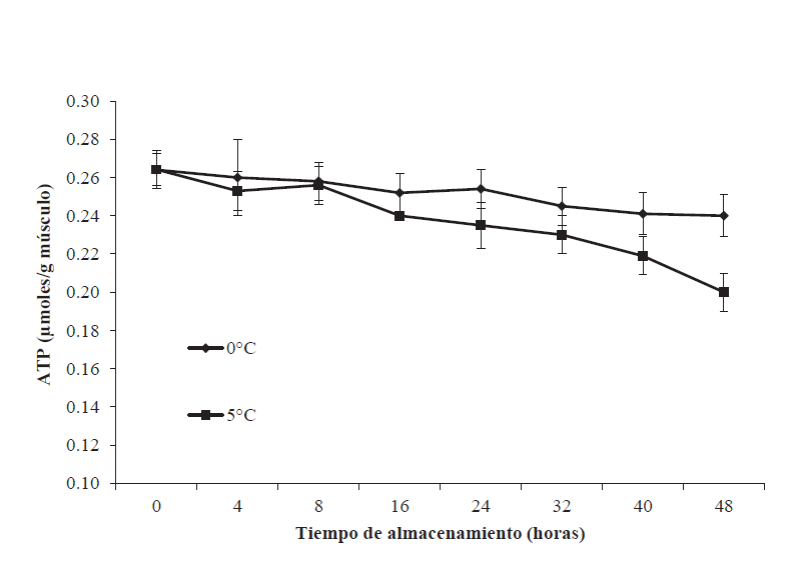
Figura 3 Contenido de ATP en el músculo de tilapia (Oreochromis niloticus)
almacenada a 0 y 5ºC durante 48 h. Los puntos de datos son la media
de n = 6. Las barras representan la desviación estándar.
Figure 3. ATP in tilapia muscle (Oreochromis niloticus)
stored at 0 and 5°C for 48 h. The data points are the average of n =
6. The bars represent the standard deviation.
En la literatura se ha descrito que, a bajas temperatura de almacenamiento la actividad de la bomba de Ca2+ del retículo sarcoplásmico disminuye, lo que provoca la presencia de altas concentraciones de Ca2+ en las miofibrillas que activan la ATP-asa miofibrilar, acelerando el consumo de ATP (Darmodaran y Gopakumar, 1988). En éste caso, se encontraron diferencias (p<0.05) en el consumo de ATP con respecto a la temperatura de almacenamiento, siendo mayor la disminución de ATP a 5ºC. Los valores iniciales de ATP obtenidos en el presente estudio son similares al reportado por Tomé et al. (2001), quienes encontraron 0.2 µmol/g en el músculo de cachama (Cachama sp.). La mayoría de los estudios coinciden al reportar valores de ATP menores a 1 µmol/g en las primeras 12-24 h, observándose normalmente el inicio del rigor mortis en este periodo de tiempo. Lo anterior se ha evaluado en la tilapia del Nilo (Oreochromis niloticus) (Montoya-Camacho et al., 2018; Castillo-Yáñez et al., 2014), el pez sierra (Scomberomorus sierra) (Ramírez-Guerra et al., 2018) y el salmón del Atlántico Salmo salar (Mørkøre et al., 2008), entre otras especies.
Glucógeno
La principal fuente energética para mantener el nivel fisiológico de ATP en el tejido muscular es la degradación del glucógeno almacenado. En la Figura 4 se presentan los resultados de glucógeno en el músculo de tilapia almacenados a 0 y 5ºC al inicio y final del almacenamiento. El contenido inicial de glucógeno fue de 2.97 ± 0.20 mg/g de músculo, el cual disminuyó a las 48 h posmortem a 2.79 ± 0.23 (p>0.05) y 1.81 ± 0.012 (p>0.05) a 0 y 5ºC, respectivamente. Estos resultados iniciales concuerdan con los reportados por Montoya-Camacho et al. (2018), quienes encontraron 5.36 mg/g en el músculo de tilapia (Oreochromis niloticus) durante el almacenamiento en congelación. Por otra parte, los valores son superiores al reportado por Cappeln y Jessen (2002), quienes encontraron un valor de 0.2 mg/g en el músculo de bacalao (Gadus morhua) durante el almacenamiento a 0ºC.
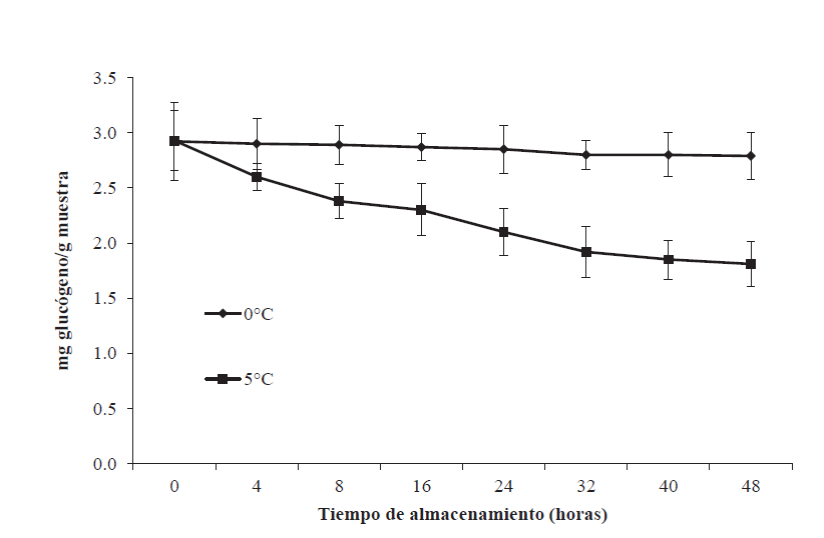
Figura 4 Contenido de glucógeno en el músculo de tilapia (Oreochromis
niloticus) almacenada a 0 y 5ºC durante 48 h. Los
puntos de datos son la media de n = 6. Las barras representan la
desviación estándar.
Figure 4. Glycogen content in tilapia muscle
(Oreochromis niloticus) stored at 0 and 5°C for 48 h. The data
points are the average of n = 6. The bars represent the standard
deviation.
En cuanto a la temperatura de almacenamiento, Jiménez-Ruiz (2012) observó una disminución más pronunciada en el contenido de glucógeno en el músculo abductor de la almeja mano de león (Nodipecten subnodosus ) almacenado a 10°C que a 5 y 0°C. Por otra parte, Huss (1998) y Cappeln y Jessen (2002) indicaron que las variaciones en el contenido de glucógeno se pueden deber principalmente a la especie, al tamaño y al estado reproductivo de los organismos, así como también al estado nutricional del pez y el grado de agotamiento y estrés al momento de la muerte.
Ácido láctico y pH
En la Tabla 1 se presentan los resultados de ácido láctico en el músculo de tilapia al inicio y después de 48 h de almacenamiento a 0 y 5ºC. En cuanto al ácido láctico, se encontró un valor inicial 2.37 ± 0.26 µmol/g de músculo, el cual no varió (p≥0.05) con respecto a la temperatura de almacenamiento, sin embargo, si se observó un aumento (p<0.05) durante el tiempo de almacenamiento, alcanzando valores de 3.08 ± 0.30 µmol/g a 0ºC y 2.56 ± 0.22 µmol/g a 5ºC a las 48 h poscaptura. En general, este compuesto es el principal responsable de la acidificación del músculo posmortem (Abe y Okuma, 1991).
Tabla 1 Efecto de la temperatura de almacenamiento (0 y 5ºC) sobre el desarrollo de
rigor mortis durante 48 h
posmortem.
Table 1. Effect
of storage temperature (0 and 5ºC) on the development of rigor
mortis during 48 h postmortem.
| Determinación | 0°C | 5°C | |
|---|---|---|---|
| 0h | 48h | 48h | |
| Ácido láctico (µmol/g) | 2.37 ± 0.26a | 3.08 ± 0.30b | 2.56 ± 0.22b |
| Textura (N) | 6.52 ± 0.22a | 6.13 ± 0.39b | 5.99 ± 0.37b |
Los valores son promedios de n = 6 ± desviación estándar. Los promedios con superíndices diferentes en una misma fila son significativamente diferentes (p≤ 0.05).
En la Figura 5 se puede observar que el pH inicial fue de 6.77 ± 0.03. Este valor está dentro del intervalo (6.7-7.0) reportado por Love (1976) para organismos marinos inmediato a su captura. En el presente estudio el pH no cambió significativamente (p≥0.05) con la temperatura, pero si con el tiempo de almacenamiento, en donde se observó una disminución (p<0.05) a las 48 h, obteniendo valores de 6.69 ± 0.04 y 6.70 ± 0.04 para 0 y 5ºC, respectivamente. Estos resultados concuerdan con los reportados por Durán et al. (2008), quienes encontraron un pH de 6.7 en el músculo de carpa (Cypinus carpio) a las 48 h de almacenamiento a una temperatura de 6-8ºC. Esta disminución de pH durante las primeras 48 h posmortem pudiera relacionarse con el aumento de los niveles de ácido láctico encontrados en este mismo periodo de tiempo (Batista et al., 2004).
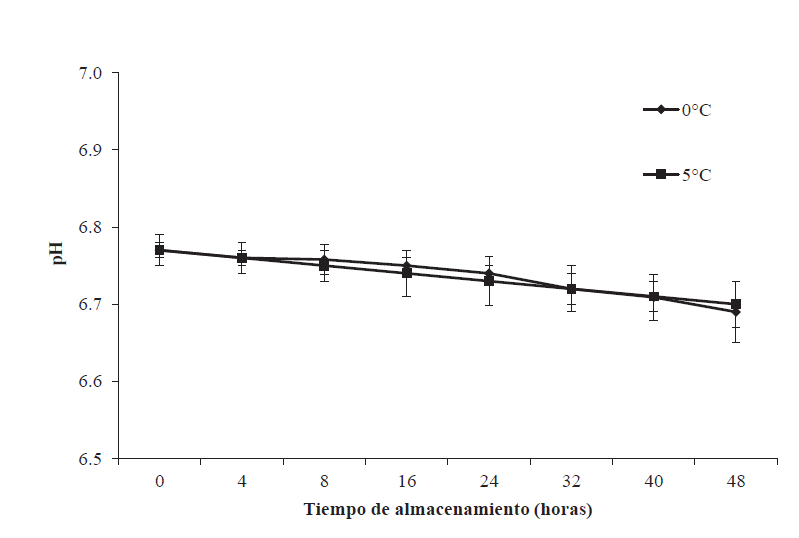
Figura 5 pH del músculo de tilapia (Oreochromis niloticus) almacenada a 0 y
5ºC durante 48 h. Los puntos de datos son la media de n = 6. Las
barras representan la desviación estándar.
Figure
5. pH of tilapia muscle (Oreochromis niloticus) stored at
0 and 5°C for 48 h. The data points are the average of n = 6. The
bars represent the standard deviation.
Textura
La textura es uno de los atributos más utilizados por los consumidores para asegurar la calidad de los alimentos. En la Tabla 1 se presentan los resultados de textura del músculo de tilapia durante el almacenamiento a 0 y 5ºC. El músculo de tilapia presentó un valor inicial de 6.52 ± 0.22 N, el cual disminuyó a las 48 h (p<0.05) alcanzando valores de 6.13 ± 0.39 y 5.99 ± 0.37 N para 0 y 5ºC, respectivamente. Esta reducción en la textura se pudiera deber a la degradación del colágeno por efecto de la disminución del pH, así como también por la actividad de enzimas endógenas (Huss, 1998). Estos resultados son similares a los descritos por Cropotova et al. (2019), Chang y Wong (2012) y Durán et al. (2008) quienes reportaron un valor inicial de textura de 5-6, 8.5 y 8.5-9.5 N en el músculo caballa del Atlántico (Scomber scombrus), cobia (Rachycentron canadum) y trucha arcoíris (Oncorhynchus mykiss), respectivamente.
Conclusiones
El almacenamiento del músculo de tilapia a 5°C provocó que el rigor mortis iniciara más rápido y fuera más pronunciado en comparación con 0°C, por lo que a esta última temperatura se pudo retardar el inicio del rigor mortis. Por consiguiente, los resultados obtenidos en el presente estudio podrían sugerir una mayor calidad y vida de anaquel a 0°C de acuerdo al comportamiento observado en los parámetros evaluados.











 nueva página del texto (beta)
nueva página del texto (beta)


