Introducción
Actualmente, las matrices naturales han provocado un creciente interés para los investigadores, esto se debe princialmente a la riqueza en el contenido de biomoléculas naturales, principalmente los compuestos antioxidantes (Martins et al., 2015). Se conoce que el uso de antioxidantes de origen vegetal, tales como ácidos fenólicos, flavonoides, tocoferoles en la industria alimentaria, ha cobrado cada día mayor importancia debido a los beneficios atribuidos para la salud humana (Daza et al., 2014).
El higo (Ficus carica) es una planta muy apreciada desde hace milenios, y su origen se ubica en Oriente Medio. Su fruto se consume en fresco como rica fuente de nutrientes y de múltiples formas en productos procesados (SIAP, 2014) y su consumo ha ido en aumento (Villalobos et al., 2016). Las frutas frescas de higo tienen naturalmente una vida corta después de la cosecha, alrededor de 7 a 10 días (Veberic et al., 2008). Conforme el proceso de oxidación va en aumento, se ha encontrado que la actividad de los sistemas enzimáticos antioxidantes disminuye (Montoya et al., 2012). Es por ello, que se ha intensificado la búsqueda por mejorar las técnicas que permitan la prolongación de los compuestos bioactivos. Entre las alternativas propuestas, la microencapsulación es un proceso de conservación que permite la protección de la molécula activa dentro de una capa de recubrimiento (Özdemir y Gokmen, 2015).
La microencapsulación por coacervación es la separación de fases de uno o varios hidrocoloides de la solución inicial y la posterior deposición de la fase de coacervación recién formada alrededor del ingrediente activo suspendido en los medios de reacción. Dependiendo del número de ingredientes poliméricos, el proceso de coacervación se puede dividir en dos tipos: simples y complejos (Zhang et al., 2012). La coacervación compleja es aquella en la cual dos o más polímeros lineales e irregulares con cargas opuestas se unen, actuando como materiales de pared (Qv et al., 2011). Sin embargo, el biopolímero utilizado como pared puede influir en la estabilidad de dichos compuestos. La selección de un material de pared apropiado, así como las propiedades fisicoquímicas del material son factores que rigen el funcionamiento adecuado de los sistemas de microcápsulas (Gupta et al., 2015). Dentro de un sistema de microencapsulación por coacervación compleja, los complejos de proteína/ polisacárido se originan principalmente en las interacciones electrostáticas de las macromoléculas de carga opuesta.
La soya es reconocida como una excelente fuente de proteínas de bajo costo que puede ser utilizada en la industria alimentaria y de envasado. Además, puede actuar como barrera en la transferencia de oxígeno y dióxido de carbono, lo que aumenta el interés de utilizarse como material de pared en el proceso microencapsulación (Nesterenko et al., 2014). Por otra parte, la gelatina es uno de los materiales más utilizados como sistema de pared, debido a sus buenas propiedades de emulsificación, formación de película, solubilidad en agua, alta actividad de estabilización; así como su tendencia a formar una densa red fina (Akhavan et al., 2016). La goma arábiga, conocida también como Acacia senegal, en uno de los materiales de pared más usados en la microencapsulación debido a su baja viscosidad, así como su propiedad de formación de películas (Gupta et al., 2015). Por lo tanto, el objetivo del siguiente trabajo fue microencapsular extractos de higo en tres etapas de maduración, así como la evaluación de su estabilidad mediante la técnica de fenoles totales, bioensayo de hemólisis y ABTS.
Materiales Y Métodos
Material vegetal
Los frutos de higo (Ficus carica) fueron recolectados de un sembradío local, ubicado en el municipio de Cajeme. Las muestras fueron lavadas, secadas y seleccionadas de acuerdo con su estado de madurez: Desarrollo, Maduro y Sobremaduro (FAO, 2003).
Medición de color, pH y solidos solubles totales
El color externo característico de los frutos (L*, a*, b*), se evaluaron de acuerdo con el sistema CIELAB utilizando un espectrofotómetro de Esfera (Serie SP60, Michigan, USA) midiendo la epidermis del fruto. La expresión de los resultados fue la media de 10 frutos con 5 mediciones por fruto. La determinación de los valores C* y H*, que corresponden a Croma (chroma) y tono (hue), respectivamente, se realizó de acuerdo a las fórmulas descritas por Mathias-Rettig y Ah-Hen (2014):
El pH se determinó de forma directa en muestras de 5 higos homogenizados con un potenciómetro (STARTER 3100, OHAUS, Parsippany, NJ, USA). Los resultados fueron la media de al menos 3 análisis por 3 repeticiones. Los sólidos solubles totales (SST) se determinaron colocando de forma directa una gota de muestra homogeneizada en un refractómetro digital (ATAGO Hand held pocket refractometer PAL-1 No. 3810). Los resultados se expresaron en °Brix y fueron el promedio de 10 repeticiones.
Preparación de extractos
Los frutos en cada estado de madurez fueron secados a 50 °C por 72 h y posteriormente pulverizadas en licuadora hasta obtener un polvo fino. Cinco g de muestra fueron mezclados con 50 mL de etanol al 96 % y macerados por 72 h, seguido fueron llevadas a sonicación por 25 min a 4 °C en un sonicador (Branson 3510). Posteriormente, se filtró al vacío con papel whatman No.1 y se concentró el extracto mediante evaporación rotativa a 45 °C (Buchi Heating Bath B-490, Buchi Rotavapor) (Sultana et al., 2009). Por último, los extractos (de cada estado de madurez) fueron liofilizados y almacenados a -20 °C en recipientes de plástico previo a la realización de las cápsulas, así como a los análisis correspondientes.
Microencapsulación de extractos
Las microcápsulas fueron preparadas por coacervación compleja de acuerdo con la técnica descrita por Santos et al. (2015) y García et al. (2016) con algunas modificaciones. Se realizó la formulación de la microcápsula, en dos complejos; el primero contenía Proteína de Soya Aislada (SPI), Goma Arábiga (GA), así como el extracto de higo, y el segundo Gelatina (G), Goma Arábiga y extracto de higo. Previamente, se realizó una emulsión de la muestra. Para ello se tomó el extracto a encapsular de cada etapa de maduración y se realizó una primera emulsión, utilizando aceite comercial, y posteriormente se adicionó tween 80 como tensioactivo, para la segunda emulsión. Este proceso se realizó utilizando un Ultra turrax (T18 basic, IKA). Posteriormente se le agregó lentamente una solución acuosa de GA (2.5 % p/v) homogenizando por 3 min a 10,000 rpm, seguido de la solución acuosa de la proteína de Soya Aislada, para el primer complejo y Gelatina, para el segundo complejo (2.5 % p/v) bajo agitación magnética. La relación final del complejo fue de 1:1:0.25 (Proteína: polisacárido: extracto). Se ajustó el pH a 4 usando ácido acético 1 M. El complejo fue enfriado en un baño de hielo bajo agitación, con una temperatura de 10 °C, agregando Tripolifosfato de sodio 0.05 M como material reticulante. El material coacervado fue almacenado por 24 h a 6 °C hasta lograr la decantación y separación de las fases. Finalmente, las microcápsulas coacervadas fueron liofilizadas (Freeze Dryer DC401, Yamato) y almacenadas a -20 °C hasta su posterior análisis. Los complejos formados y/o tratamientos fueron: T1: Desarrollo SPI/GA; T2: Maduro SPI/GA; T3: Sobremaduro SPI/GA; T4: Desarrollo G/GA; T5: Maduro G/GA; T6: Sobremaduro G/GA.
Morfología de microcápsulas
Una vez realizado la encapsulación, se tomaron muestras de cada tratamiento y se tiñeron con azul de tripano y se observó la morfología de las microcápsulas a través de un microscopio de epifluorescencia (Nikon Microscope Eclipse 50i) ayudado por el software NIS Elements Viewer para la obtención de imágenes, utilizando un objetivo de 40x.
Rendimiento de microencapsulación
El rendimiento de microencapsulación se realizó de acuerdo con el método descrito por Pulido y Beristain (2010). El rendimiento se calculó a partir de la relación entre los gramos de polvo de microcápsulas después del secado y los sólidos totales, es decir, la cantidad de extracto y biopolímeros adicionado en la solución, de acuerdo con la siguiente fórmula:
Estabilidad de las microcápsulas
Para la evaluación de la estabilidad de las microcápsu-las, se realizó una disrupción de las mismas disolviendo 0.2 g de cápsulas en citrato de sodio al 10 % (p/v) como material de liberación de núcleo (Nori et al., 2011). La estabilidad de las microcápsulas se determinó por evaluación del contenido de compuestos fenólicos, bioensayo de hemólisis, así como inhibición del radical ABTS en las muestras liofilizadas. Estas evaluaciones se realizaron una vez por semana durante 28 días para cada uno de los complejos.
Determinación de fenoles totales
El contenido de fenoles totales se cuantificó mediante el método descrito por Silva-Beltrán et al. (2015) con algunas modificaciones. La mezcla de reacción consistió en 150 µL del reactivo Folin-Ciocalteau, 120 µL de Na2CO3 y 30 µL de muestra. Se dejó reposar por 20 min en completa oscuridad y se leyó la absorbancia a 750 nm en lector de microplacas. La concentración de fenoles totales se calculó utilizando una curva estándar de ácido gálico y los resultados se expresaron como mg equivalentes de ácido gálico por gramo de peso seco de polvo microencapsulado.
Inhibición del radical ABTS
La técnica de inhibición del radical Ácido 2,2›-azino-bis (3-etilbenzo tiazolin-6 sulfónico) [ABTS], se realizó de acuerdo a la metodología descrita por Re et al. (1999) con algunas modificaciones. El radical ABTS se preparó al mezclar 19 mg en 5 mL de agua destilada, de igual manera, se preparó una solución de persulfato de potasio (37.8 mg/mL en agua destilada). Posteriormente, se tomaron 88 µL de persulfato de potasio y se le añadieron a la solución de ABTS, dejando en reposo la mezcla resultante por 12-16 h a temperatura ambiente. Una vez transcurrido el tiempo de reposos, se tomaron 500 µL de la solución ABTS y se diluyeron en 30 mL de etanol 96%, para ajustar la absorbancia a 0.7 ± 0.02 en un lector de microplacas a 750 nm (Thermo Scientific Multiskan Go, Vantaa, Finland). Una vez ajustado el radical, se tomaron 295 µL y 5 µL del extracto y la reacción se dejó reposar por 7 min y se leyó la absorbancia a 750 nm. La actividad antioxidante se calculó de acuerdo con la siguiente ecuación:
Donde, Ac es la absorbancia control y AA es la absor-bancia del antioxidante.
Bioensayo in vitro del efecto protector sobre eritrocitos humanos
La hemolisis fue inducida por el radical AAPH (2-2´-Azobis (2-methylpropionamidine) dihydrochloride) de acuerdo a la metodología descrita por Lu et al. (2010), con algunas modificaciones. Los eritrocitos fueron lavados en tres tiempos con buffer salino (PBS), realizando una centrifugación por 10 min a 1500 rpm. Una vez lavados los eritrocitos, se preparó una suspensión de eritrocitos humanos al 5 % en PBS. Para el ensayo se colocaron en un tubo de ensayo en relación 1:1:1 la solución del eritrocito, el extracto a evaluar y el radical AAPH, se mezcló para llevarlo a incubación por 3 h a 37 °C. Una mezcla de reacción similar se preparó sin extracto como control (Hemólisis completa). Terminada la incubación se agregó 1 mL de PBS y se centrifugó a 3500 rpm por 10 min, e inmediatamente se tomó la absorbancia del sobrenadante en un lector de microplacas a 540 nm. El resultado se expresó como porcentaje de inhibición, la cual fue calculada mediante la fórmula: ((Abs Control-Abs Final)/Abs Control * 100).
Resultados Y Discusión
Color, pH y solidos solubles totales
Los frutos en estado de madurez en desarrollo mostraron el valor de L* más alto (45.56), siendo su color más brillante en comparación con los frutos maduros y semimaduros (Tabla 1). Esto coincide con Solomon et al. (2006) quienes reportaron valores de luminosidad más altos en higos en etapa de desarrollo, en comparación con higo en etapa madura. En el parámetro a* se muestra la mayor tendencia al color rojo en los frutos en estado maduro con valor de 13.37. Caliskan y Aytekin (2011) evaluaron parámetros de a* en higo plenamente maduro, obteniendo valores promedio de 11.8, siendo más bajo a lo encontrado en este estudio. El parámetro b* muestra un valor mayor en los frutos en etapa de desarrollo con 20.04, el cual tiende a ser amarillo. En el índice de cromaticidad (C*), que engloba el conjunto de a* y b*, se puede observar que los tres estados de madurez presentan diferencia estadísticamente significativa (p<0.05), siendo el estado en desarrollo el que obtuvo el valor más alto con 23.46. Sin embargo, el valor obtenido en estado maduro (14.11) es similar al obtenido por Silva et al. (2009) en muestras de higo maduras previamente cocinadas. Para el índice de Hue o tono, los frutos en estado maduro presentaron un valor de 18.66, siendo el valor más cercano a 0°, el cual indica una coloración de rojo-purpura (Caliskan y Aytekin, 2011). Las etapas en desarrollo y sobremaduro presentaron valores de 58.67 y 41.52, siendo más cercanas a 40°, el cual indica un color rojo. Los valores obtenidos en las tres etapas de madurez mostraron diferencias estadísticamente significativas (p<0.05).
Tabla 1 Medición de color (L*, a*, b*, C* y H*), pH y solidos solubles totales de extractos de
Higo en tres estados de madurez (Desarrollo, Maduro y Sobremaduro).
Table 1. Color measurement (L*, a*, b* C* y
H*), pH and soluble solids of fig extracts in three stages of
maturity (Development, Mature and Overmature).
| Estado de madurez | Desarrollo | Maduro | Sobremaduro |
|---|---|---|---|
| L | 45.56 ± 0.48a | 29.67 ± 0.36b | 26.27 ± 0.26c |
| a* | 12.20 ± 0.49a | 13.37 ± 0.92a | 5.71 ± 0.37b |
| b* | 20.04 ± 0.35a | 4.51 ± 0.19b | 5.08 ± 0.91b |
| C* | 23.46 ± 0.54a | 14.11 ± 0.93b | 7.65 ± 0.87c |
| H* | 58.67 ± 0.61a | 18.66 ± 0.47b | 41.52 ± 3.49c |
| pH | 5.60 ± 0.20a | 5.5 ± 0.17a | 5.5 ± 0.20a |
| SST (°Brix) | 14.65 ± 0.35a | 18.65 ± 0.25b | 23.8 ± 0.50c |
L* (luminosidad), a* rojo (+) y verde (-), b* amarillo (+) y azul (-), C* (croma) y H* (tono). Los superíndices diferentes denotan diferencia significativa (p<0.05).
En los sólidos solubles se observó una tendencia ascendente entre cada una de las etapas, en donde el contenido de azúcares fue aumentando de acuerdo con el estado de madurez, oscilando entre 14.65-23.8 °Brix (Tabla 1). El aumento de estos valores se presenta como una tendencia natural del proceso de maduración, ocurriendo al final del crecimiento del fruto una translocación alta de azúcares (Fisher y Martínez, 1999; Villalobos et al., 2016). La acción de la hidrólisis de diversos polisacáridos estructurales tales como almidón, pectinas de la pared celular, y otros componentes monoméricos básicos, llevan a la acumulación de azúcares, tales como glucosa, fructuosa y sacarosa (Torres et al., 2013). En pH, se obtuvieron valores entre 5.5-5.6, no se encontraron diferencias significativas entre los estados de maduración. Estos valores son similares a lo reportado en frutos de higo en una etapa cercana a la madurez comercial (Viuda et al., 2015).
Rendimiento de microencapsulación
En la tabla 2, se muestran los valores obtenidos en cuanto al rendimiento de microcapsulación de higo en tres etapas de madurez. En la interacción SPI/GA, se observó que no existen diferencias significativas entre cada etapa de maduración (p<0.05). Los resultados para G/GA fueron mayores en comparación con el complejo SPI/GA. Los valores de rendimiento en el complejo G/GA variaron entre 63.83 y 67.12 %, dichos valores son similares a lo reportado por Rocha et al. (2013) al encapsular aspartamo utilizando la técnica de coacervación compleja con G y GA. Por otro lado, Wang et al. (2014) obtuvieron valores de 50-70 %, en complejos de gelatina y hexametafosfato de sodio. Estos resultados pueden ser debido a la capacidad de emulsión limitada de gelatina en la interfaz de aceite/agua en presencia de una concentración excesiva de emulsión primaria. Junxia et al. (2011) reportaron que, dentro del sistema de coacervación, el SPI además de la participación en la interacción electrostática, actúa como un emulsionante. Por lo tanto, al sumarlo con la cantidad establecida de emulsificantes utilizados para este trabajo, el exceso de grasa pudo conducir a una emulsión incompleta y una pobre interacción entre SPI y el polisacárido, dando como resultado un bajo porcentaje de rendimiento. El rendimiento de microencapsulación puede ser influenciado por el tipo de material de pared utilizado (Venil et al., 2016). Además, la viscosidad del biopolímero también puede influir en el rendimiento de microencapsulación. Si la viscosidad es baja puede ocurrir una mezcla interna que retrasa la formación de una superficie permeable, en cambio a una viscosidad alta es posible reducir la probabilidad de una mezcla interna y por lo tanto aumentar el rendimiento (Pulido y Beristain, 2010). Por otro lado, un aumento en la concentración de las soluciones (proteínas y polisacáridos), posiblemente produce paredes más resistentes, lo que lleva a los valores de rendimiento mayores (Rocha et al., 2013).
Tabla 2 Porcentaje de rendimiento de microencapsulación.
Table 2. Percentage of microencapsulation
yield.
| SPI / GA | % Rendimiento | G/GA | % Rendimiento |
|---|---|---|---|
| Desarrollo | 28.63±0.21a | Desarrollo | 64.79±0.05a |
| Maduro | 16.42±0.02a | Maduro | 63.83±0.07a |
| Sobremaduro | 15.41±0.04a | Sobremaduro | 67.12±0.06a |
SPI= Proteína de Soya Aislada; GA= Goma Arábiga; G = Gelatina. Los superín-dices diferentes denotan diferencia significativa (p<0.05).
Morfología de las microcápsulas
En la Figura 1 se muestran las micrografías de las microcápsulas de extractos de higo en los complejos SPI/ GA y G/GA, respectivamente. Se puede observar que las microcápsulas del complejo SPI/GA mostraron una superficie abollada o irregular, siendo similar para las tres etapas de maduración. Para el caso de las microcápsulas del complejo G/GA, estas mostraron una superficie con formas más esféricas e íntegras, presentando variación en cuanto a tamaño, con menos zonas abolladas ni grietas aparentes o poros en la superficie. Pulido y Beristain (2010) reportaron que, en la microencapsulación, la protección ofrecida por el material de pared y las propiedades de flujo de las microcápsulas dependen de la microestructura interior y exterior de la microcápsula y en cómo el material de pared está organizado en las microcápsulas. Asimismo, Silva et al. (2013) reportaron que paredes de microcápsulas intactas y regulares resultan en un proceso de microencapsulación más perfecto. Uno de los factores de tal morfología fue el pH en ambos complejos, ya que de acuerdo con lo reportado por Wang et al. (2014) al trabajar con pH menor a 5, es posible observar la agregación de las gotas de cápsulas, así como la capa o formación de pared en los coacervados de manera uniforme alrededor de las microcápsulas. Por lo que, esto es lo que probablemente sucedió en las microcápsulas G/GA. Por otra parte, partículas con superficies rugosas tienen áreas de contacto más grandes que los que tienen superficies lisas, que pueden hacerlos más susceptibles a reacciones de degradación, tales como la oxidación.
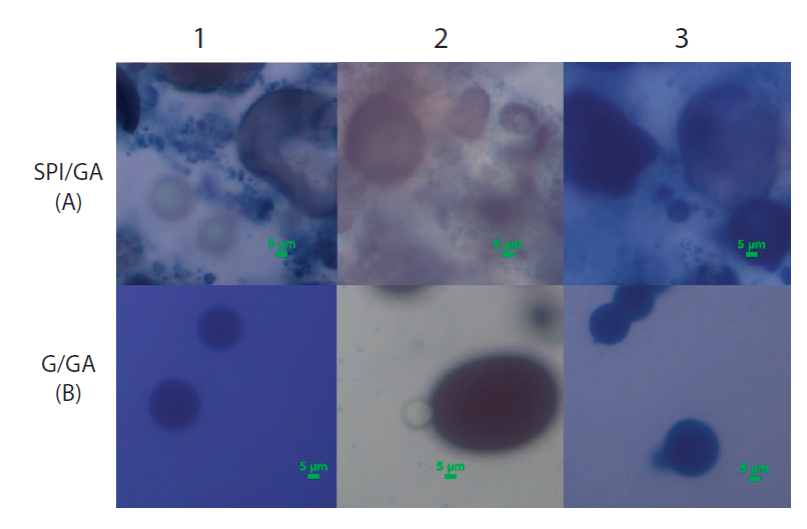
Figura 1 Micrografías ópticas de microcápsulas de extracto de higo en cada etapa: Desarrollo
(1), Maduro (2) y Sobremaduro (3) en Complejo de SPI/GA (A) y
Complejo de G/GA (B).
Figure 1. Optical micrographs of fig extract’s
microcapsules in each stage: Development (1), Mature (2) and
Overmature (3) in ISP/AG Complex (A) and G/AG Complex (B).
Determinación de fenoles totales
En la Tabla 3 se muestran los resultados obtenidos de la estabilidad del complejo SPI/GA y G/GA para la determinación de fenoles totales. De acuerdo con los valores, es posible observar una tendencia descendente durante las cuatro semanas de almacenamiento en los compuestos de ambos complejos. La mayor reducción del contenido de fenoles totales se observó en los complejos SPI/GA para los 3 estados de madurez, con valores entre 8.25 y 5.10 mgEAG/ gps. Las microcápsulas en los complejos G/GA presentaron una mayor estabilidad durante el periodo de almacenamiento, con respecto al complejo SPI/GA. Se ha reportado, que los compuestos fenólicos en la superficie del polvo microencapsulado pueden ser más propensos a la oxidación que las microcápsulas, debido a la actuación del material de recubrimiento como una barrera de protección para los compuestos fenólicos (Cam et al., 2014). Además, la estabilidad de las microcápsulas es afectada por la actividad acuosa durante el almacenamiento, lo cual puede provocar el colapso de estas (Pulido y Beristain, 2010).
El extracto microencapsulado mostró una buena protección contra la oxidación, que podría atribuirse a las propiedades antifílicas de los componentes presentes en las microcápsulas. Chidambaram et al. (2016), reportaron que un aumento en el número de grupos hidroxilo en un fenol mejora la capacidad donante de hidrógeno y la inhibición de la oxidación. La temperatura de almacenamiento es otro de los factores que también pudo haber influido en los resultados obtenidos para la estabilidad de los complejos. Paini et al. (2015) reportaron que el almacenamiento de los microencapsulados a bajas temperaturas es ideal para la prolongación de los polvos en largos periodos de tiempo.
Actividad antioxidante
Ambos complejos mostraron una tendencia similar descendente, siendo el de mayor porcentaje el complejo SPI/ GA, con valores superiores al 15 % de inhibición (Tabla 3). Sin embargo, los tratamientos de G/GA, a pesar de obtener un porcentaje de inhibición más bajo (Desarrollo 18.96-11.95, maduro 19.30-11.95 y sobremaduro 17.08-12.19 %) en comparación con los tratamientos del complejo de SPI/GA (Desarrollo 29.07-19.12, maduro 20.18-18.86 y sobremaduro 23.68-21.61 %) mostraron una mejor estabilidad de encapsulación, sobre todo a partir de la semana 2. En general, el porcentaje de inhibición para ambos complejos fue menor al 30 %. La capacidad de eliminación inferior expresada en ambos complejos está en concordancia con lo expresado por Belščak et al. (2016) quienes reportaron que una organización estructural diferente dentro de las microcápsulas puede explicar el atrapamiento inferior de los compuestos antioxidantes. La disminución de la capacidad antioxidante en los extractos encapsulados pudo deberse al efecto de la polimerización de las proteínas, las cuales, según Ifeduba et al. (2015) provocan un efecto opuesto en la actividad antioxidante en general. Wang et al. (2016) sugieren que la existencia de microcápsulas mejora la protección, así como la estabilidad de los compuestos activos bajo condiciones ambientales. Betz et al. (2012) reportaron que la presencia de aceite y emulsionantes durante la microencapsulación puede influir en la capacidad antioxidante al afectar el coeficiente de partición de antioxidantes entre la fase acuosa y la fase de aceite o debido al agotamiento de compuestos a través de la reacción con radicales de lípidos. Además, reportan que las interacciones entre proteínas y compuestos fenólicos pueden resultar en una disminución de la biodisponibilidad de los compuestos con actividad antioxidante.
Tabla 3 Medias y desviaciones estándar para la determinación de fenoles totales y actividad
antioxidante por ABTS.
Table 3. Means and standard deviations for total
phenols’ determination and antioxidant activity by ABTS.
| Prueba | Complejo | Estado de Madurez | Tiempo de almacenamiento (Semanas) | |||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |||
| Fenoles Totales* | SPI / GA G/GA | Desarrollo Maduro Sobremaduro Desarrollo Maduro Sobremaduro |
8.25±0.01a
7.54±0.15a 6.18±0.33a 5.54±0.08a 3.12±0.11b 3.82±0.07a |
7.58 ± 0.06b
5.93 ± 0.48b 5.60 ± 0.25b 3.59 ± 0.19b 3.12 ± 0.01b 3.18 ± 0.04a |
5.10 ± 0.10c
5.28 ± 0.14c 4.52 ± 0.15d 3.57 ± 0.01b 3.40 ± 0.06a 3.70 ± 0.06b |
4.28 ± 0.16d
4.58 ± 0.16d 5.10 ± 0.09c 2.75 ± 0.03c 2.82 ± 0.03c 3.36 ± 0.14c |
| ABTS** | SPI / GA G/GA | Desarrollo Maduro Sobremaduro Desarrollo Maduro Sobremaduro |
29.07±0.22a
20.18±0.06a 23.68±0.10a 18.96±0.38a 19.30±0.51a 17.08±0.29a |
18.69 ± 0.86b
17.31 ± 0.93c 18.71 ± 1.13c 11.14 ± 0.36c 13.23 ± 0.87b 13.18 ± 0.3b |
19.39 ±0.08b
19.19±0.22ab 22.24 ±0.33b 10.36 ±0.24d 12.56 ±0.35b 12.93±0.49bc |
19.12 ± 0.33b
18.86 ± 0.94b 21.61±0.42b 11.95±0.41b 13.57±0.62b 12.19±0.79cd |
*Las unidades se expresan en mgEAG/gps. ** Las unidades se expresan en % de inhibición. Los superíndices diferentes denotan diferencia significativa (p<0.05) entre tiempo de almacenamiento.
Evaluación del efecto protector en eritrocitos humanos
El ensayo de protección de eritrocitos humanos se ha utilizado como modelo para evaluar el efecto protector de los antioxidantes contra el daño oxidativo de las biomembranas porque son muy susceptibles a la hemólisis (Zhang et al., 2014; Zheng et al., 2016). Se ha reportado que el estrés oxidativo puede inducir a la disrupción de la membrana celular e incluso causar hemólisis, lo que resulta en la liberación de células libres de hemoglobina en el plasma (Wang et al., 2017).
La inhibición de hemólisis osciló entre 46-50 % en todos los tratamientos (Figura 2). El complejo SPI/GA (T1-T3) presentó una estabilidad en las etapas de maduración maduro y sobremaduro durante todo el almacenamiento. La etapa en desarrollo (T1) mostró el menor porcentaje de inhibición, disminuyendo gradualmente a partir de la semana 2, y obteniendo un valor de 34% para la semana 4. Esto podría deberse a la disminución en la concentración de compuestos con capacidad antioxidante para esta etapa de maduración, ya que en la inhibición del radical ABTS y contenido de fenoles totales, también se observó una disminución durante las 4 semanas de almacenamiento. Por otra parte, en los complejos G/GA, para la semana 2, los extractos microencapsulados mostraron una disminución en el efecto protector, y posteriormente aumentar hasta alcanzar valores entre 54-55 % de inhibición al final del almacenamiento. Se ha reportado que el efecto protector contra los eritrocitos puede estar relacionado con la presencia de compuestos bioactivos, como fenoles, flavonoides y carotenoides, en las muestras, que pueden ejercer efectos antiinflamatorios y antioxidantes (Magalhães et al., 2009; Thakur et al., 2016). Asimismo, se ha informado una baja correlación entre los compuestos fenólicos con métodos de análisis in vivo (Granato et al., 2018). Quizás, esto podría atribuirse al hecho de que los antioxidantes no han disminuido el daño oxidativo in vivo y la variación pudiera deberse a hábitos de vida, sexo o genética (Halliwell, 2012).
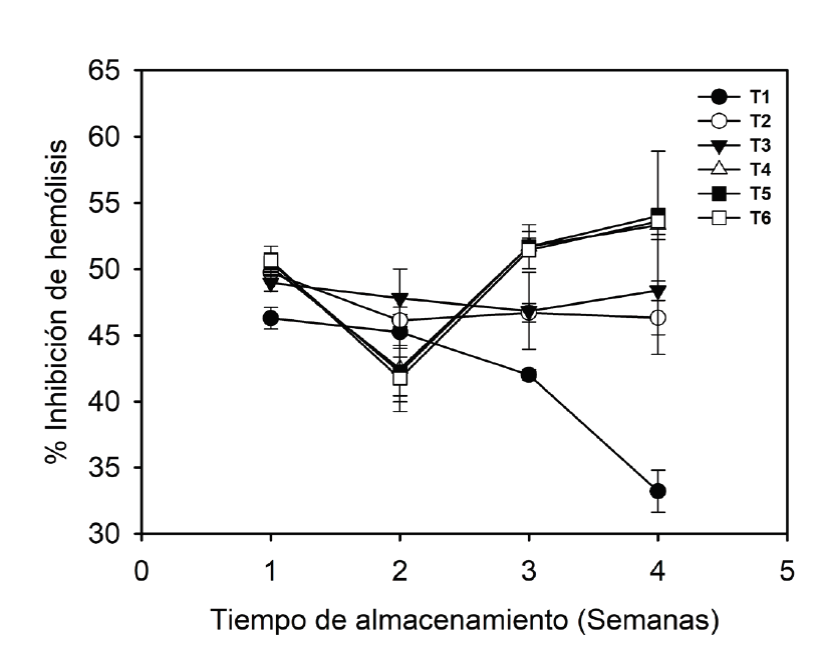
Figura 2 Estabilidad de microcápsulas del complejo SPI/GA y G/GA en la inhibición de hemólisis.
T1: Desarrollo SPI/GA; T2: Maduro SPI/GA; T3: Sobremaduro SPI/GA;
T4: Desarrollo G/GA; T5: Maduro G/GA; T6: Sobremaduro G/GA.
Figure 2. Microcapsules stability of the ISP/AG and
G/AG complex in hemolysis inhibition. T1: Development SPI/GA; T2:
Mature SPI/GA; T3: Overmature SPI/GA; T4: Development G/GA; T5:
Mature G/GA; T6: Overmature G/GA.
Los valores obtenidos en este estudio para el porcentaje de inhibición de hemólisis fueron superiores al 30 % durante las cuatro semanas en ambos complejos (SPI/GA y G/GA). Fernández et al. (2010), obtuvieron porcentajes de inhibición entre 31.07- 39.1 %, para extractos etanólicos de Renealmia alpinia. Asimismo, Pérez et al. (1995), reportaron valores similares a los encontrados en este estudio con valor promedio de 38.2% en extractos etanólicos de H. excelsa. Como parte del proceso de microencapsulación, en la etapa de emulsión es necesario incorporar un agente tensioactivo que permita la estabilidad en la doble emulsión. Se ha argumentado que los surfactantes son capaces de unirse a los eritrocitos, incluso a una concentración muy baja debido a su alta afinidad por la membrana plasmática. Este mecanismo se produce debido a la distribución del tensioactivo entre la fase acuosa y la membrana lipídica de los eritrocitos. Bajo condiciones específicas, esta unión puede inducir la estabilización de la membrana y la protección contra los cambios osmóticos o mecánicos, sino también los cambios morfológicos de los eritrocitos (Carvalho et al., 2015; Manaargadoo et al., 2016).
Conclusiones
El proceso de microencapsulación por coacervación compleja mostró ser una técnica capaz de retener los compuestos bioactivos presentes en higo. La proteína de soya aislada, gelatina y goma arábiga son biopolímeros capaces de mantener la estabilidad de dichos compuestos, al utilizarse como materiales de pared en la formación de coacervados.











 nueva página del texto (beta)
nueva página del texto (beta)


