Introducción
La acuacultura se define como el conjunto de técnicas y conocimientos aplicados para el desarrollo y producción controlada de diversos organismos acuáticos de interés económico (Singh et al., 2005; Moffitt y Cajas, 2014). Algunas actividades en acuacultura consisten en la modificación del medio en el que se desenvuelven los organismos, con la intención de estresarlos e inducirlos a que produzcan biocompuestos de interés (Moffitt y Cajas, 2014).
Dentro de los organismos que son aprovechados por la acuacultura para la producción de biocompuestos se encuentran las microalgas. Estos microorganismos son capaces de sintetizar compuestos bioactivos como los antioxidantes, que pueden ser utilizados como complementos alimenticios (Sui et al., 2019). Diversos estudios han reportado que la manipulación de las condiciones del cultivo de ciertas especies de microalgas favorecen la producción de compuestos orgánicos de interés (Rao et al., 2006; Yeesang y Cheirsilp, 2011; Yeh y Chang, 2012), tales como los carotenos, ficobilinas, xantofilas, entre otros (Rema y Gouveia, 2005; Yaşar y Şevket, 2006; Abd El-Baky et al., 2007).
Actualmente se conocen alrededor de 600 carotenoides de origen natural, de los cuales el β-caroteno es uno de los más abundantes e importantes debido a su alta actividad antioxidante y por ser precursor de vitamina A; estos compuestos antioxidantes actúan como protectores de la clorofila y del daño celular provocado por radicales libres (Nimse y Pal, 2015).
Los carotenoides son ampliamente utilizados principalmente en las industrias farmacéutica, nutracéutica y cosmética, debido a sus propiedades anticancerígenas, antioxidantes, antiinflamatorias y antiproliferativas (Rema y Gouveia, 2005; Yaşar y Şevket, 2006). Las microalgas son ampliamente aceptadas para consumo humano, por lo que se han desarrollado técnicas muy específicas para lograr la obtención de bioproductos de manera eficiente, como los carotenoides. Dentro de las microalgas que se han utilizado para la obtención de compuestos antioxidantes destacan tres géneros: Chlorella, Dunaliella y Spirulina (Chen et al., 2016; Ismaiel et al., 2016; Singh et al., 2016).
Algunos autores han demostrado que bajo condiciones de estrés, como la limitación de nutrientes y/o altos valores de salinidad, se puede estimular la producción de carotenoides en las especies de Dunaliella (Salguero et al., 2003; García González et al., 2005; Lamers et al., 2010).
A pesar de las investigaciones existentes con respecto a la obtención de carotenoides a partir del género Dunaliella, se hace evidente la necesidad de explorar el mayor número de condiciones de cultivo que combinadas permitan la obtención de una adecuada concentración de biomasa rica en estos compuestos a un menor costo. Debido a lo anterior, el objetivo de la presente investigación consistió en analizar el efecto del estrés por nitrógeno y salinidad en el contenido de β-caroteno de la microalga Dunaliella tertiolecta, con la finalidad de obtener biomasa rica en estos compuestos.
Materiales Y Métodos
Diseño experimental, selección de la cepa y condiciones de cultivo
La microalga marina Dunaliella tertiolecta fue obtenida del cepario del Departamento de Investigaciones Científicas y Tecnológicas de la Universidad de Sonora (DICTUS). El bioensayo se llevó a cabo bajo condiciones controladas de temperatura (20±1°C) e iluminación (274±52.5 μmol fotón m-2 seg-1). Se utilizó un diseño factorial 3 x 3 en el que se evaluaron tres salinidades (35, 45 y 55 UPS) y tres concentraciones de nitrógeno, mediante la modificación del contenido de NaNO3 del medio F/2 de Guillard & Ryther (1962), donde el medio F contenía: 150 g L-1, el medio F/8: 18.75 g L-1 y el medio F/16: 9.375 g L-1. Cada tratamiento se evaluó por cuadruplicado.
El cultivo microalgal se inició en matraces Erlenmeyer de 250 mL, conteniendo 150 mL de medio de cultivo. Cada uno de los medios fue inoculado con una concentración inicial de 100,000 cél mL-1.
Concentración celular
Para la determinación de la concentración celular diariamente se tomó un 1 mL de muestra de cada uno de los tratamientos, la cual se colocó en una cámara de Neubauer de 0.1 mm y se le agregó lugol para fijarla y facilitar su conteo en un microscopio compuesto (Andersen, 2005). Los días de cosecha se establecieron durante la fase estacionaria. El número de células por mililitro se obtuvo aplicando la siguiente ecuación:
Determinación de biomasa
Se tomaron muestras en la fase estacionaria para determinar el peso seco, materia orgánica y cenizas mediante métodos gravimétricos (López Elías et al., 2013). Para la determinación del peso seco se filtraron por duplicado 50 mL de cultivo en filtros GF/C de fibra de vidrio de 47 mm de diámetro previamente calibrados; después se colocaron en una estufa convencional (THELCO® LABORATORY OVEN Precision Scientific, modelo 130) a 60 °C por 24 horas y una vez secos se pesaron en una balanza analítica (METTLER, modelo AJ100). Posteriormente los filtros se colocaron en una mufla (Felisa®, modelo 3 60D) a 480 °C por 8-12 horas para la obtención de cenizas; los filtros se pesaron de nuevo y finalmente mediante la diferencia de peso seco y cenizas se obtuvo la materia orgánica.
Extracción y cuantificación de β-Caroteno
Para la extracción de carotenos se filtraron por duplicado 20 mL de cultivo (fase estacionaria), para ello se utilizaron filtros GF/C de 25 mm de diámetro; posteriormente se depositaron en tubos para centrífuga de 15 mL y se añadieron 10 mL de acetona al 90 % (v/v). Después de 24 horas en oscuridad y en condiciones de refrigeración, los tubos se centrifugaron a 5,000 gravedades durante 10 minutos (Thermo ScientificTM, modelo HeraeusTMTM MultifugeTM X1R). Se recuperó el sobrenadante de cada una de las muestras y se leyó su absorbancia a una longitud de 450 nm en un lector para microplacas (IMarkTM, modelo BIO-RAD). Para llevar a cabo la cuantificación se realizó una curva de calibración utilizando β-caroteno (SIGMA C9750) como estándar (0.6 mg mL-1).
Análisis estadístico
Los datos de la concentración celular se trataron con estadística descriptiva, además, se realizó un análisis de varianza de dos vías para determinar las diferencias entre los tratamientos en cuanto a la concentración celular, biomasa seca, cenizas, materia orgánica y contenido de β-caroteno. En los casos en donde se encontraron diferencias significativas, se empleó la prueba a posteriori de Tukey (p≤0.05) (Zar, 1999). Para el análisis estadístico se utilizó el programa STATISTICA para Windows (Statsoft, 1995).
Resultados Y Discusión
El resumen de los análisis estadísticos (ANOVA de dos vías) para todas las variables analizadas se muestran en la Tabla 1.
Tabla 1 Resumen del ANOVA de dos vías de la concentración celular, biomasa seca, cenizas,
materia orgánica y β caroteno de Dunaliella tertiolecta
cultivada en tres medios de cultivo (F, F/8 y F/16) y tres salinidades
(35, 45 y 55 UPS). salinidades (35, 45 y 55 UPS).
Table
1. Summary of two-way ANOVA for cellular concentration, dry
biomass, ash, organic matter content and β-carotene content of
Dunaliella tertiolecta cultivated in three culture media (F, F/8 and
F/16) and three salinities (35, 45 and 55 UPS).
| Análisis | Variables | Grados de libertad | F | p |
|---|---|---|---|---|
| Concentración celular | Salinidad Medio Salinidad * Medio |
2 2 4 |
3.75 182.83 14.00 |
˃0.05 0.01 0.01 |
| Biomasa seca | Salinidad Medio Salinidad * Medio |
2 2 4 |
31.35 393.15 105.00 |
0.01 0.01 0.01 |
| Cenizas | Salinidad Medio Salinidad * Medio |
2 2 4 |
56.20
121.60 100.70 |
0.01 0.01 0.01 |
| Materia Orgánica | Salinidad Medio Salinidad * Medio |
2 2 4 |
194.91 1293.22 92.82 |
0.01 0.01 0.01 |
| Β-caroteno | Salinidad
Medio Salinidad * Medio |
2 2 1 |
8.6216
439.1668 343.2016 |
0.001 0.000 0.000 |
Concentración celular
La microalga presentó el típico comportamiento sigmoidal de los microorganismos en las cinéticas de crecimiento (Peleg et al., 2007) (Figura 1). Con respecto al efecto de la salinidad y el nitrógeno en el crecimiento, se observó que las microalgas cultivadas en las tres salinidades y concentraciones de nitrógeno presentaron un incremento celular hacia el día tres en todos los medios de cultivo, para posteriormente mantenerse constantes y finalmente descender (Figura 1).
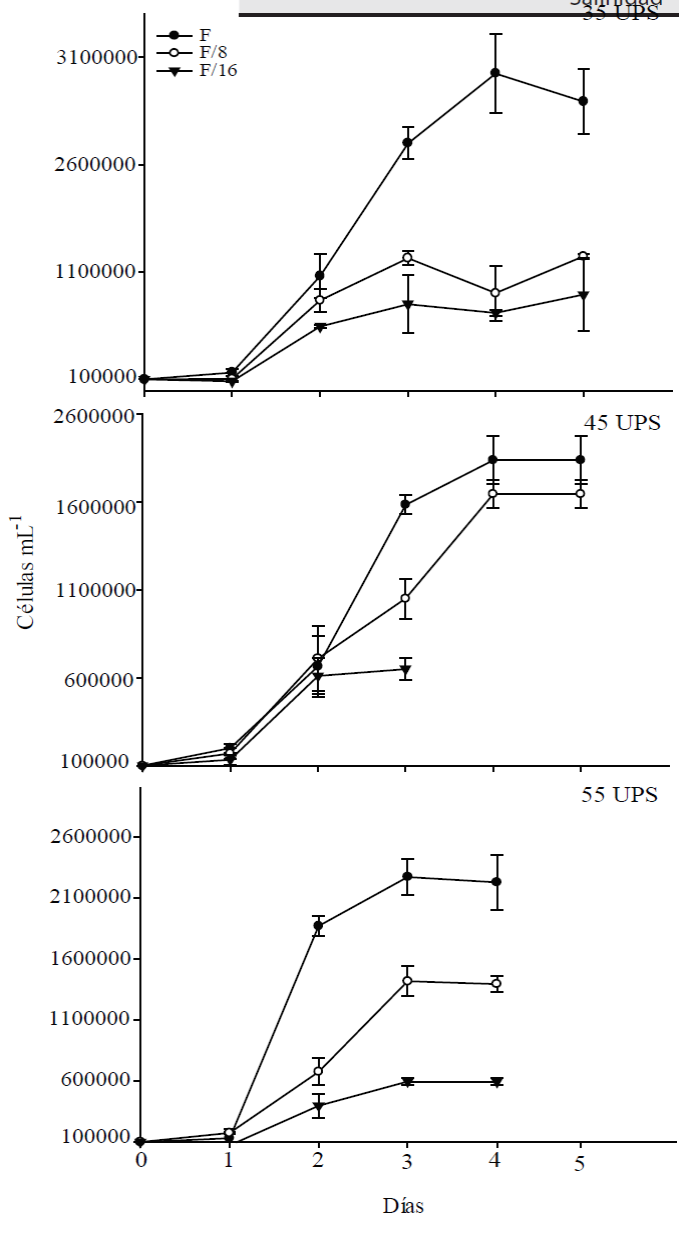
Figura 1 Cinéticas de crecimiento de la microalga Dunaliella tertiolecta
cultivada en los medios F, F/8 y F/16 a 35, 45 y 55 UPS. los datos
representan los promedios y desviación estándar (p<0.05).
Figure 1. Kinetic growth curves from Dunaliella
tertiolecta cultivated in F, F/8 and F/16 culture media at 35, 45
and 55 UPS. The data represents the mean and standard deviation
(p<0.05).
La densidad celular más alta se observó en las microalgas cultivadas a 35 UPS en el medio F (2.94 x 106 ± 4.51 x 105 cél mL-1), durante el día 3 en el desarrollo de la cinética de crecimiento (fase estacionaria), encontrándose diferencias significativas (p≤ 0.05) entre esta y los tratamientos limitados en nitrógeno (Tabla 2). Por otro lado, en los cultivos expuestos a 45 UPS se observó un incremento del crecimiento celular durante la fase estacionaria en el medio F, con 1.83x106 ± 1.36x105 cél mL-1, mientras que los medios F/8 y F/16 mostraron concentraciones celulares inferiores; sin embargo, no se encontraron diferencias significativas entre los medios F y F/8 bajo estas condiciones de salinidad.
Tabla 2 Concentración celular (toma de muestra en fase estacionaria) de
Dunaliella tertiolecta cultivada en tres medios
de cultivo (F, F/8 y F/16) y tres salinidades (35, 45 y 55 UPS).
Letras distintas en la misma fila y columna indican diferencias
significativas a p≤0.05.
Table 2. Cellular concentration (harvest day at stationary phase) of Dunaliella tertiolecta cultivated
in three culture media (F, F/8 and F/16) and three salinities (35, 45 and 55 UPS). Different letters
in the same row and column indicates significant differences at p≤0.05.
| Medio | No. Cel. mL-1 | ||
|---|---|---|---|
| 35 UPS | 45 UPS | 55 UPS | |
| F | 2.94x106 f±4.51x105 | 1.83x106 ce ±1.36 x105 | 2.22x106 e±2.22 x105 |
| F/8 | 1.13x106 bd±4.02x 105 | 1.64x106 cd ±7.91x105 | 1.39x106 cd±6.8x105 |
| F/18 | 7.20x105 ab ±3.09 x104 | 6.5x105 ab±6.31x104 | 5.93x105 a±2.78x104 |
Finalmente, las microalgas cultivadas a 55 UPS alcanzaron la máxima densidad celular durante la fase estacionaria en el medio F (2.2 x 106 ± 2.2 x 105 cél mL-1), mientras que los cultivos limitados presentaron concentraciones celulares de 1.39 x 106 ± 6.8 x 105 cél mL-1 (F/8) y 5.93 x 105 ± 2.7 x 104 cél mL-1 (F/16), encontrándose diferencias significativas (p≤0.05) entre los tres medios de cultivo (Tabla 2).
Fazeli et al. (2006) reportaron una concentración celular de 0.24 x 106 cél mL-1 para la especie D. tertiolecta cultivada bajo condiciones de estrés salino; estos valores son inferiores a los observados en la presente investigación. Shin et al. (2015) y Le Chevanton et al. (2016) reportaron que la deficiencia de nitrógeno en el medio limita el crecimiento poblacional de las microalgas pertenecientes al género Dunaliella. Por otro lado, López Elías et al. (2013) cultivaron D. tertiolecta en medios limitados en nitrógeno (NaNO3) bajo condiciones de laboratorio (35 UPS) utilizando el medio F/2 de Guillard y Ryther (1962) como control, encontrando que los cultivos expuestos a limitantes en nitrógeno presentaron una disminución en la densidad celular conforme se limita la concentración de nitrógeno en el medio; este comportamiento es similar al observado en la presente investigación (Tabla 2). Debido a que el nitrógeno es un elemento esencial de los constituyentes estructurales de la célula, así como de proteínas, enzimas, clorofila, moléculas de transferencia de energía y ácidos nucleicos, es considerado como uno de los nutrientes más críticos para el crecimiento algal (Kim et al., 2016).
La Figura 2 muestra el promedio de las concentraciones celulares en las tres salinidades entre los medios de cultivo y el promedio de las concentraciones celulares en los tres medios entre las salinidades. Este análisis permitió establecer el factor de mayor influencia en el crecimiento celular de D. tertiolecta bajo las distintas condiciones de cultivo utilizadas en la presente investigación.
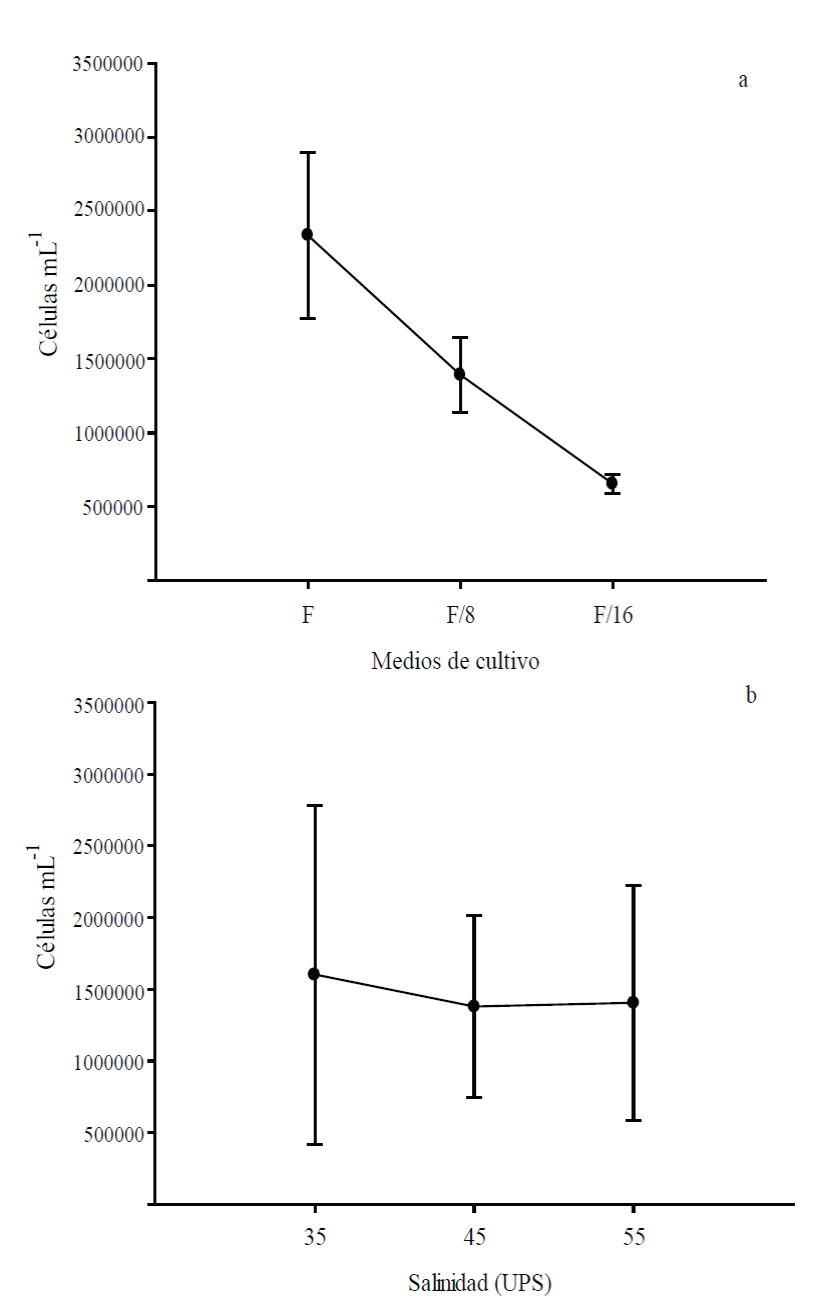
Figura 2 Promedio de las concentraciones celulares de las salinidades entre medios (a).
Promedio de las concentraciones celulares de los medios entre
salinidades (b). Las barras representan la desviación estándar de
los promedios (p<0.05).
Figure
2. Average cellular concentration among media salinities
(a). Average cellular concentration among media salinities (b). The
bars represent standard deviation of mean (p<0.05)
En términos generales para el medio F, considerando las tres salinidades, se obtuvo un crecimiento celular promedio de 2.28 x 106 ± 5.23 x 105 cél mL-1, mientras que para el medio F/8 fue de 1.39 x 106 ± 3.07 x 105 cél mL-1 y para el medio F/16 fue de 6.54 x 105 ± 6.72 x 104 cél mL-1, encontrándose diferencias significativas (p≤0.05) entre los medios (Figura 2a, Tabla 1).
Para la salinidad de 35 UPS, considerando los tres medios de cultivo, se obtuvo un crecimiento celular promedio de 1.4 x 106 ± 1.01 x 105 cél mL-1, para el tratamiento de 45 UPS fue de 1.38 x 106 ± 5.50 x 105 cél mL-1 y para 55 UPS fue de 1.41 x 106 ± 7.08 x 105 cél mL-1. No se encontraron diferencias significativas (p>0.05) entre salinidades (Figura 2b, Tabla 1).
Los resultados anteriores claramente indican que la concentración de nitrógeno en el medio de cultivo es el factor determinante en el crecimiento de esta especie, independientemente de la salinidad utilizada.
Análisis de la composición proximal
La cantidad de biomasa seca por célula, al inicio de la fase estacionaria (día 3), en los cultivos expuestos a 35 y 55 UPS aumentó significativamente (p≤0.05) conforme se disminuyó la concentración de nitrógeno en el medio (Tabla 3). Por otro lado, la biomasa de los cultivos expuestos a 45 UPS se mantuvo constante independientemente de la concentración de nitrógeno en el medio.
Tabla 3 Contenido de biomasa seca, cenizas y materia orgánica (pg cél-1) de la
microalga Dunaliella tertiolecta cultivada en tres
medios de cultivo (F, F/8 y F/16) y tres salinidades (35, 45 y 55
UPS) durante la fase estacionaria. Letras distintas en la misma fila
y columna indican diferencias significativas a
p≤0.05.
media
(F, F/8 y F/16) and three salinities (35, 45 y 55 UPS) during stationary phase. Different letters in the same row and column indicate
significant differences at p≤0.05.
| Medio | Biomasa seca | Cenizas | Materia Orgánica | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 35 UPS | 45 UPS | 55 UPS | 35UPS | 45 UPS | 55UPS | 35 UPS | 45 UPS | 55 UPS | |
| F | 247.57a±11.26 | 271.79ab±19.95 | 195.18c±13.03 | 120bd±9.06 | 154.78bc±19.06 | 61.51a±11.61 | 127.53ab±8.84 | 117.01a±2.38 | 133.67bc±7.58 |
| F/8 | 273.15ab±32.71 | 315.45b±15.93 | 213.53cd±17.36 | 146.81bc±29.29 | 185.41c±11.91 | 71.62a±12.65 | 126.34ab±5.42 | 130.04abc±6.03 | 141.91c±7.24 |
| F/18 | 570.44d±57.17 | 293.82ab±27.70 | 576.63d±56.76 | 347.5e±52.23 | 89.66ad±12.21 | 249.76d±47.55 | 222.94e±7.43 | 204.16d±16.99 | 326.87f±11.18 |
López Sánchez (1999) reportó una concentración de biomasa de 123.58 pg cél-1 en la microalga D. salina cultivada en condiciones controladas de laboratorio; este valor es inferior al observado en la presente investigación en todos los tratamientos analizados.
Estudios previos han demostrado que, en condiciones de cultivo desfavorable, las microalgas tienden a incrementar su tamaño como una estrategia para sobrevivir a las condiciones estresantes a las cuales han sido sometidas. A pesar de que a la fecha no existen investigaciones que expliquen el efecto del nitrógeno sobre el incremento en el tamaño celular, investigadores como López Elías et al. (2013) observaron que la especie D. tertiolecta, tiende a incrementar su biomasa al limitar la concentración de nitrógeno en el medio de cultivo, atribuyendo este comportamiento a un proceso de adaptación celular hacia las condiciones deficientes de este nutriente.
Por otro lado, ha sido ampliamente documentado que las condiciones de estrés por salinidad causan un incremento en el volumen celular de las microalgas (Reed et al., 1980; Hellebust e Iftikhar, 1984; García et al., 2012); este efecto ha sido principalmente estudiado en algas verdes del género Dunaliella (Serpa Ibáñez y Calderón Rodríguez, 2005; Fazeli et al., 2006; Zhu et al., 2018; Wongsnansilp et al., 2019).
La célula microalgal en condiciones naturales, en respuesta a la salinidad, tiende a equilibrar su presión osmótica con respecto al medio que la rodea; este proceso de osmorregulación obliga a la célula a producir solutos orgánicos en su interior, principalmente polioles como el glicerol, el manitol y el sorbitol, así como también azúcares como la manosa y la sacarosa (Abalde et al., 1995). Este incremento en el contenido de solutos y compuestos orgánicos provoca un aumento en el tamaño de cada célula microalgal, lo que puede traducirse en una mayor concentración de biomasa total y materia orgánica, tal como se observó en la presente investigación en los cultivos expuestos a baja concentración de nitrógeno y exceso de salinidad (Tabla 3).
Con respecto al contenido de materia orgánica, al inicio de la fase estacionaria, la concentración más alta se observó en el medio F/16 en las tres salinidades ensayadas, siendo el tratamiento a 55 UPS el que presentó la máxima concentración de materia orgánica (326.87 ± 11.18 pg cél-1) (Tabla 3). Por otro lado, no se encontraron diferencias significativas (p>0.05) entre los medios F y F/8 a 35 UPS. López Sánchez (1999) reportó una concentración de materia orgánica de 70.67 pg cél-1 en promedio para la microalga D. salina, mientras que en la presente investigación se observó el doble de la concentración reportada por este autor, lo cual podría ser debido a la limitación de nutrientes y al estrés por salinidad a la que fue sometida.
El contenido de cenizas aumentó al disminuirse la cantidad de nitrógeno en el medio F a 35 UPS; el valor más alto se observó en el medio F/16 (347.5 ± 56.7 pg cél-1). En el caso de los tratamientos a 45 UPS se observaron diferencias significativas entre los tres medios de cultivo, siendo el F/16 el que presentó una concentración menor (89.6 ± 47.55 pg cél-1). A salinidades de 55 UPS no se encontraron diferencias significativas entre los medios F y F/8, pero sí entre estos y el medio F/16, el cual presentó el valor más alto (249.7 ± 47.5 pg cél-1) (Tabla 3).
Análisis del contenido de β-Caroteno
La concentración de β-caroteno (mg L-1), al inicio de la fase estacionaria, descendió conforme se disminuyó la concentración de nitrógeno en el medio, siendo el medio F, en las tres salinidades analizadas, el que presentó las concentraciones más altas de este compuesto (Tabla 4).
Tabla 4 Contenido de β-caroteno en pg cél-1 de la microalga Dunaliella
tertiolecta cultivada en tres medios de cultivo (F, F/8
y F/16) y tres salinidades (35, 45 y 55 UPS). Letras distintas en la
misma fila y columna indican diferencias significativas
(p≤0.05).
Table 4. β-carotene content in pg cell-1 of the
microalgae Dunaliella tertiolecta cultivated in three culture media
(F, F/8 y F/16) and three salinities (35, 45 y 55 UPS). Different
letters in the same row and column indicate significant differences
(p≤0.05).
| Medio | Contenido de β-caroteno (mg L-1) | ||
|---|---|---|---|
| 35 UPS | 45 UPS | 55 UPS | |
| F | 70.4±7.2ª | 86.4±5.2b | 55±5.1c |
| F/8 | 6.9±0.99d | 5.02±0.49e | 5.62±1.9de |
| F/16 | nd± | nd | nd |
nd:no detectado
La máxima concentración de β-caroteno se encontró en los cultivos expuestos a 45 UPS en el medio F (86.4±5.2 mg L-1), observándose diferencias significativas (p≤0.05) entre este y el resto de las salinidades en los tres medios de cultivo (Tabla 4). Por otra parte, no se detectó la presencia de β-caroteno en el medio F/16 en las tres concentraciones de salinidad. Lo anterior indica que la limitación extrema de nitrógeno en la especie afecta negativamente la producción de β-caroteno, mientras que un exceso en la concentración de salinidad, por arriba de 35 UPS, favorece el aumento de este compuesto.
Mediante el proceso de osmorregulación, como se mencionó anteriormente, es posible la acumulación de ciertos compuestos que ayudan a mantener el equilibrio celular. Por lo anterior, la osmorregulación puede ser explotada comercialmente para inducir la síntesis de cantidades elevadas de compuestos orgánicos de valor comercial, tales como el β-caroteno (Abalde et al., 1995).
Fimbres Olivarría (2011) reportó una concentración de 37 mg L-1 de β- caroteno en la microalga Dunaliella sp. cultivada en medio F/2 bajo condiciones de laboratorio (35 UPS), este valor corresponde aproximadamente a la mitad de la concentración reportada en la presente investigación para las microalgas cultivadas a 35 UPS en el medio F (70.4 ±7.2 mg L-1); lo anterior considerando que el medio F/2 posee la mitad de la concentración de nitrógeno (NaNO3) con respecto al medio F.
Por otro lado, la concentración de β-caroteno alcanzada en el medio F/8 por D. tertiolecta en las tres salinidades ensayadas fue 2.6 veces menor (∼6 mg mL-1, Tabla 4) a lo reportado por Fimbres Olivarría (2011) en el mismo medio de cultivo (F/8, 35 UPS) para la microalga Dunaliella sp. (16 mg L-1). Lo anterior pudo deberse a que se trata de cepas distintas.
Wongsnansilp et al. (2019) cultivaron cepas de D. salina en luz ultravioleta en una concentración de 40 UPS con la finalidad de evaluar la producción de β-caroteno, encontrando concentraciones desde 1.33 a 2.15 g L-1, estos valores son mayores a los encontrados en el presente estudio, lo que indica que el tipo de iluminación, aunado a una alta concentración de salinidad, favorece la producción de este compuesto.
Por otro lado, Zhu et al. (2018) cultivaron D. salina disminuyendo la salinidad del medio hasta 5 UPS, encontrando valores de β-caroteno de 2.01 mg L-1; estos valores son inferiores a los reportados en la presente investigación (Tabla 4). En términos generales, a pesar de que el medio F a 35 UPS presentó una mayor concentración celular con respecto al medio F a 45 UPS (Tabla 2), no existieron diferencias significativas en cuanto al contenido de biomasa y materia orgánica (Tabla 3), pero sí se incrementó 1.2 veces la concentración de β-caroteno del medio F a 45 UPS (Tabla 4).
Con respecto a lo mencionado anteriormente, relacionando las densidades celulares, la biomasa y materia orgánica con las concentraciones de β-caroteno obtenidas a partir de D. tertiolecta, se puede concluir que las condiciones de cultivo más adecuadas para la produccion de este pigmento es el medio F a 45 UPS, a partir del cual se obtienen rendimientos de alrededor de 90 mg L-1.
Conclusiones
La limitación de nitrógeno en el medio de cultivo provoca un incremento en la concentración de biomasa y materia orgánica de la microalga Dunaliella tertiolecta. Sin embargo, afecta de manera negativa la concentración celular y el contenido de β-caroteno. Por otro lado, el aumento en la salinidad favorece el incremento de este pigmento. Por lo anterior, se concluye que las condiciones más adecuadas para la obtención de β-caroteno, en términos de productividad, es el medio F con una concentración de 45 UPS.











 nueva página del texto (beta)
nueva página del texto (beta)


