Introducción
La cabrilla arenera, Paralabrax maculatofasciatus, es un pez marino nativo del Pacifico- Centro-Oriental, se alimenta de pequeños peces, moluscos y crustáceos, los cuales captura desde su cueva durante las primeras horas del día o bien, las últimas de la tarde (Estrada-Godínez et al., 2011; Randall y Heemstra, 1993; Thomson et al., 2000). La especie es explotada a través de todo el año, principalmente en pesquerías locales donde se comercializa como uno de los productos de mayor importancia en la región noroeste de México, debido a la buena calidad de su filete (CONAPESCA-SAGARPA, 2012; Polovina y Ralston, 1987; Thomson et al., 2000). Adicionalmente, como otros miembros de la familia Serranidae, la cabrilla arenera es un pez apreciado en la pesca deportiva (CONAPESCA-SAGARPA, 2012; Randall y Heemstra, 1993).
Por otra parte, se encuentra ampliamente demostrado que los Serránidos pueden exhibir diversos patrones y comportamientos reproductivos (De Mitcheson y Liu, 2008; Randall y Heemstra, 1993; Sadovy y Domeier, 2005; Shapiro, 1981; Webb y Kingsford, 1992; Yogo, 1985). En el Golfo de California, se encuentra reportado que los serránidos tienden a formar agregaciones reproductivas durante la primavera y parte del verano. Durante este proceso, más de 40 machos nadan en compañía de una hembra hacía la superficie, liberando los gametos los cuales pueden llegar a cubrir extensas áreas. Estas agregaciones reproductivas, han sido reportadas también para otras especies de peces marinos, como la totoaba (Totoaba macdonaldi) y la curvina golfina (Cynoscion othonopterus), ambas especies emblemáticas de la región del Golfo de California, y cuyas pesquerías han colapsado como consecuencia de la pesca excesiva durante el ritual reproductivo (Aburto-Oropeza et al., 2008; Paredes et al., 2010).
De acuerdo a lo establecido por Allen et al. (1995), la cabrilla arenera desova durante el verano en la región costera de California (EUA), y al igual que otros serránidos pueden desovar en múltiples ocasiones y formar largas agregaciones reproductivas (Oda et al., 1993). En cuanto a su comportamiento reproductivo en la región del Golfo de California, algunos estudios llevados a cabo en Bahía La Paz y Bahía Almejas Baja California Sur, así como en la Bahía de San Diego (EUA), han demostrado que la especie es capaz de exhibir diversos patrones reproductivos, como el gonocorismo y el hermafroditismo, los cuales parecen depender de diversos factores, los cuales aún no han sido del todo determinados (Avilés, 2005; Hastings, 1989; Hovey y Allen, 2000; Lluch Cota, 1995).
En la actualidad, la susceptibilidad de las comunidades de peces hermafroditas no ha sido descrita completamente, sin embargo existe evidencia que demuestra que las especies de peces hermafroditas sobreexplotadas comercialmente, tienden a mostrar una desproporción de sexos (Carter et al., 1994; Coleman et al., 1996; Sadovy et al., 1994), tal y como ha sido reportado para diversas especies de abadejo como Mycteroperca microlepis y Mycteroperca phenas, las cuales han exhibido una disminución en cuanto a la proporción de machos, afectando la salud reproductiva de sus poblaciones naturales (Coleman et al., 1996).
La cabrilla arenera se explota y comercializa a través de todo el año en el Golfo de California, con escasa o nula regulación, y de acuerdo a los pescadores locales, las tasas de captura han disminuido en años recientes. Desafortunadamente, la información acerca de las tasas de captura de la especie es escasa y la poca información disponible se encuentra enfocada principalmente en el estudio de su comportamiento hermafrodita más que en sus aspectos reproductivos. Por esta razón, el objetivo principal de este estudio es determinar la biología reproductiva y el contenido bioquímico de las gónadas de la cabrilla arenera, P. maculato-fasciatus, en la región de Bahía de Kino.
Materiales y métodos
Área de estudio y obtención de los organismos experimentales
De marzo 2017 a febrero 2018, se capturaron mensualmente un total de 30 organismos de cabrilla arenera, las cuales se obtuvieron a través de los pescadores locales de Bahía de Kino (Fig.1). Para el presente estudio, se seleccionaron los organismos mayores a 10 cm de longitud, ya que a esta talla han alcanzado su madurez sexual (Hastings, 1989). Las muestras obtenidas fueron transportadas a la Unidad Experimental Kino de la Universidad de Sonora con el fin de llevar a cabo los análisis necesarios. Los datos de temperatura del agua, así como los de fotoperiodo fueron obtenidos de la Administración Nacional Oceánica y Atmosférica de los Estados Unidos (http://www.coastwatch.noaa.govy) y del Observatorio Naval Estadounidense (http://www.usno.navy.mil/USNO/astronomical-applications/data-services/rs-one-day-world).
Índices somáticos
Para cada uno de los organismos, se obtuvo la longitud total (Lt) y el peso total (Wt) para calcular el índice de condición de Fulton (K) (Ricker, 1987), el cual es expresado como (W t /Lt 3) × 100. Posteriormente, cada uno de los peces fue disectado con el fin de extraer y pesar el hígado y la gónada. El índice gonasomático (IGS) se calculó bajo la expresión (W g /W t ) × 100, mientras que el índice hepatosomático (IHS) se calculó mediante la fórmula (W l /W t ) × 100. En ambas expresiones Wg representa el peso de la gónada (g), W t representa el peso total (g) y Wl representa el peso del hígado (g).
Análisis histológico de las gónadas
Las gónadas fueron conservadas en solución Davidson AFA (ácido acético glacial, formalina y alcohol etílico al 95%). El tejido gonádico fue disectado en pequeñas muestras (1-3mm) y fueron colocadas en casetes de histología (Tissue Tek) por triplicado. Posteriormente, los tejidos fueron inmersos en concentraciones crecientes de alcohol etílico (70%, 80%, 95% y 100%), alcohol-xileno (1:1) y xileno, utilizando un deshidratador automático KEDEE programado para 12 horas de trabajo. Una vez finalizado el proceso, las muestras se colocaron en un inclusor (Leica, model EG-1160) para ser embebidas en parafina y así obtener bloques, los cuales se almacenaron a -4 oC durante 24 h. Las muestras fueron cortadas a 5μm utilizando un microtomo rotatorio semi automático (SLEE, model CUT-5062) y montadas en porta objetos debidamente etiquetados. Las laminillas se colocaron en un horno (Yamato, model DX-302-C) a 70 oC durante 2h, con el fin de remover el exceso de parafina de la laminilla. Finalmente, las muestras se tiñeron utilizando la tinción hematoxilina-eosina de Harris y posteriormente, se examinaron en un microscopio óptico (Leica Microsystems, DM1000, Wetzlar, Germany) equipado con una cámara digital (Moticam Pro, 282A) y con el programa Motic Images Plus 2.0 software (Motic, Richmond, BC, Cánada) para la adquisición de imágenes. El criterio de interpretación de los estadios gonádicos se basó en lo establecido por Andrade et al., (2003), mientras que el criterio para el diagnóstico de hermafroditismo se basó en lo establecido por Sadovy y Shapiro (1987).
Composición proximal de gónada
Para llevar a cabo el análisis proximal, se seleccionaron aleatoriamente 15 gónadas de macho y hembra, las cuales fueron analizadas en términos de humedad, grasa cruda, proteína y cenizas. El contenido de humedad y de cenizas se determinaron mediante los métodos 930.15 y 942.05 (Trucksess, 2005), respectivamente. La proteína cruda (N factor = 6.25) se determinó mediante el método 968.06, utilizando el método de combustión de Dumas por medio de un analizador de nitrógeno Dumas (Model NDA 701, VELP® Scientifica, Usmate, Italy). Finalmente, la grasa cruda fue extraída y cuantificada gravimétricamente después de secar con nitrógeno una alícuota de 5ml (Folch et al., 1957).
Análisis estadístico Los índices somáticos así como la composición proximal de gónada se analizaron mediante un análisis de varianza (ANOVA) de una vía de clasificación, utilizándose la prueba de Duncan como separador de medias en caso se observarse diferencias significativas (P < 0.05). Para el análisis de proporción de sexos, se utilizó el factor de corrección de Yates y las diferencias en cuanto a la proporción se determinaron mediante el análisis de X2. Los datos obtenidos en la presente investigación se analizaron utilizando el programa XLSTAT (2014) para Windows (versión 8.1, Addinsoft).
Resultados
Temperatura y fotoperiodo
Los datos anuales de la variación de la temperatura del agua y fotoperiodo en la región de Bahía de Kino se muestran en la Fig. 2. De marzo a julio se observó un incremento en la temperatura y fotoperiodo, mostrando valores de 18 a 30 oC y de 12h:12h a 14:10, respectivamente. De julio a septiembre, la temperatura se mantuvo estable en 30 oC, sin embargo, se observó una disminución del fotoperiodo (12h:12h). Mientras que de octubre a diciembre, se registró una disminución tanto de la temperatura como del fotoperiodo, mostrando valores que fueron de 27oC a 18 oC y de 11:13h a 10:14h, respectivamente. En enero se registró el valor mínimo de temperatura, el cual fue de 16oC, sin embargo el fotoperiodo se incrementó (11h:13h) y ya para febrero, ambos parámetros comenzaron a incrementarse simultáneamente.
Índices somáticos
Los índices somáticos calculados para la cabrilla arenera fueron afectados significativamente (P<0.05) a través del año, en términos de IGS (Fig. 3A) e IHS (Fig. 3B) pero no para K (Fig. 3C). Los valores obtenidos para el IGS fueron estadísticamente mayores durante los meses de abril (5.4%) y febrero (3.3%) en comparación con el resto de los meses evaluados, mientras que el IHS mostró su mayor valor en febrero (2.2%) en comparación con los valores obtenidos en los meses de marzo (1.2%), agosto (1.1%), septiembre (1.2%) y enero (1.1%). Los valores obtenidos para K mostraron valores que fueron de 1.5% a 1.6%, sin mostrar diferencias significativas.

Figura 3 Índices somáticos A) IGS =índice gonadosomático, B) IHS = índice
hepatosomático y C) K = factor de condición de la cabrilla arenera,
P. maculatofasciatus, capturadas de marzo 2017
a febrero 2018 en la región de Bahía de Kino. Letras diferentes
indican diferencias significativas.
Figure 3. Somatic indexes A) IGS = gonadosomatic index,
B) IHS = hepatosomatic index, and C) K = condition factor of spotted
sand bass, P. maculatofasciatus, sampled from March
2017 to February 2018 at Kino Bay. Different letters indicate
significant differences.
Composición proximal de las gónadas
En análisis proximal de gónada mostró diferencias significativas a través del año en términos de grasa cruda, humedad y cenizas pero no se encontraron diferencias para proteína cruda (Tabla 1). Los valores de grasa cruda mostraron una variación significativa, en donde el valor más alto se observó en abril (15.4%); adicionalmente, los valores más bajos se registraron en los meses de junio (6.5%), julio (6.6%), agosto (6.2%) y enero (6.9%). Los valores de humedad en el tejido gonadal mostraron también una variación significativa; los valores más altos se registraron en junio (77.9%), julio (78.2%) y agosto (77.8%), mientras que el valor mínimo se observó en abril (69.2%). El contenido de cenizas mostró los valores más altos en enero y septiembre , mientras que el valor mínimo se observó en febrero. La proteína se mantuvo estable a través del año, con valores medios que fueron de 12.2% a 13.4%.
Tabla 1 Análisis proximal de la gónada (% de peso húmedo) de la cabrilla
arenera, P. maculatofasciatus, a través del año en
Bahía de Kino.
Table 1. Gonad proximate composition (% of wet weight)
of spotted sand bass, P. maculatofasciatus,
throughout the year at Kino Bay.
| Mes | Grasa cruda | Proteína cruda | Humedad | Cenizas |
|---|---|---|---|---|
| marzo | 10.1bc ± 1.3 | 12.4 ± 2.0 | 75.3b ± 1.40 | 2.0ab ± 0.12 |
| abril | 15.4e ± 1.5 | 12.6 ±1.8 | 69.2a ± 1.50 | 2.0ab ± 0.15 |
| mayo | 11.3bcd ± 1.2 | 12.8 ±1.7 | 72.8ab ± 1.8 | 2.7b ± 0.24 |
| junio | 6.5a ± 1.5 | 12.4 ±1.5 | 77.95c ± 2.0 | 2.0b ± 0.15 |
| julio | 6.6a ± 1.1 | 12.5 ±1.6 | 78.2c ± 1.2 | 2.3ab ± 0.50 |
| agosto | 6.2a ± 1.1 | 12.2 ±1.8 | 77.8c ± 1.8 | 2.8b ± 0.70 |
| septiembre | 9.1abc ±1.4 | 12.2 ±1.8 | 74.9b ± 1.9 | 3.1b ± 0.40 |
| octubre | 8.9ab ± 2.0 | 13.4 ±1.9 | 74.4b ± 1.5 | 2.6ab ± 0.40 |
| noviembre | 8.8ab ± 1.3 | 13.1 ±1.6 | 75.2b ± 1.7 | 2.5ab± 0.60 |
| diciembre | 12.0cd ± 1.4 | 12.7 ±1.7 | 72.0b ± 1.7 | 2.6ab± 0.50 |
| enero | 6.9a ± 1.4 | 13.7 ± 1.4 | 75.4b ± 1.5 | 3.1b ± 0.70 |
| febrero | 13.6d ± 1.2 | 12.7 ± 1.6 | 72.1ab ± 1.3 | 1.6a ± 0.40 |
|
|
0.0001 | 0.979 | 0.0001 | 0.003 |
Los valores representan medias ± error estándar de 15 organismos analizados por mes. Las medias con letra diferente indican diferencias significativas (P < 0.05).
Ciclo reproductivo
Se analizaron histológicamente un total de 360 organismos, los cuales se clasificaron de acuerdo a su desarrollo sexual (Bertoncini-Andrade et al. 2003) en cinco estadios reproductivos para machos (Fig. 4): (I) Inmaduro/Descanso, (II) En Desarrollo, (III) Madurez avanzada (IV) Madurez y (V) Desove. De igual forma, en las hembras se describieron cinco estadios reproductivos (Fig. 5) de acuerdo al desarrollo de los ovocitos en la gónada (I) Inmaduro/Descanso, (II) Descanso avanzado, (III) En Desarrollo, (IV) Desarrollado y (V) Desovado. La distribución de los estadios reproductivos en los machos a través del año (Fig. 6A) indicaron que el 83% de los machos analizados en marzo se encontraban en Madurez Avanzada, ya que presentaban lóbulos gonádicos llenos de espermátides y esperma. En abril, el 50% de los machos analizados mostraron los ductos espermáticos llenos de esperma, (Madurez), mientras que en mayo, se encontró que el 100% de los machos mostraron los ductos espermáticos vacíos con gametos residuales (Desovado). De junio a agosto, los ductos espermáticos se encontraban en su mayoría con espermatogonias (Inmadurez-Descanso), y de octubre a noviembre, la mayoría de los organismos se encontraban en Madurez Avanzada (44 to 48%) y Madurez (37 to 37.5%), sin embargo en octubre (11%), se observó la presencia de organismos en Desove, los cuales se incrementaron en diciembre (76%), manteniendo un alto porcentaje en enero (58%) y febrero (75%). En el caso de las hembras (Fig. 6B) analizadas en abril, se evidenció la presencia de vesículas vitelogénicas con aspecto desorganizado, así como ovocitos de gran tamaño (debido a la hidratación), lo cual correspondió a los estadios En Desarrollo (30%) y Desarrollado (60.5%), respectivamente. En organismos analizados de junio a agosto, prevalecieron los ovocitos con un núcleo relativamente grande y aspecto bien organizado (Inmadurez-Descanso), mientras que en septiembre, se observó que los organismos analizados se encontraban en Descanso Avanzado (50%) (ovocitos con un aspecto menos organizado que en estadios previos) y Desarrollado (50%). Adicionalmente, todos los organismos analizados en octubre se encontraron Desarrollados, mientras que en diciembre, se observó la presencia de organismos Desovados (44%), los cuales se incrementaron de 83% a 100% en los meses de enero y febrero. Por otra parte, el análisis histológico de las gónadas también reveló la presencia de tejido ovárico degenerado, en conjunto con tejido testicular en proliferación, los cuales se clasificaron como organismos en transición de hembra a macho, es decir hermoafroditas protóginos (Fig. 7). Este comportamiento se observó en cinco organismos obtenidos durante los meses de abril (n=3), mayo (n=1) y junio (n=1).

Figura 4 Estadios de desarrollo testicular (secciones histológicas de 5
µm) de P. maculatofasciatus: (A) Inmaduro/Descanso
20X, (B) En desarrollo 10X, (C) Madurez Avanzada 20X, (D) Maduro 20X
y (E) Desovado 20X. Tinción Hematoxilina-Eosina. er = esperma
residual, sg = espermatogonias, sc= espermatocitos, st =
espermátidas, sz = espermas, dv =ductos vacíos, ls = espacio lobular.
Figure 4. Testicular development stages (histological
section at 5 µm) of P. maculatofasciatus: (A)
Immature/resting, 20X, (B) Developing, 10X, (C) Late mature, 20X,
(D) Ripe, 20X and (E) Spent, 20X. Hematoxilin-eosin stain. er =
residual sperm, sg = spermatogonia, sc = spermatocytes st =
spermatids, sz = spermatozoa, dv = empty ducts, ls =lobular
space.

Figura 5 Estadios de desarrollo ovárico (secciones histológicas de 5 µm)
de P. maculatofasciatus: (A) Inmaduro/Descanso 20X,
(B) Descanso Avanzado 10X, (C) En Desarrollo 20X, (D, E)
Desarrollado 10X-20X y (F) Desovado 20X. Tinción
Hematoxilina-Eosina. ti = tejido indiferenciado, gi = gametogénesis
inicial, ocI = ovocitos I, ocII = ovocitos II, ocIII = ovocitos III,
nl = nucléolo, n = núcleo, yv = vesícula vitelina, al = estrato
folicular, zr = zona radiata, oa = ovocitos atrésicos.
Figure 5. Stages of ovarian development (histological
section at 5 µm) in P. maculatofasciatus: (A)
Immature/resting, 20X, (B) Mature resting, 10X, (C) Developing, 20X,
(D, E) Developed, 10X-20X and (F) Spent, 20X. Hematoxilin-eosin
stain. ti = undifferentiated tissue, gi =initial gametogenesis, ocI
= oocytes I, ocII = oocytes II, ocIII = oocytes III, nl = nucleolus,
n = nucleus, yv = yolk vesicles, al = follicular layer, zr = zona
radiata, oa = oocytes atresia.
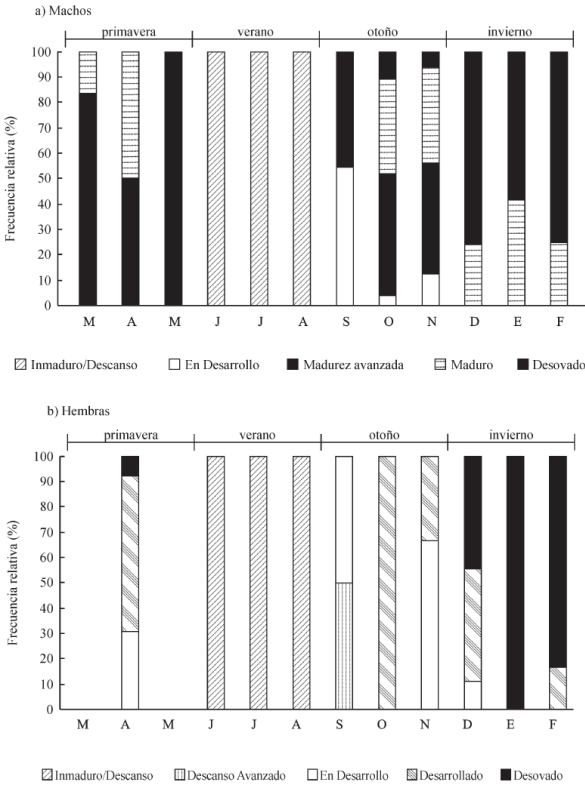
Fiigura 6 Frecuencia relativa (%) de los estadios reproductivos de
P. maculatofasciatus, A) machos y B) hembras,
capturadas de marzo 2017 a febrero 2018 en la región de Bahía de Kino.
Figure 6. Relative frequency (%) of reproductive stages
in P. maculatofasciatus, A) males and B) females,
from March 2017 to February 2018 at Kino Bay.
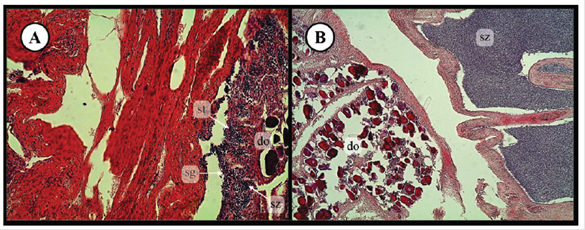
Figura 7 Organismos en transición sexual (protoginia) de
Paralabrax maculatofasciatus (A, B).
Magnificación 20X: do =ovocitos en degeneración, sg =
espermatogonias, st = espermátidas, sz = esperma.
Figure 7. Transitional individuals (protogynous) of
Paralabrax maculatofasciatus. Images at 20X: do
= degenerating ovarian tissue, sg = spermatogonia, st = spermatids,
sz = spermatozoa.
Proporción de sexos
La proporción de sexos obtenida para la cabrilla arenera mostró una variación significativa a través de los 12 meses de muestreo (Tabla 2). Se observó que los machos dominaron significativamente la población de septiembre a enero, mostrando valores de proporción que fueron desde 5 a 1 hasta 27 a 1. Por el contrario, se observó una dominancia significativa de las hembras durante los meses de agosto y septiembre, mostrando una proporción (Macho:Hembra) de 0.3 a 1, mientras que durante los meses de abril (1.1:1), junio (0.4:1) y julio (0.9:1) no se observaron diferencias significativas.
Tabla 2 Proporción de sexos y valores de χ2 con el factor de
corrección de Yates para P. maculatofasciatus de
marzo del 2017 a febrero del 2018 en la región de Bahía de Kino. El
asterisco representa diferencias significativas de la proporción
teórica esperada de 1:1 (P < 0.05).
Table 2. Sex ratio and χ2 values with Yates´
correction factor for P. maculatofasciatus from
March 2017 to February 2018 at Kino Bay. Asterisk represents
differences from the 1:1 ratio (P < 0.05).
| Mes | Machos | Hembras | Total | χ 2 | Proporción (M:H) |
|---|---|---|---|---|---|
| marzo | 30 | 0 | 30 | - | - |
| abril | 16 | 14 | 30 | 0.86 | 1.1:1 |
| mayo | 30 | 0 | 30 | - | - |
| junio | 14 | 16 | 30 | 2.82 | 0.8:1 |
| julio | 12 | 13 | 25 | 2.0 | 0.9:1 |
| agosto | 7 | 23 | 30 | 18.60 | 0.3:1* |
| septiembre | 25 | 5 | 30 | 6.0 | 5.0:1* |
| octubre | 27 | 1 | 28 | 14.0 | 27.0:1* |
| noviembre | 25 | 5 | 30 | 6.0 | 5.0:1* |
| diciembre | 25 | 5 | 30 | 6.0 | 5.0:1* |
| enero | 24 | 2 | 26 | 10.37 | 12.0:1* |
| febrero | 7 | 23 | 30 | 18.60 | 0.3:1* |
| Total | 242 | 107 | 349 | 85.30 | 2.1:1 |
Discusión
De acuerdo a la literatura, mientras el proceso de gametogénesis avanza a través del año, tanto el peso como el tamaño de la gónada tiende a incrementarse, es por esta razón que el IGS se considera como un indicador de la madurez sexual en los peces (De La Rosa et al., 2001; Grau et al., 2009). Los datos obtenidos en el presente estudio mostraron el máximo valor de IGS en el mes de abril, es decir cuando la mayoría de los organismos analizados se encontraban en el estadio IV. Estos resultados resultan similares a lo reportado para especies relacionadas como la cabrilla sardinera (Mycteroperca rosacea), donde los valores más altos de IGS se reportaron durante el periodo de desove (Estrada-Godínez et al., 2011), mientras que para el pargo del norte (Lutjanus gutattus) los valores reportados oscilan entre los 0.50% a 5.0%, y de igual forma los valores más altos se registraron en organismos sexualmente maduros (De-La-Rosa et al., 2001). Adicionalmente, también se han reportado que los valores de IGS pueden variar de acuerdo a la especie y estadio de madurez gonadal, por ejemplo para el pez angel rey (Holocanthus passer), se han reportado valores de IGS desde 0.09% (Desovado) hasta 0.15% (Madurez) en machos salvajes y de 0.87% (Desovado) hasta 3.43% (Madurez) en hembras salvajes (Urquidez-Bejarano et al., 2016), mientras que para hembras y machos de perca regia (Argyrosomus regius) se han reportado valores anuales que van desde 0.2% hasta 5.0% y desde 0.05% hasta 0.70%, respectivamente (Shabana et al., 2012).
Los valores de IHS obtenidos en el presente estudio para la cabrilla arenera fueron de 1.1% hasta 2.2%. De acuerdo a la literatura, valores altos de IHS están comúnmente relacionados con el almacenamiento de energía en el hígado, la cual es consumida durante el proceso de vitelogénesis (Pollino y Holdway, 2003; Zin et al., 2011; Sudarshan y Kulkarni, 2013; Indira et al., 2013). Por esta razón, el encontrar una correlación negativa entre el IHS y el IGS es común, como ha sido reportado para especies como la cabrilla sardinera (Estrada-Godínez et al., 2011), la sardina del Atlántico, Sardina pilchardua (Nunes et al., 2011) y el jurel bonito, Caranx caballus (Gallardo-Cabello et al., 2007). Sin embargo, esta correlación no siempre se presenta, tal y como se observó en el presente estudio para la cabrilla arenera, así como para otras especies de peces como el pargo rosado, Lutjanus guttatus (Arellano-Martínez et al., 2001), la lisa blanca, Mugil curema (Ruiz-Ramírez et al., 2017), el róbalo, Centropomus nigrescens (Gallardo-Cabello et al., 2018) y el lenguado, Cynoglossus arel (Ghaffari et al., 2011). Esta correlación negativa se podría explicar por las importantes modificaciones durante la maduración y diferenciación gonadal, las cuales pueden ser diferentes en cada especie (Bromage et al., 1992).
El factor de condición de Fulton o “K” es normalmente utilizado como un parámetro indirecto para evaluar la robustez de los peces. Aunque los valores de K tienden a variar entre las especies, en general este factor se mantiene muy cercano a 1.0 en los peces marinos; valores más altos indican una mayor robustez, mientras que valores por debajo indican una menor robustez (González-Félix et al., 2016; González-Félix et al., 2015; Perez‐Velazquez et al., 2017; Ricker, 1987). Los valores de K obtenidos en el presente estudio para la cabrilla arenera fueron de 1.5% a 1.6%. Desafortunadamente, la información acerca de los índices biológicos tanto para la cabrilla arenera, así como para otras especies similares es escasa, sin embargo, los valores se podrían considerar dentro del rango comúnmente reportado para otras especies de peces marinos, como el de la cabrilla sardinera (1.0-1.45%) (Estrada-Godínez et al., 2011), el pargo dorado, Lutjanus inermis (1.17-1.23%) (Lucano-Ramírez et al., 2012), la lisa blanca (1.25-1.45%) (Ruiz-Ramírez et al., 2017) y para la curvina de aleta corta, C. parvipinnis (0.96%) (González-Félix et al., 2017). Aunque no se detectaron diferencias significativas, los organismos capturados durante los meses de marzo, abril y noviembre, meses con una mayor actividad gametogénica, mostraron valores de K ligeramente más altos en comparación con los peces capturados de junio a agosto, periodo en el cual los peces se encontraban en el estadio Inmaduro/Descanso. Esto podría ser explicado por el hecho que el factor de condición “K” es un estimador que relaciona tanto el peso como la talla de los organismos, por lo que los valores de K tienden a disminuir cuando el peso disminuye y la longitud aumenta. Es por ello que en el presente estudio, los valores más bajos de K correspondieron a organismos en el periodo de Descanso, los cuales presentaban gónadas pequeñas en comparación con su longitud y contrariamente, los peces en un estadio gametogénico avanzado mostraron valores de K ligeramente más altos debido a la presencia de gónadas más grandes.
Por otra parte, las técnicas histológicas han sido comúnmente utilizadas para estudiar algunos aspectos reproductivos de la cabrilla arenera, sin embargo, estos estudios se han enfocado principalmente en evaluar su comportamiento hermafrodita. Es por esta razón, que los resultados aquí presentados, representan de acuerdo a nuestro conocimiento, el primer reporte que relaciona la madurez gonadal de la cabrilla arenera, Paralabrax maculatofasciatus con las características bioquímicas de la gónada. El análisis histológico mostró un alto porcentaje de machos en madurez y hembras desarrolladas en abril. Adicionalmente, se observaron machos en madurez de octubre a noviembre, aunque la presencia de machos en madurez continuó hasta diciembre, la mayor proporción de organismos se encontró en el estadio V. La presencia de hembras en el estadio IV se observó de octubre a diciembre, mientras que en diciembre, enero y febrero se observaron hembras en el estadio V. El periodo de descanso (estadio I) tanto para machos como para hembras ocurrió de junio a agosto en todos los peces analizados. Estos resultados sugieren que la cabrilla arenera puede exhibir dos picos reproductivos a través del año en la región de Bahía de Kino, donde el primer pico reproductivo toma lugar a mediados de la primavera, mientras que el segundo ocurre a mediados del otoño. Este comportamiento, es similar a lo reportado para la misma especie en estudios llevados a cabo en Baja California Sur (México) y California (EUA), en donde se reportó que el periodo de desove se lleva a cabo de mayo a septiembre con valores de fotoperiodo de 14.5h:9.5h a 15.5h:8.5h (Hovey y Allen, 2000). Sin embargo, Avilés (2005) determinó que la temporada reproductiva para P. maculatofasciatus en La Paz, Baja California Sur, ocurre de enero a julio, la cual se intensifica de febrero a mayo, una vez que la temperatura y el fotoperiodo alcanzan valores de 20-23 oC y de 12h:12h-14h:10h, respectivamente. De forma similar, Lluch Cota (1995) reportó que el periodo reproductivo de P. maculatofasciatus en Bahía Magdalena se lleva cabo desde finales del invierno hasta a mediados del otoño, sin embargo, el periodo de desove se intensifica de abril a agosto, una vez que la temperatura y el fotoperiodo alcanzan valores de 18.5-27 oC y de 14h:10, respectivamente. Adicionalmente, es ampliamente reconocido que tanto la temperatura como el fotoperiodo son dos de los factores mas importantes que controlan la reproducción en peces (Bromage et al., 1992; Clark et al., 2005; Zohar y Mylonas, 2001). En este contexto, en el presente estudio el primer pico reproductivo de la cabrilla arenera se llevó a cabo durante el periodo de abril-mayo, una vez que la temperatura y el fotoperiodo alcanzaron valores de 20-23 oC y 13h:11h-14h:10h, mientras que el segundo se llevó a cabo de octubre a noviembre cuando la temperatura y fotoperiodo alcanzaron valores de 22-27 oC y de 11h:13h-10h:14h, respectivamente, lo cual coincide con los estudios previos llevados a cabo sobre la especie (Lluch Cota, 1995; Avilés, 2005). Aunque es importante hacer notar el hecho de que se encontraron variaciones importantes en cuanto a la duración del periodo reproductivo de la cabrilla arenera, en comparación con los estudios llevados a cabo en las región de La Paz y Bahía Magdalena en Baja California Sur, estas diferencias podrían ser explicadas por el hecho de que en la región Sur del Golfo de California la temperatura del agua tiende a ser más cálida y estable en comparación con las condiciones ambientales de la región central, donde se localiza la región de Bahía de Kino (Soto-Mardones et al., 1999). Sin embargo, estos estudios coinciden con el hecho de que el proceso reproductivo de P. maculatofasciatus se intensifica cuando los valores de temperatura y fotoperiodo alcanzan valores aproximadamente de 20-27 oC y 14h:10h, respectivamente.
Por otra parte, se observó la presencia de organismos en transición de hembra a macho, es decir se encontró evidencia de hermafroditismo protógino y aunque, el hermafroditismo en el género Paralabrax se encuentra bien documentado (Avilés, 2005; Hastings, 1989; Hovey et al., 2002; Hovey y Allen, 2000; Oda et al., 1993), este trabajo se considera el primer estudio donde se reporte el hermafroditismo protogino para P. maculatofasciatus en la región central del Golfo de California.
La información concerniente a la ecología de las comunidades de peces hermafroditas es escasa, aunque se encuentra evidenciado que la pesca sin regulación puede desbalancear la proporción de sexos de una población (Carter et al. 1994; Coleman et al. 1996). Sin embargo, el hermafroditismo podría representar una ventaja como estrategia reproductiva cuando los machos o las hembras son escasas en una población (De Mitcheson y Liu, 2008; Ghiselin, 1969; Warner, 1975).
El análisis proximal de gónada de la cabrilla arenera, P. maculatofasciatus mostró una variación significativa en términos de grasa cruda y humedad, a través de los doce meses de muestreo. Los resultados obtenidos en el presente estudio evidenciaron que durante el primer pico reproductivo, el porcentaje de lípido fue estadísticamente más alto en gónadas maduras (abril) en comparación con los organismos en el estadio de descanso. Por el contrario, el porcentaje de humedad presentó valores estadísticos más altos en gónadas en descanso coincidiendo con los valores más bajos de lípidos. Aunque en la actualidad no existen reportes sobre las características bioquímicas de las gónadas de la cabrilla arenera, estos resultados son similares a lo reportado para el pez ángel rey H. passer, en donde se observó que el porcentaje de lípido en la gónada era numéricamente más alto en gónadas maduras (Urquidez-Bejarano et al., 2016) a su vez, estudios llevados a cabo en organismos salvajes de curvina de aleta corta, C. parvipinnis demostraron que el porcentaje de lípido variaba de 2.05% a 11.05%, durante la maduración temprana de la especie (González-Félix et al., 2017). En este contexto, se encuentra reportado en la literatura que los estadios reproductivos pueden afectar el contenido de lipídico de algunas especies de peces marinos, principalmente a aquéllas pertenecientes a las familias Serraniadae, Siganidae y Scombridae, lo cual puede ser atribuido al hecho de que el proceso de maduración requiere una alta movilización lipídica hacía las gónadas para llevar a cabo el proceso de vitelogénesis y espermatogénesis (Rao y Krishnan, 2011; Sprague et al., 2012; Suloma y Ogata, 2011).
La proporción de sexos mostró un desbalance a través del año, donde se observó una dominancia significativa de los machos de septiembre a enero, mientras que las hembras dominaron la población en agosto y febrero. Aunque la información sobre la proporción de sexos en las poblaciones de peces hermafroditas es escasa, se encuentra documentado en la literatura que las especies que tienden a formar agregaciones reproductivas son más susceptibles a los efectos de la sobrepesca, ya que resulta más fácil capturar una mayor cantidad de organismos mientras se encuentran reunidos en este complejo ritual reproductivo (Olsen y LaPlace, 1979). Por ejemplo, se ha observado que los abadejos, M. microlepis y M. phenas, las cuales son especies hermafroditas y formadoras de agregaciones reproductivas, sufrieron una disminución en la proporción de machos de 17% a 1% y de 36% a 18%, respectivamente, en un lapso de 25 años (Coleman et al., 1996). Por esta razón, el desbalance en cuanto a la proporción de sexos, así como la presencia de hermafroditismo en las poblaciones de P. maculatofasciatus en la región de Bahía de Kino podrían ser consecuencia de la sobreexplotación pesquera de la especie. Sin embargo, la predominancia de machos o de hembras en una población podría ser indicativo de hermafrodismo (Provost, 2013), como se observó en la presente investigación.
Conclusiones
Las poblaciones naturales de P. maculatofasciatus en la región de Bahía de Kino, Sonora, exhibieron dos picos reproductivos a través del año (a mediados de la primavera y a mediados del otoño), mientras que el periodo de descanso se llevó a cabo durante el verano. La presencia de organismos en transición de hembra a macho sugiere que algunos organismos son capaces de mostrar hermafroditismo protógino como estrategia reproductiva. Los índices biológicos IGS,IHS y K, así como la composición proximal de las gónadas de la cabrilla arenera, P. maculatofasciatus en la región de Bahía de Kino se reportan por primera vez en el presente estudio. De acuerdo al análisis proximal, la humedad fue el componente principal (69.2-78.2%), mientras que las cenizas fueron el componente de menor presencia (1.6-3.1%). La grasa cruda y la proteína mostraron valores desde 6.2% a 15.4% y de 12.2% a 13.4%, respectivamente. La proporción de sexos mostró una dominancia significativa de machos de septiembre a enero, mientras que las hembras dominaron en agosto y febrero.
Finalmente, los datos obtenidos en el presente estudio sobre el patrón reproductivo de la cabrilla arenera, P. maculatofasciatus coadyuvará en implementar el desarrollo de programas de protección, con el fin de llevar a cabo una pesquería sustentable en la región de Bahía de Kino. Sin embargo, es necesario que futuros estudios se lleven a cabo con el fin de investigar otros aspectos de suma importancia, como lo son los posibles efectos de la sobre pesca en el patrón reproductivo y la salud de las poblaciones naturales de P. macultatofasciatus en la región.











 nueva página del texto (beta)
nueva página del texto (beta)




