Introducción
Existen diferencias entre la calidad de frutos obtenidos de la producción de un cultivo sin suelo contra la producción en un cultivo en suelo, puesto que en el suelo las plantas acceden a una mayor cantidad de elementos minerales comparado con un sistema hidropónico (Juárez et al., 2007). En el cultivo de frambuesa se ha reportado menor contenido de antioxidantes (Vitamina C, tocoferol y compuestos fenólicos totales) en frutos producidos en cultivo sin suelo comparados con los que se cultivan y producen en suelo (Treftz y Omaye, 2015); se ha reportado menor contenido de sólidos solubles totales (SST) en frutos de fresa hidropónicos comparado con frutos producidos en suelo, en frutos de tomate hidropónico se ha reportado un menor contenido de vitamina C que los cultivados en suelo (Premuzic et al., 1998). Así mismo, se han obtenido niveles menores de azúcares como fructosa y glucosa en fresa, frambuesa y tomates hidropónicos comparados con los cultivados en el suelo (Premuzic et al., 1998; Treftz y Omaye, 2015). Lo anterior explica por qué los frutos hidropónicos son menos deliciosos al paladar o “less tasty” puesto que la calidad del fruto es afectada por el sistema de producción así como por condiciones climáticas y genotípicas (Martín-Hernandez et al., 2012). Aunado a esto, algunas empresas agrícolas con el objetivo de obtener mayor producción dejan de lado la calidad nutricional que pudiesen tener los frutos obtenidos en sistemas de producción sin suelo, sin embargo el contenido mineral y la biofortificación de los frutos ha comenzado a tener cada vez mayor interés (Ramos et al., 2010) y además la demanda de alimentos con un alto valor nutricional ha tenido un aumento en los últimos años. Actualmente las preferencias del consumidor han cambiado, pues ahora la sociedad se preocupa por estar informado de lo que contiene cada alimento que ingiere y debido a esto se han realizado investigaciones sobre frutos con potencial genético para presentar un alto nivel mineral y nutricional (Farruggia et al., 2016). Los frutos conocidos como berries en general poseen mayor capacidad antioxidante que otras frutas y verduras (Fredes, 2009). Es conocido que el consumo de frutos de frambuesa puede prevenir enfermedades, así como por tener efectos positivos para disminuir el estrés oxidativo (Teng et al., 2017).
En años recientes el uso de sistemas en cultivo sin suelo ha incrementado por la necesidad de producir mayores cantidades de alimentos que los que se producen en suelo y aprovechar al máximo los recursos hídricos. El incorporar enmiendas minerales de rocas molidas al medio de crecimiento en estos sistemas de producción proporciona minerales adicionales a los que comúnmente se encuentran en una solución nutritiva completa y puede generar condiciones favorables para el crecimiento adecuado de los cultivos. Con la incorporación de minerales secundarios no metálicos (remineralización), como zeolitas, dolomitas y roca fosfórica, se ha reportado un efecto positivo cuando éstas se aplican en suelos deficientes de nutrientes (Noriega et al., 2014).
Debido a lo anterior en el presente trabajo se evaluó el efecto de la aplicación de diferentes enmiendas de rocas minerales molidas en el medio de crecimiento (sustrato) y su efecto sobre el contenido mineral y antioxidante en frutos de frambuesa.
Materiales y métodos
Lugar de investigación, material vegetal y condiciones de manejo
La presente investigación se llevó a cabo en un invernadero tipo túnel ubicado en el Departamento de Horticultura de la Universidad Autónoma Agraria Antonio Narro, localizada en Buenavista, Saltillo, Coahuila, durante el periodo de enero a julio del 2017. Se utilizaron treinta y cinco plantas de frambuesa (Rubus ideaus L.) variedad fx1522 con tamaño similar en longitud (15 cm), diámetro de tallo (1 cm) y longitud de raíz (22 cm). Cada planta se trasplantó en un contenedor circular (bolsa de polietileno negro) con dimensiones de 30 cm de profundidad y 20 cm de diámetro con un volumen de 20 litros, perforadas en la parte inferior para permitir un adecuado drenaje. El medio de crecimiento utilizado fue una mezcla de peat moss y perlita en relación 2:1 (v:v), el cual se compactó ligeramente golpeando cada contenedor cinco veces en una superficie sólida. Las plantas se colocaron en el centro de cada contenedor y a una profundidad hasta cubrir el cuello de las mismas, se compactó el sustrato alrededor del tallo de cada planta manualmente, para posteriormente aplicar un riego con la finalidad de eliminar cualquier bolsa de aire que pudiese permanecer en el sistema radical. Una solución nutritiva completa (Steiner, 1961), con una concentración de N 126, P 31, K 180, Ca 130, Mg 40, S 60, Fe 3, Mn 0.5, Cu 0.1, Zn 0.6, B 0.2 y Mo 0.05 mg L-1, un pH de 5.5 y una conductividad eléctrica final que osciló entre 1.4 a 1.6 dS m-1, se aplicó manualmente todos los días de acuerdo a las necesidades de las plantas, permitiendo un drenaje del 30 %. Una semana después del trasplante, las plantas se podaron a una altura de 10 cm a partir de la base del sustrato con el objetivo de manejar tres tallos por planta, dejando los tallos que brotaron de las yemas superiores, el resto de los tallos que brotaron de las yemas inferiores se eliminaron cuando alcanzaron 2.5 cm de longitud.
Siete tratamientos fueron aplicados con las diferentes rocas molidas utilizadas: testigo sin aplicación de enmienda T1, roca fosfórica T2, dolomita T3, riolita T4, diatomita T5, zeolita T6 y harina de basalto T7, y en cada uno se tuvieron cinco repeticiones, colocadas en un diseño completamente al azar. En cada tratamiento se aplicaron 15 gramos de cada roca molida (Tabla 1) en la parte superior del sustrato y se mezcló manualmente con éste a una profundidad de cuatro centímetros, para que con cada riego bajara el producto paulatinamente.
Tabla 1 Contenido de minerales de las diferentes rocas minerales molidas
usadas como tratamientos para frambuesas cultivadas en sustrato de
peat moss y perlita.
Table 1. Mineral
content of the different ground rocks used as treatments for
raspberry plants grown in peat perlite growing medium.
| Roca fosfórica | Dolomita | Zeolita | Diatomita | Riolita | Harina de Basalto | |
|---|---|---|---|---|---|---|
| Porcentaje (%) | ||||||
| P2O5 | 26.33-33.20 | - | 0.06 | - | 0.67 | 3.98 |
| CaO | 20.06 | 32.78 | 3.82 | 1.59 | 2.46 | 12.63 |
| MgO | - | 13.35-19.53 | 0.98 | 0.38 | 2.80 | 2.80 |
| K2O | - | 0.01 | 4.70 | 0.51 | 4.47 | 2.00 |
| NaO2 | - | 0.01 | 0.03 | - | 1.24 | 2.16 |
| Fe2O3 | - | 0.02 | 2.47 | 0.36 | 2.62 | 9.64 |
| ZnO | - | - | 0.01 | - | - | - |
| Al2O3 | 6.00 | 0.42 | 13.91 | 4.04 | 7.15 | 15.16 |
| SiO2 | - | 2.19 | 73.81 | 40.80 | 32.69 | 49.54 |
| SO3 | - | 0.05 | 0.54 | - | - | - |
| S | 0.01 | - | - | - | - | - |
| TiO | - | 0.01 | 0.30 | - | - | 2.08 |
| F | 1.60 | - | - | - | - | - |
| Pb | 0.01 | - | - | - | - | - |
| As | - | - | - | - | - | - |
| Otros | - | - | - | - | 48.01 | - |
Muestreo
Los frutos utilizados para los análisis minerales y bioquímicos fueron tomados de cinco plantas y cosechados en estadio de madurez comercial. Posterior a la cosecha se trasladaron inmediatamente al laboratorio para su almacenamiento a -20 °C en un frigorífico (Daewoo DFR-25210GN) y se mantuvieron bajo estas condiciones hasta su respectivo análisis.
Altura y sólidos solubles totales
La altura fue determinada en metros al final del ciclo productivo de la planta utilizando una cinta métrica (Truper Modelo 12694), a partir de la base del sustrato y hasta el ápice del tallo. El valor reportado de esta variable fue la media de cinco tallos por cada repetición. El contenido de sólidos soluble totales (SST), se determinó midiendo en un refractómetro digital HI 96801 (0-85 %), el jugo de cinco frutos por repetición, reportándose en ºBrix.
Análisis mineral de frutos
El análisis se realizó mediante digestiones minerales de acuerdo a (Fick et al., 1976). Se pesó 1 g de muestra seca, se agregó 30 mL de HNO3 concentrado y se procedió a calentar en parrilla hasta que se destruyó por completo la materia orgánica. Después de 30 minutos y cuando la muestra se volvió transparente, se filtró en papel filtro Whatman número 41. Se aforó a 100 mL y se procedió a la cuantificación por medio de un plasma de acoplamiento inductivo con espectrofotómetro de emisión óptica (ICP-OES) (AOAC, 2000).
Preparación de extracto
El extracto de biomoléculas se realizó de acuerdo al procedimiento reportado por Ramos et al. (2010). El tejido vegetal se congeló a -20 °C y se liofilizó (FreeZone 2.5 Liter Benchtop Free Dry System, LABCONCO), posteriormente la muestra liofilizada se maceró con mortero de mano, se colocaron 200 mg del tejido pulverizado en un tubo para centrífuga de dos mililitros más 20 mg de polivinil pirrolidona, se añadió 1.5 mL de buffer de fosfatos pH 7-7.2 (0.1 M), posteriormente se sonicó (Ultrasonic Cleaner Branson 1510) por cinco minutos, para después centrifugar (Microcentrifuga Refrigerada Labnet PrismTM Ra) a 12000 rpm durante 10 min a 4 °C. El sobrenadante se recolectó y filtró con una membrana de nylon (PVDF 0.45 µm). Finalmente se diluyó en una proporción 1:15 con buffer de fosfatos a pH 7-7.2 (0.1 M).
Cuantificación de enzima catalasa (CAT)
La actividad de esta enzima fue cuantificada mediante espectrofotometría (Thhermo Scientific GENESYS 10S UV-Vis) de acuerdo al método reportado por Medrano-Macías et al., (2016). Se llevó a cabo midiendo dos tiempos de reacción, tiempo 0 (T0) y tiempo 1 (T1) separados ambos por 1 minuto. Se preparó la mezcla de reacción estándar agregando 0.1 mL del extracto de biomoléculas, 0.4 mL de H2SO4 al 5 % y 1 mL de buffer de fosfatos a pH 7.2. Para la mezcla de reacción para el T0 se agregó 0.1 mL del extracto de biomoléculas, 1 mL de H2O2 100 mM e inmediatamente después se añadieron 0.5 mL de H2SO4 al 5 %. Del mismo modo ocurrió para el T1, solo que los 0.5 mL del H2SO4 al 5 % fueron aplicados después de 1 minuto de reacción entre el peróxido y el extracto. La reacción se efectuó con agitación constante a una temperatura ambiente. Finalmente, en el espectrofotómetro de UV-VIS a 270 nm se leyó el consumo de H2O2. Las unidades de actividad (UI) fueron expresadas en mM de H2O2 por minuto entre proteínas totales.
Cuantificación de enzima superóxido dismutasa (SOD)
En cuanto a la actividad enzimática SOD se cuantificó de acuerdo al método reportado por Medrano Macías et al., (2016) para el cual se utilizó el kit para determinación SOD (SIGMA-ALDRICH, 2014). Con este método, mediante espectrofotometría se cuantifica la oxidación del colorante WST (water soluble tetrazolium salt) a WST-formazán por iones superóxido formados mediante el complejo xantina (X)/ xantina oxidasa (XO). La inhibición en la oxidación del WST es atribuido a la neutralización de los radicales superóxido por la enzima SOD, expresando las unidades en porcentaje de inhibición.
Determinación del contenido de fenoles totales
El contenido de fenoles se determinó mediante el método modificado de Sultana et al. (2009) y reportado por Medrano Macías et al. (2016), en el cual se preparó un extracto crudo moliendo 10 g de material vegetal hasta pasar por una malla 80 (177 micrones) y posteriormente se agregaron 100 mL de solvente (agua:acetona en realción 1:1 v/v) el cual se mantuvo por un tiempo de seis horas a temperatura ambiente y agitación constante. El extracto se separó de los residuos pasando a través de papel filtro Whatman No. 1, posteriormente el extracto crudo y seco se almacenó a -4 ºC en un frigorífico para su análisis posterior. Para determinación de fenoles, 50 mg de extracto crudo se mezclaron con 0.5 mL de reactivo Folin-Ciocalteu y 7.5 mL de agua des-ionizada. La mezcla se mantuvo por 10 minutos a temperatura ambiente y se agregó 1.5 mL de carbonato de sodio. Posteriormente la mezcla se calentó en baño de agua a 40 ºC por 20 minutos y se enfrió en un baño con hielo. Mediante espectrofotometría UV-VIS (Thermo Scientific GENESYS 10S UV-Vis) la absorbancia se leyó a 755 nm. Las cantidades de contenido total de fenoles se calcularon usando una curva de calibración de ácido gálico y los resultados se expresaron como equivalentes de ácido gálico en g por 100 g de peso seco.
Determinación de vitamina C
Para contenido de vitamina C, se pesaron 20 gramos de muestra fresca, se agregó 10 mL de HCl al 2 %, se maceró en un mortero y se agregaron 100 mL de agua destilada. Posteriormente se filtró a través de una gasa, y se midió el volumen total del filtrado. Finalmente se tomó una muestra de 10 mL del filtrado y se tituló con el reactivo Thielmann (10-3 N 2,6-diclorofenolindofenol) hasta la aparición de una coloración rosa. El cálculo del contenido de vitamina C presente en la muestra, se realizó mediante la metodología de Padayatt et al. (2001) y se reportó en mg por 100 g de muestra.
Resultados y discusión
Minerales en frutos
Se encontraron diferencias estadísticamente significativas (p ≤ 0.05) en el contenido mineral en frutos de frambuesa (Tabla 2). El fósforo (P), incrementó en un 27 % en los tratamientos zeolita y harina de basalto con respecto a las plantas testigo, así mismo se encontró un incremento de 18 % de P en los tratamientos a los cuales se adicionó roca fosfórica, dolomita, riolita y diatomita. Mumpton, (1999), reportó que la zeolita reduce el percolado de P manteniéndolo en el medio de crecimiento, haciéndolo probablemente más disponible para la absorción por las plantas, debido a esto existió una mayor concentración de este elemento en frutos. Brooks y Velásquez (2008) encontraron que la aplicación de zeolita favorece la liberación de fósforo, y la aplicación al sustrato presenta una tendencia natural para proveer de este elemento a las plantas cultivadas. La disponibilidad de este elemento puede verse afectada por una serie de reacciones abióticas dependientes del pH, la zeolita mejora el pH del medio de crecimiento (Pérez-Caballero et al., 2008) y así favorece una mayor disponibilidad de P. Referente a la harina de basalto con la cual se encontró una mayor concentración de P respecto los frutos control, Hinsinger et al. (2001) mencionan que la presencia de raíces de plantas en un entorno con harina de basalto, da como resultado un aumento sustancial de elementos nutritivos, incluyendo el P lo que sugiere que con este tratamiento las plantas accedieron a una concentración alta de este elemento. Así mismo Gillman et al., (2002) reportó que la aplicación de harina de basalto incremento el contenido de P en el suelo. Aunado a esto Nuñez y Gavi (1991) reportaron que a pH ligeramente acido de alrededor de 6 hay una mayor solubilidad de fosfatos en la roca fosfórica, lo cual explica la mayor absorción de P, ya que la solución nutritiva utilizada en este estudio se aplicó a un pH de 5.5~5.8. Por otro lado, el tratamiento con dolomita también provoco un aumento de P respecto al testigo. Rechcigl (2015) reportó que al aplicar dolomita al suelo obtuvo un amento en el contenido de P en el medio de crecimiento, lo que puede ser una posible respuesta al incremento de P en frutos de frambuesa en este experimento. En cuanto la aplicación de riolita la información disponible es escasa, estos resultados sugieren que la riolita aportó P ya que se encuentra en su composición, favoreciendo la disponibilidad de este elemento en el medio de crecimiento, lo cual permitió un aumento en el contenido de P en los frutos. La molienda diatomita aumentó el contenido de P, a pesar de que este elemento no forma parte de su composición. Nuestros resultados en frutos de frambuesa coinciden con los reportados por Abdalla (2010) quien reporta que al aplicar diatomita al suelo se obtiene un aumento de P en plantas de haba. Aksakal et al. (2012) mencionan que la molienda diatomita puede ser considerada como un agente alternativo para el uso en suelo, induciendo una mejora de las características físicas de éste.
Tabla 2 Concentración de macro y microelementos en frutos de frambuesa
cultivadas en sustrato de peat moss y perlita con enmiendas de
diferentes rocas minerales molidas.
Table 2. Marco and micro-elements concentration in
raspberry fruits grown in peat perlite growing medium amended with
different ground mineral rocks
| P | K | Ca | Mg | S | Fe | Cu | Mn | Si | |
|---|---|---|---|---|---|---|---|---|---|
| Tratamiento | g 100g-1 | mg 100g-1 | |||||||
| Testigo | 0.11b | 0.54b | 0.07b | 0.10b | 0.03bc | 2.31ab | 0.18c | 0.59ab | 3.02ª |
| Roca Fosfórica | 0.13a | 0.06ab | 0.03c | 0.11ab | 0.03bc | 2.51ab | 0.09d | 0.38d | 3.02ab |
| Dolomita | 0.13a | 0.69 a | 0.03c | 0.11ab | 0.03bc | 1.41cd | 0.16c | 0.38cd | 2.73abc |
| Riolita | 0.13 a | 0.68a | 0.02c | 0.10b | 0.02d | 1.34d | 0.07d | 0.47bcd | 2.35bcd |
| Diatomita | 0.13 a | 0.58b | 0.10a | 0.11ab | 0.04a | 2.63a | 0.26ab | 0.52abc | 1.70de |
| Zeolita | 0.14 a | 0.66a | 0.07b | 0.12a | 0.03ab | 2.28ab | 0.23b | 0.61a | 1.29e |
| Harina de Basalto | 0.14 a | 0.62ab | 0.07b | 0.11ab | 0.03abc | 2.00bc | 0.28a | 0.64a | 2.17cd |
Medias por columna con letra diferente son significativamente diferentes (p ≤ 0.05)
El contenido de K en frutos incrementó en un 27.7, 25.9 y 22.2 % con dolomita, riolita y zeolita respectivamente con respecto a los frutos producidos por las plantas testigo. La molienda dolomita obtuvo el valor más alto de K en frutos, posiblemente esto ocurre debido a que esta molienda presenta alto contenido de Ca y Mg en su composición, ocasionando que estos iones compitan entre ellos por los sitios de absorción (Marschner, 1995), cuando ocurre esto, la planta activa canales específicos para incrementar absorción de K (Baker y Pilbeam, 2015). El incremento de K por parte de las moliendas de riolita y zeolita se da posiblemente a que este elemento presenta una mayor concentración en su composición de 4.47 y 4.7 % respectivamente, y por lo cual se considera que al tener una mayor concentración en su composición hubo una mayor disponibilidad en el medio de crecimiento de este elemento y en consecuencia mayor absorción del ion K por la planta. Estudios han informado sobre la gran efectividad de las zeolitas como fuentes naturales de oligoelementos que complementan a NPK y su alta capacidad de adsorción (Kolyagin y Kucgerenko, 2003); incrementando rendimientos en trigo (13-15 %), berenjena (19-55 %), manzanas (13-38 %) y zanahorias (63 %) (Mumpton, 1999). Malekian et al. (2011) mencionan que la capacidad de intercambio catiónico de zeolita puede modificar las propiedades químicas del medio, de tal manera que retiene mayor cantidad de cationes. Carlino et al. (1998) demostraron que la zeolita tiene el potencial de adsorber K para posteriormente liberarlo lentamente, lo que probablemente contribuyó a encontrar un mayor contenido de este elemento en los frutos de frambuesa tratados con esta roca mineral molida. Abdi et al., (2006) reportaron un incremento en la actividad fotosintética en cultivo de fresa, debido a la disponibilidad de diferentes elementos minerales y agua para las plantas por el uso de zeolita.
El elemento Ca aumentó en frutos de frambuesa un 42.8 % con el tratamiento diatomita, mientras que con los tratamientos de zeolita y harina de basalto los resultados fueron similares a los obtenidos en los frutos testigo. Sin embargo, cuando las plantas se trataron con roca fosfórica, dolomita y riolita las concentraciones en el fruto disminuyeron en 57.1, 57 y 72.4 % respectivamente. La alta concentración de Ca en frutos de plantas tratadas con la molienda diatomita se podría explicar en parte ya que esta molienda tiene un bajo contenido de aluminio que interfiere con la absorción de calcio al formar complejos insolubles (Imadi et al., 2016). Las otras moliendas al tener alto contenido de Al crean un antagonismo que puede conducir a una menor absorbancia de calcio en la plantas (Roy et al., 1988). Los tratamientos con roca fosfórica presentaron una disminución del elemento Ca en frutos de frambuesa, ya que en su composición esta enmienda presenta alto contenido de Ca, y Al que pudieron haber formado complejos insolubles Ca-P y Ca-Al, lo que ocasionó que se precipitaran, esto podría explicar el porqué de la disminución de Ca (Sparks, 2003, Baker y Pilbeam, 2015). El contenido de Ca en frutos de frambuesa al ser tratados con riolita fue bajo y similar a la roca fosfórica, y aunque este elemento se encuentra en la composición de esta molienda, posiblemente la baja concentración de Ca se deba a la competencia de absorción entre cationes (García et al., 1999), ya que riolita contiene menor concentración de Ca con respecto a los cationes Mg y K.
La aplicación de zeolita incrementó en un 20 % la concentración de Mg siendo esta molienda con la que se obtuvo el valor más alto y la única estadísticamente superior al testigo. Perez-Caballero et al. (2008) reportaron que la aplicación de zeolita al suelo incrementa la capacidad de intercambio catiónico, lo cual permite una mayor retención de los minerales, y por lo tanto su disponibilidad. Así también se considera que la estructura porosa de las zeolitas están compuestas por cationes como Mg (Inglesazakis y Zorpas, 2012), los cuales son iones intercambiables, para el aprovechamiento de las plantas.
En cuanto al contenido de S se encontró un aumento del 33 % con el tratamiento diatomita respecto a las plantas testigo, obteniéndose con esta enmienda el valor más alto y el único superior estadísticamente respecto al testigo. Con el resto de los tratamientos los resultados fueron similares al testigo. El aumento en el contenido de S en frutos de frambuesa obtenido con el tratamiento diatomita, posiblemente se deba a que esta enmienda mejora las propiedades físicas del medio de crecimiento, como son la capacidad de retención de agua, reduciendo la lixiviación de los nutrientes como el ión S (Aksakal et al., 2012).
En la variable Fe los tratamientos con roca fosfórica, diatomita, zeolita y harina de basalto fueron estadísticamente iguales al testigo obteniéndose con todos ellos los valores más altos. En contraste, con los tratamientos de dolomita y riolita se observó una disminución del 39 y 42 % respectivamente al compararse con las plantas testigo. Tipping et al. (1986) reportaron que un pH más bajo facilita la disponibilidad del Fe, y por consiguiente su absorción a la planta, considerando que la dolomita es la enmienda que en su composición contiene un mayor contenido de Ca respecto a la demás, y puesto que el Ca es un elemento que se utiliza para aumentar el pH (Guo et al., 2018), la absorción del Fe pudo haberse reducido. La riolita en su composición tiene varios elementos esenciales que son asimilables de forma catiónica como son el K, Ca, Mg, Fe y Na (Marschner, 1995), esto pudiera explicar que la baja concentración de Fe, fue debido a la competencia que existe entre K y Fe, debido a que el ion K está en mayor concentración en esta molienda y, que fue la que propició el aumento en la concentración de K en frutos (Tabla 2).
El contenido de cobre en los tratamientos harina de basalto, diatomita y zeolita aumentó en un 55, 44 y 27 % respectivamente comparado con el testigo. El tratamiento dolomita obtuvo resultados estadísticamente iguales al tratamiento testigo, pero en los tratamientos roca fosfórica y riolita el contenido de Cu disminuyó un 50 y 38 % comparado con las plantas testigo. La molienda harina de basalto ha demostrado que tiene efectos positivos sobre el contenido de minerales entre ellos el Cu. Hinsinger et al. (2001) mencionan que la cantidad de elementos liberados del basalto, se debe a la modificación del pH en la rizósfera por efecto de las raíces de las plantas dando como resultado que el Cu se encuentre más disponible para la planta. Diatomita y zeolita como enmienda mejoran las características físicas del suelo, así como el intercambio catiónico de metales lo favorece la absorción del Cu que se aplica mediante la solución nutritiva (Hernández-Ávila et al., 2017; Perez-Caballero et al., 2008). El contenido de Cu tuvo una disminución en frutos de frambuesa con el tratamiento roca fosfórica, esto debido a los altos contenidos de P presentes en mencionada enmienda, el cual puede restringir la absorción de Cu por las raíces (Cao et al., 2004). Con respecto a la aplicación con riolita se presentó una disminución del contenido de Cu. Como se ha mencionado, riolita en su composición tiene varios elementos que son asimilables de forma catiónica como K, Ca, Mg, Fe, Na, por lo tanto, al ser el Cu un ion asimilable de forma catiónica (Marschner, 1995), posiblemente tuvo competencia entre cationes, como el K que fue el elemento con mayor concentración en la molienda, y el que mayor porcentaje de asimilación presentó.
El contenido de manganeso con los valores más altos, pero estadísticamente similares al testigo se encontró con los tratamientos de diatomita, zeolita y harina de basalto. Los tratamientos con roca fosfórica y dolomita mostraron una disminución del 36 % respecto al testigo (Tabla 2). El contenido de Mn en frutos disminuyó por efecto del tratamiento roca fosfórica y dolomita, probablemente esto se deba a que el Ca presente en la roca fosfórica incrementó el pH (Guo et al., 2018) ocasionando una disminución en la disponibilidad del Mn (Tipping et al., 1986)
El contenido de Si en los tratamientos roca fosfórica y dolomita no fueron diferentes estadísticamente al testigo, y los tratamientos riolita, diatomita, zeolita y harina de basalto presentaron una disminución del 22.2, 43.2, 57.3 y 68.2 % respectivamente (Tabla 2). El tratamiento con diatomita mostró una disminución de Si en los frutos, probablemente esto se deba a que el silicio se adsorbe como ácido silícico H4SiO4 y para esto necesita condiciones ácidas (pH<5) (Etesami, 2018) y así ser fácilmente absorbido por el sistema radical. Lo que corresponde al contenido de Si en los frutos tratados con la enmienda zeolita hubo una disminución respecto a las plantas testigo. Savvas y Ntatsi (2015) reportaron que suele haber una disminución en la absorción de Si en pH ligeramente ácidos, lo que explica por qué no hubo aumento de este elemento en los frutos con respecto al testigo. Por otra lado Etesami (2018) reportó que no solamente el pH afecta la cantidad de Si disuelto en el medio de crecimiento sino que más factores como la temperatura, y algunas actividades químicas del medio de crecimiento. Por otra parte Savvas y Ntatsi (2015) mencionan que suele haber más concentración de Si en plantas que están estresadas por factores (bióticos y abióticos) y es necesario aclarar que nuestras plantas no fueron estresadas intencionalmente.
Vitamina C
Respecto al contenido de Vitamina C, no se encontraron diferencias significativas entre los tratamientos. La vitamina C es ampliamente considerada como uno de los antioxidantes más importantes en los cítricos debido a que las plantas ante diferentes tipos de estrés (biótico y abiótico) utilizan este antioxidante como su principal sistema de defensa (Mditshwa et al., 2017).
Catalasa (CAT)
En la actividad de la enzima Catalasa los tratamientos riolita, diatomita y zeolita presentaron una mayor actividad del 154, 145, y 134 % respectivamente comparado con el testigo (Tabla 3). La actividad de la enzima CAT en los frutos de frambuesa aumentó obteniendo el valor numérico más alto con la aplicación de riolita. Cabe mencionar que con este tratamiento se obtuvo el menor contenido de micronutrientes, azufre y calcio con respecto al testigo, lo que sugiere que las plantas no se desarrollaron en condiciones óptimas, ya que al no tener los nutrientes suficientes o necesarios se ocasionó un ligero estrés a la planta (que no se detectó con vitamina C), pero que en consecuencia propició acumulación de H2O2 (Izawa et al., 1996) como señalizador de este estrés (Mhamdi et al., 2012), y como respuesta a esa señal la planta comenzó a sintetizar más enzima CAT para defenderse del estrés oxidativo provocado. Con respecto a las moliendas diatomita y zeolita la actividad de la enzima CAT, aumentó posiblemente causado por algún agente presente en la molienda que ocasionó un ligero estrés. Debona et al. (2017) comentan que la respuesta de las plantas a algún estrés ocurre a niveles bioquímicos, fisiológicos y moleculares y que el Si tiene un papel activo en la señalización para activar los diferentes mecanismos de defensa de las plantas, y se sugiere que por el alto contenido de este elemento en los tratamientos con diatomita y zeolita se activaron estos mecanismos.
Tabla 3 Contenido de antioxidantes en frutos de frambuesa cultivadas en
sustrato de peat moss y perlita con enmiendas de diferentes rocas
minerales molidas.
Table 3. Antioxidant content of raspberry fruits grown
in peat perlite growing medium amended with different ground mineral
rocks
| Tratamiento | Vitamina C | CAT | SOD | Fenoles | CA |
|---|---|---|---|---|---|
| Testigo | 47.76a | 0.88cd | 92.46a | 3.30bc | 15.61a |
| Roca Fosfórica | 46.66a | 0.70cd | 93.81a | 3.18c | 15.57a |
| Dolomita | 51.46a | 0.53d | 92.21a | 3.71abc | 15.72a |
| Riolita | 51.42a | 2.24a | 92.51a | 3.90ab | 15.40a |
| Diatomita | 45.03a | 2.16ab | 95.42a | 3.62abc | 15.69a |
| Zeolita | 48.19a | 2.06ab | 95.17a | 4.08a | 15.49a |
| Harina de Basalto | 53.31a | 1.39bc | 94.57a | 3.29ba | 14.65b |
Medias por columna con letra diferente son significativamente diferentes (p ≤ 0.05). Vitamina C se reporta en mg por 100 g de muestra. CAT: catalasa en unidades de µM de H2O2 consumido/proteínas en g/kg. SOD: Superóxido dismutasa en porcentaje de inhibición. Fenoles totales se presenta en mg de ácido gálico / 100g de peso seco. CA: capacidad antioxidante se presenta en moles.
Superóxido Dismutasa
La actividad de la enzima SOD no presento diferencias significativas entre los tratamientos (Tabla 3). SOD es la primer enzima antioxidante que actúa sobre el radical O2 cuando las plantas se encuentran en condiciones de estrés biótico y/o abiótico (Gill y Tuteja, 2010), pues este es el primer radical formado en los procesos de fotosíntesis y respiración (Medrano-Macías et al., 2016). Es importante mencionar que no se encontraron trabajos en los cuales se cuantificara SOD después de la aplicación de rocas minerales y aunque Yamamoto et al. (2002) reportaron que los mecanismos de defensa aumentan con la presencia de un elemento estresante, en nuestro estudio las rocas minerales no modificaron el estado de esta enzima. De igual manera con respecto a la capacidad antioxidante no se encontró diferencia significativa entre los tratamientos.
Fenoles totales
En cuanto al contenido de fenoles totales el tratamiento con zeolita fue el que provocó el valor más alto con 4.08 mg kg-1 superando al testigo por un 23 % más, los tratamientos dolomita, riolita, diatomita y harina de basalto no fueron diferentes al testigo y el tratamiento roca fosfórica presentó una disminución de 3.7 % respecto a las plantas testigo (Tabla 3). Estos compuestos son capaces de prevenir les efectos nocivos del estrés (Agatonovic-Kustrin y Morton, 2016) y como se mencionó anteriormente con este tratamiento se obtuvo el menor contenido de micronutrientes, azufre y calcio con respecto al testigo, sugiriendo que las plantas no se desarrollaron en condiciones óptimas, ya que al no tener los nutrientes suficientes o necesarios se ocasionó un ligero estrés que fue detectado en este caso con la producción de fenoles.
Solidos solubles totales y altura de planta de Frambuesa
Para el contenido de sólidos solubles totales (SST), solamente el tratamiento Riolita disminuyó 20 % en comparación del testigo, mientras que el resto de los tratamientos no hubo diferencia significativa (Figura 1). Finalmente, en la altura total de la planta no se encontraron diferencias significativas respecto al testigo (Figura 2).
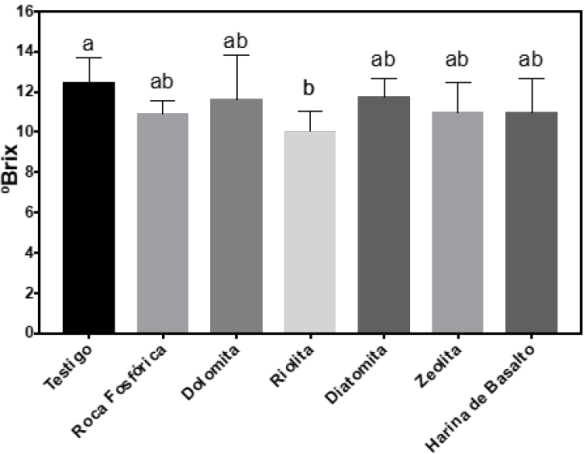
Figura 1 Contenido de sólidos solubles totales (ºBrix) en frutos de
frambuesa tratados con enmiendas de diferentes rocas minerales
molidas. La línea superior representa el error estándar y letras
diferentes indican diferencias significativas entre tratamientos (p
≤ 0.05).
Figure 1. Total soluble solids
content (ºBrix) in raspberry fruits treated with amendments of
different ground mineral rocks. The line above every column
represents the standard error and different letters mean
significative different letters mean significative difference among
treatments (p ≤ 0.05).
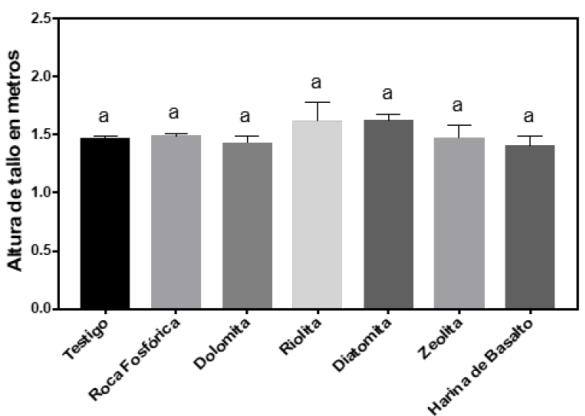
Figura 2 Altura total de plantas de frambuesa. La línea superior
representa el error estándar, letras diferentes indican diferencias
significativas entre tratamientos (p ≤ 0.05).
Figure 2. Total height of raspberry plants. The line
above every column represents the standard error and different
letters mean significative difference among treatments (p ≤
0.05).
En las variables agronómicas altura de planta, diámetro de tallo, diámetro ecuatorial del fruto, diámetro polar del fruto, y peso fresco del fruto no se encontraron diferencias significativas respecto al testigo. Por el contrario, en el número de frutos si se encontró diferencias significativas ya que con el tratamiento dolomita se encontró un aumento del 38 %, con respecto al testigo. En contraste, con roca fosfórica se encontró un 44.7 % menos respecto al testigo.
Conclusiones
El uso de rocas minerales molidas zeolita y diatomita como enmiendas minerales al medio de crecimiento, incrementa el contenido mineral en frutos de frambuesa.
La aplicación de riolita, diatomita y zeolita, incrementan el contenido de antioxidantes como la enzima catalasa y fenoles totales. El uso de enmiendas minerales es una opción para incrementar el contenido de minerales y elevar la calidad nutracéutica en frutos de frambuesa desarrolladas en cultivos sin suelo.











 nueva página del texto (beta)
nueva página del texto (beta)


