| Glosario de términos | |
|---|---|
| Adherencia | Manera en que el paciente se adhiere a las recomendaciones de su médico. |
| Ajuste | Procedimiento estadístico en el cual el efecto de las diferencias en la composición de la población en estudio ha sido comparado para minimizarlas. |
| Aleatorización | Consiste en asignar aleatoriamente (al azar) a los participantes de un ensayo a dos o más grupos de tratamiento o de control. La aleatorización es una de las formas de evitar los sesgos de selección, cuyo propósito es posibilitar las comparaciones en los grupos de asignación de los tratamientos. |
| Algoritmo | Diagrama de flujo en la toma de decisiones clínicas para apoyar la incorporación de las recomendaciones a la práctica cotidiana. |
| Aplicabilidad | El grado en que las recomendaciones contenidas en una guía de práctica clínica o un documento de consenso pueden ser incorporadas a un escenario clínico en particular. |
| Appraisal of Guidelines, Research and Evaluation (AGREE) | Colaboración internacional de investigadores con el objetivo de mejorar la calidad de las guías de práctica clínica. El instrumento AGREE fue diseñado para evaluar la calidad de las guías de práctica clínica (http://www.agreecollaboration.org). |
| Asociación | Relación estadística entre dos o más eventos,
características u otras variables. La relación puede ser causal o no.
Análisis de intención para tratar (Intention-to-treat analysis [ITT |
| análisis]) | Forma de análisis estadístico de los resultados que incluye a todos los pacientes que han sido inicialmente asignados a cada grupo de tratamiento, independientemente de que completen o no el protocolo en su totalidad. |
| Calidad de vida relacionada con la salud (Health-related quality of life [HRQL]) | Percepción que una persona tiene del impacto que ha provocado la enfermedad o su tratamiento sobre su sentimiento de bienestar y la capacidad de actuación (funcionalidad). Estas dimensiones básicas deben ser analizadas en los dominios físico, emocional y social. |
| Estudio de casos y controles | Estudio observacional en el cual el investigador selecciona individuos que han experimentado algún evento de interés y otros que no lo han presentado, para después evaluar si fueron expuestos a una posible causa. |
| Cegamiento | Manera en que se evita que los investigadores, el equipo de investigación o los participantes del estudio conozcan qué intervenciones fueron asignadas durante una investigación. |
| Comorbilidad | Coexistencia de dos o más condiciones patológicas o enfermedades en un mismo individuo. |
| Desenlace | Medición de los posibles resultados relevantes para considerar una mejoría del padecimiento con la exposición a la intervención terapéutica. |
| Efectividad | La efectividad clínica es una medición del beneficio positivo de un tratamiento concreto en la práctica médica. |
| Efecto absoluto | Diferencia entre el riesgo de ocurrencia de un evento entre dos grupos (uno en relación con el otro) en un estudio comparativo. |
| Eficacia | La eficacia clínica es una medición del resultado positivo de un tratamiento concreto en el contexto de un estudio de investigación controlado. |
| Estado basal | Conjunto de características y variables al inicio del estudio, con los cuales serán comparados los resultados subsecuentes. |
| Estándar de referencia | Prueba diagnóstica más cercana a la veracidad del fenómeno en estudio, de la que se puede disponer en un momento determinado y que será utilizada para comparar con las características de la prueba diagnóstica que se desea evaluar. |
| Estudio de cohorte | Estudio prospectivo o retrospectivo de un grupo de individuos que comparten características y que se definen por su exposición o no exposición a un factor de riesgo. |
| Estudio clínico controlado | Experimento o estudio en el que los investigadores «manipulan» uno o más factores de estudio (p. ej., deciden qué tratamiento, con qué pauta y durante cuánto tiempo lo recibirán los sujetos de cada uno de los grupos de estudio) con el objeto de valorar posteriormente los efectos producidos (o respuesta, resultado, variable dependiente), con base en un plan preestablecido. El objetivo es evaluar la eficacia y la seguridad de cualquier intervención, ya sea preventiva, curativa o rehabilitadora, y es el diseño que proporciona la evidencia de mayor calidad acerca de la relación causal entre una intervención y el efecto observado. |
| Equitativo | Distribución justa de beneficios o recursos. |
| Evidencia | Cúmulo de información en la que se sustenta una decisión clínica. Se obtiene de fuentes que incluyen estudios clínicos controlados, estudios observacionales, estudios de prueba diagnóstica, revisiones sistemáticas y consensos de expertos. |
| Grupo control | En un ensayo clínico, grupo de participantes que no reciben la intervención experimental objeto de estudio. El grupo testigo puede recibir una intervención que se considera eficaz (normal), un placebo o nada. Los resultados del grupo testigo se comparan con los del grupo experimental para determinar si hay diferencias estadísticas. |
| Heterogeneidad | En un metaanálisis, la heterogeneidad se refiere a la variabilidad o a las diferencias en las estimaciones de los efectos entre los estudios. En ocasiones se distingue entre «heterogeneidad estadística» (diferencias en los efectos declarados) y «heterogeneidad metodológica» (diferencias en el diseño de estudios). |
| Homogeneidad | La homogeneidad define la mayor o menor igualdad de los valores de una variable o de una combinación de características en un conjunto geográfico. Los parámetros de dispersión estadística, en particular la varianza, miden su inversa, la heterogeneidad. |
| Intervalo de confianza | Es un rango de valores, derivado de los estadísticos de la muestra, que posiblemente incluya el valor de un parámetro de población desconocido. Debido a su naturaleza aleatoria, es poco probable que dos muestras de una población en particular produzcan intervalos de confianza idénticos. |
| Intervención | Acción terapéutica o de algún otro tipo que modifica el estado basal del paciente. |
| Médico clínico | Médico que se encarga de proveer atención clínica. |
| Metaanálisis | Un metaanálisis es un conjunto de herramientas estadísticas que son útiles para sintetizar los datos de una colección de estudios. Se inicia recopilando estimaciones de un cierto efecto (expresado en un índice de tamaño del efecto, como la diferencia de medias tipificada, la razón de riesgo o la correlación) de cada estudio. Permite valorar estos efectos en contexto: si el tamaño del efecto es consistente, el efecto del tratamiento puede ser considerado como fuerte y el tamaño del efecto se estima con mayor precisión que con un solo estudio. Si el tamaño del efecto varía, esa variación puede ser descrita y potencialmente explicada. |
| Método de consenso | Se refiere a la toma de decisiones en común acuerdo por parte de todos los miembros de un grupo, y no por la mayoría o por una representatividad. Lo que caracteriza al consenso es el proceso por medio del cual el grupo llega a un acuerdo. El método de consenso es deseable cuando es improbable forzar el cumplimiento de la decisión, igual como si cada participante adoptara independientemente una misma decisión unánime. Por ello, algunos grupos reservan el método de decisión por consenso para decisiones particularmente complejas, arriesgadas o importantes. |
| Número necesario a tratar (Number needed to treat [NNT]) | El número de pacientes que es necesario tratar (también conocido por los calcos «número necesario a tratar» y «número necesario para tratar») es el recíproco de la reducción del riesgo absoluto; es un valor o indicador específico para cada tratamiento. |
| Placebo | Sustancia que carece de acción curativa, pero que produce un efecto terapéutico si el enfermo la toma convencido de que es un medicamento realmente eficaz. Presenta el mismo aspecto, gusto y forma que un medicamento verdadero, pero está hecho de productos inertes y sin ningún principio activo. |
| Valor de p | El valor de p (también denominado
p-valor, la p, valor de
p consignado, o bien en inglés
p-value) se define como la probabilidad de obtener un resultado al menos tan extremo como el que realmente se ha obtenido (valor del estadístico calculado), suponiendo que la hipótesis nula es cierta, en términos de probabilidad condicional. |
| Pregunta clínica | Se refiere a la pregunta identificada por el grupo de expertos para la que se ha detectado la necesidad de dar lineamientos dentro de la guía de práctica clínica, y que debe de tener una estructura. |
| Posología | Determinación de las dosis en que deben administrarse los medicamentos. |
| Pronóstico | El pronóstico, generalmente de una enfermedad, es el conjunto de datos que posee la ciencia médica sobre la probabilidad de que ocurran determinadas situaciones en el transcurso del tiempo o evolución natural de la enfermedad. Es la predicción de los sucesos que ocurrirán en el desarrollo de una enfermedad en términos estadísticos. Es un tipo de juicio clínico. |
| Resumen | Conjunto de datos de un estudio que puede ser publicado solo o con el trabajo en extenso. |
| Revisión Cochrane | Revisión sistemática de la literatura de estudios clínicos controlados que responde una pregunta clínica a través de un protocolo explícito, realizada por el grupo colaborativo Cochrane y disponible en la Biblioteca Cochrane. |
| Revisión sistemática | Las revisiones sistemáticas son artículos científicos integrativos ampliamente usados en disciplinas del área de la salud que siguen un método explícito para resumir la información que se conoce acerca de determinado tema o problema de salud. Revisan y pueden combinar, principalmente, ensayos clínicos controlados, que son los estudios primarios. Se distinguen de las revisiones narrativas en que provienen de una pregunta estructurada y de un protocolo de investigación previo. La Colaboración Cochrane es la principal organización que produce y financia revisiones sistemáticas. Además, la búsqueda de la evidencia se ha desarrollado de manera sistemática con una declaración de los criterios de selección y se han hecho una evaluación crítica de los artículos primarios y una síntesis basada en la calidad metodológica de los estudios. Cuando una revisión sistemática termina de manera cuantitativa, en un estimador estadístico, se denomina metaanálisis. |
| Riesgos | Eventos adversos de una intervención. |
| Riesgo relativo | Es una medida relativa del efecto porque indica cuántas más veces se tiende a desarrollar el evento en el grupo de sujetos expuestos al factor de exposición o factor de riesgo en relación con el grupo no expuesto. El riesgo relativo no tiene dimensiones, ya que es una razón. |
| Serie de casos | Reporte de un número de casos de un padecimiento en particular, en el que se describe la evolución del padecimiento y la respuesta al tratamiento. |
| Sesgo | Desviación sistemática de la verdad en los resultados de un estudio causada por la manera en que este fue diseñado o conducido. |
| Variables confusoras | Las variables de confusión, también llamadas «terceras variables», son variables que el investigador no controló o no eliminó, y que dañan la validez interna de un estudio de investigación. |
Introducción
Otitis media aguda
La otitis media aguda (OMA) se definió hace casi un siglo como el proceso infeccioso del oído medio, cuyas características primordiales eran la pérdida de las estructuras osiculares, el color y la hipomovilidad de la membrana timpánica1. La mayoría de los estudios reportaban aislamientos bacterianos de en aproximadamente el 70% de los casos y el tratamiento era, en gran medida, empírico. Se proponía una implicación importante de agentes virales, pero pocos estudios habían podido demostrar la etiología viral1. Actualmente, la OMA se define como el proceso infeccioso supurativo agudo del oído medio caracterizado por la presencia de exudado infeccioso y un proceso inflamatorio de la mucosa del oído medio2. La evolución de las técnicas modernas de biología molecular, de los estudios clínicos controlados y de las mejores pruebas estadísticas ha dejado conocer más detalladamente los complejos mecanismos inmunitarios que interactúan con el microbioma de la nasofaringe y del oído medio, y con los distintos microorganismos patógenos, virales y bacterianos, lo que a su vez ha permitido entender mejor el proceso de la enfermedad, así como los mecanismos de acción de las opciones terapéuticas actuales3.
La OMA es más frecuente en los niños menores de 3 años, aunque puede presentarse a cualquier edad. La prevalencia de la enfermedad es muy alta en todo el mundo. De acuerdo con lo reportado por la American Academy of Pediatrics, en los Estados Unidos se presentan 5 millones de casos al año, lo que resulta en más de 10 millones de prescripciones de antibióticos y 30 millones de visitas médicas anualmente4. Un estudio epidemiológico llevado a cabo en cinco países europeos reportó una incidencia anual del 18%. El 22% de los niños presentaron un episodio y el 7% más de dos episodios. Al inicio del estudio, el 58.2% de los niños habían recibido, al menos, una dosis de vacuna conjugada heptavalente. Se presentaron complicaciones en menos del 1% de los casos, y la mayoría de ellas en el grupo de 0 a 2 años5. Se estima que la incidencia de OMA en los Estados Unidos y en Europa en niños menores de 2 años es de 0.1 a 1.8 episodios/año por niño, lo que implica múltiples visitas médicas por el mismo episodio. Se estima, además, que el 80% de los niños a los 2 años de edad han presentado al menos un episodio de OMA.
La epidemiología de la OMA en países latinoamericanos se sintetizó en una revisión sistemática publicada por Bardach et al.6, en la cual se incluyeron 18 estudios que se llevaron a cabo en seis países (México, Argentina, Chile, Costa Rica, Brasil y Colombia), tanto en centros de referencia como en la población abierta. En México se reportó una incidencia anual de OMA de 36,000 por cada 100,000 niños menores de 4 años. Tomando en cuenta la incidencia acumulada en 5 años, se proyectó una incidencia de 10.5 millones de casos de OMA para una tasa de natalidad de 11.7 millones (89%), que resulta muy similar a la incidencia reportada en los Estados Unidos y Europa. Sin embargo, es evidente la falta de información epidemiológica en nuestra región en comparación con los países desarrollados6. Otros reportes epidemiológicos en México registraron una incidencia mayor de 600,000 casos por año. En México, la OMA es la sexta causa de morbilidad en la población infantil, la cuarta en niños de 1 a 4 años y la sexta en niños menores de 1 año7. La incidencia de complicaciones graves de la OMA, meningitis y mastoiditis en los países en desarrollo continúa siendo muy relevante. La Organización Mundial de la Salud calcula más de 50,000 muertes por complicaciones relacionadas con la OMA en niños menores de 5 años en estos países. Aunque no se conocen con detalle las razones, se considera que el pobre acceso a servicios de salud de calidad y los factores nutricionales podrían explicar la mayor mortalidad en esta población6 (Tabla 1).
Tabla 1 Principales causas de morbilidad en México, 2014
| Posición | Padecimiento | Casos |
|---|---|---|
| 1 | Infecciones respiratorias agudas | 27,493,239 |
| 2 | Infecciones intestinales por otros microorganismos y las mal definidas | 5,518,928 |
| 3 | Infección de vías urinarias | 3,666,552 |
| 4 | Úlceras, gastritis y duodenitis | 1,497,802 |
| 5 | Gingivitis y enfermedad periodontal | 1,119,159 |
| 6 | Otitis media aguda | 639,625 |
| 7 | Conjuntivitis mucopurulenta | 556,815 |
| 8 | Hipertensión arterial | 480,332 |
| 9 | Diabetes mellitus | 412,861 |
| 10 | Intoxicación por picadura de alacrán | 381,702 |
Modificada de Informe sobre la Salud de los Mexicanos.7
Desde hace décadas, los agentes bacterianos involucrados en la etiopatogenia de la OMA han sido plenamente caracterizados e identificados, y no ha habido cambios significativos en los últimos lustros. Streptococcus pneumoniae, Haemophilus influenzae no tipificable (HiNT), Moraxella catarrhalis y Streptococcus pyogenes son las bacterias identificadas en el cultivo de material de miringocentesis de oído medio con mayor frecuencia según lo reportado en la literatura mundial. Los estudios latinoamericanos no son la excepción. Los microorganismos identificados con mayor frecuencia son S. pneumoniae (32.4%) y HiNT (26.0%), este último asociado a una mayor incidencia de complicaciones y falla terapéutica6. Los serotipos de S. pneumoniae que han sido identificados con mayor frecuencia son el 14, el 6A, el 19A, el 6B, el 19F, el 23F y el 9V7,8. Sin embargo, la introducción de la vacuna neumocócica conjugada (VNC7), que contiene los serotipos 4, 14, 6B, 18C, 19F, 23F y 9V, modificó la frecuencia de serotipos no incluidos en ella, como el 19A y el 7F, lo que limitó su eficacia9. El desarrollo de vacunas neumocócicas conjugadas con mayor cobertura (VNC10 y VNC13) ha demostrado mantener estable la emergencia de cepas resistentes de S. pneumoniae9. En estudios latinoamericanos han sido identificados los 14 serotipos de S. pneumoniae, y la frecuencia de los datos combinados se reportó del 24% para el 19F, el 19% para el 6B, el 17% para el 19A, el 15% para el 5, el 11% para el 9V, el 9% para el 14 y el 8% para el 23F, que equivalen al 60-70% de las cepas aisladas6 (Tabla 2).
Tabla 2 Metaanálisis de la frecuencia de los distintos agentes bacterianos aislados en pacientes con otitis media aguda en Latinoamérica
| Agente etiológico | Prevalencia general % (IC95%) |
|---|---|
| S. pneumoniae | 32.40 (27.06-37.99) |
| H. influenzae total | 26.03 (19.52-33.12) |
| H. influenzae no tipificable | 18.26 (10.00-28.32) |
| H. influenzae tipo b | 3.75 (1.27-7.48) |
| S. pyogenes A | 5.98 (2.00-11.91) |
| S. epidermidis | 3.66 (2.31-5.32) |
| M. catarrhalis | 3.47 (2.08-5.19) |
| S. aureus | 2.77 (1.87-3.83) |
| P. aeruginosa | 1.48 (0.50-2.96) |
| Estreptococo alfa hemolítico | 1.20 (0.41-2.40) |
| Otros | 4.57 (0.92-10.75) |
| Coinfección bacteriana | 3.46 (2.34-4.80) |
| Sin crecimiento | 30.71 (24.01-37.83) |
IC95%: intervalo de confianza del 95%.
Modificada de Bardach, et al.6
Entre los factores de riesgo mejor caracterizados se encuentran la edad temprana, el sexo masculino, acudir a guarderías, historia de infección de vías aéreas superiores, hipertrofia de adenoides, alergia respiratoria, inmunodeficiencias y alteraciones craneofaciales. La exposición ambiental al humo del cigarro también es un factor de riesgo bien establecido10,11.
El uso indiscriminado de antibióticos para el tratamiento de la OMA en niños ha contribuido en gran medida a dos problemas muy relevantes: al impacto económico de la enfermedad, y a la emergencia de cepas resistentes entre los agentes causantes de OMA. Los estudios realizados en México han reportado que aproximadamente el 85% de los niños diagnosticados con OMA son tratados con antibióticos, el 30% con antihistamínicos y el 60% con analgésicos antiinflamatorios no esteroideos (AINE)12.
Con respecto a la emergencia de la resistencia bacteriana a los antimicrobianos, las cifras varían dependiendo del país y de la región. Los reportes más recientes indican que más del 50% de S. pneumoniae son resistentes a los betalactámicos, el 10% a las cefalosporinas de tercera generación, el 30% a los macrólidos, el 50% a trimetoprima-sulfametoxazol (TMP/SMZ) y el 17% a tres o más antibióticos. Más del 30% de los aislamientos de HiNT y el 100% de M. catarrhalis son resistentes a los antibióticos betalactámicos. Los factores de riesgo para la resistencia de las bacterias incluyen la asistencia a guarderías, otitis media recurrente, edad menor de 2 años y empleo de antibióticos en los últimos 3 meses13. El mal uso de antibióticos en infecciones de vías aéreas superiores, dentro de las que se cuenta la OMA, ha sido ampliamente documentado en México. Se ha reportado que, de todos los pacientes que acudieron a un servicio de atención primaria, el 60-80% recibieron antibiótico por infección de vías aéreas superiores, cuando, según los investigadores, su uso estaba justificado en solo alrededor del 15%. De igual forma, los costos directos asociados al abuso en la prescripción de antibióticos impactan de manera importante los recursos hospitalarios y de las propias familias14.
Otro aspecto muy importante para lograr un uso racional de los antibióticos y de los recursos en el tratamiento de la OMA es realizar un diagnóstico preciso. El diagnóstico de OMA continúa siendo clínico. Debido a que los síntomas no son específicos de la enfermedad, es esencial llevar a cabo una adecuada exploración física empleando otoscopia neumática. Pichichero15 realizó un estudio con médicos especialistas en pediatría de distintos países del mundo y demostró que el diagnóstico correcto de OMA se hace apenas en la mitad de los casos, y con mucha frecuencia se confunde con otitis media con derrame (Tabla 3).
Tabla 3 Síntesis de los hallazgos importantes en otitis media aguda en los últimos años y su posible impacto en la práctica clínica cotidiana
| Investigación | Impacto en la práctica clínica |
|---|---|
| Una gran variedad de virus causa infección de vías aéreas superiores. Prácticamente todas las infecciones de vías aéreas superiores tienen la capacidad de originar un cuadro de OMA, y no es indispensable la actuación bacteriana | La OMA puede ser de etiología viral o bacteriana. Al no ser necesaria la prescripción de antibiótico en todos los casos, los antibióticos como monoterapia pueden ser inadecuados en algunos casos |
| Algunos virus son especialmente afines a la mucosa del oído medio (ototrópicos), como el VSR, los adenovirus y los bocavirus | Esto confirma la necesidad de vacunas específicas para la prevención de la OMA |
| La actividad pico de virus como el VSR, el hMPV y el virus de la influenza coincide con el aumento en el número de visitas médicas | Los clínicos deben tomar en cuenta el incremento de las visitas por OMA durante la temporada de virus respiratorios |
| Durante los primeros 7 días de una infección de vías aéreas superiores, los niños pueden manifestar un proceso inflamatorio variado de la membrana timpánica y síntomas de OMA | Los médicos pueden tomar esa información para mejorar su precisión diagnóstica |
| Un biomarcador específico, la enzima LDH, se asocia a la presencia de OMA durante los primeros 4 días de una infección de vías aéreas superiores | El pronóstico de la OMA durante el curso de una infección de vías aéreas superiores usando biomarcadores específicos puede ser alentador. Se requiere más investigación al respecto |
| Se han identificado nuevos factores que determinan
virulencia en la fisiopatogenia de la OMA en relación con
S. pneumoniae, H. influenzae no tipificable y M. catarrhalis |
Estos objetivos potenciales pueden brindarnos nuevas herramientas en el tratamiento de la OMA |
hMPV: metapneumovirus humano; LDH: lactato deshidrogenasa; OMA: otitis media aguda; VSR: virus sincicial respiratorio.
Modificada de Barenkamp, et al.86
Medicina basada en la evidencia y objetivos de la guía
La definición actual de la medicina basada en la evidencia es «el uso juicioso, explícito y concienzudo de la mejor evidencia científica disponible, aunado con la mejor experiencia clínica, los valores y las preferencias de los pacientes, y considerando los costos para el mejor cuidado de los pacientes»16. La experiencia clínica conlleva un proceso de aprendizaje e integración del conocimiento que requiere tiempo y que se va perfeccionando progresivamente hasta obtener las habilidades diagnósticas y terapéuticas para un mejor cuidado de los pacientes17. La medicina basada en la evidencia, sin duda, requiere herramientas que faciliten la incorporación de todo el conocimiento científico que va surgiendo a la toma de decisiones clínicas para los pacientes18. Las revisiones sistemáticas de la literatura contienen protocolos de investigación explícitos, rigurosos y exhaustivos para identificar y evaluar de forma crítica, así como sintetizar los estudios relevantes19. Después de casi cuatro décadas de desarrollar una metodología que persigue la disminución de sesgos en las conclusiones, las revisiones sistemáticas de la literatura se han convertido en la piedra angular de la medicina basada en la evidencia19.
Al inicio de la década de 1990 se dio un impulso a otro instrumento que se situaría como pieza clave en la medicina basada en la evidencia: las guías de práctica clínica (GPC) basadas en la evidencia20-23. El reporte del Institute of Medicine (IOM) define a las GPC como «recomendaciones desarrolladas sistemáticamente para asistir a los clínicos y a los pacientes en la toma de decisiones para una mejor calidad en la atención de la salud en condiciones específicas»23. El objetivo primordial de las GPC es cerrar la brecha entre el conocimiento científico y la toma de decisiones por parte de profesionales de la salud y pacientes, apoyar en los procesos de educación médica, auxiliar a los desarrolladores de políticas públicas y administradores para eficientar el uso de recursos, y decidir sobre las tecnologías en salud más costo-eficientes22 (Fig. 1).
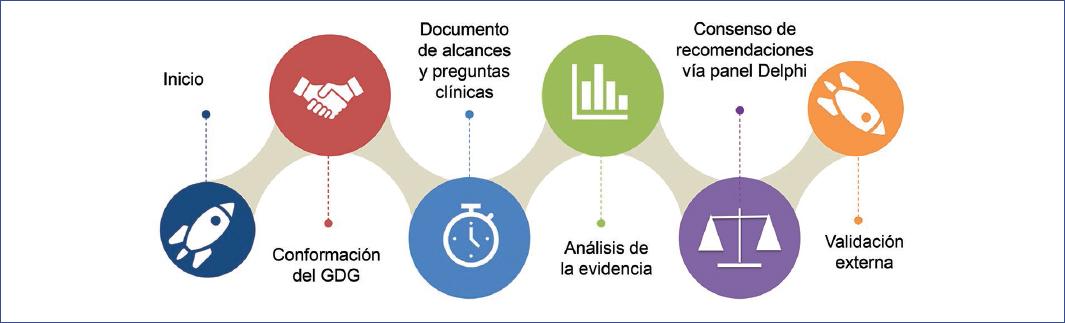
Figura 1 Desarrollo global de las guías de práctica clínica. GDG: Grupo de Desarrollo de la Guía. (Adaptada de Mayorga et al.22)
Las GPC necesitan un protocolo bien establecido para su desarrollo. Además, requieren que a la mejor evidencia disponible se incorpore la mejor experiencia clínica, pero también los puntos de vista de los usuarios finales, entre los que se debe contemplar a los pacientes y sus cuidadores, administrativos, médicos, familiares, realizadores de políticas en salud, así como cualquier organización que se desarrolle en el campo de la atención mpedica (Fig. 2)20,22.
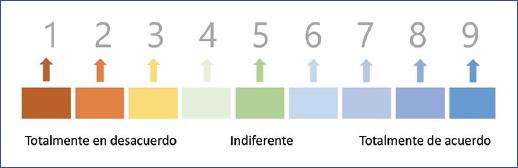
Figura 2 Escala de Likert empleada en el panel Delphi modificado. Evalúa el grado de consenso entre los expertos respecto al contenido y la redacción de cada una de las recomendaciones clínicas. (Adaptada de Mayorga et al.22)
La clasificación de la evidencia científica se llevó a cabo tomando en cuenta la clasificación desarrollada por la Scottish Intercollegiate Guidelines Network (SIGN)24 (Tabla 4). En ella se otorga el nivel más alto de evidencia a las revisiones sistemáticas de estudios clínicos controlados y aleatorizados (ECA) con muy bajo riesgo de sesgo, y sucesivamente va disminuyendo la calidad de la evidencia, pasando por ECA con alto riesgo de sesgo, estudios de cohortes y estudios de casos y controles, hasta llegar a los estudios no analíticos, como las series de casos y los reportes de casos, y en el nivel inferior de la evidencia se coloca la opinión de los expertos24 (Fig. 3).
Tabla 4 Evaluación de la calidad de la evidencia (SIGN 50)
| Nivel de la evidencia | |
|---|---|
| 1++ | Revisiones sistemáticas con o sin metaanálisis de ECA o ECA con muy bajo riesgo de sesgo |
| 1+ | Revisiones sistemáticas con o sin metaanálisis bien desarrolladas o ECA con bajo riesgo de sesgo |
| 1− | Revisiones sistemáticas con o sin metaanálisis de ECA con alto riesgo de sesgo |
| 2++ | Revisiones sistemáticas de alta calidad de estudios de cohortes o de casos y controles. Estudios de alta calidad de cohortes o de casos y controles con un riesgo muy bajo de sesgo y una alta probabilidad de que la asociación sea causal |
| 2+ | Estudios de cohortes y de casos y controles bien desarrollados con un riesgo bajo de sesgo y una alta probabilidad de que la asociación sea causal |
| 3 | Estudios observacionales no analíticos, como series de casos y reportes de casos |
| 4 | Opinión de los expertos |
| Grados de recomendación | |
| A | Por lo menos una revisión sistemática con o sin metaanálisis o ECA calificado como 1++ y directamente aplicable a la población en estudio, o un cuerpo de evidencia que consiste principalmente en estudios calificados como 1+, directamente aplicable a la población en estudio y que ha demostrado resultados consistentes |
| B | Un cuerpo de evidencia que incluye estudios clasificados como 2++, directamente aplicable a la población en estudio y que ha demostrado resultados consistentes, o evidencia extrapolada de estudios clasificados como 1++ o 1+ |
| C | Un cuerpo de evidencia que incluye estudios clasificados como 2+, directamente aplicable a la población en estudio y que ha demostrado resultados consistentes, o evidencia extrapolada de estudios clasificados como 1++ |
| D | Un cuerpo de evidencia clasificada como 3 o 4, o evidencia extrapolada de estudios clasificados como 2+ |
ECA: estudio clínico aleatorizado.
Es importante destacar que el grado de recomendación se relaciona con la fuerza de la evidencia en la cual se ha basado la recomendación clínica. No refleja la importancia clínica de la recomendación.
Modificada de Scottish Intercollegiate Guidelines Network (SIGN)24.
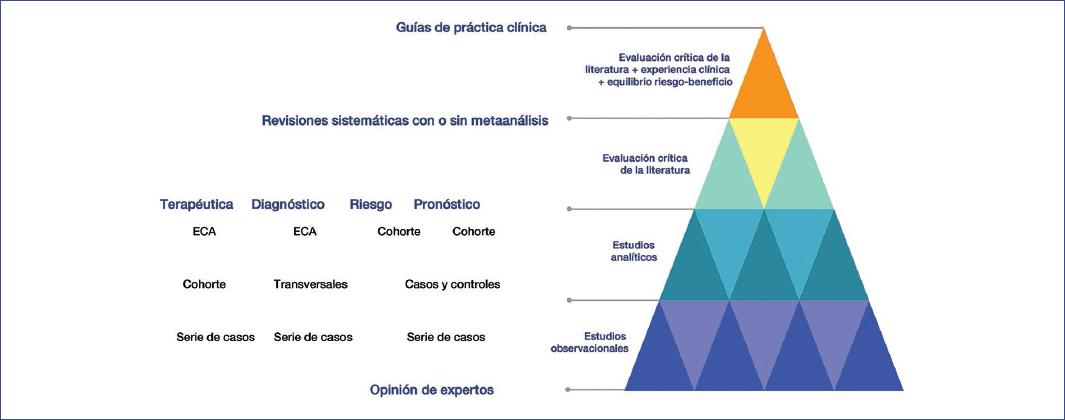
Figura 3 Pirámide de la evidencia. ECA: estudio clínico aleatorizado. (Adaptada de Mayorga et al.22)
Guías de práctica clínica sobre otitis media aguda
Las GPC más difundidas en todo el mundo probablemente sean las desarrolladas por la American Academy of Pediatrics, publicadas en 2013. En México, el Centro Nacional de Excelencia Tecnológica actualizó unas GPC para el diagnóstico y el tratamiento de la OMA en 2021, adaptando las guías publicadas en el extranjero.
Método
Grupo de Desarrollo de la Guía
Se integró el Grupo de Desarrollo de la Guía (GDG) de forma interdisciplinaria, compuesto por expertos clínicos en otorrinolaringología, otorrinolaringología pediátrica, infectología pediátrica, pediatría y medicina familiar. Los participantes fueron elegidos y convocados por parte del Colegio de Otorrinolaringología y Cirugía de Cabeza y Cuello Pediátricas de México (COPEME). También se incluyeron expertos metodológicos con experiencia en el desarrollo de revisiones sistemáticas de la literatura y GPC. Un grupo de expertos reducido (grupo nuclear [GN]) se reunió en múltiples ocasiones para definir el modo de trabajo, los tiempos y la distribución de las responsabilidades, así como los aspectos importantes en la definición de los alcances generales de la GPC y la base de datos de preguntas clínicas estructuradas.
Definición de los alcances
El GDG ensambló de manera consensuada el documento de alcances generales, en el cual se establecen las características de la población a tratar, así como las características de la población que no se incluirá en el documento. El documento de alcances establece el marco general de la GPC: describe brevemente los aspectos generales de la enfermedad y define los aspectos clínicos que se van a cubrir y los que no serán considerados. De igual forma, el documento de alcances describe la audiencia blanco que se considera de interés para la GPC y a la cual se dirigen las recomendaciones clínicas (Anexo 1).
Los aspectos más importantes del documento de alcances son los siguientes:
– Las características de la población que se incluirá.
– La definición de la población que no será cubierta por la GPC.
– El escenario o escenarios clínicos en los cuales se planea que las recomendaciones de la GPC serán implementadas.
– Los diferentes aspectos clínicos que serán evaluados durante el desarrollo de la GPC, en los cuales se contemplan pruebas diagnósticas, intervenciones médicas e intervenciones quirúrgicas, entre otros.
– Información específica para los usuarios.
– Los desenlaces clínicos que serán considerados para evaluar las distintas intervenciones terapéuticas y diagnósticas.
– Los aspectos en los cuales se espera que la GPC contribuirá para el manejo de la enfermedad.
Preguntas clínicas estructuradas
El GDG identificó las brechas en la práctica clínica cotidiana y desarrolló las preguntas clínicas. La respuesta a estas preguntas originó recomendaciones para los usuarios de la GPC. Las preguntas clínicas debían ser claras, precisas y específicas para facilitar la búsqueda y la revisión de la evidencia científica, y así evitar recomendaciones poco ajustadas a los problemas clínicos que plantea la GPC (Anexo 2).
El listado de preguntas contempló la población, las intervenciones y los comparadores estipulados en el documento de alcances. Se consideró el esquema PICO, y de acuerdo con este, se tomaron en cuenta los siguientes componentes:
– Paciente: grupos de edad, estadio de la enfermedad, comorbilidad.
– Intervención: factor pronóstico, agente etiológico, prueba, diagnóstico, tratamiento habitual o placebo, ausencia de factor de riesgo, ausencia de agente etiológico, método de referencia de prueba diagnóstica.
– Comparación: alternativa de la intervención, tal como tratamiento habitual o placebo, ausencia de factor de riesgo, ausencia de agente etiológico, método de referencia de prueba diagnóstica.
– Desenlaces (outcomes): variables de resultado clínicamente importantes en el caso de estudios sobre eficacia, pronóstico o etiología, y estimadores de rendimiento o validez.
Búsqueda exhaustiva de la evidencia científica
La evidencia se eligió siguiendo algoritmos y estrategias validadas internacionalmente. Se identificaron términos MeSH (Medical Subject Headings) para de esta forma ensamblar una estrategia de búsqueda sensible y específica, además de explícita para que sea reproducible en un futuro19. De acuerdo con la naturaleza de la pregunta clínica a responder, se estableció el tipo de estudio que fuera más confiable para contestarla. A partir de este punto, se consideraron otros tipos de estudio que pudieran responderla, aunque con menos confianza en los resultados. Siguiendo los modelos de clasificación de la evidencia, se consideraron las variables de desenlaces importantes para clínicos y pacientes (Anexo 3).
La búsqueda se llevó a cabo a partir de las preguntas clínicas estructuradas. La revisión bibliográfica preliminar incluyó la localización de GPC relevantes sobre el mismo tema. Esto permitió facilitar el ensamblaje del documento de alcances y la identificación de preguntas clínicas relevantes sobre el tema. Además, ayudó en la identificación, la evaluación y la síntesis de la evidencia científica.
Las revisiones sistemáticas desempeñan un papel crucial en el proceso de elaboración de una GPC. Los estándares internacionales actuales proponen la utilización de las revisiones sistemáticas como herramientas indispensables para la localización y la selección de la evidencia científica que soporte las recomendaciones clínicas (Anexo 3).
Una vez que los elementos de la búsqueda y selección fueron claramente definidos, se seleccionaron las bases de datos en función del tipo de publicación que se deseaba buscar y el tema objeto de cada pregunta clínica. Para el resto de las publicaciones (revisiones sistemáticas o estudios originales), las bases de datos bibliográficas son las herramientas idóneas para recuperar información, ya que agrupan conjuntos de referencias de documentos almacenadas electrónicamente y que se pueden buscar y seleccionar de manera interactiva a través de un lenguaje de consulta o interrogación.
Las bases de datos que recopilan GPC fueron consultadas usando términos MeSH. A continuación, se enumeran las distintas bases de datos que fueron consultadas para localizar las GPC publicadas y relevantes para la elaboración de la nuestra:
– Organismos recopiladores. El más completo es la National Guideline Clearinghouse (NGC), de cobertura internacional, perteneciente a la Agency for Healthcare Research and Quality (AHRQ) de los Estados Unidos. En el Reino Unido destaca el NeLH Guidelines Finder, de la National Electronic Library for Health (NeLH). El catálogo de guías realizadas en España se recoge en Guiasalud. La base de datos Trip Database es un motor de búsqueda útil que ofrece una idea rápida del volumen de GPC existentes. Se consultaron también las bases de datos de las principales sociedades y academias del área de la especialidad a escala internacional en búsqueda de GPC publicadas.
– Organismos elaboradores. Se incluyeron el National Institute for Health and Care Excellence (NICE) del Reino Unido, la Scottish Intercollegiate Guidelines Network (SIGN), el Institute for Clinical System Improvement (ICSI) de los Estados Unidos el National Health and Medical Research Council (NHMRC) de Australia y el New Zealand Guidelines Group (NZGG).
– Centros de metodología. Destacan por su interés la Guidelines International Network (GIN), la colaboración AGREE (Appraisal of Guidelines Research and Evaluation) y el GRADE Working Group como grupo de trabajo que desarrolla el sistema emergente Grading of Recommendations Assessment, Development and Evaluation (GRADE). En bases como Medline también se encuentran indexadas GPC y existen filtros que se pueden aplicar en las búsquedas. No obstante, no es la forma más eficiente de localizarlas.
Para la búsqueda exhaustiva de revisiones sistemáticas se ensamblaron diversas estrategias de búsqueda y se utilizaron distintas bases de datos generales y especializadas en revisiones sistemáticas. Se emplearon estrategias de búsqueda publicadas y validadas que ya hubieran demostrado ser sensibles y específicas, así como los términos MeSH.
Las bases de datos consultadas para identificar revisiones sistemáticas fueron Cochrane Library (contiene revisiones sistemáticas de estudios clínicos controlados de alta calidad, independientes y confiables para ser incluidas en el cuerpo de evidencia), Best Practice, The Campbell Collaboration Library of Systematic Reviews, Centre for Reviews and Dissemination databases (incluyendo la base DARE), Centre for Reviews and Dissemination, National Institute for Health Research (NIHR), Database of Promoting Health Effectiveness Reviews, The Database of Promoting Health Effectiveness Reviews (DoPHER), TripDatabase, The Evidence for Policy and Practice Information and Co-ordinating Centre (EPPI-Centre), Medline, PubMed (National Library of Medicine), Scopus Large International y EMBASE a través de OVID, NICE y el NIHR para identificar Health Technologies Assessment (HTA) de alta calidad.
Solo en los casos en que las preguntas clínicas no contaban con una revisión sistemática para ser respondidas o las GPC no identificaron evidencia científica de alta calidad, se realizaron búsquedas exhaustivas de la literatura para intentar encontrar estudios clínicos que respondieran a esa pregunta.
Las bases de datos que se consultaron para identificar estudios clínicos publicados fueron The Cochrane Library (hasta octubre de 2018), Cochrane Central Register of Controlled Trials, Cochrane Database of Systematic Reviews y Database of Abstracts of Reviews of Effects (DARE) (Issue 1, 2018), Medline 1950-2018 (OVID), Embase 1980-2018 (OVID), Cinahl 1982-2018 (NLH Search 2.0), Cumulative Index to Nursing and Allied Health Literature (1982 a 2018), LILACS (1998 a 2018), ARTEMISA (1999 a 2018) y SCIELO (1999 a 2018).
Evaluación de la calidad y jerarquización de la evidencia
Se emplearon herramientas diseñadas y validadas internacionalmente para evaluar la calidad de la evidencia científica considerando el tipo de documento evaluado. En el caso de las GPC se empleó la herramienta AGREE II (The Appraisal of Guidelines for Research & Evaluation II), que fue diseñada para evaluar la calidad metodológica y la variabilidad de las GPC. Para las revisiones sistemáticas de la literatura se empleó la herramienta AMSTAR II (Assessing the Methodological Quality of Systematic Reviews). Para el caso en el que se condujo una revisión sistemática de estudios clínicos, se utilizaron las siguientes herramientas validadas: CONSORT (Consolidated Standards of Reporting Trials) para estudios clínicos controlados, MOOSE (Meta-analysis of Observational Studies in Epidemiology), QUADAS (Quality Assessment of Diagnostic Accuracy Studies) para estudios de prueba diagnóstica y STROBE (Strengthening the Reporting of Observational Studies in Epidemiology) para estudios observacionales25-31.
Cada una de estas herramientas califica distintos rubros y utiliza diferentes escalas. Se emplearon de manera individual y se calificaron por pares, con un tercer evaluador en caso de que hubiera poca concordancia entre los revisores.
Se han publicado numerosas clasificaciones para evaluar la calidad de la evidencia. Por consenso, se decidió utilizar la escala desarrollada por SIGN, la cual se basa en dos atributos para evaluar la calidad de la evidencia científica (nivel de evidencia): el diseño del estudio y el riesgo de sesgo. Para la clasificación del diseño del estudio se utilizan los números del 1 al 4. El número 1 corresponde a ensayos clínicos o revisiones sistemáticas de estos ensayos, y el número 4 se refiere a la opinión de expertos. Para evaluar el riesgo de sesgo se utilizan signos que informan sobre el grado de cumplimiento de los criterios clave relacionados con ese potencial riesgo: ++, + y −. De esta forma, con la ayuda de la plantilla de lectura crítica, se evaluó cada estudio, ya fueran estudios individuales (ECA o de cohortes) o revisiones sistemáticas. Esta valoración de la calidad de la evidencia científica de los diferentes estudios disponibles para responder a las preguntas formuladas fue utilizada luego en la graduación de la fuerza de las recomendaciones24.
Extracción de la evidencia y análisis
Las GPC preferentemente deben incorporar revisiones sistemáticas para sustentar con evidencia científica las recomendaciones clínicas, una vez que las revisiones sistemáticas han sido evaluadas en su calidad30,31. Se llevaron a cabo reuniones con el GDG para revisar el texto completo de cada una de las revisiones sistemáticas y poder extraer los resultados. Se consideraron las medidas de asociación, resultado de los metaanálisis reportados en las mismas, para determinar el tamaño del efecto global, ya fuera de la razón de momios (OR, odds ratio), el riesgo relativo (RR) o la diferencia de los promedios ponderados de los efectos (weighted mean estimate of the effect) de acuerdo con los distintos desenlaces definidos por el GDG. Para los estudios de prueba diagnóstica es importante considerar otras medidas de asociación, como la sensibilidad, la especificidad y los valores predictivos positivo y negativo.
En las preguntas clínicas para las que no se encontraron revisiones sistemáticas publicadas de buena calidad, se llevó a cabo la revisión sistemática para identificar estudios clínicos. Una vez hecha la evaluación de la calidad y de la posibilidad de sesgo, se llevó a cabo el metaanálisis.
En primer lugar, se definió la naturaleza de los valores de acuerdo con el tipo de desenlace a estudiar. Una vez extraídas las medidas de asociación, se determinó el grado de heterogeneidad entre los resultados de los estudios, para lo que se utilizó la prueba Q de Der Simonian y Laird. Una vez demostrado que la heterogeneidad no era significativa, se llevó a cabo el metaanálisis bajo el modelo de efectos fijos, cuando se asumió que no existía heterogeneidad entre los estudios incluidos en la revisión, y el modelo de efectos aleatorios, cuando se asumió que los estudios incluidos en la revisión constituían una muestra aleatoria de todos los estudios existentes. En los casos pertinentes, se presentó la información en una forest plot, en la que se pretendió mostrar el efecto estimado en cada estudio junto con el valor obtenido combinando los resultados de todos los estudios, y acompañados por sus respectivos intervalos de confianza. Esta gráfica contiene también la línea vertical del valor correspondiente a la ausencia de efectos (RR = 1 o diferencia de medias = 0) y los límites de relevancia clínica para determinar si las diferencias, además de alcanzar significación estadística, son de una magnitud relevante.
Consenso formal de expertos
Se llevó a cabo el consenso de expertos utilizando la metodología de panel Delphi modificada32-34. Cada experto respondió las preguntas, las cuales fueron modificadas de acuerdo con las respuestas en distintas rondas posteriores. En cada ronda de preguntas y respuestas, a las que se les puede dar un carácter cualitativo o cuantitativo, el GN integró las respuestas de todos los expertos de la ronda previa y realizó las modificaciones de manera consensuada para ser enviadas a la siguiente ronda. Lo ideal era que los expertos revisaran su respuesta previa y consideraran la nueva respuesta para dirigirse a un porcentaje más alto de acuerdo. Finalmente, el proceso se detuvo cuando se alcanzó un grado mínimo de consenso entre los expertos32-34.
Las recomendaciones clínicas fueron redactadas y propuestas por el GN con base en la evidencia científica identificada, evaluada, extraída y sintetizada (Tabla 5). La estructura de la información permitió que las contribuciones de los expertos fueran consensuadas y recogidas para desarrollar los textos que se expusieron a consideración del resto del GDG. El GN controló la interacción de los participantes al procesar la información y filtrar el contenido relevante. Esto permitió reducir de manera importante el efecto negativo de las discusiones cara a cara entre los expertos32-34.
Tabla 5 Tipos de recomendación
| Evidencia y consenso clínico | Recomendación |
|---|---|
| Las consecuencias indeseables claramente superan los beneficios | Recomendación fuerte en contra |
| Las consecuencias indeseables probablemente superen a los beneficios | Recomendación condicionada en contra |
| El balance entre consecuencias indeseables y beneficios clínicos está equilibrado o es incierto | Recomendación para realizar investigación y posiblemente recomendación condicionada para uso en estudios clínicos |
| Los beneficios clínicos probablemente superen a las consecuencias indeseables | Recomendación condicionada |
| Los beneficios clínicos claramente superan a las consecuencias indeseables | Recomendación fuerte |
| Redacción de las recomendaciones | |
| – Recomendación fuerte se puede hacer cuando hay confianza en que, para la mayoría de nuestros pacientes, la intervención o acción ofrece más beneficio que riesgo (o más riesgo que beneficio). La recomendación debe claramente dirigir y contener «debe/no debe» en su redacción. | |
| – Recomendaciones condicionadas pueden hacerse cuando la intervención o acción va a brindar más beneficio que riesgo en la mayoría de los pacientes. Las recomendaciones condicionadas pueden incluir «se puede considerar» en su redacción | |
Modificada de Scottish Intercollegiate Guidelines Network (SIGN)24.
Para determinar el grado de acuerdo entre los expertos se empleó una escala de Likert con valores del 1 al 9, significando el 1 que el experto está «totalmente en desacuerdo» con el planteamiento de la recomendación y el 9 que el experto está «totalmente de acuerdo» con la misma. Los números intermedios manifiestan que el experto no tiene una postura en el planteamiento o la redacción de la recomendación (Fig. 2).
El porcentaje de acuerdo mínimo deseable entre los expertos participantes en el panel Delphi se definió como el 70%. Además de evaluar el porcentaje de expertos que califican la recomendación, se calcularon las medidas de tendencia central y de dispersión: media, mediana, moda, desviación estándar y recorrido de los rangos intercuartílicos. Se estableció un mínimo de 7.0 en la media como criterio para alcanzar un grado mínimo de consenso. Se empleó un sistema electrónico para que los integrantes del GDG calificaran cada recomendación de manera anónima para obtener la estadística en tiempo real32-34 (Tabla 6).
Tabla 6 Estadística del panel Delphi modificado
| Pregunta clínica | Ronda 1 | Ronda 2 | ||
|---|---|---|---|---|
| Media | Acuerdo (%) | Media | Acuerdo (%) | |
| 1 | 8.4 | 92 | — | — |
| 2 | 7.9 | 83 | — | — |
| 3 | 8.3 | 92 | — | — |
| 4 | 8.1 | 83 | — | — |
| 5 | 7.6 | 75 | 7.5 | 83 |
| 6 | 7.9 | 75 | — | — |
| 7 | 7.9 | 83 | — | — |
| 8 | 8.4 | 92 | — | — |
| 9 | 8.0 | 92 | — | — |
| 10 | 7.2 | 83 | 7.9 | 92 |
| 11 | 7.9 | 83 | — | — |
| 12 | 7.5 | 83 | 8.1 | 92 |
| 13 | 8.5 | 100 | — | — |
| 14 | 8.4 | 100 | — | — |
| 15 | 7.3 | 75 | 8.2 | 92 |
| 16 | 7.9 | 92 | — | — |
| 17 | 8.3 | 100 | — | — |
| 18 | 8.7 | 100 | — | — |
| 19 | 8.2 | 92 | — | — |
| 20 | 8.0 | 92 | — | — |
Se calcularon la media, la desviación estándar y el recorrido de los rangos intercuartílicos, así como el porcentaje de acuerdo entre los miembros del Grupo de Desarrollo de la Guía (GDG). Aunque se estableció el 70% como un porcentaje adecuado de consenso, el GDG decidió pasar a nueva ronda todas las preguntas que quedaron por debajo del 75% de acuerdo, para aumentar el nivel de acuerdo entre los participantes.
Redacción de las recomendaciones
En diversas ocasiones los miembros del GN se reunieron para revisar el cúmulo de evidencia que respondía las preguntas clínicas estructuradas y, de acuerdo con el nivel de evidencia, poder determinar el grado de recomendación y la redacción de las recomendaciones.
Las recomendaciones clínicas deben ser una guía para los tomadores de decisiones. Por ello, el GDG fue cuidadoso en evitar cualquier ambigüedad al momento de la redacción. Se tomó en cuenta la evidencia científica, aunque el GDG consideró también su experiencia clínica en la redacción de las recomendaciones. Las recomendaciones consideraron también la relación riesgo/beneficio para establecer la toma de decisiones.
Programa de involucramiento de los pacientes
El Colegio de Otorrinolaringología y Cirugía de Cabeza y Cuello Pediátricas de México hizo extensiva la invitación a participar en el desarrollo de la GPC a una de las asociaciones de pacientes con mayor trayectoria en el manejo de padecimientos crónicos. Se solicitó que la asociación formara un grupo de representantes para validar y proponer modificaciones a las recomendaciones clínicas y el documento final. En conjunto con los expertos clínicos, los pacientes fueron parte de las mesas de discusión durante el desarrollo de la GPC35.
Cuerpo de la evidencia
Se realizaron las búsquedas en las bases de datos antes mencionadas para identificar otras GPC. Además, se llevaron a cabo diez estrategias de búsqueda exhaustiva de la literatura en PubMed y Embase (Anexo 3) para identificar revisiones sistemáticas con o sin metaanálisis de acuerdo con estrategias validadas internacionalmente (cuatro) y estudios clínicos (seis) (Fig. 3).
Recomendaciones clínicas
Diagnóstico
Pregunta clínica 1. ¿Cuál es la precisión diagnóstica del examen médico y de los estudios de laboratorio y gabinete en pacientes pediátricos mayores de 6 meses con OMA?
Recomendación. Se recomienda llevar a cabo el diagnóstico de OMA tomando en cuenta la presencia de signos y síntomas de infección aguda (otalgia, retracción del pabellón auricular por parte del niño, fiebre, otorrea), presencia de un proceso inflamatorio del oído medio (abombamiento de la membrana timpánica) y presencia de derrame (inmovilidad de la membrana timpánica a la otoscopia neumática o timpanometría). Para verificar la posición y la movilidad de la membrana timpánica es recomendable realizar otoscopia neumática o timpanometría. (Nivel de evidencia 2+, Grado de recomendación C, Recomendación fuerte).
Revisión de la literatura y análisis. La mayoría de los estudios clínicos coinciden en que, para hacer el diagnóstico de OMA, es requisito contar con datos clínicos que indiquen una infección aguda, como la inflamación de la membrana timpánica y la presencia de derrame en el oído medio36. Una revisión sistemática de la literatura37, cuyo objetivo fue evaluar la precisión diagnóstica de distintas herramientas clínicas, reportó seis estudios de prueba diagnóstica de suficiente calidad. La timpanocentesis se consideró como el estudio de referencia. Sin embargo, de toda la evidencia identificada, solo un estudio la utilizó como estándar de referencia para la comparación. Seis estudios cumplieron los criterios de calidad. La presencia de otalgia obtuvo una razón de verosimilitud (RV) de 3.0 a 7.0, aunque únicamente estuvo presente en el 50-70% de los pacientes. La retracción del pabellón auricular por parte del niño también se asocia con el diagnóstico de OMA con RV de 3.3 (intervalo de confianza del 95% [IC95%]: 2.1-5.1)37. Al emplear la otoscopia neumática, los signos parecen tener una mejor precisión diagnóstica que los síntomas. La opacidad de la membrana timpánica obtuvo RV de 34, el abombamiento mostró RV de 51 y su hipomovilidad una RV de 31. El color de la membrana timpánica presentó RV baja (8.4 en hiperemia franca y 1.4 en hiperemia discreta)37 (Fig. 4).

Figura 4 A: otoscopia normal en la que se aprecia la membrana timpánica con una coloración grisácea, una posición neutra y un adecuado reflejo del cono luminoso. B: otoscopia de un paciente con otitis media aguda en la que se aprecia la membrana timpánica abombada, muy hiperémica y con un proceso inflamatorio importante.
Además de la otoscopia neumática, la timpanometría es un método diagnóstico confiable cuando se compara con los signos y síntomas38 (Tabla 7).
Tabla 7 Recomendaciones clínicas con respecto al diagnóstico, la prevención y el tratamiento de la otitis media aguda
| Pregunta | Recomendación | Nivel de evidencia G de recomendación |
|---|---|---|
| 1 | Se recomienda llevar a cabo el diagnóstico de OMA con la presencia de signos y síntomas de infección aguda | Nivel de evidencia 2+ Grado de recomendación C Recomendación fuerte |
| 2 | Se recomienda administrar las vacunas neumocócicas conjugadas de acuerdo con la Cartilla Nacional de Vacunación | Nivel de evidencia 1++ Grado de recomendación A Recomendación fuerte |
| 3 | Se recomienda la administración de la vacuna de influenza de acuerdo con las recomendaciones de la Cartilla Nacional de Vacunación | Nivel de evidencia 1+ Grado de recomendación A Recomendación fuerte |
| 4 | Se recomienda no utilizar antibióticos como tratamiento profiláctico para la OMA recurrente en población pediátrica | Nivel de evidencia 1+ Grado de recomendación A Recomendación fuerte en contra |
| 5 | Se sugiere no utilizar preparaciones inmunoestimulantes para disminuir la frecuencia y la intensidad de los episodios de OMA recurrente. Sin embargo, existe un beneficio en la disminución de las infecciones de vías aéreas superiores en niños susceptibles. Se requieren estudios clínicos | Nivel de evidencia 1+ Grado de recomendación A Recomendación para realizar investigación, y posiblemente recomendación condicionada para uso en estudios clínicos |
| 6 | Se sugiere el uso de paracetamol o ibuprofeno en el manejo de la otalgia en la OMA como tratamiento de primera línea | Nivel de evidencia 1+ Grado de recomendación A Recomendación fuerte |
| 7 | La edad menor de 24 meses y cursar con OMA bilateral son indicadores pronósticos para un cuadro más prolongado, por lo que se recomienda el uso de antibiótico desde el inicio. Se recomienda que el tratamiento inicial se limite al uso de antibióticos betalactámicos, tipo amoxicilina o amoxicilina/clavulanato a dosis de 90 mg/kg al día con base en amoxicilina (dosis máxima 4 g al día) | Nivel de evidencia 1++ Grado de recomendación A Recomendación fuerte |
| 8 | En pacientes mayores de 24 meses con enfermedad leve y en los que se puede garantizar el seguimiento correcto en las 24-48 horas siguientes, se sugiere establecer un periodo de seguimiento sin antibiótico. En los pacientes que no cumplen con esas características se sugiere que el tratamiento inicial se limite al uso de antibióticos betalactámicos, tipo amoxicilina o amoxicilina/clavulanato a dosis de 90 mg/kg al día con base en amoxicilina | Nivel de evidencia 1++ Grado de recomendación A Recomendación fuerte |
OMA: otitis media aguda.
Se realizó una síntesis de las recomendaciones para cada pregunta clínica, con sus niveles de evidencia y grados de recomendación. Es importante revisar todo el texto para conocer la recomendación completa.
Intervenciones para la prevención
Pregunta clínica 2. ¿Cuáles son la eficacia y seguridad de la vacuna conjugada para el neumococo en comparación con placebo o con no vacunar para disminuir el riesgo de presentar OMA en niños mayores de 6 meses?
Recomendación. Se recomienda administrar las vacunas neumocócicas conjugadas, de acuerdo con la Cartilla Nacional de Vacunación, debido a su impacto positivo en la prevención de la enfermedad invasiva, aunque el impacto es menos marcado en la prevención de episodios de OMA en niños. (Nivel de evidencia 1++, Grado de recomendación A, Recomendación fuerte).
Revisión de la literatura y análisis. La primera vacuna neumocócica conjugada (VNC) que demostró una respuesta inmunogénica adecuada empezó a utilizarse en la década de 1990. Esta vacuna contiene serotipos capsulares neumocócicos unidos de forma covalente con proteínas transportadoras. Las VNC han tenido un papel relevante en la enfermedad debido a que las elaboradas a base de antígenos puros no demostraron una respuesta inmunogénica adecuada en los niños menores de 2 años. La primera VNC fue la heptavalente que cubría los serotipos 4, 6B, 9V, 14, 18C, 19F y 23F de S. pneumoniae. En una revisión sistemática Cochrane publicada en 200939, cuyo objetivo fue evaluar la eficacia y la seguridad de estas VNC para la prevención de la OMA en niños, los autores incluyeron siete estudios clínicos que emplearon VNC7 y VNC11 en distintos países. Los estudios mostraron gran heterogeneidad en cuanto a población, intervenciones y desenlaces evaluados39. La VNC7 mostró disminución del 6% (IC95%: −4 a 16) y del 7% (IC95%: 4-9) en dos estudios, mientras que la VNC11 mostró disminución del 34% (IC95%: 21-44) y la VNC9 una disminución del 17% (IC95%: −2 a 33) en los episodios de OMA en niños39. Una revisión sistemática publicada por Pavia et al.40 en 2009 incluyó siete estudios con 17,156 sujetos vacunados y 16,330 sujetos control. Los metaanálisis mostraron una eficacia del 57% (IC95%: 48-64) para prevenir los episodios de OMA ocasionados por los serotipos contenidos en la VNC y del 29% (IC95%: 20-38) para disminuir los episodios atribuidos a cualquier serotipo. Estas eficacias disminuyeron sensiblemente en los pacientes que no completaron el esquema de vacunación. La eficacia de la VNC para prevenir los episodios de OMA recurrente fue del 10% (IC95%: 4-15). Se observó que la necesidad de colocación de tubos de ventilación disminuyó el 20%40. Otra revisión sistematizada publicada en 2012 por Taylor et al.41 incluyó estudios aleatorizados y no aleatorizados, y reportó una eficacia del 0-9% en los estudios aleatorizados y una efectividad del 17-23% en los estudios no aleatorizados. La actualización de la Colaboración Cochrane con el mismo objetivo, publicada en 201442, incluyó nueve estudios clínicos aleatorizados y 48,426 pacientes. La calidad de la evidencia fue alta, de acuerdo con la evaluación metodológica de los autores. Sin embargo, los resultados de los metaanálisis muestran valores estimados del efecto global muy similares a los de las revisiones sistemáticas previas: una disminución del 6-7% con la VNC7 y del 34% con la VNC11.
Otra revisión sistemática posterior, realizada por Ewald et al.43, incluyó 21 estudios clínicos aleatorizados, aunque solo en 12 de ellos había niños menores de 2 años. La VNC7 fue evaluada en 11 estudios, la VNC9 y la VNC10 en tres, y la VNC11 en dos. Las VNC disminuyeron la incidencia de OMA de cualquier etiología (RR: 0.93; IC95%: 0.86-1.00) y de OMA neumocócica (RR: 0.57; IC95%: 0.39–0.83). Aunque el impacto en la incidencia de OMA en los niños con las VNC sigue siendo modesto, la repercusión fue mayor en la incidencia de neumonía neumocócica (RR: 0.78; IC95%: 0.62-0.97)43.
Pregunta clínica 3. ¿Cuáles son la eficacia y seguridad de la vacuna de la influenza en comparación con placebo o con no vacunar para disminuir el riesgo de presentar OMA en los niños mayores de 6 meses?
Recomendación. Se recomienda la administración de la vacuna de la influenza por su impacto positivo en la disminución de la enfermedad de vías respiratorias bajas, de acuerdo con las recomendaciones de la Cartilla Nacional de Vacunación. Sin embargo, es muy discreta la repercusión en la disminución de la incidencia de OMA en los niños. La vacuna de la influenza posee un adecuado perfil de seguridad y solo se han reportado eventos adversos leves. (Nivel de evidencia 1+, Grado de recomendación A, Recomendación fuerte).
Revisión de la literatura y análisis. Una revisión sistemática Cochrane44 publicada en 2017, cuyo objetivo fue evaluar la eficacia y seguridad de la vacuna contra la influenza en la disminución de los episodios de OMA en niños, incluyó 11 estudios clínicos que evaluaron a 17,123 niños. El metaanálisis demostró una disminución discreta en la incidencia de, al menos, un episodio de OMA con seguimiento mayor de 6 meses (RR: 0.84; IC95%: 0.69-1.02). No obstante, también se observó disminución en el uso de antibióticos en los niños vacunados (RR: 0.70; IC95%: 0.59-0.83). Respecto a la seguridad, se reportó mayor incidencia de fiebre (RR: 1.15; IC95%: 1.06-1.24) y de rinorrea (RR: 1.17; IC95%: 1.07-1.29), aunque no en la presencia de faringitis. No se reportaron eventos adversos graves. La calidad de la evidencia fue de baja a moderada44.
Pregunta clínica 4. ¿Cuáles son la eficacia y seguridad de los distintos agentes antibióticos en comparación con placebo para disminuir la frecuencia de los episodios de OMA en los niños mayores de 6 meses?
Recomendación. Se recomienda no utilizar antibióticos como tratamiento profiláctico para la OMA recurrente en población pediátrica. La evidencia científica no ha logrado demostrar un beneficio consistente a largo plazo y el tratamiento antibiótico conlleva el riesgo de contribuir a la emergencia de resistencia bacteriana y la aparición de eventos adversos. (Nivel de evidencia 1+, Grado de recomendación A, Recomendación fuerte en contra).
Revisión de la literatura y análisis. Una revisión sistemática con metaanálisis publicada en 1993 por Williams et al.45, con el objetivo de determinar la eficacia y seguridad de los antibióticos como profilácticos de la OMA, incluyó nueve estudios clínicos para evaluar el uso de antibióticos en la prevención de los episodios de OMA recurrente en niños. De los nueve estudios incluidos (958 pacientes), siete obtuvieron IC95% que cruzaron el valor de ausencia de efecto. El metaanálisis reportó 0.11 episodios por paciente al mes en el grupo con medicamentos (IC95%: 0.03-0.19) en comparación con el grupo control, que reportó 0.19 episodios por paciente al mes (IC95%: 0.13-0.26). No se halló diferencia significativa en el tiempo de tratamiento ni en el número de episodios previos. El número necesario para tratar (NNT) fue de nueve, lo que significa que se necesitaría tratar a nueve pacientes para ver el beneficio en uno. La calidad de los estudios, en general, fue pobre, y los resultados mostraron un beneficio discreto de los antibióticos como profilácticos en la OMA45. Han sido muy limitados los estudios clínicos controlados publicados a partir de esta revisión sistemática. Un estudio clínico aleatorizado, doble ciego y controlado con placebo, publicado por Roark y Berman46 en 1997, incluyó 194 pacientes de 3 meses a 6 años de edad con al menos tres episodios de OMA en los 6 meses previos, de los cuales 158 completaron el estudio. Los pacientes fueron divididos en tres grupos: uno recibió amoxicilina-clavulanato cada 12 horas, otro amoxicilina-clavulanato cada 24 horas y el otro recibió placebo. Al final del tratamiento no hubo diferencias significativas en la incidencia de episodios de OMA en ninguno de los tres grupos de tratamiento. Tampoco se encontraron diferencias después de estratificar por edad o temporada del año46. Otro estudio clínico aleatorizado publicado por Teele et al.47 en el año 2001 incluyó pacientes que habían presentado al menos un episodio de OMA antes de los 6 meses o dos episodios antes del año de vida. Los pacientes recibieron amoxicilina, sulfisoxazol o placebo. Este estudio incluyó 117 pacientes que fueron seguidos al menos por 1 año después de iniciar el estudio. Se encontró diferencia significativa en la probabilidad de mantenerse libre de episodios de OMA entre amoxicilina y placebo (70% vs. 32%; p < 0.01), así como una menor probabilidad de experimentar al menos dos o más episodios de OMA (10% vs. 29%; p < 0.01). Sin embargo, no hubo diferencias significativas entre los grupos de sulfisoxazol y placebo. Las proporciones de pacientes que experimentaron dos o más episodios al final del estudio fueron similares (amoxicilina 33%, sulfisoxazol 28%, placebo 34%). Otro estudio clínico controlado publicado por Foglé-Hansson et al.48 incluyó niños que habían presentado al menos un episodio de OMA antes de los 6 meses de edad. Los pacientes recibieron placebo o penicilina V. Se incluyeron 90 pacientes, pero solo 70 siguieron el protocolo. Al final del estudio no se reportaron diferencias estadísticamente significativas en el número de episodios de OMA.
Pregunta clínica 5. ¿Cuáles son la eficacia y seguridad de los distintos inmunoestimulantes en comparación con placebo para disminuir el riesgo de presentar OMA en los niños mayores de 6 meses?
Recomendación. Se sugiere no utilizar preparaciones inmunoestimulantes para disminuir la frecuencia e intensidad de los episodios de OMA recurrente en población pediátrica debido a la muy limitada evidencia sobre su eficacia y seguridad. Sin embargo, existe un beneficio en la disminución de infecciones de vías aéreas superiores en niños susceptibles. (Nivel de evidencia 1+, Grado de recomendación A, Recomendación para realizar investigación y posiblemente recomendación condicionada para uso en estudios clínicos).
Revisión de la literatura y análisis. Del Río-Navarro et al.49 publicaron en 2006 una revisión sistemática a través de la Colaboración Cochrane con el objetivo de evaluar el impacto de diversas preparaciones de inmunoestimulantes en la disminución de la frecuencia de episodios de infección de vías aéreas superiores en niños, incluida la OMA recurrente. Fueron pocos los estudios clínicos controlados que se consideraron en esta revisión sistemática y que incluyeron esa variable de desenlace. Uno de los estudios incluidos fue el de Fukuda et al.50 doble ciego y controlado con placebo, con una muestra muy pequeña (18 pacientes en el grupo de timomodulina y 17 pacientes en el grupo con placebo). Al final del estudio, el 55% de los pacientes con timomodulina permanecieron libres de infección, en comparación con el 20% del grupo placebo. Un aspecto importante es que no se definió el método de aleatorización, por lo que existe mayor riesgo de sesgo. Otro estudio incluido en esta revisión fue publicado por Mora et al.51 quienes estudiaron niños de 4 a 14 años con historia de OMA recurrente que fueron asignados para recibir extracto ribosomal (D53) o placebo durante 3 semanas. Se incluyeron 81 pacientes, y al final de los 6 meses del estudio se reportó una diferencia significativa (p < 0.001) con respecto a la frecuencia y la duración de los episodios, la incidencia de fiebre e incluso las variables de función auditiva. Sin embargo, no se estableció si el estudio fue aleatorizado ni el método del mismo, por lo que también existe alto riesgo de sesgo. Otro estudio publicado más tarde (2004) por el mismo autor52 incluyó 72 pacientes con OMA recurrente. En este segundo trabajo se evaluó la administración de extracto ribosomal (D53) y se reportaron resultados similares. A la fecha, no existen estudios clínicos controlados de otros grupos que hayan reproducido estos resultados. En esta revisiones sistemáticas se concluyó que hacen falta estudios clínicos controlados con un mayor número de pacientes pediátricos susceptibles de presentar episodios de OMA recurrente49.
Tratamiento
Pregunta clínica 6. ¿Cuáles son la eficacia y la seguridad de los analgésicos no esteroideos en comparación con placebo o con otros agentes activos para el manejo del dolor en los pacientes pediátricos mayores de 6 meses con OMA unilateral o bilateral?
Recomendación. Se recomienda el uso de paracetamol o ibuprofeno en el manejo de la otalgia en la OMA en niños como tratamiento de primera línea. El balance riesgo-beneficio otorga mayor valor al beneficio clínico del alivio del dolor en relación con la baja incidencia de eventos adversos. (Nivel de evidencia 1+, Grado de recomendación A, Recomendación fuerte).
Revisión de la literatura y análisis. A través de la Colaboración Cochrane, Sjoukes et al.53 publicaron una revisión sistemática con el objetivo de evaluar la eficacia y seguridad de los AINE y del paracetamol, solos o combinados, en el manejo de la otalgia ocasionada por la OMA en niños. Esta revisión sistemática incluyó tres estudios clínicos controlados que evaluaron 327 pacientes, a los cuales se les estableció un riesgo de sesgo de bajo a moderado. Los resultados de esta revisión sistemática fueron que el paracetamol y el ibuprofeno como monoterapia son más efectivos que el placebo en la mejoría del dolor a las 48 horas: paracetamol en comparación con placebo (RR: 0.38; IC95%: 0.17-0.85) con un NNT de 7, e ibuprofeno en comparación con placebo (RR: 0.28; IC95%: 0.11-0.70) con un NNT de 6. No hubo diferencias significativas en cuanto a la incidencia de eventos adversos entre el paracetamol, el ibuprofeno y el placebo. Sin embargo, la evidencia fue muy limitada para demostrar la eficacia a las 24 horas, a las 48-72 horas y a la semana de iniciado el padecimiento53 (Tabla 7).
Pregunta clínica 7. ¿Cuáles son la eficacia y seguridad de las distintas clases de antibióticos en comparación con placebo o con otros agentes activos para el tratamiento de los pacientes de 6 a 24 meses de edad con OMA unilateral o bilateral?
Recomendación. La edad menor de 24 meses y el cursar con OMA bilateral son indicadores que pronostican un cuadro más prolongado, por lo que se recomienda el uso de antibiótico en estos pacientes desde un inicio. La evidencia demuestra que los antibióticos ofrecen mayor beneficio a los pacientes menores de 24 meses con OMA bilateral u otorrea. (Nivel de evidencia 1++, Grado de recomendación A, Recomendación fuerte).
Se recomienda que la elección de antibióticos para el tratamiento inicial se limite al uso de betalactámicos, tipo amoxicilina o amoxicilina-clavulanato, a dosis de 90 mg/kg al día con base en amoxicilina (dosis máxima 4 g/día formulación 14:1). Sin embargo, presentan un riesgo aumentado de eventos adversos como vómito, diarrea y eccema cutáneo. (Nivel de evidencia 1++, Grado de recomendación A, Recomendación fuerte).
En los casos de reacción alérgica a los betalactámicos de tipo I (reacción anafiláctica o urticaria que se presentan de manera inmediata) se pueden considerar macrólidos o clindamicina. En los casos de reacción alérgica no tipo I se puede considerar también el uso de cefalosporinas de segunda y tercera generación, ya que presentan menor reacción cruzada con la penicilina. Se pueden considerar otros antibióticos como alternativa de tratamiento inicial, como cefdinir, cefuroxima, cefpodoxima, ceftibuteno o ceftriaxona intramuscular. (Nivel de evidencia 1++, Grado de recomendación A, Recomendación fuerte).
Pregunta clínica 8. ¿Cuáles son la eficacia y la seguridad de las distintas clases de antibióticos en comparación con placebo o con otros agentes activos para el tratamiento de niños mayores de 24 meses con OMA unilateral o bilateral?
Recomendación. Los antibióticos, en general, no tienen efecto sobre el dolor durante las primeras 24 horas de iniciado el padecimiento y ofrecen un beneficio modesto en los días siguientes. También ofrecen un efecto modesto en la prevención de la perforación timpánica, en la disminución de episodios contralaterales y en los cambios de los hallazgos timpanométricos. La OMA es un padecimiento autolimitado en la mayoría de los casos, como se ha demostrado tanto en los países desarrollados como en aquellos en vías de desarrollo. (Nivel de evidencia 1++, Grado de recomendación A, Recomendación fuerte).
Por lo tanto, en los pacientes mayores de 24 meses con enfermedad leve y en los que se puede garantizar el seguimiento correcto en las 24-48 horas siguientes, se sugiere establecer un periodo de seguimiento sin antibiótico. (Nivel de evidencia 1−, Grado de recomendación A, Recomendación fuerte).
Sin embargo, en los pacientes que no cumplen con esas características se sugiere que el tratamiento inicial se limite al uso de antibióticos betalactámicos, tipo amoxicilina o amoxicilina-clavulanato, a dosis de 90 mg/kg al día con base en amoxicilina formulación 14:1. Para tal efecto, se deberá considerar el riesgo de presentar eventos adversos como vómito, diarrea y eccema cutáneo.
En casos de reacción alérgica tipo I a los betalactámicos (reacción anafiláctica o urticaria que se presentan de manera inmediata), se pueden considerar macrólidos o clindamicina. En casos de reacción alérgica no tipo I se pueden considerar también cefalosporinas de segunda y tercera generación, ya que presentan menor reacción cruzada con la penicilina. Se pueden considerar otros antibióticos como alternativa de tratamiento inicial, como cefdinir, cefuroxima, cefpodoxima, ceftibuteno o ceftriaxona intramuscular. (Nivel de evidencia 1++, Grado de recomendación A, Recomendación fuerte).
Revisión de la literatura y análisis. El papel que desempeñan los virus y las bacterias en la fisiopatología de la OMA en los niños ha sido bien establecido desde hace décadas. Sin embargo, los avances en el diagnóstico y las técnicas de detección, desde los cultivos microbiológicos hasta las técnicas moleculares y las técnicas más modernas de secuenciación (NGS, next-generation sequencing), han permitido recrear el microbioma de los sujetos sanos, pero también el de los pacientes con OMA, OMA recurrente y otras formas crónicas de la enfermedad53,54. La asociación de cuadros de OMA con infecciones virales de vías respiratorias altas, sobre todo en niños de 6 meses a 3 años de edad, se ha reportado hasta en el 90% y con un rango del 50-90%. Los virus se han detectado en el 14-25% de los casos de derrame del oído medio. La frecuencia de cada agente viral varía según la zona geográfica y la edad de los pacientes. No obstante, el virus sincicial respiratorio (58%) y el rinovirus (50%) son los más frecuentes.
Por el contrario, otros tipos de virus, como coronavirus, adenovirus, bocavirus, influenza, parainfluenza, enterovirus y metapneumovirus humano, son menos comunes4,10,55.
Se ha observado que el riesgo de que una infección viral de vías respiratorias altas progrese a OMA —ya que al inflamarse la mucosa respiratoria de la trompa de Eustaquio se modifican las propiedades reológicas del moco, afectando la función del aparato mucociliar— depende de la colonización bacteriana de la nasofaringe. Si en el microbioma se encuentran los tres patógenos bacterianos que habitualmente son los agentes etiológicos de la OMA bacteriana (S. pneumoniae, HiNT y M. catarrhalis), la posibilidad de que ocurra la enfermedad es de hasta el 50%. En cambio, si no se encuentra ninguna de estas tres bacterias, la posibilidad de desarrollar una OMA es de tan solo el 10%56. Cada vez más información indica que el perfil del microbioma en los primeros meses de vida es muy importante para una mayor propensión a presentar cuadros de OMA. Los perfiles de microbioma asociados con una mayor incidencia de infecciones son aquellos en los que predominan Streptococcus spp. y Haemophilus spp. Por el contrario, una mayor proliferación de especies de Moraxella y de Corynebacterium/Dolosigranulum se asocia con perfiles más estables. Los estudios de secuenciación del ADN en pacientes con OMA han reportado en algunas series que la colonización por Moraxellaceae, Streptococcaceae y Pasteurellaceae se asocia con una mayor frecuencia de episodios de OMA. Otros estudios realizados para analizar el derrame del oído medio en niños con OMA posterior a la introducción de la vacuna contra el neumococo 13-valente han confirmado la presencia de HiNT en el 50-60% de los casos, de S. pneumoniae en el 15-25% y de M. catarrhalis en el 12-15%. En la era posvacunal, los serotipos 11A, 15A, 15B, 15C, 21, 23A y 23B son los más comunes54.
Se ha reportado la emergencia de nuevos patógenos, como Turicella otitidis (5%) en la otitis media crónica y Alloiococcus otitidis (3%) en la otitis externa, aunque todavía no se han esclarecido en su totalidad los mecanismos etiopatogénicos para estos microorganismos en la OMA54.
Los mecanismos fisiopatogénicos de las bacterias causantes de OMA se pueden resumir en la interacción de la bacteria con el epitelio respiratorio y su aparato mucociliar. Si bien son una barrera efectiva, los microorganismos poseen la capacidad de producir enzimas que la atraviesan. La adherencia al epitelio respiratorio es otro momento crucial para la infección bacteriana. Los pili son estructuras fundamentales, y se cree que se adhieren a moléculas como I-CAM y V-CAM expresadas en la superficie epitelial. Una vez atravesada la barrera epitelial, las bacterias interactúan con diversas moléculas, muchas de ellas proinflamatorias (factor de necrosis tumoral alfa, interleucina 8, interferón gamma, entre otras), y células de la respuesta inmunitaria innata. No obstante, las bacterias han desarrollado otros mecanismos, como proteasas, hemaglutininas, proteínas C y lipoproteínas, entre otras. La elaboración de una matriz extensa de exopolisacáridos y exopolímeros, conocida como biopelícula, resulta en la protección de las bacterias que ahí habitan y concede cierta resistencia contra los antibióticos betalactámicos y macrólidos. Estas biopelículas se han observado principalmente en la otitis media con derrame y la otitis media crónica55.
Hace más de dos décadas se reportaban porcentajes de resistencia de S. pneumoniae en muy distintos rangos, desde el 1% en Holanda hasta el 80% en Corea, pasando por porcentajes intermedios del 10-40% en los Estados Unidos. La enzima betalactamasa es producida por el 20-50% de H. influenzae y por el 90% de las cepas de M. catarrhalis. Sin embargo, considerando una muy alta proporción de resolución espontánea, estos porcentajes de resistencia bacteriana no se han traducido como un impacto negativo en los desenlaces clínicos en general57,58. Mather et al.59 se plantearon el objetivo de evaluar los patrones de resistencia de los patógenos bacterianos de la OMA en niños en una revisión sistemática publicada en 2019. Incluyeron 48 estudios clínicos (15,871 muestras), en los cuales se aislaron e identificaron bacterias en el 0.67% de las muestras. Las bacterias más comúnmente aisladas fueron S. pneumoniae en el 30% (IC95%: 0.27-0.32), H. influenzae en el 23% (IC95%: 0.27-0.32) y M. catarrhalis en el 5% (IC95%: 0.04-0.06). Cabe mencionar que la gran mayoría de los estudios emplearon el cultivo tradicional; solo un estudio empleó técnicas de reacción en cadena de la polimerasa para detectar e identificar los patógenos bacterianos. Los patrones de susceptibilidad reportados en el metaanálisis con la combinación de todos los estudios incluidos mostraron que S. pneumoniae presenta el 86% (IC95%: 0.69-0.95) de susceptibilidad para amoxicilina, el 60% (IC95%: 0.51-0.68) para penicilina, el 93% (IC95%: 0.81-0.98) para amoxicilina-clavulanato y el 64% (IC95%: 0.48-0.78) para eritromicina. En H. influenzae se obtuvo el 82% (IC95%: 0.67-0.92) de susceptibilidad para amoxicilina, el 43% (IC95%: 0.05-0.92) para penicilina, el 98% (IC95%: 0.88-1.00) para amoxicilina-clavulanato y el 53% (IC95%: 0.30-0.74) para eritromicina, y el 71% (IC95%: 0.61-0.79) en cepas no productoras de betalactamasas. En el caso de M. catarrhalis se obtuvo el 12% (IC95%: 0.01-0.65) de susceptibilidad para amoxicilina, el 13% (IC95%: 0.01-0.63) para penicilina, el 98% (IC95%: 0.91-1.00) para amoxicilina-clavulanato y el 53% (IC95%: 0.30-0.74) para eritromicina, y el 0.07% (IC95%: 0.03-0.17) en cepas no productoras de betalactamasas59. Los resultados de esta revisión sistemática confirman lo publicado anteriormente respecto a la muy alta tasa de resistencia de H. influenzae y M. catarrhalis productoras de betalactamasas frente a los antibióticos de primera línea.
En 2018, el Grupo Interinstitucional para la Vigilancia de Enfermedades Bacterianas Prevenibles por Vacunación (GIVEBPVac), que forma parte de la red de vigilancia Latinoamericana llamada SIREVA (Sistema de Redes de Vigilancia de los Agentes Responsables de Neumonías y Meningitis Bacterianas), publicó un reporte de las características bacteriológicas de aislamientos provenientes de diversos hospitales de México60. En este reporte se observó una discreta disminución en la resistencia antimicrobiana a los betalactámicos de los aislamientos que no provenían de casos de meningitis, lo que implica la posibilidad de emplearlos para el tratamiento de las infecciones causadas por neumococos sin necesidad de emplear otros de mayor espectro. Esto hace muy importante el uso racional de antibióticos en los casos en que se sospeche un agente viral, lo que disminuiría la transformación genética de los neumococos en cepas resistentes de difícil tratamiento en el microbioma nasofaríngeo. Un estudio multicéntrico realizado en México y publicado por Macías-Parra et al.61 reportó que en el 64% de las muestras tomadas mediante timpanocentesis se obtuvo crecimiento y aislamiento bacteriano. Se identificaron S. pneumoniae (29%) y H. influenzae (35%) como los principales patógenos. El 50% de los casos ocurrieron en niños que recibieron la VNC de siete serotipos; en general, se identificaron los serotipos 19A, 19F y 23F, mientras que las cepas de H. influenzae no fueron tipificables. S. pneumoniae mostró tasas de resistencia del 3% para amoxicilina-clavulanato, del 57% para cefuroxima, del 26% para cefotaxima, del 51% para eritromicina, del 97% para azitromicina, del 63% para tetraciclina, del 0% para levofloxacino y del 89% para TMP/SMZ, mientras que H. influenzae mostró porcentajes de resistencia del 0% para amoxicilina-clavulanato, del 5% para cefuroxima, del 25% para ampicilina, del 0% para cefotaxima, del 15% para azitromicina, del 5% para tetraciclina, del 0% para levofloxacino y del 51% para TMP/SMZ61. Otro estudio realizado en México62 reportó una resistencia general de S. pneumoniae del 65% para penicilina, del 19% para cefotaxima, del 23% para azitromicina y eritromicina, del 61% para TMP/SMZ, del 5% para amoxicilina y del 12% para clindamicina. Tanto amoxicilina-clavulanato como ceftriaxona, imipenem, meropenem, teicoplanina, telitromicina y vancomicina mostraron susceptibilidad del 100%62. Otro estudio, cuyo objetivo fue evaluar la susceptibilidad de S. pneumoniae en pacientes con OMA, encontró resistencia general del 52% a la penicilina, del 0.3% a amoxicilina-clavulanato, del 34% a cefaclor, 10% a cefuroxima, 1.3% a ceftriaxona, 1% a levofloxacino, del 38% a TMP/SMZ y del 31% a tetraciclina; además, la resistencia a la penicilina se asoció con organismos multirresistentes63. Otro estudio realizado en México64 (2008), pero en cepas invasivas de S. pneumoniae, se planteó el objetivo de medir la resistencia a distintos antibióticos. Las cepas meníngeas (serotipos 19F, 3, 6B, 14 y 23F) mostraron resistencia a la penicilina (16%), eritromicina (23%) y sulfametoxazol (58%), mientras que las cepas no meníngeas (serotipos 19F y 3) no mostraron resistencia a la penicilina (0%), pero sí a la eritromicina (18%) y al sulfametoxazol (82%). Otro estudio publicado en México por Gómez et al.65 encontró que los serotipos más frecuentes fueron 6B y 19F (16.67%), seguidos de 6A, 14 y 23F (15.27%), en los niños con OMA, lo que coincide con los estudios previos también publicados en México66,67.
Rovers et al.68 realizaron una revisión sistemática, en 2007, con el objetivo de determinar los factores asociados con una resolución más prolongada de la OMA en niños de 6 meses a 12 años de edad. Incluyeron estudios clínicos controlados que hubieran aleatorizado a los pacientes para recibir antibiótico, placebo o un periodo de observación sin antibiótico. Para el análisis, solo consideraron pacientes que no recibieron antibióticos. El desenlace evaluado fue la evolución prolongada de la OMA, definida por la presencia de fiebre u otalgia a los 3-7 días de iniciar el cuadro. Los autores identificaron 19 estudios clínicos controlados, de los cuales excluyeron nueve. Se incluyeron en total seis estudios que evaluaron 824 pacientes. Los resultados del análisis multivariado mostraron que la edad menor de 2 años (OR: 2.1; IC95%: 1.5-2.9) y la OMA bilateral (OR: 1.7; IC95%: 1.2-2.4) fueron factores predictivos independientes para dolor o fiebre a los 3-7 días de iniciado el padecimiento. De igual forma, las variables asociadas con el dolor a los 3-7 días fueron la edad menor de 2 años (OR: 2.0; IC95%: 1.4-2.9) y OMA bilateral (OR: 1.8; IC95%: 1.3-2.6), y las variables asociadas con la fiebre en los días 3-7 fueron edad menor de 2 años (OR: 1.6; IC95%: 1.0–2.6) y la presencia de fiebre al inicio de la enfermedad (OR: 3.0; IC95%: 1.8–4.9). Así mismo, se realizaron diversos análisis de sensibilidad para encontrar posibles variables confusoras o modificadoras del efecto, pero no se encontraron cambios en los resultados.
Una revisión sistemática publicada por Vouloumanou et al.69 en 2009 evaluó la eficacia y seguridad de los antibióticos para el tratamiento de la OMA en pacientes de 6 meses a 12 años de edad. Los autores incluyeron 11 estudios clínicos controlados: en siete de ellos se compararon antibióticos frente al placebo y en los cuatro restantes se compararon antibióticos frente a la conducta de observación sin antibiótico. Los antibióticos empleados fueron amoxicilina (en cuatro), amoxicilina-clavulanato (en uno) y penicilina V (en uno); en el otro se utilizaron de forma combinada amoxicilina y penicilina con sulfisoxazol. La duración del tratamiento fue de 7 días (en cuatro) o de 10 días (en cinco). Los resultados de los metaanálisis que incluyeron estudios controlados con placebo mostraron que el éxito terapéutico se asoció con el uso de antibióticos (en siete estudios clínicos y 1405 pacientes; RR: 1.11; IC95%: 1.05-1.18), como también los ensayos en los que se compararon frente a la conducta expectante (cuatro estudios clínicos, 915 pacientes; RR: 1.18; IC95%: 1.07-1.32) y los estudios combinados (11 estudios clínicos, 2320 pacientes; RR: 1.13; IC95%: 1.08-1.19). Asimismo, la persistencia de síntomas a los 2-4 días fue menos probable con el uso de antibióticos (cinco estudios, 1299 pacientes; RR: 0.68; IC95%: 0.54-0.85). Sin embargo, los eventos adversos fueron más frecuentes con el uso de antibióticos (siete estudios clínicos, 1807 pacientes; RR: 1.50; IC95%: 1.16-1.95)
A través de la Colaboración Cochrane, Kozyrskyj et al.70 publicaron en 2010 una revisión sistemática con el objetivo de evaluar la efectividad de esquemas cortos de antibióticos (menos de 7 días) en comparación con cursos largos (7 días o más) para el tratamiento de la OMA en niños. El desenlace primario fue la falla del tratamiento, definida como falta de resolución clínica, recaída o recurrencia al mes de haber iniciado el tratamiento. Los autores incluyeron 49 estudios clínicos aleatorizados. Los antibióticos evaluados fueron amoxicilina-clavulanato (en 32 estudios), azitromicina (en 21), cefaclor (en ocho), cefdinir (en dos), cefixima (en dos), cefpodoxima (en cuatro), cefprozilo (en dos), cefuroxima (en tres), ceftriaxona (en nueve), claritromicina (en uno), penicilina (en tres) y TMP/SMZ (en uno). Los resultados indicaron que la administración de antibiótico durante 5 días puede incrementar el riesgo de presentar síntomas y signos, recaída o recurrencia en los días 8-19 (OR: 1.37; IC95%: 1.15-1.64). Cuando en el análisis se incluyeron únicamente los estudios con bajo riesgo de sesgo, la asociación fue más fuerte en la falla de tratamiento (OR: 2.03; IC95%:1.48-2.77). Cuando se compararon los mismos antibióticos, los resultados favorecieron los esquemas largos (OR: 1.65; IC95%: 1.35-2.01). Cuando se evaluaron las recurrencias y las recaídas al mes de tratamiento, no se observaron diferencias estadísticamente significativas. Por otra parte, se llevó a cabo un análisis de subgrupos de acuerdo con la edad (menores de 2 años). Se incluyeron seis estudios clínicos con 614 pacientes, pero no se pudo apreciar una diferencia significativa en el desenlace con ambos esquemas70,71.
En otra revisión sistemática publicada por Spurling et al.71 (2013) a través de la Colaboración Cochrane se incluyeron tres estudios clínicos controlados que evaluaron pacientes con OMA para comparar el uso de antibióticos inmediato frente al uso retardado. No se encontraron diferencias significativas entre ambas estrategias de tratamiento en los distintos desenlaces evaluados. La misma revisión sistemática fue actualizada por Spurling et al.72 en 2017, pero no reportaron nuevos estudios publicados, por lo que se llegó a las mismas conclusiones.
Una revisión sistemática publicada por Venekamp et al.73 (2013) a través de la Colaboración Cochrane evaluó la eficacia y seguridad de los antibióticos en niños con OMA. Se incluyeron 12 estudios clínicos controlados que evaluaron 3,317 pacientes para comparar el tratamiento con antibiótico frente al placebo y con antibiótico inmediato frente a la observación (incluyendo la estrategia de antibiótico retardado) en niños con OMA. Los resultados de los metaanálisis mostraron que el dolor no mejoró después de 24 horas de tratamiento (RR: 0.89; IC95%: 0.78-1.01). Sin embargo, a los 2-3 días sí se observó diferencia a favor del antibiótico (RR: 0.70; IC95%: 0.57-0.86) con NNT de 20. Un efecto similar se reportó a los 4-7 días (RR: 0.79; IC95%: 0.66-0.95) con NNT de 20. El manejo con antibiótico mostró mejoría estadísticamente significativa en lo referente a las perforaciones de la membrana timpánica (RR: 0.37; IC95%: 0.18-0.76), con un NNT de 33, y a los episodios contralaterales (RR: 0.49; IC95%: 0.25-0.95), con NNT de 11. Por su parte, los eventos adversos se presentaron con mayor frecuencia en los pacientes que recibieron antibiótico (RR: 1.34; IC95%: 1.16-1.55), con un número necesario para hacer daño (NNH) de 14. Respecto a las estrategias de tratamiento (antibiótico inmediato o tratamiento retardado), se incluyeron cinco estudios clínicos controlados (1149 pacientes). Los metaanálisis pudieron incluir 959 pacientes y no se observaron diferencias significativas (RR: 0.75; IC95%: 0.50-1.12) ni complicaciones serias en ninguno de los dos grupos. Sin embargo, el uso inmediato de antibióticos sí se relacionó con la presentación de diarrea, vómito o eccema cutáneo (RR: 1.71; IC95%: 1.24-2.36). Posteriormente, en 2015, los mismos autores74 publicaron una actualización que incluyó un estudio clínico controlado adicional a la revisión sistemática previa (13 estudios) y un total de 3401 pacientes. Los resultados indicaron que el 60% de los pacientes mejoraron a las 24 horas, sin importar si recibieron antibiótico o placebo. Los antibióticos no disminuyeron el dolor a las 24 horas (RR: 0.89; IC95%: 0.78-1.01), pero al menos el 30% presentaron disminución del dolor residual a los 2-3 días (RR: 0.70; IC95%: 0.57-0.86), con NNT de 20. El 25% de los enfermos refirieron menos dolor a los 4-7 días (RR: 0.76; IC95%: 0.63-0.91), con NNT de 16. El resto de los desenlaces fueron muy similares a los reportados en la revisión sistemática de 2013. Se incluyeron cinco estudios clínicos que evaluaron el periodo de observación expectante (1149 niños), y el resultado de los metaanálisis no difirió de la revisión sistemáticas de 2013. Es importante destacar que estos estudios clínicos fueron llevados a cabo en países industrializados, por lo que no es claro el efecto de un estado socioeconómico bajo en los desenlaces clínicos74.
Los resultados de un metaanálisis de datos de seis estudios clínicos controlados (1643 pacientes) mostró que los antibióticos son de mayor beneficio en niños menores de 2 años con OMA bilateral (NNT: 4) y en niños con OMA y otorrea concomitante (NNT: 3)74. Un estudio clínico controlado publicado por Tähtinen et al.75 incluyó niños de 6 a 35 meses y encontró que los pacientes que más se beneficiaron con el uso de antibióticos fueron los que presentaron un abombamiento franco de la membrana timpánica (NNT: 2).
Pregunta clínica 7b y 8b. ¿Cuáles son la eficacia y la seguridad de las distintas clases de antibióticos para el tratamiento de la OMA refractaria o con falla de tratamiento?
Recomendación. Se define como falla de tratamiento cuando no hay mejoría de los síntomas de la OMA en las primeras 48 a 72 horas de haber iniciado el tratamiento antibiótico.
En caso de que el manejo inicial haya sido con amoxicilina, se sugiere el manejo con amoxicilina-clavulanato o sulbactam a dosis de 90 mg/kg al día con base en amoxicilina (Formulación 14:1). Si el paciente recibió inicialmente amoxicilina-clavulanato o sulbactam o alguna cefalosporina, se sugiere el uso de ceftriaxona intramuscular (50 mg/kg al día) por 3 días. Si se presenta falla del tratamiento después de un segundo antibiótico, será muy importante revalorar al paciente y realizar timpanocentesis y un cultivo con antibiograma. Una opción puede ser una fluoroquinolona (levofloxacino) cuando existe falla de múltiples tratamientos o se sospecha el involucro de bacterias multirresistentes. Los estudios de seguridad de moxifloxacino en niños son muy escasos, por lo que no se sugiere su uso en esta población. (Nivel de evidencia 1−, Grado de recomendación B, Recomendación condicionada).
Revisión de la literatura y análisis. La GPC de la American Academy of Pediatrics2 define la falla de tratamiento cuando no hay mejoría de los síntomas de la OMA en las primeras 48 a 72 horas de haber iniciado el tratamiento antibiótico. La GPC recomienda, para los pacientes que recibieron amoxicilina, el uso de amoxicilina-clavulanato a dosis altas (90 mg/kg al día). Son abundantes los estudios bacteriológicos que reportan un incremento de la resistencia bacteriana a los distintos antibióticos, aunado a la carencia de nuevas clases terapéuticas, lo que ha llevado a la dificultad en el manejo de la OMA causada por microorganismos multirresistentes. Algunos estudios publicados hace algunos años reportan tasas de resistencia en S. pneumoniae del 3% para amoxicilina-clavulanato, el 57% para cefuroxima, el 26% para cefotaxima, el 51% para eritromicina, el 97% para azitromicina, el 63% para tetraciclina, el 0% para levofloxacino y el 89% para TMP/SMZ, mientras que H. influenzae mostró porcentajes de resistencia del 0% para amoxicilina-clavulanato, el 5% para cefuroxima, el 25% para ampicilina,el 0% para cefotaxima, el 15% para azitromicina, el 5% para tetraciclina, el 0% para levofloxacino y el 51% para TMP/SMZ61. Otro estudio realizado en México62 reportó resistencia general en S. pneumoniae del 65% para penicilina, el 19% para cefotaxima, el 23% para azitromicina y eritromicina, el 61% para TMP/SMZ, el 5% para amoxicilina y el 12% para clindamicina. Amoxicilina-clavulanato, ceftriaxona, imipenem, meropenem, teicoplanina, telitromicina y vancomicina mostraron una susceptibilidad del 100%62. Otro estudio encontró resistencia general en S. pneumoniae del 52% para penicilina, el 0.3% para amoxicilina-clavulanato, el 34% para cefaclor, el 10% para cefuroxima, el 1.3% para ceftriaxona, el 1% para levofloxacino, el 38% para TMP/SMZ y el 31% para tetraciclina63.
En los pacientes que recibieron amoxicilina-clavulanato o una cefalosporina de tercera generación de forma inicial se sugiere el uso ceftriaxona intramuscular en un esquema de 3 días en vez de 1 día2. En casos de falla del tratamiento con el uso de múltiples antibióticos se debe considerar la timpanocentesis y cultivo de la secreción, para decidir el uso del antibiótico guiado por el antibiograma. Cuando no es posible realizar la timpanocentesis, se puede considerar el uso de fluoroquinolonas respiratorias, como levofloxacino2. Se han reportado porcentajes de resolución bacteriológica del 95% con ceftriaxona intramuscular en pacientes con falla de tratamiento previo42,43,76,77.
No se encontraron revisiones sistemáticas en las que se hayan evaluado las distintas alternativas de antibióticos en pacientes con falla de tratamiento u OMA refractaria. Un estudio clínico publicado por Haiman et al.78 evaluó el impacto de la administración de dos diferentes esquemas de ceftriaxona intramuscular. Se demostró eficacia en la erradicación bacteriana en pacientes que no habían respondido al esquema antibiótico previo. El impacto en la colonización bacteriana de S. pneumoniae resistente a la penicilina fue menor, resultando en una colonización de microorganismos resistentes a las 2 semanas de tratamiento. En otro estudio clínico publicado por Sher et al.79 se evaluó la eficacia de una quinolona (gatifloxacino, actualmente retirado del mercado por problemas de seguridad) para el tratamiento de pacientes pediátricos con OMA y falla de tratamiento o con OMA recurrente. En los pacientes con falla de tratamiento, la respuesta clínica fue del 87.5% en los menores de 24 meses y del 97% en los mayores de 24 meses con el esquema de gatifloxacino, en comparación con el 63.6% en los menores de 24 meses y el 83.9% en los mayores de 24 meses que recibieron amoxicilina-clavulanato. No se observaron microorganismos resistentes a la fluoroquinolona. El evento adverso que se presentó con mayor frecuencia fue diarrea (10% con gatifloxacino y 18% con amoxicilina-clavulanato). En un estudio clínico publicado por Noel et al.80 con el objetivo de evaluar la eficacia de levofloxacino (10 mg/kg dos veces al día) en comparación con amoxicilina-clavulanato en pacientes pediátricos con OMA, se incluyeron 1650 pacientes que fueron aleatorizados para recibir cualquiera de los dos esquemas de manera cegada. La cura clínica al final del estudio se observó en el 72.4% de los tratados con levofloxacino y en el 69% de los tratados con amoxicilina-clavulanato. No se observaron diferencias significativas en la incidencia de eventos adversos entre ambos grupos. El 3% de los pacientes del grupo de levofloxacino presentó eventos adversos musculoesqueléticos, en comparación con el 2% del grupo de amoxicilina-clavulanato. En general, se presentaron eventos adversos gastrointestinales en ambos grupos, y fue necesario descontinuar el tratamiento solo en el 4% con levofloxacino y en el 3% con amoxicilina-clavulanato debido a estos eventos adversos, la mayoría de ellos gastrointestinales.
Los lineamientos de la American Academy of Pediatrics81 para el uso extendido de las distintas quinolonas en pediatría sugieren emplearlas para el tratamiento de infecciones respiratorias altas multirresistentes. El levofloxacino y el moxifloxacino muestran una excelente cobertura contra gramnegativos, grampositivos y patógenos respiratorios como S. pneumoniae, Mycoplasma pneumoniae y Chlamydophila pneumoniae. Sin embargo, casi no existen estudios sobre el uso de moxifloxacino en población pediátrica. Los datos de seguridad del levofloxacino en niños se han reunido de distintos estudios clínicos (uno de ellos para el manejo de la OMA) que incluyeron 2523 pacientes. El evento adverso más frecuente fue el dolor articular (el 85% de todos los eventos adversos), sin que se hayan encontrado alteraciones articulares en la exploración física ni mediante resonancia magnética. En este mismo estudio, una cohorte de pacientes fue seguida durante 12 meses para determinar la seguridad a largo plazo. Al final del periodo de estudio se observó un aumento discreto de eventos adversos. No se encontraron diferencias en el crecimiento entre ambos grupos en un periodo de seguimiento de 5 años.
La revisión sistemática de Rovers et al.68 (2007), cuyo objetivo fue determinar los factores asociados con una resolución más prolongada de la OMA en niños de 6 meses a 12 años de edad, incluyó estudios clínicos controlados que hubieran aleatorizado a los pacientes para recibir antibiótico, placebo o un periodo de observación sin antibiótico. Para el análisis, solo se incluyeron aquellos pacientes que no recibieron antibióticos. El desenlace evaluado fue la evolución prolongada de la OMA, definida por fiebre u otalgia a los 3-7 días de iniciar el padecimiento. Los autores identificaron 19 estudios clínicos controlados, de los cuales nueve fueron excluidos. Se incluyeron seis estudios que evaluaron 824 pacientes. Los resultados del análisis multivariado mostraron que la edad menor de 2 años (OR: 2.1; IC95%: 1.5-2.9) y la OMA bilateral (OR: 1.7; IC95%: 1.2-2.4) fueron factores predictivos independientes para dolor o fiebre a los 3-7 días de iniciado el cuadro. De igual forma, las variables asociadas con el dolor a los 3-7 días fueron la edad menor de 2 años (OR: 2.0; IC95%: 1.4–2.9) y la OMA bilateral (OR: 1.8; IC95%: 1.3-2.6). Las variables asociadas con la fiebre en los días 3-7 fueron la edad menor de 2 años (OR: 1.6; IC95%: 1.0–2.6) y la presencia de fiebre al inicio de la enfermedad (OR: 3.0; IC95%: 1.8-4.9). Así mismo, se realizaron diversos análisis de sensibilidad para encontrar posibles variables confusoras o modificadoras del efecto, pero no se encontraron cambios en los resultados (Tabla 8).
Tabla 8 Recomendaciones clínicas con respecto al tratamiento de la otitis media aguda
| Pregunta | Recomendación | Nivel de evidencia Grado de recomendación |
|---|---|---|
| 7b y 8b | En caso de que el manejo inicial haya sido con
amoxicilina, se sugiere el manejo con amoxicilina-clavulanato o
sulbactam a dosis de 90 mg/kg al día con base en amoxicilina.
Si el manejo inicial fue con amoxicilina-clavulanato o sulbactam o alguna cefalosporina, se sugiere el uso de ceftriaxona intramuscular (50 mg/kg al día) durante 3 días. Si se presentara falla del tratamiento después de un segundo antibiótico, será muy importante la revaloración del paciente y la realización de timpanocentesis y cultivo con antibiograma. Una opción puede ser una fluoroquinolona (levofloxacino) cuando existe falla de múltiples tratamientos o se sospecha el involucro de bacterias multirresistentes |
Nivel de evidencia 1− Grado de recomendación B Recomendación fuerte |
| 9 | No se recomienda el uso de descongestivos combinados con antihistamínicos H1 sistémicos para el manejo de la OMA en niños | Nivel de evidencia 1++ Grado de recomendación A Recomendación fuerte en contra |
| 10 | No se recomienda el uso de descongestivos tópicos nasales debido a que no hay evidencia de alta calidad que haya demostrado su eficacia y seguridad | Nivel de evidencia 4 Grado de recomendación D Recomendación para realizar investigación, y posiblemente recomendación condicionada para uso en estudios clínicos |
| 11 | No se sugiere el uso de corticoesteroides sistémicos para el manejo de la OMA en niños, ya que no existe evidencia de alta calidad para sustentar su eficacia y seguridad | Nivel de evidencia 1+ Grado de recomendación A Recomendación para realizar investigación, y posiblemente recomendación condicionada para uso en estudios clínicos |
| 12 | No se recomienda el uso de corticoesteroides intranasales debido a que no hay evidencia de alta calidad que haya demostrado su eficacia y seguridad | Nivel de evidencia 4 Grado de recomendación D Recomendación para realizar investigación, y posiblemente recomendación condicionada para uso en estudios clínicos |
OMA: otitis media aguda.
Se realizó una síntesis de las recomendaciones para cada pregunta clínica, con sus niveles de evidencia y grados de recomendación. Es importante revisar todo el texto para conocer la recomendación completa.
Pregunta clínica 9. ¿Cuáles son la eficacia y seguridad de los descongestivos sistémicos en comparación con placebo o con otros agentes activos para el tratamiento de los pacientes pediátricos mayores de 6 meses con OMA unilateral o bilateral?
Recomendación. No se recomienda el uso de descongestivos combinados con antihistamínicos H1 sistémicos para el manejo de la OMA en niños. (Nivel de evidencia 1++, Grado de recomendación A, Recomendación fuerte en contra).
Revisión de la literatura y análisis. En 2008, Coleman y Moore82 publicaron una revisión sistemática a través de la Colaboración Cochrane en la que evaluaron la eficacia y seguridad de los descongestivos combinados con antihistamínicos en niños con OMA. Se incluyeron 15 estudios clínicos controlados que evaluaron 2695 pacientes. Los resultados de los metaanálisis demostraron que no hubo diferencias significativas en las tasas de resolución, alivio de síntomas, disminución de la necesidad de cirugía y otras complicaciones. Solo la persistencia de derrame en el oído medio mostró diferencia significativa a favor del tratamiento con descongestivo combinado con antihistamínico sistémico a las 2 semanas de evolución (RR: 0.76; IC95%: 0.60-0.96; NNT: 10). Además, se observó incremento en la frecuencia de eventos adversos (5-8 veces más) en los pacientes que recibieron medicamento.
Pregunta clínica 10. ¿Cuáles son la eficacia y seguridad de los descongestivos tópicos nasales en comparación con placebo o con otros agentes activos para el tratamiento de los pacientes pediátricos mayores de 6 meses con OMA unilateral o bilateral?
Recomendación. No se recomienda el uso de descongestivos nasales tópicos debido a que no hay evidencia de alta calidad que haya demostrado su eficacia y seguridad. (Nivel de evidencia 4, Grado de recomendación D, Recomendación condicionada en contra).
Revisión de la literatura y análisis. No hay estudios clínicos controlados publicados en pacientes pediátricos con OMA que hayan evaluado la eficacia y seguridad de los descongestivos tópicos. El panel de expertos de esta guía llegó al 100% de consenso en esta recomendación.
Pregunta clínica 11. ¿Cuáles son la eficacia y la seguridad de los corticoesteroides sistémicos en comparación con placebo o con otros agentes activos para el tratamiento de los pacientes pediátricos mayores de 6 meses con OMA unilateral o bilateral?
Recomendación. No se sugiere el uso de corticoesteroides sistémicos para el manejo de la OMA en niños, ya que no existe evidencia de alta calidad para sustentar su eficacia y seguridad. (Nivel de evidencia 1+, Grado de recomendación A, Recomendación para realizar investigación y posiblemente recomendación condicionada para uso en estudios clínicos).
Revisión de la literatura y análisis. Ranakusuma et al.83 publicaron en 2018 una revisión sistemática a través de la Colaboración Cochrane con el objetivo de evaluar la eficacia y seguridad de los corticoesteroides sistémicos para el tratamiento de la OMA en niños. Los autores incluyeron estudios clínicos controlados. Dos estudios clínicos cumplieron con los criterios de inclusión, en los cuales se evaluaron 353 pacientes de 3 meses a 6 años de edad. El primer estudio incluyó 179 pacientes y al finalizarlo se observó mejoría de los síntomas en el 94% de los pacientes del grupo con tratamiento en comparación con el 89% del grupo con placebo (RR: 1.06; IC95%: 0.97-1.16), y al día 5 del 91% frente al 87% (RR: 1.05; IC95%: 0.95-1.17), respectivamente. Se debe mencionar que la calidad metodológica del estudio fue baja. El otro estudio incluyó 73 pacientes y reportó mejoría en los desenlaces en el grupo tratado con corticoesteroides (OR ajustada: 65.9; IC95%: 1.28-1000; p = 0.037). En ambos casos, la evidencia fue calificada como baja o muy baja, y no suficiente para conocer la eficacia y seguridad de los corticoesteroides sistémicos en el manejo de la OMA en niños.
Pregunta clínica 12. ¿Cuáles son la eficacia y seguridad de los corticoesteroides intranasales en comparación con placebo o con otros agentes activos para el tratamiento de los pacientes pediátricos mayores de 6 meses con OMA unilateral o bilateral?
Recomendación. No se recomienda el uso de corticoesteroides intranasales debido a que no hay evidencia de alta calidad que haya demostrado su eficacia y seguridad. (Nivel de evidencia 4, Grado de recomendación D, Recomendación para realizar investigación y posiblemente recomendación condicionada para uso en estudios clínicos).
Revisión de la literatura y análisis. No existen estudios clínicos controlados publicados en pacientes pediátricos con OMA que hayan evaluado la eficacia y la seguridad de los corticoesteroides intranasales. El panel de expertos de esta guía llegó al 100% de consenso en esta recomendación.
Pregunta clínica 13. ¿Cuáles son la eficacia y seguridad de los antihistamínicos sistémicos en comparación con placebo o con otros agentes activos para el tratamiento de los pacientes pediátricos mayores de 6 meses con OMA unilateral o bilateral?
Recomendación. No se recomienda el uso de antihistamínicos H1 sistémicos para el manejo de la OMA en niños. (Nivel de evidencia 1++, Grado de recomendación A, Recomendación fuerte en contra).
Revisión de la literatura y análisis. Coleman y Moore82 publicaron en 2008 una revisión sistemática por parte de la Colaboración Cochrane con el objetivo de evaluar la eficacia y la seguridad de los descongestivos combinados con antihistamínicos en niños con OMA. Se incluyeron 15 estudios clínicos controlados que evaluaron 2695 pacientes. Los resultados de los metaanálisis demostraron que no hubo diferencias significativas en las tasas de resolución, alivio de síntomas, disminución de la necesidad de cirugía y otras complicaciones. Solo la persistencia de derrame en el oído medio mostró una diferencia significativa a favor del tratamiento con descongestivo combinado con antihistamínico sistémico a las 2 semanas de evolución (RR: 0.76; IC95%: 0.60-0.96; NNT: 10). Adicionalmente, se observó incremento en la frecuencia de eventos adversos (5-8 veces más) en los pacientes que recibieron medicamento. En los estudios que evaluaron únicamente antihistamínicos se encontró no solo una falta de eficacia, sino también riesgo elevado de persistencia del derrame en el oído medio en comparación con el grupo que recibió placebo (RR: 1.23; IC95%: 0.91-1.66)79 (Tabla 9).
Tabla 9 Recomendaciones clínicas para el tratamiento de la otitis media aguda
| Pregunta | Recomendación | Nivel de evidencia Grado de recomendación |
|---|---|---|
| 13 | No se recomienda el uso de antihistamínicos H1 sistémicos para el manejo de la OMA en niños | Nivel de evidencia 1++ Grado de recomendación A Recomendación fuerte en contra |
| 14 | No se recomienda el uso de mucolíticos debido a que no hay evidencia de alta calidad que haya demostrado su eficacia y seguridad | Nivel de evidencia 4 Grado de recomendación D Recomendación para realizar investigación, y posiblemente recomendación condicionada para uso en estudios clínicos |
| 15 | No se sugiere el uso de preparaciones tópicas para el manejo del dolor en los pacientes pediátricos con OMA con membrana timpánica íntegra, ya que no existe evidencia de alta calidad para sustentar su eficacia y seguridad | Nivel de evidencia 1+ Grado de recomendación A Recomendación para realizar investigación, y posiblemente recomendación condicionada para uso en estudios clínicos |
| 16 | Se sugiere el uso de preparaciones tópicas combinadas de antibiótico y corticoesteroides para el manejo de la OMA unilateral o bilateral con membranas timpánicas perforadas y otorrea. Es importante evitar las preparaciones que contengan antibióticos potencialmente ototóxicos | Nivel de evidencia 1− Grado de recomendación B Recomendación condicionada |
| 17 | No se sugiere el uso de medicina alternativa y complementaria, ya que no existe evidencia de alta calidad para sustentar su eficacia y seguridad. La falta de estandarización puede presentar riesgos en el perfil de seguridad y conducir a la presentación de eventos adversos | Nivel de evidencia 1− Grado de recomendación A Recomendación para realizar investigación, y posiblemente recomendación condicionada para uso en estudios clínicos |
| 18 | No se recomienda la realización de miringotomía para el manejo de la OMA no complicada en niños, ya que los estudios han demostrado su falta de eficacia y un mayor porcentaje de falla de tratamiento en los pacientes a quienes se realizó miringotomía. Se sugiere su realización en casos seleccionados de falla de tratamiento cuando se sospecha el involucro de microorganismos multirresistentes | Nivel de evidencia 1− Grado de recomendación A Recomendación condicionada en contra |
OMA: otitis media aguda.
Se realizó una síntesis de las recomendaciones para cada pregunta clínica, con sus niveles de evidencia y grados de recomendación. Es importante revisar todo el texto para conocer la recomendación completa.
Pregunta clínica 14. ¿Cuáles son la eficacia y seguridad de los mucolíticos en comparación con placebo o con otros agentes activos para el tratamiento de los pacientes pediátricos mayores de 6 meses con OMA unilateral o bilateral?
Recomendación. No se recomienda el uso de mucolíticos debido a que no hay evidencia de alta calidad que haya demostrado su eficacia y seguridad. (Nivel de evidencia 4, Grado de recomendación D, Recomendación para realizar investigación y posiblemente recomendación condicionada para uso en estudios clínicos).
Revisión de la literatura y análisis. No existen estudios clínicos controlados publicados con pacientes pediátricos con OMA que hayan evaluado la eficacia y seguridad de los mucolíticos. El panel de expertos de esta guía llegó al 100% de consenso en esta recomendación.
Pregunta clínica 15. ¿Cuáles son la eficacia y seguridad de las gotas óticas en comparación con placebo o con otros agentes activos para el tratamiento del dolor en los pacientes pediátricos mayores de 6 meses con OMA unilateral o bilateral con membrana timpánica íntegra?
Recomendación. No se sugiere el uso de preparaciones tópicas para el manejo del dolor en los pacientes pediátricos con OMA debido a que no existe evidencia de alta calidad para sustentar su eficacia y seguridad. (Nivel de evidencia 1+, Grado de recomendación A, Recomendación fuerte en contra).
Revisión de la literatura y análisis. Foxlee et al.84 publicaron en 2006 una revisión sistemática con el objetivo de evaluar la eficacia y la seguridad de las preparaciones tópicas (sin antibiótico) para el manejo del dolor en pacientes con OMA. Incluyeron cinco estudios clínicos que evaluaron a 391 pacientes pediátricos. Dos estudios (117 niños) compararon gotas analgésicas. Los resultados mostraron diferencia estadísticamente significativa en la proporción de pacientes que manifestaron disminución de la intensidad de la otalgia al menos del 50% evaluada a los 10 y 30 minutos de la instilación de las gotas anestésicas (RR: 2.13, IC95%: 1.19-3.80, y RR: 1.43, IC95%: 1.12-1.81, respectivamente). No obstante, la diferencia en la mejoría se dejó de observar a los 20 minutos de instilado el medicamento (RR: 1.43; IC95%: 1.12-1.81). La evaluación de estos cinco estudios clínicos provee evidencia limitada sobre la eficacia de las distintas preparaciones analgésicas en niños con OMA.
Pregunta clínica 16. ¿Cuáles son la eficacia y seguridad de las gotas óticas combinadas de antibiótico y corticoesteroides en comparación con placebo o con otros agentes activos para el tratamiento de los pacientes pediátricos mayores de 6 meses con OMA unilateral o bilateral con membranas timpánicas perforadas u otorrea?
Recomendación. Se sugiere el uso de preparaciones tópicas combinadas de antibiótico y corticoesteroides para el manejo de la OMA unilateral o bilateral con membranas timpánicas perforadas y otorrea. (Nivel de evidencia 1−, Grado de recomendación B, Recomendación condicionada).
Es importante evitar las preparaciones que contengan antibióticos potencialmente ototóxicos en pacientes con OMA y membrana timpánica perforada. (Nivel de evidencia 4, Grado de recomendación D, Recomendación condicionada).
Revisión de la literatura y análisis. No se encontraron estudios clínicos controlados ni revisiones sistemáticas que hubieran evaluado la eficacia y seguridad de preparaciones tópicas de gotas óticas combinadas de antibióticos y antiinflamatorios para el tratamiento de la OMA. Sin embargo, en una revisión sistemática realizada por Venekamp et al.85 en 2016 se pudieron extrapolar datos de pacientes con otorrea posterior a la inserción de tubos de ventilación, lo que permitió evaluar pacientes menores de 18 años manejados con gotas óticas con antibiótico, solo o combinado con corticoesteroides, y con gotas con corticoesteroides en monoterapia. Los autores incluyeron nueve estudios clínicos controlados que evaluaron diversas combinaciones y se compararon con diversas alternativas de tratamiento. Respecto a la evaluación de las gotas tópicas que contenían la combinación de un antibiótico con corticoesteroides, solo un estudio fue incluido en la evidencia. En un estudio aleatorizado que incluyó 331 pacientes, un primer grupo recibió gotas de fluocinolona, otro grupo recibió ciprofloxacino/fluocinolona y un tercer grupo recibió ciprofloxacino como monoterapia. Los resultados en cuanto al tiempo de duración de la otorrea mostraron diferencias significativas a favor del segundo grupo en comparación con el primero (22 días IC95%: 14-22 vs. 5 días IC95%: 4–6 vs. 7 días IC95%: 6-8, respectivamente).
Cuando se comparó el efecto de la combinación de gotas óticas con antibiótico más corticoesteroides frente al uso de antibiótico solo, el metaanálisis de dos estudios clínicos (590 pacientes analizados) mostró que los pacientes que recibieron la combinación presentaron mayor probabilidad de resolución completa antes de concluir las 2 semanas de tratamiento (35% vs. 20%; RR: 1.76; IC95%: 1.33-2.31; I2: 0%, modelo de efectos fijos), con NNT de 12. Otros desenlaces, como el resultado audiológico, no mostraron diferencias significativas entre los grupos. Respecto a la incidencia de eventos adversos, no se encontraron diferencias significativas entre los grupos evaluados con los resultados de tres estudios clínicos controlados (RR: 0.86; IC95%: 0.55-1.312; I2: 0%, modelo de efectos fijos).
Pregunta clínica 17. ¿Cuáles son la eficacia y seguridad de la medicina alternativa y complementaria en comparación con no utilizarla o con placebo para el tratamiento de los pacientes pediátricos mayores de 6 meses con OMA unilateral o bilateral?
Recomendación. No se sugiere el uso de medicina alternativa y complementaria para el manejo de la OMA en niños, ya que no existe evidencia de alta calidad para sustentar su eficacia y seguridad. La falta de estandarización puede presentar riesgos en el perfil de seguridad y conducir a la presentación de eventos adversos. (Nivel de evidencia 1−, Grado de recomendación A, Recomendación condicionada en contra).
Revisión de la literatura y análisis. Una revisión sistemática de la literatura publicada por Marom et al.86 en 2016 evaluó la eficacia y seguridad de diversas opciones consideradas dentro de la medicina alternativa y complementaria, en las que se agrupan la homeopatía, la ozonoterapia, la acupuntura, el xilitol, la vitamina D y la medicina herbolaria (fitoterapia), entre otras. Sin embargo, la calidad de la evidencia fue muy baja y la calidad metodológica de la revisión sistemática presenta alto riesgo de sesgo al no incluir una revisión crítica de la literatura. Aunque la conclusión de los autores fue que hacen falta estudios clínicos controlados de alta calidad metodológica para evaluar estas alternativas, dejaron abierta la posibilidad de que exista algún beneficio con algunas de ellas. Otra revisión sistemática publicada por Altunç et al.87 evaluó la eficacia y la seguridad de la homeopatía para el tratamiento de algunos padecimientos en niños y adolescentes. Solo se encontró un estudio clínico que evaluó 75 pacientes entre 6 meses y 18 años de edad con OMA. En este estudio no se encontraron diferencias significativas en la falla de tratamiento, pero sí una diferencia en el alivio de los síntomas evaluado por los pacientes. Las conclusiones de los autores establecen que no hay suficiente evidencia de alta calidad para poder recomendar la homeopatía en el tratamiento de la OMA. Otra revisión sistemática publicada por Son et al.88 evaluó la eficacia y seguridad de la medicina herbal en el tratamiento de la OMA, incluyendo siete estudios, de los cuales seis fueron publicados en China y uno en Rusia (en total 1067 pacientes). Los estudios presentaron alto riesgo de sesgo al no reportar los métodos de cuidado de asignación de las intervenciones y de cegamiento. No fue posible llevar a cabo un metaanálisis debido a la alta heterogeneidad en el reporte de los resultados y a la falta de estandarización de las diferentes intervenciones. La conclusión de los autores fue que la evidencia encontrada era de muy baja calidad, por lo que no fue posible llegar a una conclusión sobre la eficacia de este tipo de intervenciones terapéuticas.
Pregunta clínica 18. ¿En qué casos está indicada la miringotomía en pacientes pediátricos mayores de 6 meses con OMA?
Recomendación. No se recomienda la realización de miringotomía para el manejo de la OMA no complicada en niños, ya que los estudios han demostrado falta de eficacia y mayor porcentaje de falla de tratamiento en los pacientes a quienes se realizó miringotomía. La alta resolución espontánea de la OMA y el potencial de complicaciones y de dificultad para realizar la miringotomía son argumentos que sostienen la recomendación en contra. Se recomienda su realización en casos seleccionados de falla de tratamiento cuando se sospecha el involucro de microorganismos multirresistentes. (Nivel de evidencia 1−, Grado de recomendación A, Recomendación condicionada en contra).
Revisión de la literatura y análisis. En 2014, Venekamp et al.89 publicaron una revisión sistemática en la que incluyeron un estudio clínico que evaluó la realización de miringotomía en comparación con no realizarla. Se incluyeron 171 pacientes de 2 a 12 años con diagnóstico de OMA. No se encontró ninguna diferencia en el resultado de la mejoría del dolor a las 24 horas y a los 7 días entre ambos grupos de tratamiento (72.2% con miringotomía frente al 72.5% sin miringotomía, y 89% con miringotomía frente al 90% sin miringotomía, respectivamente). No se reportaron otros desenlaces. Para la comparación de la miringotomía con la administración de antibióticos se encontraron tres estudios clínicos controlados. Uno de ellos, que incluyó 105 pacientes de 3 meses a 1 año de edad, reportó mayor persistencia de la infección en el oído medio en los pacientes con miringotomía a los 9-11 días (70% frente al 7%; p < 0.001) y a los 3-6 días (80% frente al 31%; p < 0.0001). Otro estudio reportó mejoría del dolor a las 24 horas y a los 7 días, y no encontró ninguna diferencia entre ambos grupos de tratamiento (72.2% con miringotomía frente al 72.3% con amoxicilina, y 89% con miringotomía frente al 93% con amoxicilina, respectivamente). Un tercer estudio incluyó información de 83 episodios de OMA en niños de 2 a 12 años con OMA grave. La falla de tratamiento a las 12 horas se reportó en el 23% de los pacientes a quienes se realizó miringotomía, en comparación con el 4% de los pacientes que recibieron amoxicilina (p = 0.006).
Investigación futura
Dentro de la GPC existen temas sin respuesta o para los que la evidencia no ha alcanzado la cobertura adecuada para dar lugar a ciertas recomendaciones. Por ello, existen grupos de trabajo internacionales que se encargan de crear protocolos dirigidos a responder estas preguntas90. Actualmente, tanto la emergencia de nuevas resistencias bacterianas y de microorganismos multirresistentes como el poco desarrollo de nuevas clases terapéuticas en lo que se refiere a antibióticos son los retos más importantes para el manejo de la OMA en los niños. Otro aspecto poco estudiado es el desarrollo de preparaciones tópicas que ayuden al manejo del dolor agudo en la OMA. Por el momento, el uso de AINE es eficaz para el control del dolor. Sin embargo, contar con un medicamento tópico eficaz y seguro sería una gran adición al armamento terapéutico de la OMA.
Validación externa
Este documento fue revisado y validado por el Dr. Sarbelio Moreno Espinosa, pediatra infectólogo, director de Enseñanza y Desarrollo Académico, y por el Dr. Juan Garduño Espinosa, director de investigación, del Hospital Infantil de México Federico Gómez.
De igual manera, el Colegio Mexicano de Otología, Neurootología y Cirugía de Base de Cráneo, A.C. revisó de manera externa e independiente el manuscrito y todas las recomendaciones que lo integran, mediante la designación, por parte de ellos, del Dr. Arturo Alanís Ibarra, jefe del servicio de otorrinolaringología del Hospital Pediátrico de Sinaloa; la Dra. María Guadalupe Isabel Montes Dorantes, adscrita al Hospital del Niño Dr. Federico Gómez Santos, Saltillo, Coahuila; el Dr. Alfredo Vega Alarcón, jefe del servicio de neurootología del Instituto Nacional de Neurología y Neurocirugía Dr. Manuel Velasco Suárez, Ciudad de México; la Dra. Erika María Celis Aguilar, jefa de enseñanza del Hospital Civil de Culiacán, Sinaloa; y el Dr. Benjamín García Enríquez, adscrito al Centro Médico, Instituto de Seguridad Social del Estado de México y Municipios, Toluca, y presidente del Colegio Mexicano de Otología, Neurootología y Cirugía de Base de Cráneo.
Representantes de los pacientes
Una asociación de pacientes con larga trayectoria en la defensa de los derechos de pacientes (Asociación Mexicana de Lucha contra el Cáncer, A.C.) nombró dos representantes para revisar de manera independiente las recomendaciones incorporadas en este manuscrito.
Actualización
Se planea un periodo de actualización de la GPC de 3-4 años para incorporar nueva evidencia científica a las recomendaciones.
Información importante
Esta GPC y los documentos que sean publicados basados en ella representan herramientas originadas por el consenso de expertos clínicos acerca de las terapias y la toma de decisiones vigentes para el manejo de la OMA. Este documento ha sido publicado para que los especialistas consideren las recomendaciones clínicas y las incorporen a la toma de decisiones de su práctica clínica cotidiana. Sin embargo, estas recomendaciones no se encuentran por arriba del criterio clínico independiente de cada médico y de las condiciones individuales de cada paciente.











 nueva página del texto (beta)
nueva página del texto (beta)


