Introducción
Las displasias ectodérmicas son genodermatosis caracterizadas por distrofia de las estructuras derivadas del ectodermo, incluyendo la piel, el pelo, las uñas, los dientes y las glándulas de secreción exocrina. La variedad más común es la displasia ectodérmica hipohidrótica (DEH), con una incidencia de 7/100,000 nacidos vivos1,2. La presentación más frecuente de las DEH es la ligada al cromosoma X (DEHLX, MIM#305100), causada por variantes patogénicas del gen EDA en Xq13.1 (MIM*300451). Este gen codifica la ectodisplasina A, una molécula de señalización que participa en la comunicación epitelio-mesénquima durante el desarrollo de la piel2-5. Otros genes autosómicos asociados con DEH son EDAR (MIM*604095), EDARADD (MIM*606603) y WNT10A (MIM*606268), con un patrón de herencia recesivo o dominante, según la variante implicada6.
Se describe el caso de un paciente de 6 años con las características clínicas cardinales de la displasia ectodérmica hipohidrótica ligada al cromosoma X (DEHLX), su diagnóstico molecular y las implicaciones que este tiene para su manejo y asesoramiento genético.
Caso clínico
Varón de 6 años, hijo de padres jóvenes, sanos y no consanguíneos; dos hermanos mayores sanos y un hermano menor con retraso global del desarrollo y paresia corporal izquierda (Figura 1A). El paciente nació a las 38 semanas de gestación vía cesárea por desproporción cefalopélvica, con un peso de 2800 g (percentil 15-50), una talla de 50 cm (percentil 50) y Apgar 9 a los 5 minutos. Mostró adecuado desarrollo psicomotor. El paciente fue referido por presentar hipotricosis, ausencia de piezas dentarias y episodios recurrentes de hipertermia no asociada a procesos infecciosos. A la exploración física, la edad cronológica era mayor que la aparente; peso de 13.5 kg (percentil 10-25), talla de 93 cm (percentil 5-10) y perímetro cefálico de 50 cm (percentil 15-50). Presentó cráneo con disminución del diámetro bitemporal, cabello ralo y escaso con implantación adecuada; las cejas arqueadas, escasas, casi ausentes en el tercio medio. Las líneas de expresión de ambos párpados (superior e inferior) se mostraron marcadas en ambos ojos y con pestañas escasas. Se detectó la raíz nasal ancha con puente nasal elevado, hipoplasia de la región facial media, filtrum corto y semiborrado, labios gruesos con eversión e hipodoncia e incisivos centrales cónicos (Figuras 1B y 1C). El resto de la exploración fue normal y el diagnóstico clínico fue DEH ligada al cromosoma X (DEHLX).

Figura 1 A: Árbol genealógico del propositus. B: Fenotipo del propositus. Se observa frontal amplio, implantación del cabello alta, cabello escaso y ralo, y cejas escasas. C: Forma anormal de los dientes.
Previo consentimiento informado y autorización institucional, se obtuvo una muestra de sangre periférica del paciente y su madre, y se extrajo el ADN. La secuenciación del gen EDA identificó un cambio de citosina por timina en el exón 2 (NM_001005609.1:c.466C>T, rs132630313) (Figura 2), que cambia el aminoácido 156 arginina por cisteína (p.Arg156Cys) en el gen EDA. Las variantes en este residuo han sido descritas como patogénicas en diferentes poblaciones, incluyendo familias mexicanas5-9 y en la base de datos ClinVar. La madre del paciente resultó negativa para la variante.
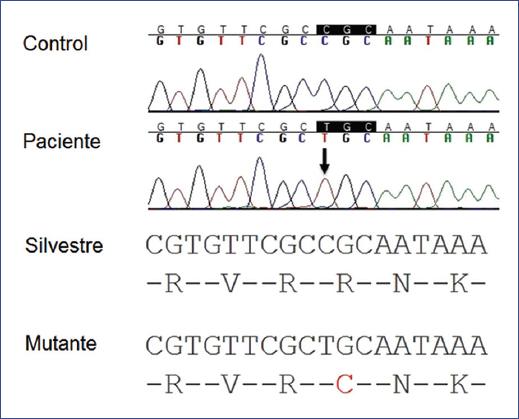
Figura 2 Electroferograma del exón 2 de EDA. Secuencia parcial de un control (panel superior) y del paciente con DEHLX, donde la flecha señala el cambio de citosina por timina (c.466C>T). En la parte inferior de la figura se comparan las secuencias parciales silvestres y mutantes del transcrito y de la proteína EDA. En letra roja se señala la sustitución de la arginina 156 por una cisteína en la proteína.
Discusión
El paciente presentó los datos característicos de DEHLX: hipotricosis, hipohidrosis, dientes cónicos, fiebre sin causa aparente y dismorfias. El diagnóstico clínico de DEHLX suele realizarse en el lactante mayor o en edad preescolar por las manifestaciones clínicas aparentes10. En algunos casos, el diagnóstico puede hacerse al nacimiento si se presenta una dermatosis descamativa similar a la de la ictiosis11. La expresión fenotípica completa de la DEHLX se observa en el sexo masculino; las mujeres heterocigotas (o portadoras) pueden presentar o no datos clínicos debido a la penetrancia incompleta por inactivación sesgada del cromosoma X, con gravedad variable12,13.
En la DEH se presentan los siguientes datos clínicos cardinales2: en primer lugar, hipotricosis, con cabellos delgados y escasos, pigmentación anormal y tasa de crecimiento lenta; suele aparecer calvicie prematura, y el pelo de la región axilar o genital puede ser normal14. En segundo lugar, hipohidrosis, que puede llevar a episodios de hipertermia, con una tasa de mortalidad de hasta el 30% durante la infancia temprana11; aparecen intolerancia al calor y xerosis de la piel. También se ha descrito xeroftalmía por disfunción de las glándulas de Meibomio15. Por último, oligodoncia o hipodoncia grave, con ausencia de seis o más piezas dentarias; los dientes suelen ser pequeños y displásicos, con morfología cónica hasta en el 80% de los pacientes16.
Se han descrito dismorfias faciales en la DEH2, como en el presente caso (Figura 1B). La prevalencia de rinitis alérgica es del 44% y hasta el 43% de los pacientes presentan otitis media recurrente4; alteraciones no observadas en el paciente. Los pacientes con DEH tienden a presentar un peso menor que el esperado para su edad17,18; la estatura y el desarrollo psicomotor, en general, no se ven afectados17. Sin embargo, este paciente presentó una talla de 93 cm (percentil 5-10) y un peso de 13.5 kg (percentil 10-25).
Se ha documentado que la DEH puede asociarse con retraso del crecimiento, posiblemente debido a condiciones nutricionales, a cuidados médicos deficientes o al inicio tardío del tratamiento de las alteraciones dentales18.
El gen EDA tiene ocho exones9 y su secuenciación detecta las variantes presentes en más del 80% de los pacientes con DEH19,20. La proteína codificada por este gen está compuesta por 391 aminoácidos y seis dominios funcionales21; es miembro de la familia del factor de necrosis tumoral alfa y presenta dos isoformas principales: EDA-A1 y EDA-A215,21. La vía de señalización de EDA-EDAR es crítica para la formación y el desarrollo de los anexos cutáneos, con conservación alta entre especies. EDA-A1 se une al receptor EDAR y EDA-A2 se une al receptor XEDAR, que no está implicado en la DEH. Se ha propuesto que EDA ejerce su función al modular la expresión de activadores e inhibidores de la formación de la plácoda, y controla la formación de los folículos pilosos y el desarrollo de las glándulas sudoríparas22,23.
Las variantes patogénicas de EDA afectan a distintas regiones de la proteína, con implicaciones funcionales diferentes según el sitio alterado22,24. En la proteína, el residuo 156 forma parte de una secuencia consenso que permite a la furina escindir a EDA para ser liberada al espacio extracelular y unirse a EDAR. Este dominio contiene aminoácidos básicos (153-159) que permiten el reconocimiento del sitio de corte. La variante de sentido erróneo p.Arg156Cys impide el corte y la solubilización de EDA, lo que evita la señalización adecuada e interrumpe el desarrollo de los anexos cutáneos20,22.
El 60% de las variantes de EDA se localizan en los exones 6-8 y no existe una correlación precisa genotipo-fenotipo2,24. En pacientes mexicanos, la mayoría de las mutaciones reportadas son variantes de nucleótido único con cambio de sentido, sin que se haya establecido una correlación entre las variantes y el cuadro clínico5,10. Sin embargo, la afección en pacientes de sexo masculino parece ser mayor en las variantes sin proteína funcional25. La variante patogénica de novo identificada en el paciente de este caso ya había sido reportada en pacientes mexicanos con fenotipo similar5. Las variantes del exón 2 en el residuo 156, p.Arg156Cys/His/Ser/Leu/Gly, sitio de corte por furina, y en los residuos vecinos necesarios para su reconocimiento, se han reportado en diferentes poblaciones6-9,13,18, con frecuencia de novo, por lo que se consideran sitios «calientes» para mutación6.
En un estudio previo se determinó que la tasa de mutaciones de novo para EDA es inferior al 10%26. La frecuencia de madres portadoras de la mutación (17.3 en 100,000) parece obedecer a una prevalencia alta de mutaciones ocurridas durante la espermatogénesis en sus padres. Este fenómeno fue descrito incluso antes de la identificación de EDA, con una tasa de mutación en la espermatogénesis de 3.5:1 con respecto a la ovogénesis27. En los estudios realizados en mujeres de familias con DEHLX se describe una frecuencia alta de mujeres heterocigotas, quienes en su mayoría presentan la sintomatología4,5,25,28-30.
La secuenciación de EDA en los pacientes con DEHLX identifica un porcentaje alto de variantes patogénicas, dado que la mayoría de los casos corresponden a variantes de nucleótido único2. El resto de los pacientes se asocia con variantes estructurales detectables por métodos de análisis de deleción-duplicación, como la reacción en cadena de la polimerasa cuantitativa, la amplificación de sondas múltiples dependiente de ligación o los microarreglos dirigidos a exones específicos2.
Existen diagnósticos diferenciales para DEHLX, ya que, si bien se considera que la DEH afecta a todos los derivados ectodérmicos, cuando existe onicodistrofia se debe sospechar, por ejemplo, un síndrome de hipodoncia-displasia ungueal2, entre otros diagnósticos. Además, algunos síndromes de displasias ectodérmicas se caracterizan por ectrodactilia, fisura de labio/paladar, polidactilia u otras alteraciones de los miembros; ante la presencia de cualquiera de estas características se debe pensar en otro tipo de displasia ectodérmica3.
Los pacientes con DEH requieren un manejo multidisciplinario para optimizar el desarrollo psicosocial, mejorar la función oral y prevenir la hipertermia. El tratamiento dental y ortodóntico debe iniciarse en el primer año de vida para favorecer una alimentación adecuada, así como para mejorar el aspecto estético y la calidad de vida2. El diagnóstico prenatal se puede realizar en embarazos de riesgo en los que el producto presente DEHLX por un método no invasivo, como la ultrasonografía, que permite la medición del número de yemas dentarias presentes entre las semanas 18 y 28 de gestación31.
En modelos murinos y caninos se ha aplicado tratamiento posnatal y prenatal. La molécula utilizada, conocida como Fc-EDA, es una proteína recombinante de fusión que incluye el dominio de unión al receptor de EDA (100% conservado entre los ratones y los humanos) y el dominio constante de la IgG1 humana (EDI200, Edimer Pharmaceuticals). La molécula actúa en forma directa por unión al receptor EDAR, reemplazando a la molécula EDA ausente o defectuosa del feto. Solo con el tratamiento prenatal se logró un desarrollo normal de las glándulas sudoríparas y de las yemas dentales21,32-34.
Se han reportado tres casos de tratamiento in utero en pacientes con diagnóstico ultrasonográfico de DEHLX de dos familias (un embarazo gemelar y un embarazo con producto único). En estas familias, la mutación en EDA en la madre era conocida debido a que existía un hermano afectado. La administración de la molécula Fc-EDA se realizó por amniocentesis en las semanas 26 y 31 de gestación en el embarazo gemelar, y solo en la semana 26 en el feto único. Posnatalmente, el diagnóstico fue corroborado por análisis molecular en los tres pacientes, y se observó la recuperación de la capacidad normal de sudoración, una mayor cantidad de glándulas de Meibomio en el párpado y una mayor cantidad de yemas dentarias en comparación con sus hermanos afectados35.
El diagnóstico clínico y molecular de DEHLX tiene implicaciones para el asesoramiento genético; en el caso de los varones afectados, todas sus hijas serán heterocigotas para la variante patogénica, mientras que ninguno de sus hijos varones estará afectado por la enfermedad (siempre que la madre no presente una variante patogénica de EDA)2.
Por otra parte, en las mujeres heterocigotas, con o sin datos clínicos de la enfermedad, sus hijos varones tienen un 50% de riesgo de estar afectados y sus hijas un 50% de riesgo de ser heterocigotas. En las mujeres heterocigotas, la afección clínica dependerá de la penetrancia que presente la variante, condicionada por el patrón de inactivación del cromosoma X, con variabilidad interfamiliar e intrafamiliar en la expresión fenotípica2,15.
En este caso, se ha presentado un paciente varón de 6 años con las características clínicas cardinales de DEHLX: hipotricosis, oligodoncia e hipohidrosis. Se identificó la variante patogénica c.466C>T, p.Arg156Cys de novo, ya reportada previamente en la población mexicana.
El estudio molecular en los pacientes masculinos con DEH, además de corroborar el diagnóstico clínico, permite brindar un asesoramiento genético con bases moleculares y abre la posibilidad de identificar mujeres heterocigotas para brindarles un manejo temprano, incluyendo el tratamiento prenatal en embarazos futuros para prevenir las manifestaciones de DEHLX.











 nueva página del texto (beta)
nueva página del texto (beta)


