Introducción
La osteogénesis imperfecta (OI) es el trastorno óseo hereditario más común1, con una incidencia de 1 en 10,000 a 25,000 nacimientos a escala mundial2,3. Este trastorno está causado principalmente por mutaciones de los genes que codifican a las cadenas del colágeno tipo I, y en la mayoría de los casos presentan un patrón de herencia autosómico dominante2.
Se han propuesto varios sistemas de clasificación para describir su variabilidad4. En 1979, Sillence, et al. propusieron una clasificación en cuatro tipos (I-IV) basada en los hallazgos clínicos y radiológicos de los pacientes5,6. Sin embargo, ante la extensa heterogeneidad genética, esta clasificación fue complementada por Rauch, et al., quienes la ampliaron a 16 tipos diferentes1,7, divididos en cinco grupos, basándose en la vía metabólica afectada con respecto a la síntesis, estructura, procesamiento, modificación postraduccional, plegamiento7, reticulación2,7, hidroxilación2, mineralización y diferenciación de colágeno tipo I2,7.
La OI se caracteriza principalmente por el aumento en la fragilidad ósea1,3,7 y la disminución de la masa ósea4, lo que da lugar a fracturas frecuentes que producen dolor, deformidad y discapacidad1. Se puede asociar con huesos wormianos, hipoacusia, escleras azules, dentinogénesis imperfecta8-10, escoliosis, deformidad8, hiperlaxitud en la piel9, hipermovilidad articular8,9, predisposición a presentar hematomas y talla baja8,10. Los tipos de OI encontrados con mayor frecuencia en el entorno ortopédico pediátrico son los tipos I (leve fragilidad ósea), III (grave) y IV (moderada)1.
El diagnóstico de OI puede ser sencillo cuando existen antecedentes familiares y las características típicas; sin embargo, puede dificultarse en pacientes con fenotipo leve o cuando se identifican hijos afectados con historial de fracturas4. El objetivo del presente estudio fue exponer las características clínicas y epidemiológicas de una serie de pacientes pediátricos con diagnóstico de OI evaluados en la Unidad de Genética Médica de la Universidad de Los Andes (UGM-ULA).
Métodos
El presente trabajo consiste en una serie de 37 casos en los que se analizaron los datos clínicos y epidemiológicos disponibles de los pacientes evaluados en la consulta de la UGM-ULA de enero de 2006 a diciembre de 2018. Esta institución representa el único centro de referencia en genética médica del estado de Mérida. Se encuentra ubicado en el Instituto Autónomo Hospital Universitario de Los Andes, el cual se califica dentro del sistema de salud venezolano como un centro tipo IV. Además, sirve a los estados vecinos del suroccidente de Venezuela que no cuentan con servicios de genética.
Se incluyó solamente un paciente de cada familia, con diagnóstico clínico de OI y edad comprendida entre 0 y 15 años, de acuerdo con la clasificación clínica y radiológica de Sillence. Estos pacientes presentaron un historial recurrente de más de dos fracturas y otros signos asociados con OI que orientaron su diagnóstico clínico. Los pacientes con diagnósticos de lesión no accidental fueron excluidos, así como los casos de osteoporosis idiopática o secundaria y displasias esqueléticas que pudieran predisponer a fracturas.
Resultados
Del total de pacientes estudiados, 21 fueron de sexo masculino (56.76%) (Tabla 1). El 40.54% (15) presentó antecedentes familiares de OI. De estos, 14 casos mostraron un clásico patrón de herencia autosómico dominante a través de la construcción de la genealogía (Fig. 1 A). En la mayoría de los casos estudiados, se observó solamente un individuo afectado en la familia (Fig. 1 B). La OI tipo I fue la más frecuente, con 31 casos (83.78%) (Tabla 1).
Tabla 1 Distribución de los pacientes evaluados según el sexo y tipo de osteogénesis imperfecta
| Tipo | Masculino | Femenino | Total | |
|---|---|---|---|---|
| I | IA | 11 | 9 | 20 |
| IB | 7 | 4 | 11 | |
| II | A | -- | 2 | 2* |
| III | 2 | 1 | 3 | |
| IV | IVB | 1 | -- | 1 |
| Total | 21 (56.76%) | 16 (43.24%) | 37 |
*Fallecidos.
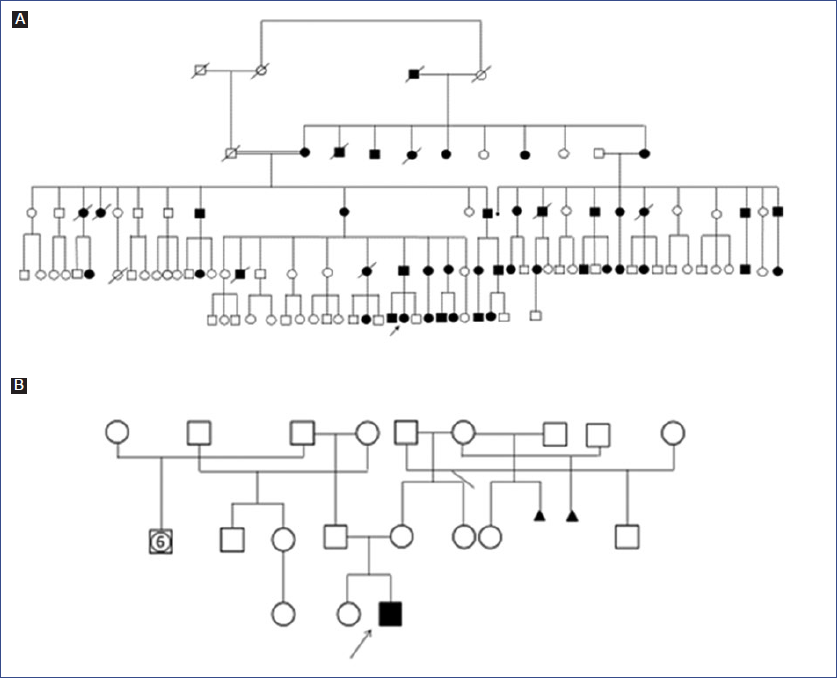
Figura 1 A: Genealogía que muestra el patrón de herencia autosómica dominante en el que se ven afectados los miembros de una familia en todas las generaciones. Se observan ambos sexos afectados por igual y la transmisión de varón a varón. La flecha señala a la paciente estudiada. B: La flecha señala el único paciente afectado en la familia.
De forma aislada, el radio del lado derecho fue el hueso que más frecuentemente presentó fractura, y de forma conjunta, el fémur fue el más afectado, según lo referido por los representantes y registrado en la historia clínica de los pacientes (Tabla 2). Por su parte, la presencia de escleras azules fue el hallazgo que se encontró con más frecuencia, en 32 pacientes (86.49%), seguido por la predisposición de hematomas, en 16 pacientes (43.24%) (Tabla 3). No se pudo precisar la presencia de dentinogénesis imperfecta debido al fallecimiento precoz de dos pacientes, que correspondieron a los casos de OI tipo IIA.
Tabla 2 Localización de la fractura según el hueso afectado de los pacientes evaluados con osteogénesis imperfecta
| Localización | Derecho | Izquierdo |
|---|---|---|
| Clavícula | 2 | 3 |
| Húmero | 5 | 5 |
| Radio | 12 | 8 |
| Cúbito | 10 | 8 |
| Huesos de la mano | 4 | 1 |
| Fémur | 10 | 11 |
| Tibia | 9 | 6 |
| Peroné | 4 | 3 |
| Huesos del pie | 2 | 1 |
Tabla 3 Hallazgos clínicos adicionales en los pacientes evaluados con osteogénesis imperfecta
| Hallazgos clínicos | Presente | Ausente | NP/NE |
|---|---|---|---|
| Macrocefalia | 5 | 32 | - |
| Escleras azules | 32 | 5 | - |
| Dentinogénesis | 15 | 20 | 2* |
| Hipoacusia | 2 | 15 | 20 |
| Escoliosis | 11 | 26 | - |
| Hernias | 7 | 30 | - |
| Deformidad | 8 | 29 | - |
| Talla baja | 15 | 22 | - |
| Hiperlaxitud articular | 9 | 26 | 2* |
| Hematomas | 16 | 19 | 2* |
*Comprende los dos casos de osteogénesis imperfecta tipo IIA.
NP/NE: no precisado o no estudiado.
El 62.16% (23 casos) fueron referidos del Servicio de Pediatría, seguidos del 24.32% (9 casos) de los servicios de Ortopedia y Traumatología y del 13.51% (5 casos) de Endocrinología. En cuanto a su origen, 26 pacientes provenían del estado de Mérida (70.27%) y 5 del estado de Táchira (13.51%) (Tabla 4). Además, 31 individuos fueron procedentes del medio urbano (83.78%).
Discusión
La OI es un trastorno hereditario del tejido conectivo causado predominantemente por mutaciones heterocigotas en cualquiera de los dos genes que codifican para colágeno tipo I (COL1A1 o COL1A2) en más del 90% de los casos8,9,11-13. No se observa diferencia en la prevalencia entre los sexos13, y los individuos presentan una amplia variabilidad fenotípica, que varía en gravedad desde formas clínicas leves a letalidad perinatal4,9. La serie de casos presentada muestra las diferentes frecuencias en los tipos de OI, y coincide con lo documentado en la literatura, donde el tipo I es el más común. Por otra parte, la mayor presencia en el sexo masculino reportada en este estudio puede deberse a que estos pacientes están más expuestos a la actividad física, lo que puede influir en el motivo de consulta.
La clasificación de Sillence divide la OI en función de la gravedad y la progresión de los síntomas: no deformantes leves (tipo I), letales perinatales (tipo II), graves progresivamente deformantes (tipo III) y moderados (tipo IV)8,9,14. Un análisis cuidadoso del patrón de herencia y el fenotipo clínico puede ayudar a guiar las pruebas genéticas cuando están disponibles9. Los avances en genética molecular han identificado genes adicionales que causan la OI, lo que ha complicado su clasificación8.
Una nomenclatura empleada para categorizar el tipo de OI es la establecida por Bonafe, et al.15, donde la OI se encuentra incluida dentro del grupo 25 y describe al fenotipo de forma no deformante (tipo I), perinatal letal (tipo II), progresivamente deformante (tipo III), de gravedad moderada (tipo IV) y OI con calcificación en la membrana interósea y callo hipertrófico (tipo V)8,15. Además, se menciona que se debe utilizar una clasificación híbrida del gen causal, junto con el fenotipo clínico, para evitar la ambigüedad8. Aunque no se disponga de estudios moleculares, una evaluación clínica interdisciplinaria puede orientar el diagnóstico y la terapéutica.
La OI tipo I se origina de un defecto cuantitativo en la producción de colágeno tipo I debido a un alelo silenciado del gen COL1A19 que causa haploinsuficiencia8. Generalmente, surge como resultado de un codón de parada prematuro dentro del gen, por lo que estas mutaciones conducen a la producción de la mitad de la cantidad normal de la proteína. Por otra parte, las OI tipos II, III y IV son el resultado de defectos estructurales, ocasionados por la sustitución del aminoácido glicina, que interrumpen el triple ensamblaje helicoidal del colágeno, y afectan su función e interacciones en la matriz extracelular8. Por lo tanto, surgen como defectos cualitativos y se presentan en los fenotipos más graves13.
Entre los hallazgos clínicos asociados con la OI se encuentran la macrocefalia e hidrocefalia. Por su parte, la invaginación basilar es infrecuente, pero fatal; los síntomas incluyen cefalea, parálisis de nervios craneales inferiores, nistagmos, disfagia, cuadriparesia y ataxia9. La cifoscoliosis cervical grave9,16, aunque infrecuente, puede causar compresión de la médula espinal, cuyos síntomas incluyen trastornos sensoriales o motores de las extremidades8, así como obstrucción pulmonar y compresión de órganos14,17. La hipoacusia conductiva y neurosensorial9,16 es generalmente progresiva y se presenta en el 5% de los niños con OI. Las escleras azules se describen particularmente en la OI de tipo I; el color puede variar, y generalmente es más oscuro en la infancia9. Por su parte, la dentinogénesis imperfecta9,16 se presenta en el 28% y se caracteriza por dientes opalescentes debido a una mayor proporción de esmalte transparente y una dentina opaca. La dentición primaria es más afectada que la permanente; las maloclusiones y la erupción dental retardada ocurren hasta en el 60-80%9 y contribuyen al aumento del riesgo de caries16. La hiperlaxitud articular es común y puede provocar la dislocación de las articulaciones9,16 y disminuir la elasticidad de la piel, lo que facilita la aparición de hernias y un aumento de la fragilidad capilar que ocasiona hematomas9. Los pacientes pueden presentar talla baja desproporcionada16, hipercalciuria hasta en el 36% de los casos y mayor riesgo de litiasis renal9. En adultos, la dilatación de la raíz aórtica, seguida del prolapso de la válvula mitral, es la manifestación valvular más frecuente9,16,17.
Después de la presencia de fracturas, las escleras azules y la predisposición a presentar hematomas fueron los hallazgos adicionales más frecuentes en los pacientes estudiados. Ante la pleiotropía de esta entidad, la evaluación clínica debe ser exhaustiva, incluso antes de que las complicaciones puedan evidenciarse.
Los niños que presentan lesión no accidental constituyen el diagnóstico diferencial más importante en la OI. El patrón de fracturas ocurre en costillas posteriores y metafisarias asociadas con hemorragia retiniana, que puede diferenciar la lesión no accidental de la OI. Las fracturas de costillas se pueden encontrar hasta en el 22% de los individuos con OI. Por otra parte, la osteoporosis juvenil idiopática también puede presentarse con historia de fracturas vertebrales frecuentes asociada con dolor óseo antes del inicio de la pubertad. Se deben considerar las causas secundarias de osteoporosis, como la malabsorción, uso de glucocorticoides, deficiencias de hormonas, leucemia linfoblástica aguda e inmovilidad, las cuales deben ser capaces de diferenciarse con base en la historia clínica y las investigaciones de laboratorio. Finalmente, otros trastornos esqueléticos que se asemejan a la OI también pueden considerarse en el diagnóstico; tal es el caso del síndrome de osteoporosis-pseudoglioma, osteoporosis idiopática juvenil9, raquitismo, hipofosfatemia ligada al cromosoma X16 , Ehlers-Danlos8, hiposfosfatasia9,16 e hiperfosfatasia idiopática9.
Los objetivos del tratamiento van encaminados a solucionar los problemas más frecuentes que se evidencian en la OI, y buscan aumentar la masa ósea, disminuir el número de fracturas, evitar la talla baja y lograr la normalidad en la vida cotidiana18. Las diferentes opciones disponibles del tratamiento deben ser individualizadas en cada caso y se requiere igualmente de la evaluación de un equipo médico interdisciplinario.
La OI representa el principal motivo de consulta de alteración en el sistema esquelético en la UGM-ULA.
En esta serie de casos de OI, se resalta la amplia forma clínica de presentación de esta enfermedad, por lo que su evaluación debe ser individual e interdisciplinaria, incluso en los diferentes individuos afectados de una misma familia. Además de brindar la atención médica adecuada, se podrá brindar el oportuno asesoramiento genético familiar a través de su seguimiento y estudio.











 nueva página del texto (beta)
nueva página del texto (beta)


