Introducción
Los nevos melanocíticos (NM) son hamartomas constituidos por la proliferación anormal de melanocitos que se agrupan en nidos o tecas en la epidermis, dermis o, de manera infrecuente, en el tejido celular subcutáneo, tejido graso, fascia o músculo. Pueden clasificarse como congénitos si están presentes desde el nacimiento o en los primeros meses de vida, o como adquiridos si aparecen después de los 6 meses de edad. Los nevos congénitos representan solamente el 1% de los NM y se clasifican, a su vez, de acuerdo con su tamaño, en pequeños, medianos, grandes y gigantes1-4.
Los NM congénitos gigantes (NMCG) se definen como lesiones melanocíticas que alcanzarán un diámetro ≥ 20 cm en la edad adulta, y afectan aproximadamente del 15 al 37% de la superficie corporal total. Se estima que su incidencia es de 1:20,000 nacidos vivos, y es más frecuente en mujeres. A pesar de su baja prevalencia, la importancia de los NMCG radica en prevenir o tratar las complicaciones con las que se encuentran asociados, principalmente el desarrollo de melanoma, la afectación del sistema nervioso central y un impacto psicológico y social desfavorable, tanto en el paciente como en su familia3-7.
Fisiopatología
Se desconoce el mecanismo exacto que conduce a la proliferación de los NMCG. Sin embargo, se sabe que durante la embriogénesis, a partir de la quinta semana de gestación, ocurre una alteración en las vías de señalización de los melanoblastos provenientes de la cresta neural, lo que provoca una migración o diferenciación anormal de estas células, las cuales terminarán agrupándose en nidos o tecas en la epidermis, dermis u otros tejidos3,7,8.
Por otra parte, desde un punto de vista molecular, existe la teoría de que el desarrollo de los melanocitos es parcialmente controlado por el protooncogén c-MET y, en menor medida, por c-KIT, que codifican para proteínas transmembranales que actúan como receptores con actividad de tirosina cinasa y que se expresan en las células epiteliales de la epidermis y dermis, incluyendo los melanocitos. El factor de crecimiento de hepatocitos (HGF) es el ligando exclusivo de c-MET que, al unirse a su receptor, provoca su autofosforilación e induce la activación simultánea de dos vías de señalización: la vía de las MAP cinasas (MAPK/ERK) y la vía de la fosfatidilinositol 3-cinasa (PI3K). El resultado final de la activación de MAPK/ERK es la proliferación celular, mientras que, al inhibir la apoptosis, el resultado de la vía de PI3K es la supervivencia y la capacidad de invasión de la célula epitelial. Por su parte c-KIT, al unirse con el factor de células madre a través de su actividad de tirosina cinasa, también influye en el desarrollo y diferenciación de los melanocitos. Ambos protooncogenes pueden encontrarse sobreexpresados en los pacientes con NMCG, además de que el incremento en la producción de HGF confiere un riesgo adicional para el desarrollo de melanoma en estos pacientes3,9.
Finalmente, se ha demostrado que, además, existe susceptibilidad genética en los pacientes que presentan NMCG. La mutación más común que se ha identificado es la del codón NRAS Q61, presente hasta en el 80% de los casos. De igual manera, aunque con menor frecuencia, puede existir mutación de BRAF V600. El gen BRAF es activado por las proteínas de la familia RAS, e inicia la cascada de señalización MAPK, que fomenta la progresión del ciclo celular y la diferenciación celular. Además, NRAS está implicado en el crecimiento, supervivencia y diferenciación celular. Se ha observado una prevalencia aumentada de mutaciones en los genes BRAF y NRAS en melanomas y NMC, lo que ha cobrado recientemente una gran importancia en el abordaje diagnóstico de estos pacientes, ya que los inhibidores de BRAF podrían representar una nueva alternativa terapéutica. Ciertos estudios apuntan a que existe una relación entre la expresión del gen BRAF y el tamaño de los NMC, que es mayor en el caso de nevos de menor tamaño. Sin embargo, aún deben realizarse más investigaciones para poder asegurar dicha relación7,10,11.
Cuadro clínico
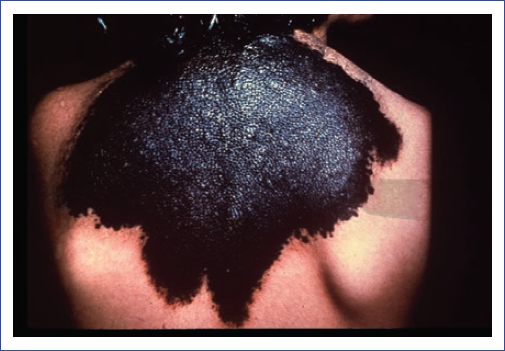
Al momento del nacimiento, los NMCG se presentan como máculas o lesiones elevadas de un tono marrón claro, con la presencia de folículos pilosos (pero sin pelo en su interior). En la edad adulta, cambian sus características morfológicas a lesiones de bordes bien definidos, cuyo color oscila entre marrón oscuro, azul y negro, y con una superficie irregular, lisa o queratósica, con o sin presencia de vellos terminales largos y gruesos, los cuales suelen alinearse en forma de remolino en aquellos pacientes con lesiones en la línea media3,4,12.
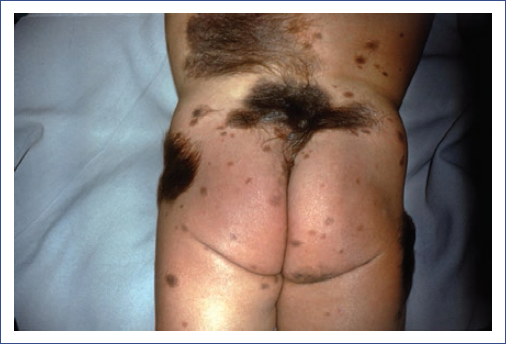
Los NMCG pueden afectar cualquier área anatómica, incluyendo la piel cabelluda. La localización más frecuente es el tronco (47%), seguido de las extremidades (30%) y la cabeza (22%). Las lesiones pueden ser únicas o, más frecuentemente, múltiples. Hasta el 78% de los pacientes presentan lesiones satelitales (NMC pequeños), que cuando son numerosos (por lo general más de 20), aumentan el riesgo de melanoma o melanosis neurocutánea (MNC)2,6,10,13.
Con el tiempo, principalmente durante la infancia, pueden ocurrir cambios en los nevos, que representan un reto diagnóstico y deberán alertar al médico sobre posibles características sugestivas de malignidad. Gran parte de los individuos presentan características atípicas de las lesiones, pero se deberá prestar mayor atención a la aparición de erosiones, placas, lesiones de aspecto nodular y cambios en la coloración. Por su parte, la despigmentación del nevo o un halo de despigmentación pueden presentarse como un evento aislado, lo que ocasionalmente lleva a la involución de la lesión o se asocia con el desarrollo de vitíligo14-16.
En la mayoría de los pacientes, los NMCG suelen ser asintomáticos. Sin embargo, en ocasiones, pueden acompañarse de prurito, xerosis y alteraciones en la sudoración. Estos síntomas son secundarios a una pérdida de la arquitectura normal de la piel y a la disfunción de sus estructuras anexas, lo que predispone a una mayor fragilidad, con lo que aumenta el riesgo de erosión o ulceración3,7.
Además de las repercusiones fisiológicas, esta entidad afecta la calidad de vida y tiene un gran impacto psicológico en los pacientes al provocar depresión y aislamiento social por la apariencia estética que confiere, así como ansiedad y temor con respecto a la posibilidad de desarrollar cáncer3,10.
Clasificación
Se han propuesto varias clasificaciones para los NM, aunque se considera que el tamaño del nevo es el determinante principal en la mayoría de ellas. Una de las clasificaciones más utilizadas ha sido la de Koft, et al., quienes agrupan los nevos en pequeños (< 1.5 cm), medianos (1.5-19.9 cm) y gigantes (≥ 20 cm)8,17.
En el 2013, Krengel, et al. enfatizaron que el tamaño no es el único factor para un mal pronóstico, tanto para el desarrollo de entidades asociadas (melanoma y MNC) como para los resultados cosméticos del tratamiento. Por ello, dichos autores propusieron una nueva clasificación para los NMC en la que se incluyen otros aspectos además del tamaño, lo que resulta una manera más completa para evaluar el riesgo de melanoma en los pacientes con NMCG (Tabla 1). Dicha clasificación se emplea cada vez con mayor frecuencia en la consulta dermatológica; sin embargo, aún no es aceptada universalmente a pesar de haber mostrado una adecuada correlación con el riesgo de malignización de las lesiones13.
Tabla 1 Clasificación de Krengel para nevos melanocíticos congénitos (NMC) (2013)
| Tamaño estimado en la edad adulta | |
|---|---|
| Pequeño | < 1.5 cm |
| Mediano M1 M2 |
1.5‑10 cm 10‑20 cm |
| Grande L1 L2 |
20‑30 cm 30‑40 cm |
| Gigante G1 G2 |
40‑60 cm > 60 cm |
| Múltiples medianos | ≥ 3 NMC sin que exista predominio de alguno |
| Localización Cabeza Tronco Extremidades |
Cara y
piel cabelluda Cuello, hombros, tórax anterior, abdomen, espalda, flancos, glúteos y región genital Miembros torácicos, manos, miembros pélvicos y pies |
| Nevos
satélite S0 S1 S2 S3 |
No presenta < 20 20‑50 > 50 |
| Rugosidad R0 R1 R2 |
No presenta Moderada Marcada |
| Heterogeneidad del color C0 C1 C2 |
No presenta Moderada Marcada |
| Nódulos N0 N1 N2 |
No presenta Dispersos Múltiples nódulos dérmicos o subcutáneos |
| Hipertricosis H0 H1 H2 |
No presenta Moderada Marcada |
Modificado de Price, et al.13
Las clasificaciones de los NMCG están diseñadas para la edad adulta, por lo que, en el caso de los neonatos o infantes, se debe estimar el tamaño que alcanzará el nevo al finalizar la etapa de crecimiento. Para esto, al momento del nacimiento se mide el diámetro máximo del nevo y se multiplica por un factor constante: por 1.7 si la localización del nevo es en la cabeza; por 2.8 cuando es en el cuello, tronco, glúteos y miembros superiores; y por 3.3 si se encuentra en los miembros inferiores5,13,15,18.
Como se mencionó anteriormente, la localización anatómica de los nevos representa por sí misma un factor pronóstico, por lo que, a su vez, los NMCG se pueden clasificar de acuerdo con su distribución. Martins, et al.12,19 han descrito un patrón denominado «6B», según el cual los nevos pueden tener la siguiente distribución:
- En bolero o chaleco. Involucra la parte superior de la espalda, incluyendo el cuello y los hombros (Fig. 1).
- Espalda. Involucra la espalda, sin afectar los hombros y los glúteos, y suele ser de forma redonda.
- En bañador (bathing trunk). Involucra principalmente la región genital y los glúteos, pero puede abarcar los miembros inferiores, así como el tórax anterior y posterior, sin afectar los hombros ni el cuello (Fig. 2).
- Pecho/abdomen. lnvolucra el tórax anterior y el abdomen. No se mezcla con la distribución en bolero o en bañador.
- Extremidad. Involucra únicamente una extremidad, y no hay afección de los hombros ni de la región genital.
- Cuerpo. Involucra casi la totalidad de la superficie corporal. En la mayoría de los casos es una mezcla de los patrones en bolero y en bañador.
El patrón que se observa con más frecuencia es el de bañador, seguido en orden decreciente por el patrón en bolero, espalda, pecho/abdomen, extremidad y cuerpo. El patrón en bañador es el que posee el mayor riesgo para el desarrollo de melanoma o MNC12,19.
Diagnóstico
El diagnóstico del NMCG es clínico; sin embargo, la dermatoscopia y la histología son herramientas complementarias. Pelin, et al. realizaron uno de los estudios más grandes sobre las características dermatoscópicas de los NM, y observaron que el 100% de los pacientes con NMCG tenían una pigmentación atípica, y más del 50%, hipertricosis. El patrón en empedrado fue el más prevalente, hasta en el 28%, seguido por un patrón globular, retículo-globular y retículo-parchado11,20,21.
Por otra parte, histológicamente, los NMCG se caracterizan por la presencia de melanocitos agrupados en forma de nidos en la epidermis, que alcanzan ocasionalmente la hipodermis, músculo, hueso y, con menor frecuencia, estructuras vasculares o nervios de la piel. También hay la hiperplasia melanocítica intraepidérmica y de la unión dermoepidérmica con displasias y anomalías nucleares, así como hiperplasia y alargamiento de las crestas epidérmicas debido al aumento en el número de melanocitos3,8,20.
Complicaciones
Los NMCG se asocian con múltiples complicaciones, entre las que se encuentran principalmente el melanoma y la MNC. Sin embargo, también puede presentar asociación con otros tumores, como el rabdomiosarcoma, liposarcoma, neurosarcoma, entre otros1,5,22.
La presencia de NMCG, a pesar de su carácter benigno, representa un factor de riesgo importante para el desarrollo de melanoma, principalmente en las primeras dos décadas de la vida, con un riesgo relativo de malignización de 52-1,000 veces mayor que el de la población general, y una edad media de presentación a los 14 años. El tamaño (≥ 20 cm), la presencia de nevos satélite, la hipertricosis, el aspecto nodular, la rugosidad o el color heterogéneo son características que por sí mismas aumentan el riesgo de malignidad, que se exacerba al existir antecedentes familiares de melanoma, exposición prolongada a la luz ultravioleta o inmunosupresión8,13,23,24.
Del 5 al 10% de los pacientes con NMCG desarrollan melanoma, que suele ser cutáneo, aunque, de forma excepcional, también puede presentarse en su variante extracutánea. Cuando este debuta en la edad adulta, se asocia con factores de peor pronóstico, como un espesor de Breslow > 2 mm, la presencia de ulceración y metástasis. A pesar de lo anterior, se ha observado que, sin importar la etapa clínica del melanoma que presente el paciente adulto con NMCG, su sobrevida será similar a la de los pacientes con melanoma y sin antecedente de NMCG18,25,26.
Un aspecto importante a considerar en estos pacientes es que el nevo melanocítico no determina la localización del melanoma, ya que se estima que solamente el 66% de los casos de melanoma se asientan sobre el propio nevo; el resto se localizan fuera de este o, incluso, sobre un área en la que había sido extirpado previamente un nevo, de manera parcial o total. Por ello, se desconoce el verdadero beneficio de la escisión quirúrgica del nevo de manera profiláctica, y la indicación terapéutica sigue siendo controversial8,27.
Un problema frecuente en los pacientes con NMCG es el sobrediagnóstico de lesiones malignas, ya que la mayoría de ellos presentará, en algún momento, características atípicas del nevo, lo que en ocasiones implica un reto diagnóstico para el médico. Un ejemplo de ello son las lesiones proliferativas, que son de carácter benigno y representan uno de los principales diagnósticos diferenciales del melanoma, pues comparten algunas características como el rápido crecimiento, el cambio en el color o la forma y la ulceración. En la histología, ambos presentan una alta tasa mitótica, con mitosis atípicas, atipia nuclear y necrosis; sin embargo, una cuenta mitótica > 5 mitosis/mm2 y un cambio parcial en el número de copias de los cromosomas, determinado por hibridación fluorescente in situ (FISH, por sus siglas en inglés fluorescence in situ hybridization), aumenta la posibilidad diagnóstica de melanoma28-30.
Por otra parte, la MNC es un síndrome que puede encontrarse en los pacientes con NMCG. Se caracteriza por la proliferación de melanocitos en el sistema nervioso central, principalmente en las leptomeninges, y se presenta con mayor frecuencia en pacientes con nevos > 20 cm localizados en los planos posteriores de la cabeza, el cuello o la columna vertebral o en aquellos pacientes con múltiples nevos satélite. La MNC se encuentra asociada con la malformación de Dandy-Walker, quistes de la fosa posterior, defectos vertebrales y síndrome de la médula espinal anclada3,27,31.
La incidencia de la MNC es baja y solamente del 1.5-11% de los pacientes son sintomáticos, con un amplio espectro de manifestaciones neurológicas que se pueden presentar, aunque se suele encontrar un aumento de la presión intracraneal, hidrocefalia, déficit motor y crisis convulsivas antes de los 2 años de edad en la mayoría de los pacientes. Además, en caso de existir afección de la médula espinal, se puede presentar mielopatía, radiculopatía o disfunción de esfínteres. El diagnóstico de MNC puede sospecharse clínicamente; sin embargo, el estándar de oro es la biopsia. No existe un tratamiento definitivo, y el pronóstico de estos pacientes es pobre, con una mortalidad del 50% a los 3 años de haber realizado el diagnóstico12,18,31.
Tratamiento
No existe un tratamiento específico o estandarizado para los NMCG, por lo que el manejo de estos pacientes es controversial frente a las distintas opciones terapéuticas. En un estudio realizado por Wramp, et al. se evidenció que, hasta en el 50% de los casos, la prevención del melanoma es el determinante principal para guiar el tratamiento, seguido de la cuestión estética en el 14%, cuando también deben considerarse otros factores en el manejo individualizado de estos pacientes, como la edad, el tamaño de la lesión, la localización, profundidad, síntomas, factores de riesgo para malignización y consecuencias psicológicas. Con base en lo anterior, el objetivo del tratamiento será lograr un equilibrio entre la mejoría cosmética, la disminución del riesgo de malignidad y la preservación de la función32-34.
El tratamiento del NMCG puede ser quirúrgico o conservador, dependiendo de la dificultad de la ejecución de la escisión, así como de los riesgos y beneficios que implique dicho procedimiento. La principal ventaja del tratamiento quirúrgico es la disminución en el riesgo de malignización de la propia lesión en sí. No obstante, no disminuye el riesgo de que el melanoma se presente fuera de la lesión o de forma extracutánea. Por otra parte, una de las grandes desventajas de los tratamientos conservadores es que no se eliminan las células névicas de las capas profundas de la piel. Por el contrario, quedan escondidas del dermatoscopio, dificultando así el seguimiento de la lesión a largo plazo para la detección de características sugestivas de malignidad11,21,33,35-37.
En la Tabla 2 se discuten algunos de los aspectos más relevantes de las distintas técnicas terapéuticas que se pueden emplear en los pacientes con NMCG3,11,21,33,35-37.
Tabla 2 Principales indicaciones y consideraciones de las distintas opciones terapéuticas de los nevos melanocíticos congénitos gigantes3,11,21,33,35,37
| Tratamiento | Indicaciones | Principales complicaciones/ Otras consideraciones |
|---|---|---|
| Quirúrgico Escisión parcial o completa Expansores de piel Injertos de piel |
-
Absoluta: escisión de una lesión maligna - Relativa: disminuir el riesgo de malignización y mejorar el aspecto estético - Mejorar el aspecto estético y disminuir el riesgo de malignidad - Se utilizan posterior a la escisión parcial o completa de la lesión - Se utilizan principalmente en lesiones localizadas en cabeza y cuello |
-
Cicatrices hipertróficas o queloides - No desaparece de manera completa el riesgo de melanoma o MNC - Puede ser necesario realizar múltiples intervenciones quirúrgicas - Infección, seroma, rechazo del injerto, dehiscencia de las suturas y cicatrices queloides - Disminuyen el número de intervenciones quirúrgicas |
| Conservador Curetaje Dermoabrasión Láser (Q‑switched Nd‑YAG (por sus siglas en inglés, neodymium‑doped yttrium aluminium garnet), CO2, Ruby Peeling químico |
- Mejorar
el aspecto estético - Pacientes con contraindicaciones quirúrgicas - Se pueden realizar a edades más tempranas que algunos tratamientos quirúrgicos - Mejorar aspecto estético - Pacientes con contraindicaciones quirúrgicas - Mejorar aspecto estético - Pacientes con contraindicaciones quirúrgicas - Se utiliza principalmente en nevos con pigmentación clara y localización en la cara |
- Sangrado
abundante, infección y repigmentación - Dificultan el seguimiento de la lesión a largo plazo a través de la dermatoscopia - Infección, cicatrices y repigmentación - Requiere de múltiples sesiones - Suele utilizarse más como terapia coadyuvante que como monoterapia - Mejora la hipertricosis - Infección, cicatrices y repigmentación - No mejora la hipertricosis |
MNC: melanosis neurocutánea.
En un estudio realizado por Wramp, et al. se evidenció que los injertos o los expansores de piel fueron los tratamientos que proporcionaron mayor satisfacción a los pacientes y familiares, mientras que la mayoría de los pacientes se mostró inconforme con las escisiones parciales o la dermoabrasión. Lo anterior puede deberse a que los pacientes no reciben suficiente información previa al tratamiento, lo que genera expectativas que no son reales, además de que se desconocen las posibles complicaciones de cada opción terapéutica, principalmente el riesgo de repigmentación y la mala cicatrización a la que conllevan muchos de estos tratamientos.
A pesar de que los tratamientos invasivos suelen tener mejores resultados, siempre hay el riesgo de complicaciones o recidivas. Por ello, algunos autores proponen un manejo conservador del NMCG si el paciente así lo desea y si no existen anormalidades clínicas o dermatoscópicas de la lesión34,35.
Seguimiento y control
Los pacientes con NMCG requerirán de un seguimiento a largo plazo, el cual se recomienda que sea en intervalos de 6 a12 meses, utilizando la dermatoscopia o microscopia confocal. Así mismo, el seguimiento fotográfico suele ser de gran utilidad15,20. En las consultas de control, el dermatólogo no solo debe vigilar el tamaño y características del NMCG, sino que también debe buscar intencionadamente si existen nuevas lesiones satélite, síntomas de MNC o afección psicológica, además de mantener informados y educar continuamente a los familiares y al paciente (según su edad) sobre los riesgos que implica esta entidad y la importancia de acudir a las consultas de control y seguimiento5.
En algunas ocasiones, el seguimiento a largo plazo de los pacientes con NMCG puede ser difícil, por la tendencia de presentar irregularidades, cambios en la coloración e hipertricosis. Durante la edad pediátrica y la adolescencia, dichos cambios suelen ser normales y frecuentes en la historia natural del nevo, mientras que, de presentarse en la edad adulta, son sugestivos de malignidad. Sin embargo, sin importar la edad de presentación, ante la sospecha de malignidad siempre estará indicado el seguimiento histológico a través de la biopsia cutánea11,38,39.
A pesar de que el NMCG es una entidad infrecuente, es importante que los pediatras y dermatólogos estén familiarizados con las características morfológicas propias de esta lesión, los cambios que puede sufrir y las complicaciones a las que se encuentra asociada, con la finalidad de realizar un abordaje diagnóstico y terapéutico adecuado que pueda cambiar el pronóstico del paciente.
Los NMCG se asocian a un riesgo elevado de desarrollar melanosis neurocutánea y melanoma, entidades con alta mortalidad. Por ello, es necesario educar a la familia y al paciente sobre la importancia de un seguimiento estricto y a largo plazo, con la finalidad de detectar de manera temprana y oportuna las posibles complicaciones coexistentes y, con ello, disminuir la morbimortalidad del paciente. Además, es importante considerar las repercusiones psicológicas y sociales que conlleva este padecimiento, para brindar un tratamiento multidisciplinario que impacte favorablemente en la calidad de vida de los individuos que lo padecen.











 text new page (beta)
text new page (beta)