Introducción
Los pacientes en tratamiento por cáncer padecen una serie de efectos celulares, principalmente en las células con alta tasa de replicación como las de la médula ósea, folículos pilosos y cavidad oral1. El daño directo de la terapia citotóxica hacia los tejidos orales produce una complicación frecuente denominada mucositis orofaríngea (MO)2,3, que se manifiesta como eritema y edema en la mucosa hasta formar úlceras orales4,5 (Fig. 1). La MO se presenta generalmente de 3 a 5 días después de iniciar la quimioterapia y alcanza su máxima intensidad entre los días 7 y 10, cerca del conteo más bajo de neutrófilos. En el caso de la radiación de cabeza y cuello se presenta aproximadamente al final de la primera semana6-8. Los pacientes de trasplante de células madre hematopoyéticas (TCMH) refieren la MO como una de las complicaciones más dolorosas y debilitantes9. La morbilidad en pacientes por MO grave se asocia con dolor, a veces intratable y que necesita de analgesia narcótica, y con ingesta insuficiente de alimentos y líquidos que conlleva estados de desnutrición y deshidratación con requerimiento de nutrición parenteral, lo que da como resultado cambios psicológicos y el compromiso del tratamiento del cáncer, y que puede reducir significativamente la calidad de vida (CV) del paciente5,9,10. No todos los pacientes en tratamiento con quimioterapia desarrollan MO, por lo que se han descrito factores de riesgo que pueden incrementar su desarrollo. Entre ellos destacan la edad, debido a la velocidad de la mitosis epitelial9,11 y a la presencia de más receptores para el factor de crecimiento epidérmico en el epitelio8,12, el tipo de neoplasia hematológica, la condición oral pretratamiento, el grado de neutropenia y la desnutrición. La frecuencia de complicaciones orales se presenta hasta en el 85% de los pacientes con dosis intensas de quimioterapia y radioterapia13.
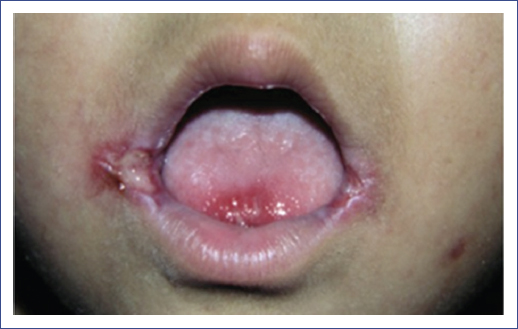
Figura 1 Paciente con mucositis orofaríngea grado 2 en las comisuras y la mucosa interna de los labios y la punta de la lengua.
La CV relacionada con la salud se define como un constructo multidimensional que integra la percepción del paciente ante el impacto de la enfermedad y su tratamiento, así como su funcionamiento en diversos aspectos de la vida, incluyendo las áreas físicas, psicológicas y de la salud social14. La medición de la CV se basa en elementos subjetivos que requieren de instrumentos de evaluación válidos, reproducibles y confiables15. Cuando son desarrollados en otros países con otro idioma o con el mismo, no pueden ser utilizados en nuestra población sin antes llevar un proceso de traducción, adaptación cultural y validación16.
Existen instrumentos para valorar la CV del paciente con MO que evalúan la gravedad de los síntomas, el dolor, los sentimientos, la limitación física. En conjunto, lo anterior interfiere con funciones de la vida diaria17, por lo que el instrumento Oropharyngeal Mucositis-Specific Quality-of-Life (OMQoL)18 evalúa el impacto global de la MO en la CV desde la perspectiva de los pacientes. El propósito de este estudio fue traducir, adaptar culturalmente y validar el OMQoL en niños mexicanos en tratamiento por cáncer.
Métodos
Se trata de un estudio de validación, transversal, multicéntrico, realizado en cuatro hospitales pediátricos en México entre marzo del 2015 y julio del 2016. El tamaño de muestra calculado fue de acuerdo al coeficiente Alfa de Cronbach (poder: 0.80, α: 0.05, consistencia interna: 0.70, K: 30) a través del programa PASS Sample Size 13. Se incluyeron pacientes de manera consecutiva de 8 a 16 años de edad, con diagnóstico de neoplasia hematológica o de tumor sólido, tratados con quimioterapia y radioterapia o trasplante de células madre hematopoyéticas (TCMH) con diversos grados de MO y que firmaron la carta de consentimiento y asentimiento informados. Se excluyeron aquellos pacientes cuyos padres, tutores o ellos mismos no tuvieran la capacidad para leer y contestar de manera autónoma el OMQoL. La investigación fue aprobada por los comités de ética e investigación de todas las instituciones participantes.
El OMQoL se obtuvo de manera directa de la Dra. Karis Cheng, autora original. El instrumento tiene 31 ítems que involucran cuatro dimensiones (sintomatología, alimentación, función social y sintomatología a la deglución) para estimar la CV. A cada ítem se le asigna una puntuación de 1 a 4 que describe desde «nada» a «mucho», con relación a si el encuestado ha tenido problemas durante los 3 días anteriores. Todas las puntuaciones se anotan de forma inversa (ejemplo, 1 = 4, 2 = 3, 3 = 2 y 4 = 1). Las puntuaciones de las subescalas se transforman linealmente a una escala de 0 a 100 ([total de las puntuaciones brutas de cada ítem de la subescala/puntaje bruto máximo posible de los ítems totales de la subescala] x 100). El puntaje más alto indica una adecuada CV. El OMQoL en inglés presenta una adecuada confiablidad (Alfa de Cronbach > 0.90), validez convergente con la escala para MO de la Organización Mundial de la Salud (OMS) (r = −0.724 a −0.971; p<0.01) y validez concurrente con la versión china del cuestionario de calidad de vida de la Organización Europea para la Investigación y Tratamiento del Cáncer, el European Organization for Research and Therapy of Cancer Quality of Life Questionnaire−30, Chinese version (EORTC QLQ-C30 [Ch]) (r = 0.450-0.724; p<0.01)18,19.
En este estudio, la MO fue evaluada con la escala para MO de la OMS22,20 y la Oral Mucositis Assessment Scale (OMAS), la cual mide el eritema (0: ninguno, 1: medio/moderado y 2: severo) y la ulceración o pseudomembrana (0: ninguno, 1: < 1 cm2, 2: 1-3 cm2 y 3: > 3 cm2) en nueve sitios diferentes de la cavidad bucal21. Las evaluaciones orales estuvieron a cargo de tres estomatólogas pediatras con previa estandarización interobservador (kappa = 0.72). Posteriormente, los participantes completaron el instrumento Pediatric Quality of Life-3 (PedsQL-3) modulo cáncer (versión de 8-12 y de 13-18 años de edad), adaptado y validado en población mexicana, el cual evalúa la CV de niños con cáncer tomando en cuenta signos y síntomas como dolor, náuseas, ansiedad ante procedimientos, ansiedad ante tratamientos, preocupaciones, problemas cognitivos y apariencia física. Los datos se convierten en los siguientes: 0→100, 1→75, 2→50, 3→25 y 4→0. El resultado es el promedio de la suma lineal de los ítems; el puntaje más alto refleja una adecuada CV22. Se incluyeron en el estudio solo los instrumentos con el 100% de ítems contestados.
Para el análisis estadístico se empleó el paquete estadístico SPSS versión 18 y estadística descriptiva para resumir las características demográficas y clínicas. La validez de contenido y constructo se estimó con el análisis factorial exploratorio. La correlación de Spearman entre el OMQoL y la escala de la OMS, OMAS y el PedsQL-3 módulo cáncer se calculó para estimar la validez convergente. La consistencia interna se calculó con el coeficiente Alfa de Cronbach.
Resultados
Se realizó la traducción directa del OMQoL al español por dos traductores independientes. Posteriormente, las dos versiones se unificaron, integrando una primera versión por medio de un grupo de expertos en medición y CV. Después se realizó la retrotraducción de esta versión en español al inglés por dos traductores diferentes. Se comparó la versión retrotraducida con la original y las diferencias se resolvieron mediante el consenso de expertos.
Se realizó una prueba piloto en 25 pacientes con una media de edad de 10.6 ± 1.5 años, con diferentes diagnósticos oncológicos y grados de MO, con el objetivo de corroborar que los participantes comprendieran el nuevo instrumento. Antes de su aplicación, se dio una plática para mostrar las partes de la cavidad bucal y explicar términos clave como MO y úlceras. A los participantes se les dio a leer el nuevo OMQoL en español y se les pidió que hicieran sugerencias y comentarios con relación al instrumento. El tiempo aproximado de aplicación de la prueba fue de 15 minutos. Los participantes sugirieron modificar ciertos términos que para ellos no eran claros. Las palabras «hinchazón», «me angustia», «enrojecimiento», «sensación de ardor», «tengo dificultad», «nutritivo», «voz más baja y no es clara», «bebo», «sólida» y «tragar» se modificaron a «hinchado», «me preocupa», «rojo», «me arde», «me cuesta trabajo», «sano», «hablo bajito y no me entienden», «tomo», «dura» y «pasarme la comida o saliva». Además, el enunciado «Tengo mi expresión (incluyendo el sonreír a los demás) y comunicación afectada» se cambió por «Mi cara, mi sonrisa y mi plática con los demás no es igual que antes». Debido a las sugerencias y modificaciones, se realizó una segunda prueba piloto en 18 pacientes con características similares, donde la mayoría de los enunciados fueron bien comprendidos. Se conformó la nueva versión del OMQoL en español adaptado para niños mexicanos. En las pruebas pilotos se observó que la mayoría de los niños tenían canalizada una vena en una o ambas manos, por lo que, en estos casos, los niños señalaban la respuesta y el investigador o los padres la circulaban.
Posteriormente, se incluyeron consecutivamente a 193 participantes, con una mediana de edad de 11 años (media 10.91 ± 2.381 y rango 8-16). El 52.3% (101) fueron de sexo femenino, 63 (32.6%) presentaron MO grado 2 y 48 (24.9%), grado 3 (Fig. 1). Las características clínicas se describen en la Tabla 1. Para obtener las características psicométricas del OMQoL en español se calcularon los estadísticos descriptivos para los 31 ítems (Tabla 2). Posteriormente, se probó el poder discriminativo de los ítems, es decir, su capacidad para detectar diferencias en las cantidades del atributo que se está midiendo, lo que, de acuerdo con Magnusson23, puede hacerse al probar que existe una relación sistemática entre los puntajes del ítem y el total de la prueba. Para esto se hizo una comparación de grupos extremos con respecto al total de la prueba (puntajes inferiores al primer cuartil y puntajes superiores al tercer cuartil) con la prueba U de Mann Whitney, misma que se seleccionó debido a que la distribución de los ítems no fue normal. Todos los ítems fueron conservados por discriminar significativamente.
Tabla 1 Características clínicas de los participantes del estudio de validación del OMQoL en español adaptado a niños
| Características | Frecuencia (%) n = 193 |
|---|---|
| Diagnóstico | |
| LAL Pre B | 80 (41.5) |
| LAM | 26 (13.5) |
| Osteosarcoma | 18 (9.3) |
| Linfoma no Hodgkin | 9 (4.7) |
| Rabdomiosarcoma alveolar | 9 (4.7) |
| Sarcoma de Ewing | 8 (4.1) |
| Rabdomiosarcoma embrionario | 4 (2.1) |
| Linfoma linfoblástico de células T | 4 (2.1) |
| LAL Pre T | 4 (2.1) |
| Linfoma de Hodgkin | 3 (1.6) |
| Schwannoma maligno | 2 (1.0) |
| Otros | 26 (13.4) |
| Tratamiento oncológico | |
| Quimioterapia | 176 (91.2) |
| Quimioterapia/Radioterapia | 12 (6.2) |
| TCMH | 3 (1.6) |
| Radioterapia | 2 (1.0) |
| Etapa de tratamiento | |
| Inducción | 50 (25.9) |
| Consolidación | 35 (18.2) |
| Mantenimiento | 25 (13) |
| Primer ciclo | 17 (8.8) |
| Segundo ciclo | 8 (4.1) |
| Tercer ciclo | 7 (3.8) |
| Cuarto ciclo | 11 (5.7) |
| Reinducción | 10 (5.2) |
| Quimioterápicos | |
| MTX | 19 (9.8) |
| MTX-6MP | 13 (6.7) |
| VCT-Doxo-CFM | 12 (6.2) |
| MTX-L-aspar-Dexametasona | 11 (5.7) |
| MTX-VP16-AraC | 9 (4.7) |
| L-aspar | 8 (4.1) |
| VCT-L-aspar-Dauno | 7 (3.6) |
| IFM-Doxo | 6 (3.1) |
| Cisplatino-Doxo | 5 (2.6) |
| MTX-VCT | 5 (2.6) |
| VCT | 5 (2.6) |
| MTX-VP16-CFM | 4 (2.1) |
| Etoposido-CFM | 4 (2.1) |
| VCT-L-aspar | 4 (2.1) |
| Otros | 112 (41.9) |
| Grado de MO (OMS) | |
| Grado 0 | 20 (10.4) |
| Grado 1 | 44 (22.8) |
| Grado 2 | 63 (32.6) |
| Grado 3 | 48 (24.9) |
| Grado 4 | 18 (9.3) |
| Valor de OMAS | Mediana 0.60 (02.5) |
| Tipo de nutrición | |
| Tolera la vía oral | 127 (65.8) |
| Tolera únicamente líquidos | 48 (24.9) |
| Parenteral | 13 (6.7) |
| Enteral | 5 (2.6) |
| Tipo de analgésico | |
| Sin analgésico | 59 (30.5) |
| Analgésico no opioide | 109 (56.5) |
| Analgésico opioide | 25 (13) |
*Los datos se presentan como número, porcentaje, desviación estándar (±) y rango.
AraC: citarabina; CFM: ciclofosfamida; Dauno: daunorrubicina; Doxo: doxorrubicina; IFM: ifosfamida; LAL: leucemia aguda linfoblástica; LAM: leucemia aguda mieloblástica; L-aspar: L-asparginasa; MO: mucositis orofaríngea; MTX: metotexato; OMAS: Oropharingeal Mucositis Assessment Scale; OMS: Organización Mundial de la Salud; TCMH: trasplante de células madre hematopoyéticas; VCT: vincristina; VP16: etopósido; 6MP: 6 mercaptopurina.
Tabla 2 Resultados del análisis de los reactivos del OMQoL-español adaptado a niños
| Reactivos | Media | Desviación estándar | Sesgo |
|---|---|---|---|
| 1. Tengo hinchado dentro de mi boca | 2.98 | 1.005 | −0.691 |
| 2. Tengo úlceras en mi boca | 2.91 | 0.936 | −0.616 |
| 3. El dolor en la boca me preocupa | 2.99 | 1.005 | −0.727 |
| 4. Tengo pus o sangre en mis labios o dentro de mi boca | 3.46 | 0.866 | 1.550 |
| 5. Siento molestia al cepillarme los dientes o enjuagarme la boca | 2.92 | 1.012 | −0.942 |
| 6. El dolor en la boca no me deja dormir | 3.44 | 0.934 | 1.231 |
| 7. Me duele la boca | 2.59 | 1.072 | −1.235 |
| 8. Tengo rojo o me arde dentro de mi boca | 2.73 | 0.980 | −1.030 |
| 9. Me cuesta trabajo abrir mi boca | 3.05 | 1.067 | −0.829 |
| 10. No puedo disfrutar la comida | 2.93 | 1.120 | −1.195 |
| 11. No me gusta comer fuera de mi casa por la molestia en la boca | 2.90 | 1.236 | −1.390 |
| 12. Mi saliva se vuelve pesada o pegajosa y necesito escupir muchas veces | 2.90 | 1.139 | −1.270 |
| 13. Tengo cambios en los sabores | 3.01 | 0.976 | −0.674 |
| 14. La dificultad para comer me preocupa | 2.94 | 1.059 | −0.992 |
| 15. Me tardo más tiempo en comer o beber | 2.67 | 1.096 | −1.284 |
| 16. He bajado de peso | 2.90 | 1.023 | −0.994 |
| 17. He cambiado mi comida | 2.68 | 1.090 | −1.290 |
| 18. Como menos alimentos suaves y duros | 2.67 | 1.082 | −1.268 |
| 19. Me preocupa que coma poco y no sea sano | 2.90 | 1.109 | −1.126 |
| 20. Hablo con voz bajita y no me entienden | 3.08 | 1.082 | −0.827 |
| 21. Tengo dificultad para hablar | 3.52 | 1.092 | −0.799 |
| 22. Necesito usar otras cosas (por ejemplo papel y pluma o señas para hablar con los demás) | 3.52 | 0.884 | 1.586 |
| 23. Me da vergüenza comer con mi familia o amigos | 3.48 | 0.896 | 1.720 |
| 24. La dificultad para hablar me preocupa | 3.22 | 1.014 | −0.209 |
| 25. No quiero hablar con otras personas (ni por teléfono) porque me molesta mi boca | 3.17 | 1.079 | −0.600 |
| 26. Mi cara, mi sonrisa y mi comunicación con los demás no son igual que antes | 2.95 | 1.107 | −1.045 |
| 27. Me duele la garganta | 3.13 | 1.052 | −0.856 |
| 28. Tomo pocos líquidos (por ejemplo, agua, jugo o sopa) | 3.21 | 0.990 | −0.226 |
| 29. Me cuesta trabajo pasarme la comida blanda y dura | 2.98 | 1.082 | −1.028 |
| 30. Siento que me ahogo fácilmente al pasar los líquidos, la comida y la saliva | 3.49 | 0.879 | 1.383 |
| 31. Me cuesta trabajo pasarme la saliva | 3.24 | 0.983 | −0.656 |
OMQoL:Oropharyngeal Mucositis-Specific Quality-of-Life.
Con estos datos se realizó un análisis de consistencia interna, y se obtuvo un Alfa de Cronbach de 0.963, y un análisis de correlación entre los ítems y el total de la suma de los mismos para identificar el tipo de método de extracción de factores y el método de rotación necesaria para los datos obtenidos. Con esta prueba se observó que los datos presentaban correlaciones de medias a altas (≥ 0.60), por lo que se eligió el método de extracción de factores de ejes principales y el método de rotación oblicua Promax24.
Los resultados mostraron un valor de adecuación de la muestra Kaiser-Meyer-Olkin de 0.952 y una prueba de esfericidad de Barlett significativa (p ≤ 0.001), lo que indica un excelente grado de relación conjunta de las variables, y ello es apropiado para realizar un análisis factorial (Tabla 3). Se eliminaron dos ítems (18 y 21 con cargas factoriales de 1.003 y 1.000, respectivamente) por ser casos Heywood (dado que la solución no es interpretable por tener comunalidades ≥ 1 y debido a la imposibilidad de tener más del 100% de varianza)24. De forma similar, se eliminaron los ítems 10, 12,15 y 19 de la dimensión dieta por presentar cargas factoriales < 0.40 en los cuatro factores25.
Tabla 3 Cargas factoriales de la matriz de componentes rotados del OMQoL-español adaptado a niños
| Elementos | Cargas factoriales | |||
|---|---|---|---|---|
| Factor | ||||
| 1 Función social | 2 Síntomas | 3 Deglución | 4 Dieta | |
| 25. No quiero hablar con otras personas (ni por teléfono) porque me molesta la boca | 0.947 | −0.042 | −0.044 | 0.083 |
| 24. La dificultad para hablar me preocupa | 0.898 | −0.005 | 0.008 | −0.023 |
| 20. Hablo con voz más bajita y no me entienden | 0.847 | −0.164 | 0.076 | 0.108 |
| 22. Necesito usar otras cosas (por ejemplo papel y pluma o señas) para poder comunicarme con los demás | 0.844 | −0.073 | 0.017 | 0.033 |
| 23 Me da vergüenza comer con mi familia o amigos | 0.694 | 0.068 | 0.094 | −0.300 |
| 9. Me cuesta trabajo abrir mi boca | 0. 473 | 0.378 | −0.166 | 0.157 |
| 14. La dificultad para comer me preocupa | 0.470 | 0.370 | −0.060 | 0.132 |
| 11. No me gusta comer fuera de mi casa por las molestias en la boca | 0.427 | 0.226 | 0.077 | 0.020 |
| 26. Mi cara, mi sonrisa y mi comunicación con los demás no son igual que antes | 0.423 | 0.1940 | 0.065 | 0.207 |
| 5. Siento molestia al cepillarme los dientes o enjuagarme la boca | −0.187 | 0.848 | −0.053 | 0.046 |
| 2. Tengo úlceras en mi boca | 0.148 | 0.695 | −0.104 | 0.099 |
| 3. El dolor en la boca me preocupa | −0.009 | 0.672 | 0.100 | −0.009 |
| 1. Tengo hinchado dentro de mi boca | 0.040 | 0.566 | 0.162 | −0.012 |
| 8. Tengo rojo o sensación de ardor dentro de mi boca | 0.035 | 0.499 | 0.078 | 0.199 |
| 4. Tengo pus o sangre en mis labios o dentro de mi boca | 0.188 | 0.447 | 0.144 | −0.292 |
| 6. El dolor en la boca no me deja dormir | 0.087 | 0.422 | 0.275 | −0.110 |
| 27. Me duele mi garganta | −0.037 | 0.008 | 0.788 | 0.067 |
| 31. Me cuesta trabajo tragarme la saliva | 0.011 | 0.003 | 0.786 | 0.118 |
| 30. Siento que me ahogo fácilmente al pasar los líquidos, la comida y la saliva | 0.068 | 0.159 | 0.703 | -0.079 |
| 28. Tomo poquitos líquidos (por ejemplo, agua, jugo o sopa) | 0.168 | 0.014 | 0.509 | -0.004 |
| 13. Tengo cambios en los sabores | −0.124 | −0.134 | 0.453 | 0.371 |
| 29. Me cuesta trabajo pasarme la comida (blanda y dura) | 0.228 | 0.131 | 0.451 | 0.086 |
| 7. Me duele la boca | −0.132 | 0.140 | −0.020 | 0.615 |
| 16. He bajado de peso | 0.130 | −0.220 | 0.155 | 0.545 |
| 17. He cambiado mi comida (por ejemplo, el tipo de alimentos, forma y tamaño) | 0.011 | 0.252 | 0.077 | 0.543 |
OMQoL: Oropharyngeal Mucositis-Specific Quality-of-Life.
El análisis factorial exploratorio indicó que la escala se compone de cuatro factores que explican el 56.672% de la varianza con 25 ítems (validez de constructo). Nuevamente se calculó la confiablidad de la nueva versión en español del OMQoL, y se obtuvo un Alfa de Cronbach de 0.954 (IC 95%: 0.941-0.972) para el total de la escala. La correlación entre el OMQoL en español y la escala de la OMS para MO fue significativa (r = −0.720; p < 0.01), al igual que con la escala OMAS (r = −0.689; p<0.01). La correlación con el PedsQL-3 módulo cáncer para niños fue moderada pero significativa (r = 0.426; p < 0.01), y resultó en una adecuada validez convergente (Tabla 4).
Tabla 4 Correlación del OMQoL en español con el PedsQL-3 módulo cáncer, Escala de MO (OMS) y Escala OMAS*
| OMQoL en español adaptado a niños, valor de p | |
|---|---|
| Escala para MO según la OMS (grado de severidad de MO) | −0.735** |
| Escala OMAS | −0.690** |
| PedsQL-3 Módulo cáncer (8-12 años/13-18 años) | 0.426** |
* Calculado por la correlación de Spearman.
**La correlación es significativa con un nivel de 0.01 (dos colas). MO: mucositis orofaríngea; OMQoL: Oropharyngeal Mucositis-Specific Quality-of-Life; OMS: Organización Mundial de la Salud; OMAS: Oropharingeal Mucositis Assessment Scale.
Discusión
El enfoque que involucra la relación de CV y MO está en constante crecimiento como un área de evaluación integral de la terapia oncológica. Sin embargo, la información en niños es limitada porque no se cuenta con instrumentos específicos para este grupo de edad. Debido a esto, en ocasiones se emplean instrumentos genéricos y enfocados a adultos para estimarla. Ejemplos de estos instrumentos son el Oral Health Impact Profile-14 (Perfil de Impacto de la Salud Oral-14), que omite signos y síntomas, como sangrado, ardor bucal, percepción de la saliva, fonación, deglución, disgeusia y dolor de garganta, que frecuentemente refieren los pacientes con MO26,27; el Functional Assessment of Cancer Therapy-Head and Neck (Evaluación Funcional de la Terapia del Cáncer - Cuestionario cabeza y cuello)28; y el European Organization for Research and Therapy of Cancer-Quality of Life Questionnaire−30 (Instrumento de la Organización Europea para la Investigación y Tratamiento del Cáncer-Calidad de Vida - Cuestionario 3029. Todos ellos tienen una utilidad limitada para la extensa sintomatología que involucra la MO. Otros, como el Patient-Reported Oral Mucositis Symptoms30 y el Oral Mucositis Weekly Questionnaire-Head and Neck Cancer31, miden los síntomas de MO -excluyendo toda una gama de características que la rodean- y no incluyen elementos para evaluar la CV.
En el presente estudio, 80 pacientes (41.5%) padecían leucemia aguda linfoblástica, la neoplasia maligna que afecta alrededor del 50% de los niños con cáncer, seguida de la leucemia mieloide y el linfoma. Los pacientes con tumores sólidos principalmente presentaron osteosarcoma, ya que es el tipo de tumor que más afecta a los adolescentes. Estas enfermedades se tratan con protocolos intensos que producen mielosupresión y daño a las mucosas, por lo que influyen en la proporción de los distintos grados de MO: el grupo con grado 4 fue el que presentó el menor porcentaje (9.3%). La evaluación psicométrica de la nueva versión del OMQoL en español reveló que los ítems eran representativos de la CV y MO al presentar una adecuada validez convergente, a pesar de existir adecuaciones para su traducción en español y adaptación a niños. El análisis factorial mostró un nuevo orden en las dimensiones: la subescala de función social se posicionó como la primera dimensión (nueve ítems), seguido de síntomas (siete ítems), deglución (seis ítems) y dieta (tres ítems). Con ello pudo explicarse por qué, en nuestra cultura, la expresión y la comunicación son muy importantes, seguido de la evidente afección que produce la MO. A pesar de la eliminación de cinco ítems en la subescala de dieta («No puedo disfrutar la comida», «Mi saliva se vuelve pesada o pegajosa y necesito escupir muchas veces−, «Me tardo más tiempo en comer o beber», «Me preocupa que coma poco y no sea sano», «Como menos alimentos suaves y duros» y «Tengo dificultad para hablar») y uno de función social («Tengo dificultad para hablar»), el instrumento conservó una adecuada confiabilidad (Alfa de Cronbach= 0.954).
Cuando se pretende adaptar culturalmente un instrumento a un país con idioma diferente al original y, en este caso, a una edad diferente, es probable que algunos ítems no sean bien comprendidos o sean irrelevantes. Esto se ve reflejado en cargas factoriales bajas y la consecuente necesidad de eliminación de ítems, ya que conservarlos podría conducir a un sesgo de información e interpretación por parte de los participantes16.
Las correlaciones del OMQoL con las escalas de MO (OMS y OMAS) mostraron una adecuada validez convergente, mientras que la correlación con el PedsQL-3 fue moderada. Posiblemente, esto se debe a que el PedsQL-3 evalúa más áreas de la vida, que, aunque pudieran relacionarse con MO, no se centran en el mismo criterio de evaluación, sino que involucran una serie de variables a las cuales están expuestos los pacientes oncológicos, como el dolor corporal, el dolor y temor a las canalizaciones o aspirados de medula ósea, las náuseas, el temor al médico u hospital, la preocupación por los efectos secundarios de su tratamiento y la afectación en la apariencia física.
La evaluación de la CV en pacientes con MO debe realizarse con instrumentos específicos, confiables y válidos para esta relación, ya que los instrumentos generales no pueden captar los signos y síntomas orofaríngeos que pueden llegar a limitar la alimentación, comunicación y apariencia física percibida, entre otros. Esto se presenta sobre todo en niños que, por su corta edad, no comprenden el panorama de su diagnóstico y tratamiento, además del dolor en la boca que presentan -secundario a las úlceras-, el impacto del sangrado bucal y la incapacidad de abrir la boca o comunicarse, lo cual implica para ellos una gran angustia y desesperación.











 text new page (beta)
text new page (beta)


