Introducción
El asma constituye un grave problema de salud a escala mundial. Actualmente afecta a más de 300 millones de personas1y tiene una prevalencia estimada del 1 al 18%2. Su frecuencia se ha visto incrementada en los últimos años, y dada la importancia que tiene el padecimiento y la derrama económica que supone su mal manejo, se han realizado muchos esfuerzos para mejorar el tratamiento de los pacientes que la presentan.
Es bien sabido que la piedra angular del manejo del asma es la terapia inhalada3. Sin embargo, a pesar de esto, se reconoce que solamente el 70% de los pacientes cumple el tratamiento adecuadamente4, y sólo del 39 al 67% de los médicos conocen y pueden explicar las técnicas de inhalación adecuadas5.
La primera referencia conocida de la administración de un aerosol con fines terapéuticos es el papiro de Ebers (1554 a.C.), en el que se describía la inhalación del vapor que desprendían las plantas de beleño negro (Hyoscyamus niger) en pacientes con dificultad para respirar6. No fue hasta 1858 que se presentó, en la Academia de Medicina de París, el primer inhalador «a presión», inventado por Sales Girons en Francia. Seis años después, en Londres, Newton patentaba un aparato de inhalación para la administración de medicamentos en polvo seco7. Para la primavera de 1955, la hija del director general de Riker Laboratories, Inc., le preguntó a su padre por qué no podía tener su medicamento para el asma en una lata de aerosol como el espray de cabello8. Para ese momento, los pacientes con asma se administraban su medicamento broncodilatador a través de un nebulizador de mano sin la posibilidad de medir una dosis reproducible9, lo que provocaba gran variación en los efectos terapéuticos. En el verano de ese año se iniciaron los primeros ensayos clínicos con un prototipo de inhalador de dosis medida presurizada (pMDI), con lo que se demostró su eficacia. Los primeros pMDI, sulfato de isoproterenol y bitartrato de epinefrina, fueron lanzados en marzo de 19568. En la década subsecuente, se inició el desarrollo de espaciadores y cámaras con válvula de retención, lo que evidencia que, para alcanzar el control de los síntomas del asma, no solo importaba el tipo de fármaco, sino también el dispositivo y la técnica utilizada para su administración9.
Cuando se habla de terapia inhalada, se debe tomar en cuenta que esta tiene características muy particulares. El depósito pulmonar de un medicamento inhalado a través del tracto respiratorio es más complejo que cuando se administra por vía oral y varía dependiendo de varios factores, tanto inherentes al sujeto como al medicamento y a la forma de administrarlo.
Dentro de los factores dependientes del sujeto, se debe considerar tanto la geometría del árbol bronquial como el patrón ventilatorio y la mecánica pulmonar. Ambos factores se describen a continuación:
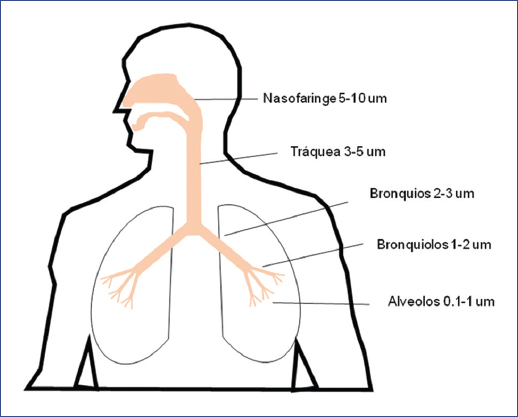
Geometría del árbol bronquial. Las vías aéreas tienen aproximadamente 23 generaciones: las primeras 14 presentan músculo liso circunferencial y cartílago, y corresponden al 5% del total del árbol bronquial; las últimas siete abarcan el 95% de la superficie de la vía aérea y no presentan cartílago. El estiramiento y tracción son lo que permite a esta sección mantener su permeabilidad4. Debido a lo anterior, es de suponer que diferentes fármacos están dirigidos a diversas regiones. Por ejemplo, los β2-agonistas generalmente están dirigidos a generaciones de vías aéreas más proximales que contienen músculo liso circunferencial, mientras que los esteroides presentan una distribución más uniforme, ya que sus receptores están presentes a lo largo de toda la vía aérea10. A este hecho se debe sumar que existe un cambio en el diámetro circunferencial de la vía respiratoria conforme se avanza en cada generación, por lo que el tamaño de la partícula del fármaco administrado influirá directamente en el sitio de su depósito.
Patrón ventilatorio y mecánica pulmonar. El grado de enfermedad pulmonar en el momento de la inhalación también influye significativamente en el depósito pulmonar: la inflamación, hipersecreción de moco y broncoconstricción reducen el diámetro de las vías respiratorias y aumentan la velocidad del flujo de aire y la turbulencia, lo que provoca el depósito del fármaco en las vías respiratorias proximales11. Otro dato importante a tomar en cuenta es que los niños tienen vías respiratorias más pequeñas que los adultos, y es probable que las vías respiratorias de pacientes asmáticos sean más estrechas que las vías respiratorias de sujetos sanos, debido a la inflamación, remodelación y broncoconstricción, característicos de este padecimiento12.
Con respecto a los factores inherentes al medicamento, dentro de los más importantes están el tamaño de la partícula, la velocidad de ingreso, el crecimiento higroscópico y la carga electrostática:
-
Tamaño de la partícula. Para que la terapia inhalada sea exitosa, se requiere que se generen partículas de medicamento que penetren más allá de la orofaringe y la laringe y que se depositen en la vía aérea pequeña3. Dado que los aerosoles generan partículas de varios tamaños, al igual que los inhaladores de polvo seco (DPI)1, se utiliza una medida «promedio», conocida como diámetro de la masa media aerodinámica (DMMA), cuyo significado es que el 50% de las partículas en el aerosol son más pequeñas y el 50% más grandes que la DMMA reportada4.
El diámetro aerodinámico se considera el factor relacionado con la partícula más importante que afecta el depósito del aerosol10. Las partículas > 5 µm son más propensas a depositarse por impacto en la orofaringe y ser deglutidas13; las partículas de 4 a 5 µm se depositan de manera primaria en las vías aéreas bronquiales/conductoras, y las partículas más pequeñas permanecen en la corriente de aire y son llevadas a las vías periféricas y la región alveolar (Fig. 1).
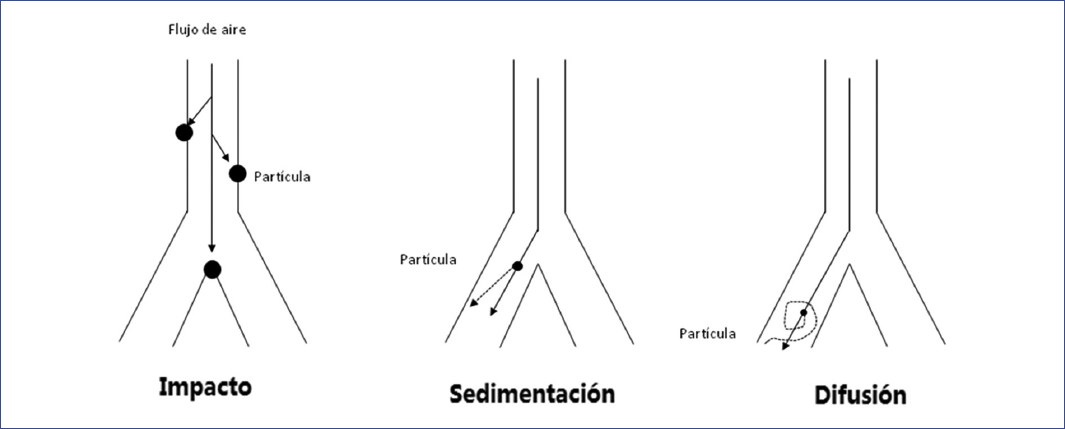
Al entrar en la vía aérea, las partículas se depositarán por tres mecanismos: impacto, sedimentación y difusión. Esto depende de la velocidad de inhalación y el tamaño de la partícula:
Impacto. Se origina por el choque de las partículas de aerosol en la vía aérea y afecta generalmente a partículas > 5 µm que se administran con alta velocidad de disparo o descarga y de flujo inspiratorio. Lo primero depende del dispositivo, y lo segundo, del paciente. Este mecanismo es muy importante para el depósito de fármacos en las primeras siete generaciones de bronquios4,13, y ocurre principalmente con agonistas β2-adrenérgicos. Si el paciente se encuentra llorando, se debe evitar administrar el medicamento, ya que aumenta el impacto. Se recomienda realizar siempre inhalaciones lentas y estables en pacientes tranquilos, y no olvidar que se si se utiliza un inhalador de dosis medida, se debe de acompañar de una cámara espaciadora, y utilizar la técnica adecuada.
Sedimentación. Es el asentamiento de partículas de entre 0.5-5 µm por efecto de la gravedad13. Se produce predominantemente en vías aéreas de mediano calibre y más allá de la generación ocho, donde la velocidad de aire es menor4.La sedimentación se favorece durante una inhalación profunda y aplazando lo más que se pueda la exhalación para que las partículas se precipiten por gravedad y se pueda alcanzar un mayor depósito pulmonar.
Difusión. Afecta a partículas muy pequeñas (< 1 µm) en regiones de bajo flujo pulmonar, donde el movimiento aleatorio de las mismas, denominado movimiento Browniano, tiene una mayor influencia que la gravedad14 (Fig. 2). Aunque las partículas pequeñas (≈1 µm) tienen mayor potencial de ser exhaladas (10% de la dosis), la mayor parte de la dosis se deposita a nivel pulmonar (60%), y una cantidad mucho menor a nivel orofaríngeo (30%)15.
Velocidad de ingreso. El flujo de aire influye directamente en el impacto de las partículas en las paredes de las vías aéreas y constituye uno de los aspectos más importantes en el depósito pulmonar. Una inhalación lenta y profunda después de una exhalación profunda, con una duración de 2 a 3 s en niños y de 4 a 5 s en adultos, genera flujos de 30 l/min, que son ideales para pMDI y mínimos para DPI16. El flujo inspiratorio mayor a 60 l/min incrementa el impacto en la orofaringe y las vías respiratorias superiores, por lo que se debe de evitar hacerlo de manera precipitada. Con el uso de las cámaras espaciadoras se disminuye la velocidad de ingreso y el depósito orofaríngeo.
-
Crecimiento higroscópico. La adición y eliminación de agua pueden afectar significativamente el tamaño de partícula de un aerosol higroscópico (que tiene tendencia a absorber humedad del ambiente) y la deposición. Algunas partículas pueden incrementar de tamaño en condiciones de alta humedad. Este crecimiento se encuentra en función del diámetro inicial de la partícula: si es < 1 mm, puede incrementar hasta cinco veces su tamaño, mientras que si es > 2 mm, el tamaño puede aumentar hasta tres veces. La humedad de la vía respiratoria es suficiente para generar estos cambios.
El aumento en el tamaño de partícula por encima del tamaño inicial afecta la cantidad de fármaco depositado y, particularmente, su distribución en la vía respiratoria13.
-
Carga electrostática. La disponibilidad del medicamento en aerosol puede verse afectada por cargas electrostáticas presentes durante su generación o transporte, lo que afecta el depósito pulmonar17.
La carga electrostática de los aerosoles puede variar dependiendo de la formulación, el material utilizado en los dispositivos y las cámaras espaciadoras. Tratando de minimizar este problema, se han implementado diversas estrategias que tienen como objetivo mejorar la disponibilidad del medicamento en la vía respiratoria. Estas incluyen el uso de materiales antiestáticos en los dispositivos de inhalación o el cebar las paredes de la cámara espaciadora con 20 dosis del medicamento inhalado, para recubrir la superficie interna y minimizar la carga estática. Actualmente, la solución más práctica y menos costosa es usar espaciadores no conductores, lavarlos con detergente para trastes y secarlos al aire libre. Todo esto permite una mayor entrega final del medicamento18.
Forma de administración: tipo de dispositivo
El éxito de la terapia inhalada implica la adecuada elección del fármaco, la selección del dispositivo con el cual se administrará15 y, sobre todo, la correcta capacitación para su uso.
Un gran número de dispositivos de inhalación han sido diseñados en los últimos años. En general, se asume que el dispositivo ideal debería tener las siguientes características:
Efectivo: Permite la inhalación de las partículas del medicamento ≤ 6 µm, independientemente del flujo inspiratorio del paciente.
Reproducible: Permite la inhalación de la misma cantidad de medicamento siempre.
Preciso: Permite saber el número de dosis del medicamento restante en el dispositivo.
Estable: Es capaz de proteger el medicamento de los efectos de la temperatura y cambios de humedad.
Cómodo: Es fácil de utilizar, fácilmente transportable, de tamaño pequeño, multidosis.
Versátil: Permite el uso de diferentes combinaciones de medicamentos por inhalación.
Amigable con el ambiente: No debe contener contaminantes químicos ni dañar la capa de ozono.
Asequible: Tiene un precio justo y es recargable19.
En la actualidad, los dispositivos se agrupan dependiendo del tipo y forma de administración del medicamento:
Todos han probado una eficacia similar, siempre y cuando se utilicen con la técnica correcta20. La decisión de su uso se toma basándose en la edad del paciente, la capacidad de coordinar entre la inhalación y la activación del dispositivo y en la presencia de síntomas de asma (esto afecta el flujo inspiratorio)21. Una vez considerados estos factores, y después de haber instruido al paciente en la técnica específica del dispositivo, el profesional de la salud debe solicitar una demostración para cerciorase de que se haga de manera correcta.
Inhaladores de dosis medida presurizados
Fue uno de los primeros dispositivos utilizados, cuya principal innovación fue la portabilidad. Antes de ellos se utilizaban aparatos de tamaño considerable para nebulizar el medicamento. Otra ventaja que supuso su uso fue la practicidad: con una técnica adecuada de inhalación profunda, se podía administrar la dosis del medicamento deseado solo y, finalmente, su característica de ser multidosis.
El pMDI es un dispositivo que genera un aerosol (sistema de dos fases definido como la dispersión de una suspensión de partículas sólidas o gotas líquidas en un medio gaseoso)22 mediante el uso de un cartucho presurizado de aluminio que contiene el medicamento micronizado en una suspensión con etanol, como cosolvente, e hidrofluoroalcano (HFA), como propelente. Durante varias décadas se utilizó clorofluorocarbono (CFC) como propelente para los pMDI; sin embargo, este gas daña la capa de ozono. Como en 1987 se firmó el protocolo de Montreal, se estableció el cambio de CFC por HFA, el cual no afecta la capa de ozono23.
Los componentes estructurales del pMDI convencional son el frasco, válvula dosificadora, activador, pieza bucal, formulación y propelente24. La suspensión del medicamento se encuentra a una presión de 3 a 4 atmósferas y genera partículas de 2 a 4 µm. La válvula dosificadora está diseñada para entregar una cantidad precisa de aerosol (20-100 µl) cada vez que el dispositivo se activa. Cuando el inhalador no se utiliza, una válvula interna entre el frasco y la cámara de medición se abre, lo que permite que la cámara se llene de una mezcla de propelente-medicamento en forma líquida. Al mismo tiempo, otra válvula externa entre la cámara de medición y el aire del exterior se cierra. Mientras el paciente presiona el frasco para la activación de la dosis, la válvula interna se cierra y la externa se abre, liberando la mezcla de medicamento-propelente, retenida en la cámara, a través del orificio del activador en forma de aerosol. Internamente, el activador incluye una boquilla de pulverización (orifico activador) y la cámara de expansión, en la cual el propelente liberado de la cámara de medición se expande y se volatiliza parcialmente debido a la disminución de la presión25-27 (Fig. 3).
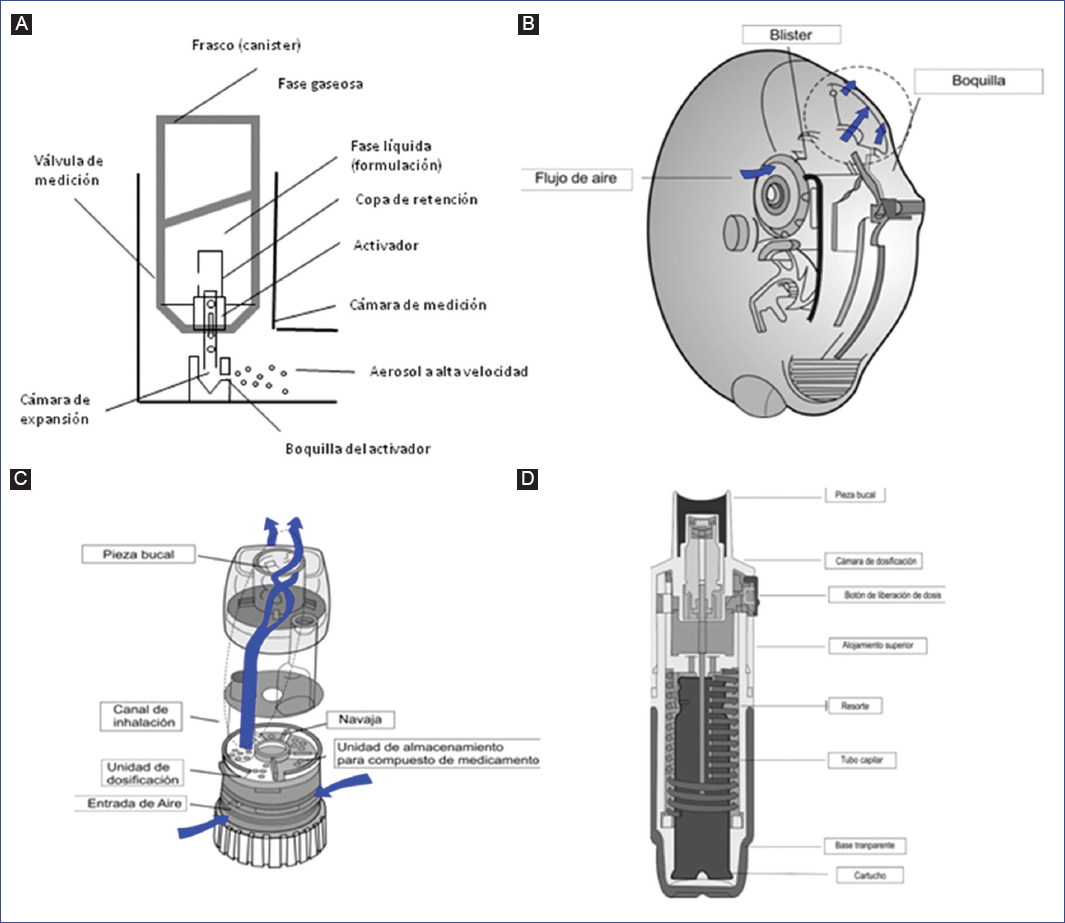
Figura 3 Componentes clave de los dispositivos: Inhaladores presurizados de dosis medida (A); polvo seco: Diskus® (B) y Turbuhaler® (C); y Respimat® (D) (modificado de Newman SP y Azouz W, et al.26,27).
A escala mundial, los pMDI son los dispositivos de inhalación más ampliamente utilizados para el tratamiento del asma y de la enfermedad pulmonar obstructiva crónica3 (Tabla 1).
Tabla 1 Medicamentos disponibles en México en dispositivo pMDI, DPI y niebla fina
| Tipo de medicamento | Nombre genérico | Marcas | |
|---|---|---|---|
| pMDI | Broncodilatadores de corta acción | Salbutamol | Ventolin®, Assal®, Aurosal®, Farmarest®, Inbumed®, Salamol®, Salbutalan® |
| Bromuro de ipratropio | Atopyo® y Atrovent® | ||
| Esteroides inhalados | Beclometasona | Qvar®, Baclonet®, Beclazone®, Dobipro®, Mizraba | |
| Ciclesonida | Alvesco® | ||
| Fluticasona | Flixotide® | ||
| Budesonida | Numark®, Aerosial®, Jagodi® | ||
| Combinación de esteroide inhalado y broncodilatadores de larga acción | Fluticasona con salmeterol | Seretide Evohaler®, Lasfligen® | |
| Budesonida con formoterol | Vannair® | ||
| Mometasona con formoterol | Zenhale® | ||
| DPI | Esteroides inhalados | Budesonida | Dosis única: Miflonide Aerolizer® |
| Multidosis: Pulmicort Turbuhaler® | |||
| Mometasona | Multidosis: Elovent Twisthaler® | ||
| Combinación de esteroide inhalado y broncodilatadores de larga acción | Fluticasona con salmeterol | Dosis única: Nimbus y Ulfhinlas® | |
| Multidosis: Seretide Diskus e Irflosol Forspiro® | |||
| Budesonida con formoterol | Multidosis: Symbicort Turbuhaler® | ||
| Bromuro de aclidinio con formoterol | Dosis única: Duaklir Genuair® | ||
| Beclometasona con formoterol | Multidosis: Innovair Nexthaler® | ||
| Trifenatato de vilanterol con fluticasona | Multidosis: Relvar Ellipta® | ||
| Broncodilatadores de larga acción | Fumarato de formoterol | Multidosis: Oxis Turbuhaler® | |
| Niebla fina | Broncodilatador de corta acción | Salbutamol con bromuro de ipratropio | Combivent Respimat® |
| Broncodilatador de larga acción | Tiotropio | Spiriva Respimat® |
DPI: inhalador de polvo seco; pMDI: inhalador presurizado de dosis medida.
Inhaladores de dosis medida presurizados con espaciador
Un espaciador es un dispositivo de extensión que se sitúa entre el paciente y el pMDI28. Estos dispositivos ayudan a mejorar la eficiencia en el uso de los cartuchos presurizados al aumentar la distancia entre la boca y el dispositivo, lo que disminuye la velocidad de flujo del aerosol y el impacto en la orofaringe, y permite la evaporación del freón y la disminución del tamaño de la partícula. Además, facilitan la penetración y depósito pulmonar (mayor al 30%).
Varios factores influyen sobre su eficacia, el espacio entre la entrada y la salida del inhalador, el material del que están hechos, la técnica de inhalación y el cuidado en general del dispositivo.
Existen diferentes tipos de espaciadores: el tubo abierto, el diseño de flujo inverso, en el cual el pMDI se sitúa cerca de la boca y es disparado en dirección lejana al paciente, y la cámara con reservorio o de retención, que es el más utilizado y que permite mantener el aerosol dentro de la cámara por un tiempo finito3,29 (Fig. 4). Los hay de gran diversidad de tamaño: desde 50 ml hasta 750 ml, lo cual puede impactar en la cantidad total del fármaco que se deposita en la orofaringe o en los pulmones. Cuando el espaciador es pequeño se deposita menos medicamento a nivel pulmonar y más a nivel orofaríngeo. Inversamente, al aumentar la capacidad del espaciador, existe un mejor depósito a nivel pulmonar y menos a nivel orofaríngeo. Sin embargo, cuando se trata de pacientes con un volumen corriente pequeño (niños ≤ 2 años), el volumen de espaciado grande requiere de tiempos más largos de administración30. Existen estudios donde los diferentes dispositivos espaciadores aumentan la biodisponibilidad del medicamento inhalado31,32. Sin embargo, el punto fundamental para la entrega del medicamento es una técnica adecuada33,34.
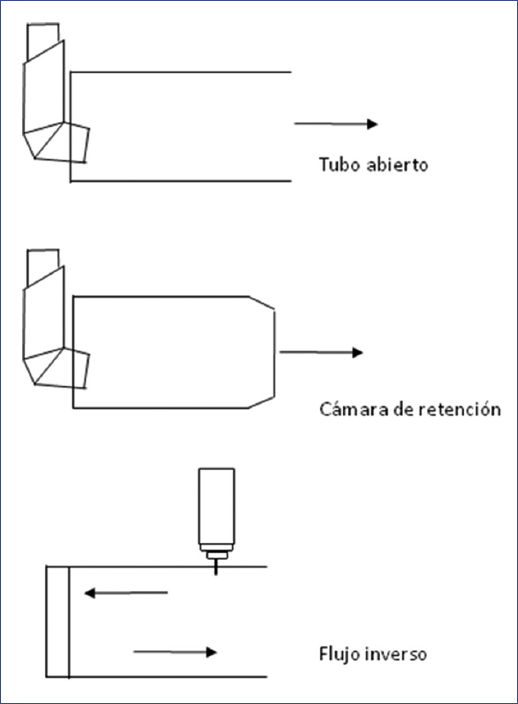
Figura 4 Tipos de dispositivos complementarios (cámara espaciadora) para inhaladores presurizados de dosis medida (modificado de Adkinson Jr. et al.29).
A pesar de las diferencias entre los diferentes espaciadores, todos tienen algunas ventajas inherentes a los diseños:
Reducen la velocidad de las partículas del pMDI, lo cual se produce durante el tiempo que el aerosol atraviesa la longitud del espaciador o cámara de retención con válvula.
Incrementan la fracción de partículas finas FPF debido al impacto de las partículas más grandes del medicamento y la evaporación parcial del propelente dentro de la cámara35.
Superan, en parte, el problema de coordinar la activación con la inhalación, incrementando así el depósito pulmonar. No obstante, la coordinación es necesaria, ya que se ha demostrado que los retrasos en la inhalación reducen significativamente la entrega pulmonar36.
Pueden utilizarse a cualquier edad, incluso en pacientes en asistencia respiratoria mecánica y con traqueostomía.
No producen tos ni broncoespasmo reflejo, que a veces se presenta con el uso de pMDI sin espaciador.
Debido a que reducen el impacto en la orofaringe, los espaciadores y las cámaras de retención con válvula se recomiendan para el uso principalmente de corticosteroides. Sin embargo, aun así, es importante enjuagar la boca del paciente después de inhalar un corticosteroide con cualquiera de estos dispositivos, para retirar las partículas impactadas en la orofaringe10.
La mayoría de los espaciadores están hechos de materiales plásticos no conductores: la aerosolización y el manejo cotidiano inducen una carga electrostática en la superficie interna y externa de los mismos. El efecto neto de estas cargas electrostáticas es la atracción de partículas de aerosol hacia las paredes y la reducción significativa de la dosis disponible de aerosol para inhalación37. Se han desarrollado algunos espaciadores «sin estática», que se basan en el tipo de material plástico utilizado o en la presencia de una capa extremadamente delgada de metal en su superficie interna que reduce la estática. En las cámaras de retención con este tipo de materiales, el aerosol se mantiene suspendido por periodos más prolongados38.
Una recomendación para disminuir la estática en los dispositivos es que, tanto los nuevos como los previamente utilizados, se laven con detergente para trastes líquido diluido, no se enjuaguen y se dejen secar al aire libre. Estas medidas permitirán que se acumule un revestimiento con este material dentro del espaciador, que disminuirá la estática37,39, lo que incrementará la entrega de medicamento por el espaciador. El efecto del revestimiento con detergente sobre la carga electrostática disminuye después de una semana40, pero la eficiencia del depósito del fármaco a nivel pulmonar se sigue manteniendo durante cuatro semanas, por lo que se recomienda repetir el lavado en este tiempo41.
La principal desventaja de este tipo de dispositivos es que generalmente son voluminosos y menos portátiles que un pMDI.
Inhaladores de dosis medida presurizados activados por inhalación
Se desarrollaron para superar el problema de mala coordinación de activación-inhalación con los pMDI estándar. Los inhaladores de dosis medida presurizados activados por inhalación (BA-pMDI) actualmente disponibles son el Autohaler®, que automáticamente se acciona a velocidades de flujo inspiratorio de ≈30 l/min, y el Easi-Breathe®, que se activa a 20 l/min10.
Inhaladores de polvo seco
A principios de los setenta aparecieron los primeros DPI en los EE. UU.42, que se presentaron como una opción más amigable con el medio ambiente (al no contener productos fluorados), con mayor estabilidad química que las formulaciones líquidas28 y que requerían mínima coordinación entre la respiración y la activación del dispositivo43. El primero en aparecer fue el Spinhaler®, dispositivo unidosis que perforaba una cápsula que se depositaba manualmente en una ranura y era inhalado por una pieza bucal. Conforme pasaron los años, se agregaron mejoras al diseño, dispositivos multidosis y sustancias acarreadoras que permitían una mejor entrega a nivel pulmonar.
Actualmente existen dos tipos básicos de DPI, según en el número de dosis que el dispositivo puede llevar: unidosis, donde el medicamento es suministrado en cápsulas individuales que se depositan manualmente por el paciente, y multidosis, que utilizan dosis medidas y selladas de fábrica, empacadas de tal manera que el dispositivo no tenga que ser recargado. De estos últimos, existen aquellos que tienen la formulación a granel (en masa) en un reservorio y que tienen un mecanismo incorporado para medir dosis individuales tras la activación, y aquellos con cantidades predosificadas y dispensadas de fábrica dentro de discos, cartuchos o tiras empacadas en blísteres10.
Desde el punto de vista del diseño, las partes primarias de un DPI son las mismas para todos los tipos de dispositivos. Consisten en una formulación en polvo, un mecanismo de dosificación que contiene (o mide) una sola dosis de medicamento, un principio de desaglomeración del polvo, que dispersa el polvo en la corriente de aire inhalado, y una pieza bucal44 (Fig. 3).
Los DPI disponibles actualmente se clasifican como dispositivos pasivos, porque utilizan la energía de la vibración que ejerce el paciente al inhalar sobre la pieza bucal para facilitar la desaglomeración del medicamento6 y, por lo tanto, la entrega de la dosis depende del esfuerzo inspiratorio del paciente. Para cada inhalador hay un mínimo de energía, es decir, el flujo inspiratorio requerido para proporcionar una eficiente desagregación de la formulación, debajo del umbral mínimo de energía, el paciente no tendrá el efecto terapéutico del medicamento. La mayoría de los DPI comercialmente disponibles requieren de una tasa de flujo inspiratorio pico entre 30 y 60 l/min para la entrega del polvo, con algunas variaciones en los diferentes dispositivos. Es importante tener en cuenta que niños, adultos mayores y aquellos que experimenten una exacerbación grave pueden no ser capaces de generar el flujo inspiratorio suficiente para su adecuado funcionamiento, por lo que en estos pacientes se requerirá el uso de un dispositivo de inhalación diferente.
En general, los DPI actuales tienen una media de depósito en las vías respiratorias entre el 40 y el 80% de la dosis medida45 (con una adecuada técnica de inhalación), que resulta similar e incluso ligeramente mejor que aquellos observados para los pMDI29. La mayoría de estos dispositivos se valen del uso de una sustancia acarreadora (lactosa o glucosa) que se mezcla con el medicamento y permite que el polvo pueda pasar más fácilmente fuera del dispositivo. La mayor parte de estas partículas, debido a su tamaño (20-65 µm), se depositan en la orofaringe (por lo que se debe recomendar siempre el enjuague bucal), lo que permite que las partículas más pequeñas del medicamento (1-2 µm) se entreguen a nivel pulmonar29.
Un punto a considerar es que la humedad del ambiente puede afectar marcadamente el medicamento suministrado desde el DPI. La dosis entregada a nivel pulmonar disminuye en un ambiente húmedo, probablemente como resultado de la aglutinación del polvo por la humedad añadida, por lo que es de suma importancia almacenar los DPI en un ambiente frío y seco. Otra desventaja es que estos dispositivos no pueden utilizarse en pacientes con asistencia respiratoria mecánica ni con traqueostomía.
En la actualidad, existen diferentes dispositivos DPI: Turbuhaler®, Diskus®, Eklira®, Irflosol®, Twisthaler®, Ellipta®, Diskhaler®. En general, todos ellos funcionan bajo el mismo principio y cambian solo en algunas especificaciones, como el flujo inspiratorio, el uso de transportadores y el diseño (Tabla 1)46.
Inhalador de niebla fina
La idea de desarrollar este tipo de dispositivos era combinar las ventajas de los pMDI y los nebulizadores. Son pequeños inhaladores portátiles y manuales, que no requieren un suplemento de energía (como los pMDI) para liberar el medicamento. Se presentan libres de propelente, en forma de una suave niebla, lo que disminuye la probabilidad de depósito orofaríngeo.
Actualmente se cuenta con el dispositivo conocido como Respimat® (Boehringer-Ingelheim). Este inhalador está disponible en tres presentaciones: bromuro de ipratotropio/salbutamol (Combivent®), bromuro de tiotropio (Spiriva®) y olodaterol (Striverdi®).
La solución del medicamento es almacenada en una bolsa plegable dentro del cartucho del dispositivo. Respimat® tiene un resorte de tensión que, al ser torcido a 180°, fuerza un volumen medido de solución de medicamento a través de un tubo capilar dentro de una microbomba; una vez que el paciente presiona el botón de liberación de dosis, la energía liberada del resorte impulsa la dosis dentro del uniblock, la parte estructural única de este dispositivo. El uniblock permite que la solución de medicamento pase a través de canales de filtro muy finos, y libera dos corrientes de chorro de solución de medicamento que convergen, y crea una fracción grande de gotitas respirables con baja velocidad (Fig. 3)47.
El inhalador de niebla fina aerosoliza partículas entre 1 a 5.8 µm, lo que ayuda a evitar la pérdida del medicamento durante la exhalación y a facilitar el depósito pulmonar a través del mecanismo de sedimentación48, con un depósito pulmonar de alrededor del 40 al 53%.
Selección del inhalador
Existen factores importantes cuando se selecciona un inhalador49 (Tabla 2). Por ejemplo, el tamaño de la partícula, la preferencia del paciente, la habilidad para utilizar y generar un nivel apropiado de flujo inspiratorio para el dispositivo50,51, y las ventajas y desventajas descritas para cada uno de ellos (Tabla 3). En población pediátrica existen problemas específicos que hay que tomar en cuenta cuando se prescribe un inhalador; por ejemplo, se sabe que el llanto reduce de manera importante la entrega de aerosol a las vías aéreas periféricas, por lo que se deberá recomendar un ambiente tranquilo que incremente la comodidad de este grupo de pacientes durante la administración de los medicamentos inhalados.
Tabla 2 Comparación de distintos tipos de inhaladores
| Tipo y marca | Tamaño de las partículas (µm) | Depósito pulmonar (%) | Depósito faríngeo (%) | Flujo inspiratorio requerido (litros/min) |
|---|---|---|---|---|
| pMDI | ||||
| General | ||||
| ICP + Cámara | 1.4-8 | 7.8-34 | 53.9-82.2 | 20-30 |
| Partícula fina | 2-3.2 | 11.2-68.3 | 31.2 | 20-30 |
| Innovair® | 1-2 | 31-34 | 33-58 | 20-30 |
| Alvesco® | 1 | 50-52 | 32.9 | 20-30 |
| DPI | ||||
| General | ||||
| Monodosis | 1-2 | 25-30 | 70-75 | 30-60 |
| Aerolizer® | 1.9-7.9 | 13-20 | 73 | > 90 |
| Breezhaler® | 2.8 | 39 | 45 | > 90 |
| Handihaler® | 3.9 | 17.8 | 71 | < 50 |
| Multidosis | ||||
| Diskus® | 3.5 | 7.6 | - | 30-60 |
| Easyhaler® | - | 18.5-31 | - | < 50 |
| Ellipta® | 24 | 15-27 | - | < 50 |
| Genuair® | - | 30.1 | 54.7 | 60-90 |
| Nexthaler® | 1.41.5 | 56 | 43 | 60-90 |
| Spiromax® | - | 28-49 | - | 60-90 |
| Turbuhaler® | 1.7-5.4 | 14.2-38 | 53-71.6 | 50-60 |
| Twisthaler® | 2-2.2 | 36-37 | - | < 50 |
| Niebla fina | ||||
| Respimat® | 1-2 | 40-53 | 19.3-39 | 20-30 |
DPI: inhalador de polvo seco; ICP: inhalador de cartucho presurizado; pMDI: inhalador presurizado de dosis medida.
Modificado de De Ávila, et al.49.
Tabla 3 Ventajas y desventajas de los diferentes tipos de dispositivos
| Tipo | Ventajas | Desventajas |
|---|---|---|
| pMDI | - Portátil y compacto - Difícil de contaminar - Menos costoso que otros inhaladores - Dosis entregada y tamaño de la partícula independiente de la maniobra de inhalación - Adecuado para situaciones de urgencia - Tiempo de tratamiento corto - Disponible para la mayoría de las formulaciones de medicamentos |
- Inhalación lenta y profunda (30 l/min) seguida de 10 s de sostener la respiración o - Respiración lenta a volumen corriente empezando inmediatamente después de la activación - Activación de solo una dosis por inhalación |
| pMDI con espaciador | - Adecuado para niños pequeños y adultos mayores - Reducción del depósito orofaríngeo - Adecuado para situaciones de urgencia |
- Retraso, múltiples disparos y carga estática reducen la biodisponibilidad pulmonar - Voluminoso: mucho menos portable que el pMDI solo - La mayoría de los espaciadores están específicamente diseñados para un pMDI |
| DPI | - Pequeño y portátil - Activado por respiración - Se requiere menor coordinación del paciente - Poco tiempo de tratamiento - Disponible para la mayoría de las sustancias |
- Se requiere de flujo inspiratorio moderado a alto - No adecuado para niños < 4 años - Puede no ser apropiado para situaciones de urgencia - Algunos sensibles a la humedad - No adecuado para la entrega de grandes dosis de broncodilatadores |
DPI: inhalador de polvo seco; pMDI: inhalador presurizado de dosis medida.
Modificado de Broeders ME, et al.50.
A pesar de no estar incluido en esta revisión, un nebulizador puede ser utilizado como una alternativa adecuada, especialmente en el escenario de síntomas agudos; sin embargo, los nebulizadores no se recomiendan para el tratamiento crónico y continuo porque son más caros, la administración del medicamento consume más tiempo y requiere de mayor mantenimiento. Además, los nebulizadores son fuentes potenciales de contaminación microbiana del tracto respiratorio: tanto los nebulizadores portátiles en jet como los ultrasónicos se han asociado con neumonía nosocomial52.
Técnica de inhalación
Independientemente del dispositivo que se recomiende, es muy importante la capacitación del paciente sobre el adecuado uso (Tablas 4, 5 y 6). Existen varios videos informativos disponibles en Internet53-55.
Tabla 4 Técnica para uso de pMDI
| 1. Quite la tapa de la pieza bucal del inhalador |
| 2. Agite el inhalador (no es necesario para algunos pMDI con HFA. El paciente debe revisar el folleto de instrucciones) |
| 3. Sostenga el inhalador en posición vertical |
| 4. Exhale todo el aire |
| 5. Coloque la pieza bucal del inhalador entre sus labios y dientes o coloque la pieza bucal a 4 cm de distancia de su boca; mantenga su lengua abajo y fuera del camino de la pieza bucal |
| 6. Dispare el inhalador justo después de una inhalación muy lenta y muy profunda |
| 7. Continúe inhalando muy lentamente hasta que sus pulmones se llenen (debe tomar por lo menos 5 segundos en llenar sus pulmones) |
| 8. Retire el inhalador de su boca y aguante la respiración mientras cuenta hasta 10 o lo más que pueda |
| 9. Exhale lentamente |
HFA: hidrofluoroalcano; pMDI: inhalador presurizado de dosis medida.
Modificado de Sanchis J, et al.53.
Tabla 5 Técnica para uso de pMDI con espaciador o cámara espaciadora
| 1. Quite la tapa de la pieza bucal |
| 2. Active el inhalador si es la primera vez que se usa, si ha estado varios días sin uso, o si se cayó. El activar el inhalador implica agitarlo y dispararlo al aire (lejos de la cara) hasta cuatro ocasiones (revise las instrucciones del dispositivo) |
| 3. Inserte el pMDI en el espaciador |
| 4. Agite el pMDI durante 5 segundos de forma vigorosa |
| 5. Mantenga el inhalador en posición vertical entre su dedo índice y el pulgar, puede usar la otra mano para sujetar el espaciador |
| 6. Exhale de forma normal a través de su boca |
| 7. Coloque la pieza bucal entre sus dientes y cierre los labios firmemente alrededor de la pieza bucal del espaciador (si usa una máscara facial, colóquela sobre la nariz y la boca) |
| 8. Asegúrese de que su lengua no bloquee la pieza bucal del espaciador |
| 9. Presione el contenedor del pMDI con su dedo índice para que salga el medicamento |
| 10. Al mismo tiempo, inhale profunda y lentamente a través de su boca hasta que los pulmones se llenen por completo; esto le llevará de 3 a 5 segundos |
| 11. Mantenga la medicina durante 5 a 10 segundos. Si no puede inspirar de forma completa o no puede detener la respiración el tiempo suficiente, puede inhalar una segunda ocasión para vaciar el espaciador y detener el aire de nuevo por otros 5 segundos |
| 12. Si usted requiere más de un disparo, espere de 15 a 30 segundos entre disparo y disparo. Agite de nuevo el pMDI antes del siguiente disparo. No dé dos disparos en el espaciador y trate de vaciarlo con una inhalación |
| 13. Cuando finalice, tape la pieza bucal |
| 14. Si su medicamento contiene un esteroide (a veces llamado glucocorticoide o corticoesteroide), enjuague su boca y haga colutorios con agua después de su uso. Escupa el agua, no la trague |
| 15. Puede usar su espaciador para más de un medicamento; quite el primero para usar los siguientes |
pMDI: inhalador presurizado de dosis medida.
Tabla 6 Técnica de para uso de DPI Turbuhaler® y Diskus®
| Técnica de Turbuhaler | Técnica de Diskus |
|---|---|
| 1. Retire la tapa del inhalador | 1. Abra el inhalador |
| 2. Mantenga el inhalador en posición vertical | 2. Empuje la palanca hacia atrás por completo |
| 3. Gire el mango en sentido contrario a las manecillas del reloj y luego de regreso hasta escuchar un click | 3. Exhale a volumen residual |
| 4. Exhale a volumen residual | 4. Exhale lejos de la pieza bucal |
| 5. Exhale lejos de la pieza bucal | 5. Coloque la boquilla entre los dientes y los labios |
| 6. Coloque la boquilla entre los dientes y los labios | 6. Inhale con fuerza y profundamente |
| 7. Inhale con fuerza y profundamente | 7. Sostenga la respiración durante 5 segundos |
| 8. Sostenga la respiración durante 5 segundos | 8. Exhale lejos de la pieza bucal |
| 9. Exhale lejos de la pieza bucal (coloque la tapa después del uso del Turbuhaler) | 9. Cierre el inhalador |
DPI: inhalador de polvo seco.
Modificado de Basheti IA, et al.55.
A pesar de la terapia adecuada, cuando se evalúa a un paciente con síntomas de asma no controlado, una de las preguntas que deben hacerse es si el paciente está utilizando la medicación prescrita. Las tasas de adherencia al medicamento en pacientes asmáticos son bajas. Esto se debe al mal control de la enfermedad, exacerbaciones, alto costo del tratamiento y falta de acceso a los servicios de salud.
Es frecuente que los pacientes utilicen sus inhaladores de manera incorrecta. En algunos casos, solo del 46 al 59% de los pacientes realizan una técnica de inhalación eficiente56, e incluso el 25% nunca han recibido capacitación con una técnica del correcto uso de inhalador57. Dos revisiones sistemáticas sobre la problemática del uso de inhaladores indican que solamente el 31% de asmáticos que utilizan espaciadores lo hacen con la técnica adecuada. Los errores más frecuentes son la mala coordinación entre el disparo y la inhalación y el no poder retener la respiración después de la deposición del medicamento, lo que llega a ocurrir hasta en el 45% de los casos58.
Entre los profesionales de la salud, la técnica fue correcta en solamente el 15.5%, cifra que ha disminuido en los últimos años59.
A la fecha no existen una serie de pasos universales para todos los dispositivos; sin embargo, cada uno cuenta con unas instrucciones de uso muy similares.
Las demostraciones personales o en grupos pequeños son las más eficaces, y es importante no perder de vista que el reentrenamiento periódico es siempre necesario60. La técnica de inhalación mejora a casi el doble (del 57.4% al 97.9%) después de tres sesiones de entrenamiento61.
En conclusión, el control óptimo del asma depende, en gran medida de la terapéutica seleccionada, del dispositivo empleado y de la eliminación de factores que reducen la adherencia del paciente al tratamiento. La selección del dispositivo siempre deberá hacerse de forma conjunta con el paciente, evaluando los pros y los contras de cada uno de ellos.











 text new page (beta)
text new page (beta)