Introducción
La histiocitosis de células de Langerhans (HCL) es una enfermedad caracterizada por lesiones únicas o múltiples de tipo osteolítico, secundarias a una proliferación clonal de células histológicamente similares a las células de Langerhans en uno o varios órganos1.
En los niños, la histiocitosis se clasifica en clase I o histiocitosis X; clase II o síndrome hemofagocítico (asociado a infección o familiar); y clase III o histiocitosis maligna, leucemia monocítica aguda y el verdadero linfoma histiocítico.
La HCL es un trastorno histiocítico raro y su incidencia exacta se mantiene desconocida. Se ha diagnosticado en todos los grupos de edad, pero es más común en los primeros 3 años de vida. La incidencia reportada se estima entre 3 y 5 casos por cada millón de niños y 1 a 2 casos por cada millón de adultos2,3.
La presentación clínica es heterogénea; varía según el sitio de la lesión y la edad de presentación clínica, siendo las más comunes las lesiones líticas en el hueso3. En la población pediátrica, el sitio más frecuente es el cráneo, en el 40% de los casos; en los adultos se presenta predominantemente en la mandíbula (30%) y en las extremidades (17%). Pocos casos de HCL se han reportado en la literatura con compromiso de cuerpos vertebrales en la población pediátrica3,4.
A continuación , se describe el caso de una paciente a quien se le diagnosticó HCL con compromiso vertebral y de tejidos blandos adyacentes.
Caso clínico
Paciente de sexo femenino , de 7 años de edad, que acude a consulta por un cuadro clínico de 5 días de evolución consistente en dificultad para la marcha asociada a múltiples caídas desde su propia altura y disminución progresiva de la fuerza en los miembros inferiores, sin otra sintomatología asociada.
Al examen de ingreso se encontraba sin alteración en sus signos vitales y con una exploración física general normal. En el examen neurológico no se encontró déficit en los pares craneales. Al evaluar la fuerza muscular, la paciente presentaba disminución de la fuerza en los miembros inferiores (4/5), sin alteración en los miembros superiores. Los reflejos miotendinosos mostraron hiperreflexia rotuliana y aquiliana bilateral junto con respuesta plantar extensora bilateral (signo de Babinski). Presentaba hipoestesia para todas las modalidades sensitivas, con nivel T10.
Al ingreso a la institución, la paciente fue valorada por pediatría. Por el hallazgo de síndrome piramidal e hipoestesias en los miembros inferiores, se sospechó lesión a nivel torácico, por lo que se solicitó resonancia magnética (RM) de columna y tomografía computariza da (TC) de cráneo simple para descartar otros diagnósticos diferenciales.
La TC descartó patología intracraneal; sin embargo, la RM de columna (Fig. 1) evidenció una lesión de señal intermedia en T1 y T2 comprometiendo el cuerpo vertebral T9, con fractura patológica por compresión axial con extensión al canal espinal y los tejidos blandos paravertebrales, condicionando compresión medular con mielopatía radiológica. El componente epidural presentó unos diámetros aproximados de 36 x 33 x 10 mm; se asoció con una discreta alteración en la señal del muro posterior de los cuerpos vertebrales adyacentes por infiltración contigua. Dado el hallazgo de vertebra plana con extensión epidural y paraespinal en una niña de 7 años, se consideró, como primera posibilidad, HCL en T9 con compromiso por contigüidad de T8 y T10.
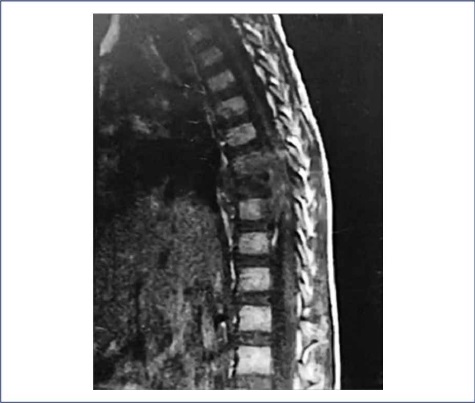
Figura 1 Resonancia magnética de columna en la que se evidenció una lesión de señal intermedia en T1 y T2 comprometiendo el cuerpo vertebral T9, con fractura patológica por compresión axial con extensión al canal espinal y los tejidos blandos paravertebrales, condicionando compresión medular con mielopatía radiológica.
Por los hallazgos descritos se dio inicio al tratamiento con esteroides y se realizó descompresión quirúrgica con laminectomía de T8-T9, encontrando un tumor gris rojizo friable no aspirable, vascularizado, que comprometía los pedículos de T8-T9 y con invasión del canal raquídeo en el 100%. Se realizó resección parcial y biopsia de la lesión.
La paciente presentó una evolución posquirúrgica adecuada, sin nuevo deterioro neurológico, con una recuperación completa de la fuerza y la sensibilidad en los miembros inferiores en la primera semana posoperatoria.
La valoración histológica del material resecado mostró una proliferación hipercelular de células, como linfocitos maduros, eosinófilos, neutrófilos, algunos plasmocitos y presencia de unas células grandes irregulares (algunas con núcleos con hendiduras, otras con nucléolo prominente y citoplasma espumoso). Los hallazgos morfológicos descritos sugieren un trastorno linfoproliferativo, que incluía como primera posibilidad diagnóstica la HCL; se realizó inmunohistoquímica de la biopsia y se encontraron marcadores CD1a y CD207 positivos, confirmando el diagnóstico de HCL.
Posterior al diagnóstico de HCL, la paciente fue so metida a tratamiento con vinblastina y prednisona por 6 semanas.
Discusión
La HCL es un trastorno histiocítico de etiopatogenia desconocida5,6. Tiene una sintomatología y una presentación clínica heterogéneas; es más común en la población pediátrica y afecta el sistema óseo en el 77% de los casos, la piel y las mucosas en el 39%, los nódulos linfáticos en el 19% y el hígado en el 16%5,7.
Si bien el 77% de las lesiones en la HCL son de paciente descrita en este caso, es rara7. De acuerdo con la literatura, solo el 1-8% de todos los casos tienen compromiso vertebral8,9. Usualmente, las lesiones multifocales se presentan en menores de 3 años, y las lesiones únicas ocurren en pacientes adultos.
La paciente descrita en este caso debutó con dificultad para la marcha y paraparesia espástica. Estos hallazgos también son poco frecuentes en pacientes con HCL, pues los síntomas más comunes son la presencia de exantema, disnea, taquicardia, polidipsia, linfadenopatías y pérdida de peso10. La sintomatología se deriva de la localización de la lesión y del compromiso multisistémico. Dado el compromiso único vertebral de la paciente, la sintomatología es extraña y poco concordante con la HCL.
En la HCL con compromiso vertebral , la manifestación más común es el granuloma eosinofílico , así como la presencia de un conglomerado de células de Langerhans , linfocitos , macrófagos, eosinófilos y células gigantes11. La imagen radiológica característica es el aplanamiento vertebral11, como presentaba la paciente.
El diagnóstico de HCL se realizó con una biopsia confirmatoria de la lesión, con histoquímica positiva para receptores CD1a y CD207. Siendo una enfermedad tan poco común y con sintomatología heterogénea, se deben plantear diagnósticos diferenciales. Las vértebras planas también se observan en enfermedades neoplásicas, como el sarcoma de Ewing, el osteosarcoma, el linfoma y la leucemia, y en patologías infecciosas como la tuberculosis y la osteomyelitis11-13. También deben considerarse enfermedades de trastornos histiocíticos, como la enfermedad de Erdhei-Chester, el xantogranuloma juvenil y la linfocitosis hemofagocítica14.
En cuanto al tratamiento, se debe iniciar el enfoque diagnóstico con una estratificación del riesgo y clasificar la enfermedad dependiendo de cuántos sistemas compromete. La Histiocyte Society15 sugiere, para el tratamiento de la HCL, una combinación de prednisona con vinblastina inicialmente por 6 semanas; este trata miento ha demostrado poca toxicidad y excelentes resultados. Las dosis recomendadas son 40 mg/m2 al día de prednisolona por 4 semanas y 6 mg/m2 semanal de vinblastina por 6 semanas15.
La Histiocyte Society15 recomienda realizar seguimientos en el primer año de tratamiento por el riesgo de toxicidad de los medicamentos. Por el compromiso vertebral de la paciente descrita, se sugiere realizar un seguimiento clínico cada 6 semanas, pruebas de laboratorio (función hepática y renal, osmolaridad sanguínea y urinaria, hemograma) cada 3 meses, e imágenes diagnósticas solo si se sospecha una recidiva tumoral15.
La frecuencia de recidiva en los pacientes similares al caso presentado anteriormente es muy baja, cercana al 5%, lo cual indica un buen pronóstico16. Si se evidencia algún tipo de recidiva, debe realizarse otro esquema con prednisolona, vinblastina y mercaptopurina. Se ha reportado hasta el 85% de éxito con este tratamiento de segunda línea17. El seguimiento se debe realizar con controles imagenológicos y bioquímicos.
El pronóstico en la enfermedad focal es muy bueno. En el caso de la enfermedad sistémica, el 60% de los pacientes que la presentan tienen un curso crónico, siendo necesario buscar otras líneas de tratamiento.
La HCL es una enfermedad poco frecuente, con una clínica heterogénea de difícil diagnóstico, y la presentación vertebral es muy rara. La presencia de vértebra plana orienta al diagnóstico, pero debe confirmarse con una evaluación histológica de la lesión.











 text new page (beta)
text new page (beta)


