Introducción
«La humanidad tiene tres grandes enemigos: la fiebre, el hambre y la guerra, de los cuales el mayor, por mucho, es la fiebre.»
(William Osler)
A pesar de que la temperatura es un signo vital clásico, su valoración en el paciente crítico ha recibido poca atención en comparación con otros signos, ya que, a diferencia de estos, las enfermedades infecciosas ocasionalmente afectan el sistema termorregulador.
En la unidad de cuidados intensivos (UCI) la fiebre ocurre, frecuentemente, tanto en el paciente adulto1 como en el pediátrico2, y aunque su origen puede ser diverso, la sepsis es su principal causa, alcanzando el 74% en los pacientes hospitalizados3, mientras que en la población infantil las patologías infecciosas representan el 80%4. La fiebre debe ser vista como un componente esencial del huésped en la respuesta inflamatoria sistémica, siendo un importante mecanismo de defensa y resistencia contra las infecciones, durante el cual el organismo por sí mismo se somete temporalmente a estrés térmico como un mecanismo regulador global5.
Existe importante evidencia experimental animal referente al beneficio de la fiebre6,7; no obstante, su presencia ocasiona un efecto deletéreo en los pacientes con daño cerebral agudo, alteración neuropsiquiátrica, una limitada reserva cardiorrespiratoria (choque) o inestabilidad metabólica8.
Tanto en la población general como en la médica existen conceptos erróneos sobre la fiebre y su tratamiento9,10,11,12,13,14. Habitualmente, la fiebre se trata en forma amplia y sistemática en muchas UCI, siendo frecuente que el paciente reciba terapia no farmacológica o farmacológica, pues se le atribuye un rol putativo de riesgo para la salud; sin embargo, no existe evidencia contundente a favor de su uso sistemático15. Se debe tener presente que el tratamiento de la fiebre siempre intervendrá con el proceso inflamatorio en curso en el huésped5. Por otra parte, los agentes farmacológicos para reducir la fiebre pueden causar efectos hemodinámicos indeseables (hipotensión arterial)16, disfunción plaquetaria y hemorragia gastrointestinal17 o disfunción hepatorrenal en el paciente deshidratado o con morbilidad asociada18,19,20,21,22,23,24.
Finalmente, para diversas condiciones específicas no está aún definido si la fiebre o la respuesta fisiológica a ella causa morbimortalidad, ni si su tratamiento confiere algún beneficio. De esta manera, el control térmico permanece en debate en el paciente con sepsis, así como también el propósito del mismo8,25,26.
Los objetivos de esta revisión son realizar una actualización sobre los mecanismos de termorregulación y el desarrollo de fiebre desde una perspectiva evolutiva, en su fisiopatología, y sobre la evidencia disponible para sus efectos benéficos y nocivos. Específicamente, se analiza el papel de la fiebre y el empleo de terapia antipirética en el paciente con una infección grave. No se efectuó una revisión sistemática sobre el tema.
Regulación de la temperatura corporal
La endotermia es una característica de todos los mamíferos y las aves27,28, quienes regulan su temperatura corporal mediante el balance entre la producción y la pérdida de calor. El calor es generado por la actividad metabólica y, dependiendo de la temperatura ambiental, puede ser adquirido desde el ambiente o perdido hacia el mismo. En respuesta a la infección, muchos animales aumentan en forma temporal su temperatura entre 2 y 4 °C mediante la alteración del equilibrio entre generación y eliminación de calor29.
En los mamíferos, el control homeostático de la temperatura corporal (termorregulación) es esencial y está estrictamente regulado (± 0.2 °C), obteniéndose mediante mecanismos autonómicos, endocrinos, metabólicos y conductuales30,31. A diferencia de otros mamíferos, los humanos presentan una alta capacidad defensiva contra el calor mediante la termorregulación autonómica del flujo sanguíneo cutáneo y la transpiración.
El sistema de termorregulación comprende una red de termorreceptores de ubicación periférica y central (vía aferente sensorial), un centro integrador (hipotálamo) y mecanismos efectores de calentamiento y enfriamiento corporal, los cuales incluyen la regulación del flujo sanguíneo periférico, la producción de escalofríos y la sudoración (enfriamiento evaporativo) (Fig. 1).
Se debe señalar que la actividad termorreguladora autonómica es similar en niños y adultos bajo condiciones ambientales neutras; no obstante, existen algunos patrones únicos en los lactantes32 y los niños, los cuales presentan una menor adaptación a temperaturas ambientales extremas (mayor relación superficie corporal/masa, menor pérdida evaporativa)33, así como también en los adolescentes prepuberales34. El paciente neonato presenta inestabilidad termorreguladora durante los primeros 2-3 días de vida, logrando luego una adecuada homeotermia35.
El rango normal para la temperatura corporal aceptado es de 36.1 a 37.8 °C36, presentando variación con la actividad física y los factores ambientales37. La temperatura central es mayor en el paciente pediátrico que en el adulto38.
Además del estricto control de la temperatura, existe variabilidad rítmica en un periodo de 24 horas, asociada con el ciclo sueño-vigilia (nadir matinal)39. Este ritmo circadiano está alterado en el paciente críticamente enfermo40.
Definición de fiebre, respuesta febril e hipertermia
La definición de fiebre es arbitraria, pues depende del método utilizado para su medición41, de la población estudiada (infección, cuidados posresucitación, etc.) y del propósito por el cual se determina42.
Se entiende por fiebre la elevación regulada de la temperatura central consecuencia de un complejo proceso inflamatorio y originada en el centro termorregulador, la cual es a menudo, pero no necesariamente, parte de la respuesta defensiva del huésped ante estímulos infecciosos y no infecciosos reconocidos como patogénicos o extraños43. De esta manera se origina una respuesta rápida y estereotipada del sistema inmunitario innato44 frente a las infecciones, en la cual la temperatura corporal raramente sobrepasa los 41 °C y no causa daño tisular.
Cabe destacar que la fiebre es uno de los componentes de la respuesta febril, entendida esta como una reacción fisiológica mediada por citocinas y caracterizada por la regulación al alta (upregulation) del punto de ajuste termostático, involucrando la generación de reactantes de fase aguda, la activación del sistema nervioso central y autonómico, la participación de los sistemas inmunitario y endocrinológico, y además un componente de modificación conductual30,45,46,47.
Finalmente, la fiebre debe ser distinguida de la hipertermia (> 41 °C), la cual corresponde a un aumento de la temperatura corporal no ocasionado por un cambio en el punto de ajuste hipotalámico, que no presenta variación diurna, es potencialmente deletérea y las citocinas pirogénicas no están directamente involucradas. Esto se debe a una alteración en los mecanismos que controlan la producción o la pérdida de calor (excesiva temperatura ambiental, síndrome neuroléptico maligno, tirotoxicosis grave).
Se define fiebre en los niños, según la Organización Mundial de la Salud, como una temperatura rectal ≥ 37.5 °C37. Clínicamente, fiebre es una temperatura corporal de al menos 1 °C más que la media en el sitio donde es evaluada. Los grados de temperatura aceptados como fiebre son ≥ 38 °C para la temperatura rectal y ≥ 37.4 °C para la temperatura axilar48. La importancia de por lo menos 1 °C más que la temperatura media radica en la variación diurna de la temperatura corporal normal, la cual se eleva por la tarde (17-19 h). Estas fluctuaciones son mayores en los niños que en los adultos, y más pronunciadas durante los episodios febriles48.
Mecanismos de la fiebre. Una estrategia de la evolución
Desde una perspectiva evolutiva, la fiebre surgió como una respuesta adicional del huésped ante la infección, previa a la aparición de la inmunidad adaptativa, pero en el escenario de una bien establecida respuesta de choque térmico e inmunidad innata en los animales mayores. Así, la fiebre es una respuesta inmunitariamente primitiva y filogenéticamente preservada en los mamíferos y las aves49, que data de probablemente hace 600 millones de años5,50 (Fig. 2). Esta respuesta se considera en general limitada a los animales homeotermos; no obstante, muchos animales poiquilotermos, como vertebrados menores51, artrópodos52 y anélidos, desarrollan un proceso similar incrementando su temperatura central ante la presencia de infección mediante la búsqueda de un ambiente más cálido.
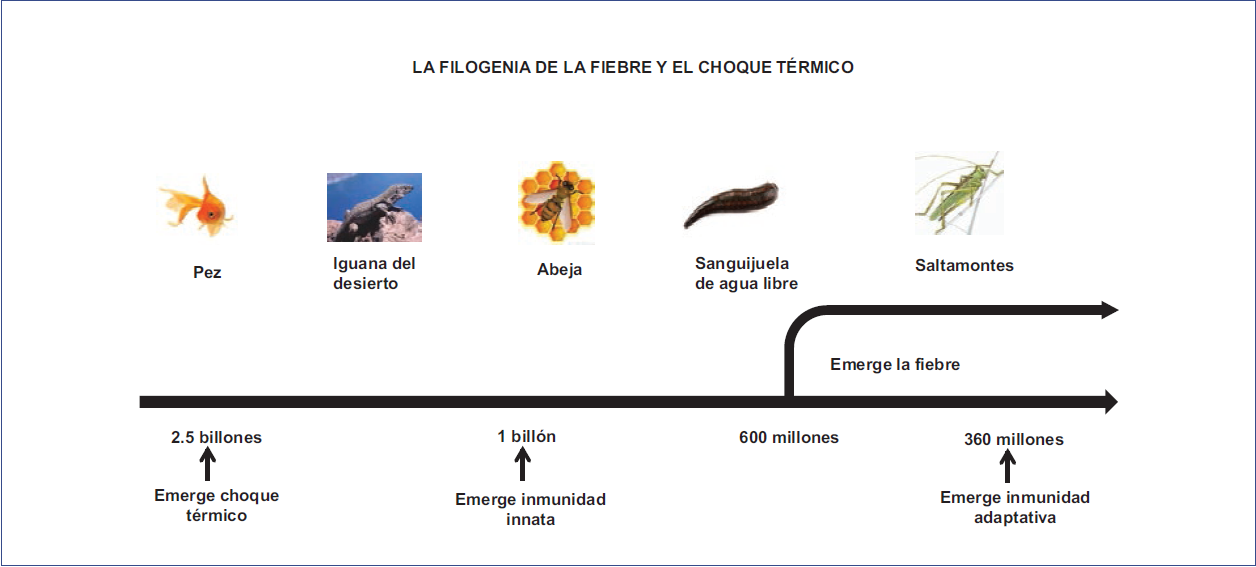
Figura 2 La relación filogenética de la fiebre, el choque térmico y la inmunidad innata y adaptativa. Los animales actuales utilizan la fiebre como una estrategia para hacer frente a la infección, como se muestra en la figura. Las edades filogenéticas aproximadas de la fiebre (600 millones de años) y los procesos biológicos relacionados también se observan en la figura.
La fiebre se ha documentado en las dos mayores divisiones de animales, deuterostomados y protostomados, lo que nos sugiere que el aumento de la temperatura central en respuesta a la infección es una estrategia conservada de supervivencia, la cual evolucionó desde el momento en que se separaron estas dos últimas líneas evolutivas52. Por otra parte, la fiebre puede bloquearse por inhibición de la enzima ciclooxigenasa (COX) en diversas especies de poiquilotermos53,54 y homeotermos, lo cual sugiere la posibilidad de que los mecanismos del desarrollo de la fiebre pudieron haber evolucionado desde un ancestro común.
Aunque la temperatura corporal normal de un mamífero está determinada por la temperatura climática cuando este apareció por primera vez en nuestro planeta55, en un reciente estudio se calculó que la temperatura central óptima de un mamífero es de aproximadamente 36.7 °C, derivada de la compensación entre la propagación bacteriana por hipotermia y el incremento del costo metabólico propio de la hipertermia56.
Bases celulares y moleculares
El desarrollo de fiebre implica que diversas vías de intercomunicación inmunitaria-neural propaguen la respuesta inflamatoria al sistema nervioso central, inmediatamente después de la activación periférica del sistema inmunitario innato57 (Fig. 3).
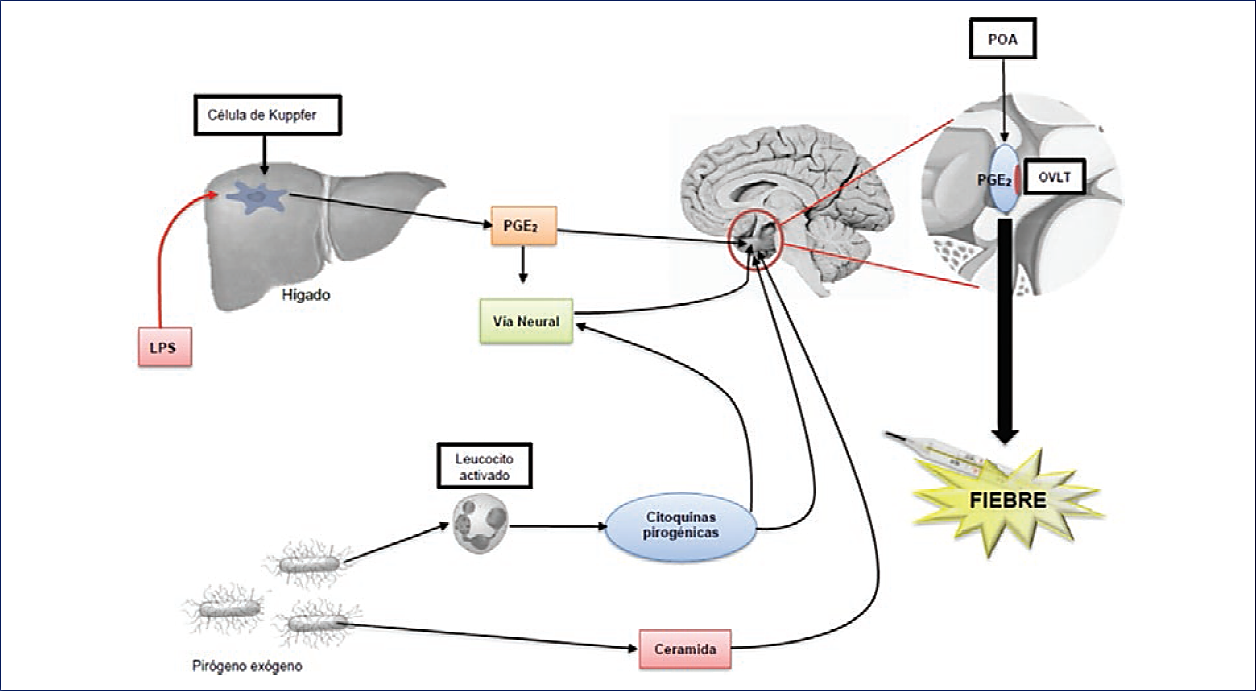
Figura 3 Mecanismo propuesto para la generación de la fiebre en la sepsis. La estimulación de células centinelas por pirógenos exógenos produce pirógenos endógenos, los cuales estimulan la producción de fiebre en el área preóptica del hipotálamo, vía segundos mensajeros tales como la prostaglandina E2 y la ceramida. La prostaglandina E2 también se produce en las células de Kupffer en el hígado, en respuesta a la estimulación del lipopolisacárido, la cual adicionalmente estimula el área preóptica por vía nervio vago. LPS: lipopolisacárido; OVLT: órgano vasculoso de la lámina terminal; PGE2: prostaglandina E2; POA: área preóptica. (Modificada de Walter, et al. 157)
En el modelo clásico de inducción de fiebre de origen infeccioso, el pirógeno exógeno lipopolisacárido44, un prototipo de patrón molecular asociado a patógeno (PAMP, pathogen-associated molecular patterns), es identificado por los receptores de reconocimiento de patrones o receptor Toll-like tipo 4 en lo que podemos denominar una «primera oleada»58. Dichos receptores se encuentran ubicados en las células inmunitarias periféricas circulantes (monocitos y macrófagos) y residentes (células de Kupffer hepáticas), originando la transcripción genética, sintetizando y liberando pirógenos endógenos como la interleucina-1, el factor de necrosis tumoral alfa (TNF-a, tumor necrosis factor)59, la interleucina 6 y el interferón gamma (Tabla 1). Estas citocinas, junto con los PAMP, desencadenarán una «segunda oleada» de activación, originando una intercomunicación inmunitaria-neural por vía de los receptores vagales (núcleo del tracto solitario troncoencefálico), en la barrera hematoencefálica y en los órganos circunventriculares, específicamente en el órgano vasculoso de la lámina terminal (OVLT), el cual está localizado en el receso óptico de la región anteroventral del tercer ventrículo y se interconecta con los núcleos preópticos del hipotálamo44,60,61.
Tabla 1 Principales pirógenos endógenos, mediadores antipiréticos y su acción
| Mediador | Papel en la fiebre |
|---|---|
| IL-I | Pirógeno endógeno más potente en humanos |
| TNF-a | Pirógeno endógeno; mediador de la inflamación |
| IL-6 | Pirógeno endógeno |
| IL-8 | Pirógeno endógeno |
| IFN-γ | Pirógeno endógeno |
| MIP-1β o CCL4 | Quimiocina de monocitos y linfocitos T, entre otras células inmunitarias |
| NF-κB | Factor transcripcional que controla la expresión de pirógenos endógenos |
| AP-1 | Factor transcripcional que controla la expresión de pirógenos endógenos |
| IL-I RA | Citocina endógena antipirética |
| IL-10 | Citocina endógena antipirética |
| TNF-α-BP | Citocina endógena antipirética |
| AVP | Antipirético endógeno |
| α-MSH | Antipirético endógeno |
| Glucocorticoides | Antipirético endógeno |
| ACTH | Antipirético endógeno |
ACTH: hormona adrenocorticotropa; AP-1: proteína activadora 1; AVP: arginina-vasopresina; CCL4: ligando de quimiocina 4; IFN-γ: interferón gamma; I-L: interleucina; IL-I RA: antagonista del receptor de IL-I; MIP-1b: proteína inflamatoria de macrófagos 1 beta; α-MSH: hormona estimulante del melanocito alfa; NF-κB: factor nuclear kappa B; TNF-α: factor de necrosis tumoral alfa; TNF-α-BP: receptor del factor de necrosis tumoral alfa.
Se debe destacar que el mecanismo exacto mediante el cual las citocinas circulantes (moléculas hidrófilas) alcanzan el tejido neural no ha sido dilucidado por completo. Se han propuesto diversas hipótesis, tales como una alteración de la barrera hematoencefálica en la zona del OVLT, el transporte activo de citocinas o la activación de receptores para citocinas en el endotelio de la vasculatura neural62.
El OVLT sintetiza prostaglandina E2 (PGE2) intracerebral, la cual es el mediador crítico terminal63, por vía de la enzima inducible COX-2 y la prostaglandina E1 (PGE1) sintasa microsomal64,65. En modelos experimentales animales se ha demostrado que el mecanismo de transcripción de la COX-2 muestra regulación al alta (upregulation) en las células endoteliales y perivasculares de la microvasculatura cerebral entre 90 minutos y 12 horas después de la administración de lipopolisacárido66,67,68.
La PGE2 intracerebral, mediante el AMP cíclico, actúa en el núcleo preóptico reduciendo la frecuencia de disparo de las neuronas sensibles al calor, originando una respuesta destinada a disminuir la pérdida de calor y aumentar su producción hasta alcanzar un nuevo punto de ajuste hipotalámico, el cual, una vez logrado, será mantenido por el mismo mecanismo empleado en la regulación de la temperatura corporal normal.
La PGE2 se elimina activamente del cerebro mediante el transportador de aniones orgánicos-3, pero la relación entre su tasa de eliminación cerebral y la duración de la fiebre aún no está establecida69.
El derivado lipídico ceramida puede actuar como segundo mensajero independientemente de la PGE2, siendo de particular importancia en los estadios precoces de la generación de la fiebre70.
Debe destacarse la existencia de un mecanismo de retroalimentación negativa mediado por glucocorticoides, vía factor nuclear kappa B (NF-kB) y activador de proteína-1. Asimismo, la respuesta febril también está regulada por citocinas antipiréticas específicas (Tabla 1).
Existe evidencia en numerosos modelos experimentales del papel de la COX-2 en la vasculatura neural para la generación de fiebre71. Así, ratones knockout para COX-2 no son capaces de originar una respuesta febril72, y en humanos, el uso de inhibidores selectivos de la COX-2 reduce la fiebre73,74. No obstante, las citocinas pirogénicas estimulan la generación de PGE2 y además pueden contribuir al desarrollo de fiebre mediante vías alternativas (independientes de la PGE2)75, lo cual podría explicar la falla terapéutica de los inhibidores de la COX-2 en algunos pacientes.
Consecuencias metabólicas de la fiebre
La estimulación del área preóptica hipotalámica por mediadores pirogénicos ocasiona activación simpática76 y determina el desarrollo de taquicardia en el paciente con sepsis (estrés adrenérgico)77. Sin embargo, esta también puede presentarse en caso de bloqueo de la actividad simpática78, atribuyéndose un papel a mediadores humorales (prostanoides) y factores metabólicos sobre los receptores celulares del marcapaso cardíaco79.
El incremento de la temperatura corporal origina un aumento en la frecuencia cardíaca (10 lat/min por cada grado Celsius)80,81, del gasto cardíaco y del consumo de oxígeno (VO2)82, además de una mayor producción de dióxido de carbono (VCO2)83 y catecolaminas63 84. Por el contrario, el enfriamiento corporal en el paciente febril sedado y ventilado reduce el gasto energético85, y en el paciente críticamente enfermo reduce el VO2 en un 10% por cada grado Celsius de disminución de la temperatura central, así como también el VCO23,86. De lo anteriormente mencionado, parece evidente que cualquier efecto benéfico de la fiebre siempre debe ser evaluado en forma individual y acorde al costo metabólico originado por la misma, en especial en pacientes con baja reserva cardiorrespiratoria (altas dosis de vasopresores-inótropos, asincronía paciente-ventilador).
Consecuencias inmunitarias de la fiebre
La fiebre induce la producción de proteínas de choque térmico (HSP, heat shock proteins), las cuales se encuentran altamente preservadas entre distintos organismos87 y se expresan en respuesta a diferentes estímulos o condiciones de estrés88,89, siendo esenciales para la sobrevida celular90; su función es dotar de termotolerancia a la célula29,91,92,93.
Ante la presencia de fiebre, la extravasación transendotelial de los neutrófilos94 y la capacidad de fagocitosis son optimizadas95. Además, la unión mediada por L-selectina del linfocito humano al endotelio vascular se ve mejorada con la temperatura en rango febril, lo cual favorece la migración linfocitaria al sitio de inflamación tisular. Sin embargo, neutrófilos y macrófagos presentan una significativa disminución en su funcionamiento a temperaturas ≥ 41 °C96. Finalmente, el incremento de la temperatura ocasiona una aceleración de la apoptosis dependiente de la caspasa en neutrófilos humanos, proceso que desempeña un papel en limitar la inflamación y el daño tisular durante la infección97.
Consecuencias farmacológicas de la fiebre
La fiebre puede afectar la absorción, la distribución y la eliminación de algunos fármacos administrados al paciente crítico. Muy pocos estudios se han efectuado en población humana98. Se ha descrito una alteración en el perfil farmacocinético para algunos antibióticos99. De este modo, aún no existe certeza sobre los efectos de la fiebre en la farmacocinética y la farmacodinámica que permita eventualmente modificar la terapia farmacológica en el paciente séptico febril.
Importancia de la fiebre en los animales con infección
Si el desarrollo de fiebre representa una respuesta beneficiosa o riesgosa para el huésped ha sido tema de debate por muchas décadas100, y aún no existe una respuesta inapelable disponible. Quizás el argumento más poderoso para apoyar su efecto benéfico presenta bases teleológicas7,50. Como se ha señalado, la fiebre está presente en los animales vertebrados ectotermos (reptiles, anfibios y peces) y endotermos (mamíferos y aves), así como también en algunos invertebrados. Dado el significativo costo metabólico-energético y nutricional de la respuesta febril83, su persistencia en un tan amplio grupo de organismos nos entrega evidencia sobre su ventaja evolutiva7. Diversos modelos experimentales animales así lo han demostrado, entre los que destacan los estudios pioneros de Kluger, et al. 100 referentes a la conducta de búsqueda de calor en lagartos infectados y su efecto en la sobrevida7,53,101.
El incremento artificial de la temperatura ha probado mejorar la sobrevida del ratón a la infección por virus herpes simple102, poliovirus103, virus Coxsackie104, virus de la rabia105 y en un modelo experimental de peritonitis bacteriana por Klebsiella pneumoniae106. No obstante, se debe destacar que este aumento térmico no se homologa a la respuesta febril en los animales endotermos.
En un modelo animal de choque séptico se demostró un mayor tiempo de sobrevida en el grupo experimental (fiebre > 39 °C), a la vez que el uso de terapia antipirética se asoció con menores concentraciones de HSP70 circulante107.
Por otra parte, un metaanálisis sobre el efecto del uso de fármacos antitérmicos en animales infectados con virus de la gripe demostró que su empleo se asoció con un mayor riesgo de mortalidad108, y similares hallazgos se han evidenciado para infecciones bacterianas53,109,110.
A pesar de que las consideraciones provenientes de una visión evolutiva avalan el efecto protector de la fiebre, estas no necesariamente son aplicables al paciente crítico en la actualidad, en quien la eliminación de patógenos es asistida con tratamiento farmacológico.
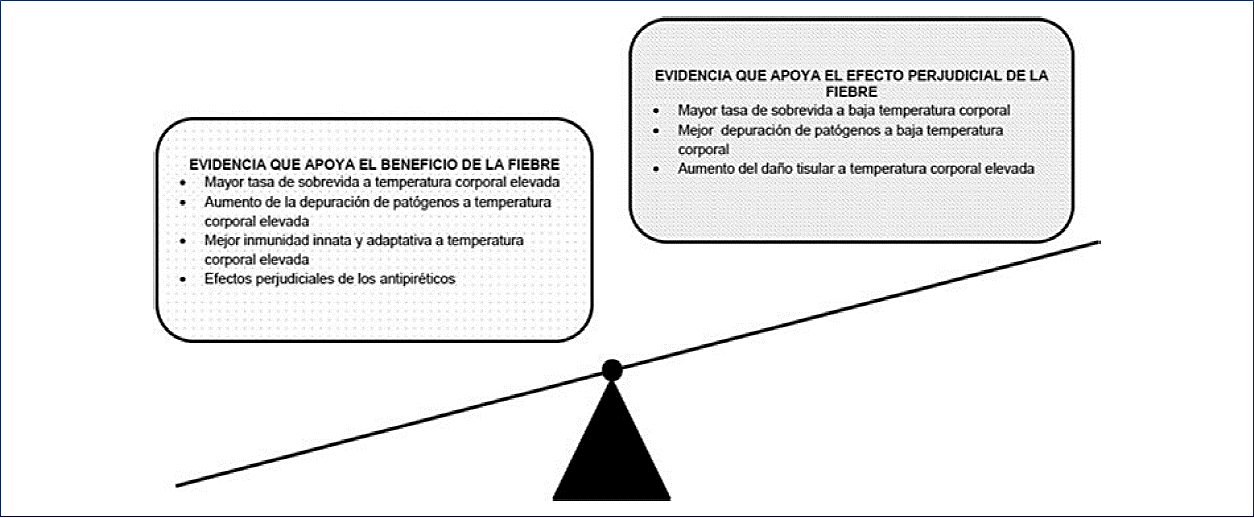
En resumen, aunque no hay una respuesta consistente proveniente de estudios experimentales sobre el beneficio de la fiebre en la enfermedad crítica, la balanza se inclina sutilmente hacia su valor benéfico (Fig. 4). Sin embargo, aún no se han manifestado los efectos protectores de estos hallazgos experimentales en el ámbito clínico.
Fiebre en el paciente con infección
Dado lo previamente señalado, la pregunta debe ser: ¿en qué condiciones es beneficioso tratar la fiebre?
El efecto de la fiebre en el pronóstico del paciente adulto sigue siendo objeto de controversia. Esto se debe, en parte, a que se ha reportado el uso de diversas definiciones y momentos en los cuales la fiebre se ha evaluado, por lo que es difícil identificar un umbral para el desarrollo de consecuencias clínicas relevantes. Diversos estudios en pacientes con sepsis han comunicado un efecto deletéreo111, neutro112 o benéfico113 de la fiebre. Recientemente, un gran estudio de cohorte retrospectivo mostró en pacientes sépticos no neutropénicos que la presencia de fiebre se asociaba con una menor mortalidad, hallazgo no evidenciado en los pacientes neutropénicos, lo que podría sugerir una relación entre la activación del neutrófilo durante el episodio febril y la mortalidad114.
En la población infantil existen escasas comunicaciones sobre el papel de la fiebre en el paciente en la UCI. Gordijn, et al. (2 señalaron en un estudio observacional retrospectivo que el 40% de los pacientes presentaron fiebre durante su permanencia en la UCI, la mayoría dentro de las primeras 48 horas de ingresados y en relación con el diagnóstico primario. La fiebre que se iniciaba tras 48 horas se asoció con una mayor estadía.
La literatura científica señala un mayor riesgo para el desarrollo de fiebre y pone de manifiesto una relación entre la magnitud de esta (> 39.5 °C), la gravedad de la enfermedad y la mortalidad1. Por lo tanto, parece razonable asumir que el tratamiento antipirético podría mejorar el pronóstico del paciente; sin embargo, como se señala a continuación, esta presunción no es tan evidente como parece.
Tratamiento antipirético en el paciente con infección
Se han propuestos diversos enfoques para el control de la fiebre:
-Tratarla cuando ocurre: se administra un fármaco cuando la temperatura excede un umbral predefinido.
-Estricta prevención de la fiebre: se mantiene la temperatura bajo el umbral de la fiebre.
-Estricta mantención de la normotermia: mediante un manejo dirigido de la temperatura (TTM, targeted temperature management), en el que se ocupa un rango predefinido de normotermia (36-37 °C).
En cuanto a las estrategias terapéuticas empleadas en el paciente febril, no existe una práctica estandarizada, aunque habitualmente su uso se justifica en términos de bienestar y disminución del estrés fisiológico cardiorrespiratorio16,42,111,115. Sin embargo, la mayoría de los médicos inician tratamiento cuando la temperatura es > 38.5 °C116. No existen datos que confirmen, en el paciente con sepsis, la superioridad de una modalidad de terapia antipirética sobre otra117. En la Tabla 2 se mencionan algunos criterios para la elección de métodos antipiréticos (farmacológicos y no farmacológicos).
Tabla 2 Criterios propuestos para la elección entre terapia antipirética farmacológica y no farmacológica para el paciente con sepsis
| Fármaco antipirético | Enfriamiento físico |
|---|---|
| Paciente no sedado | Disfunción hipotalámica |
| Necesidad concomitante de analgesia | Necesidad de control térmico estricto |
| Paciente con inestabilidad hemodinámica | |
| Ausencia de respuesta al uso de terapia farmacológica |
Es importante destacar que los agentes antipiréticos actúan en el punto de ajuste hipotalámico, lo cual suprime la respuesta generadora de temperatura y, por ende, para ser efectivos se requiere la integridad del sistema termorregulador. En contraparte, los dispositivos de enfriamiento de superficie reducen la temperatura corporal, pero no disminuyen la producción de temperatura. Ambos presentan mecanismos opuestos sobre el tono vascular; el primero de ellos provoca vasodilatación para mejorar la pérdida de calor, mientras que el enfriamiento corporal produce vasoconstricción. Esto ocasionará una repercusión hemodinámica distinta en el paciente con sepsis16, la cual se debe tener en consideración.
En la actualidad, no es posible establecer con certeza si tratar la fiebre en el paciente con sepsis neurológicamente indemne es beneficioso o riesgoso para su pronóstico vital117,118 (Fig. 5). Sin embargo, la evidencia disponible señala que una temperatura > 40 °C debe de ser tratada en cualquier caso117. A favor de su tratamiento, se señala que la inducción de cambios sistémicos originados por la fiebre, tales como aumento de la demanda de oxígeno y energía (siendo esta última especialmente riesgosa en el paciente con sepsis y disfunción hemodinámica), se puede disminuir mediante una estrategia antipirética16. Asimismo, en modelos experimentales animales se ha demostrado que la fiebre puede empeorar el daño pulmonar inflamatorio119,120 y exacerbar el daño inducido por la ventilación mecánica121.

Figura 5 Riesgos potenciales (extraneurológicos) de la fiebre en el paciente séptico y objetivos terapéuticos de su control. CO2: dióxido de carbono; PK/PD: farmacocinética/farmacodinámica.
Empero, el tratamiento de la fiebre puede enmascarar síntomas y signos para el pronto diagnóstico de una infección grave122,123 y retardar el inicio de una apropiada terapia antibiótica, lo que se asocia con mayor mortalidad124. Además, al decidir tratar la fiebre en forma indiscriminada, se debe tener presente que esta mejora la función inmunitaria celular125, determina la velocidad de crecimiento de algunos patógenos bacterianos126 y virales16 127, influye en la magnitud de la parasitemia128 y optimiza la acción bactericida de la terapia antibiótica129. Asimismo, la evidencia clínica señala que el paciente con sepsis naturalmente hipotérmico presenta un peor pronóstico vital que el paciente que genera una respuesta febril130,131,132. Recientemente, un hallazgo similar se ha descrito para pacientes con síndrome de dificultad respiratoria aguda133. Además, un estudio multicéntrico observacional confirmó que el uso de agentes antipiréticos, ya fueran antiinflamatorios no esteroideos o paracetamol, incrementa la mortalidad en los pacientes con sepsis112. En la misma línea, el estudio en curso Fever and antipyretic in critically ill patients evaluation (ensayo FACE II)134 comparará la seguridad y la eficacia de dos objetivos de control de temperatura (< 38 vs. < 39.6 °C) en la supervivencia del paciente.
Existen potenciales riesgos de la terapia antipirética en relación con el curso temporal de la enfermedad, evidenciándose en condiciones experimentales in vivo la excesiva liberación de TNF desde las células inmunitarias (inhibición de la retroalimentación negativa por PGE2) 135. En clínica, el uso de paracetamol se ha relacionado con el desarrollo de hipotensión arterial136, siendo la presencia de sepsis un factor de riesgo para este padecimiento137; su uso también se ha asociado con acidosis piroglutámica en pacientes críticos adultos138 y pediátricos139. Últimamente se ha evaluado el papel de este fármaco como antioxidante en el paciente con sepsis140, y están en desarrollo ensayos clínicos sobre su seguridad y eficacia en pacientes críticos adultos141,142 (NCT02280239-NCT01869699).
En la actualidad existen pocos estudios aleatorizados que evalúen la eficacia de la terapia antipirética en pacientes adultos críticamente enfermos. Bernard, et al.143 no encontraron diferencia en la mortalidad a los 30 días con el uso de ibuprofeno por 48 horas en pacientes con sepsis y al menos una disfunción orgánica. Zhang, et al.144 señalaron que no hay una reducción de la mortalidad con el uso de terapia antipirética en los pacientes con sepsis. Se ha demostrado (ensayo HEAT) que el uso de paracetamol intravenoso cada 6 horas, frente a placebo, en pacientes con infección o sospecha de esta y temperatura > 38 °C (20% con choque séptico), no fue efectivo en disminuir el número de días libres de UCI, así como tampoco presentó ningún efecto benéfico sobre la mortalidad a los 28 y 90 días145,146,147.
Dos importantes metaanálisis concluyeron que el uso de terapia antipirética no muestra beneficio en lo referente a la mortalidad en pacientes de UCI con infección y sin patología neurológica148,149. Si bien el uso de fármacos antipiréticos143,150,151 reduce la temperatura en el paciente crítico152, no existe evidencia contundente sobre su efecto en la reducción de la mortalidad153.
En relación con el uso de enfriamiento de superficie para alcanzar la normotermia (TTM: 36.5-37 °C) en el paciente adulto con choque séptico febril ventilado, un estudio multicéntrico francés demostró que es seguro y útil en cuanto a disminuir el requerimiento de vasopresores y lograr una mejor sobrevida a los 14 días. Sin embargo, hubo más infecciones secundarias en el grupo intervenido y no se observó diferencia en la mortalidad al momento del alta de la UCI o del hospital154. Un análisis post hoc confirmó que el descenso observado en la mortalidad era efecto directo de la disminución de la temperatura corporal y no de una reducción de la frecuencia cardiaca155. El uso de medidas de enfriamiento externo es difícilmente tolerado por el paciente consciente, y recientemente se señaló que su uso puede ser riesgoso en el paciente con sepsis144.
Referente al empleo de hipotermia terapéutica, aún no se han comunicado los resultados del estudio danés Cooling And Surviving Septic Shock Study (CASS)156, el cual evalúa el uso de hipotermia inducida (32-34 °C) por 24 horas, seguida de un control térmico (36-38 °C) por 48 horas, en la mortalidad de pacientes adultos con choque séptico.
A futuro, dados los resultados inconsistentes en el uso de terapia antipirética en el paciente crítico, revisiones sistemáticas y metaanálisis debieran establecer si la fiebre en una población específica es un marcador de gravedad o un factor de riesgo asociado y si su tratamiento pudiese mejorar el pronóstico vital.
Conclusiones
La fiebre es una respuesta evolutivamente antigua y bien conservada, en general beneficiosa, del huésped ante la infección. Sin embargo, la asociación entre fiebre, etiología, tratamiento antipirético y morbimortalidad es particularmente compleja, permaneciendo aún muchas interrogantes.
La continua progresión en el conocimiento de la fisiopatología de la inducción de la fiebre en el paciente con sepsis debería llevar a un mejor entendimiento de las razones para emplear una determinada estrategia de control térmico. Aunque no existen recomendaciones sobre un método preferido en la práctica clínica, el médico dispone de opciones precisas, seguras y eficientes.
En la actualidad no existe evidencia definitiva del efecto benéfico del uso de terapia antipirética en el paciente pediátrico con sepsis en la UCI. La evaluación de la respuesta biológica ante una determinada estrategia de control de la temperatura permitirá una terapia individualizada, lo cual debería ocasionar un manejo más coherente del paciente febril y, eventualmente, una mejoría en el pronóstico.











 nueva página del texto (beta)
nueva página del texto (beta)