Infecciones del tracto urinario
Las infecciones del tracto urinario (ITU) son causadas principalmente por patógenos de origen intestinal que contaminan la uretra y ascienden hasta la vejiga. Adicionalmente, algunos factores propios de la bacteria o del hospedero favorecen la colonización del riñón, donde el uropatógeno asciende a través de los uréteres1. Las ITU pueden ser adquiridas en la comunidad y en los hospitales, y están asociadas con elevadas tasas de morbilidad en todo el mundo2. Estas ITU son clasificadas de acuerdo con el sitio de infección: orina (bacteriuria asintomática), vejiga (cistitis), riñón (pielonefritis) y sangre (bacteriemia)3. Las ITU también son caracterizadas con signos y síntomas generales tales como hematuria, piuria, disuria, frecuencia urinaria, urgencia, fiebre, además de dolor en la espalda baja y suprapúbico4.
En México, las ITU son un problema de salud pública por su alta morbilidad. Cada año se registran aproximadamente cuatro millones de casos5. Las poblaciones con alto riesgo de contraer ITU son los recién nacidos, las niñas en edad preescolar, las mujeres con actividad sexual y ambos sexos en la edad avanzada1),(2. Las ITU en la edad reproductiva representan la segunda causa de morbilidad en las mujeres, y en el embarazo son la causa más frecuente de complicaciones perinatales6. En el año 2016 se reportaron 3,149,091 de casos de ITU en mujeres, de los cuales 1,392,235 fueron en mujeres entre 20 y 44 años de edad6. En el sexo masculino, las ITU fueron la tercera causa de morbilidad, con 957,875 casos por año. La distribución está asociada con la edad; sin embargo, esta infección disminuye en los adultos mayores de 44 años6. Las ITU en la pubertad (15 a 19 años) representan la tercera causa de morbilidad, con 297,831 casos; en la edad pediátrica (< 15 años) causan 360,220 casos6. La prevalencia de las ITU en menores de un año es de 20,300 casos por año; adicionalmente, la frecuencia de estas infecciones es del 0.4-1.0% en las niñas, del 0.1% en los niños circuncidados y del 0.7% en los niños no circuncidados6),(7.
Escherichia coli uropatogénica (UPEC, por sus siglas en inglés) es el agente causal en más del 80% de las ITU; sin embargo, las infecciones por catéter en los hospitales se han asociado también con otros géneros, como Staphylococcus, Klebsiella, Enterobacter, Proteus y Enterococcus. La secuenciación completa de los genomas de las cepas clínicas de UPEC -F11, IAI39, UMN026, UTI89, 536, CFT073, ABU 83972 y VR50- ha mostrado que la adquisición de factores de virulencia ocurre en islas de patogenicidad, plásmidos y fagos a través de la transferencia horizontal de genes8. Estos factores de virulencia están localizados en la superficie bacteriana. Algunos de ellos, que la bacteria utiliza para colonizar el tracto urinario (TU) y para generar patología clínica, son exportados para anclarse en la membrana externa (Figura 1)9),(10. El mecanismo de patogenicidad de UPEC inicia con la adherencia a través de la participación de adhesinas fimbriales (FimH, PapG, SfaS, FocH, CsgA y DrA) localizadas en la parte distal de diferentes fimbrias (tipo 1, P, S, F1C, curli y Dr, respectivamente)11),(12. La interacción de las adhesinas con los receptores (proteínas a-D-manosiladas, glicoesfingolípidos, ácido neuramínico, factor que acelera el decaimiento [Daf, por sus siglas en inglés] y proteínas de la matriz extracelular), localizados en las células del TU, activa diferentes vías de señalización (apoptosis) y contribuye a la colonización de las células del TU13),(14. La expresión de la a-hemolisina (HlyA, por sus siglas en inglés), la toxina autotransportadora secretada (Sat, por sus siglas en inglés) y el factor necrotizante citotóxico (CNF-1, por sus siglas en inglés) contribuye al aumento de la capacidad citotóxica en el TU10. La presencia de sistemas de captación de hierro (yersiniabactina y aerobactina) es necesaria para la persistencia y la colonización de UPEC en una zona anatómica con un bajo aporte de hierro9. La adherencia de UPEC a las células del TU es un proceso inicial que promueve la invasión para evitar el flujo de la orina, la actividad de anticuerpos y de proteínas con propiedades bactericidas, además de la acción de los antibióticos15. La invasión por UPEC ocurre a través de un mecanismo tipo zipper, un proceso que involucra la membrana celular del hospedero para envolver a la bacteria mediante la activación de varias proteínas (tirosina cinasa, fosfoinositol-3 [PI-3] cinasa y la proteína de control de división celular [Cdc, por sus siglas en inglés]) que promueven complejos entre componentes del citoesqueleto (como la actina, los microtúbulos y la vinculina)16. Interesantemente, UPEC es capaz de sobrevivir dentro de los macrófagos, un evento que contribuye a su diseminación en el TU17. En el citoplasma, UPEC inicia la formación de estructuras tipo biopelículas, denominadas comunidades bacterianas intracelulares (CBI), que se encuentran encapsuladas en vesículas fusiformes RAB27b+ (por las siglas en inglés de proteína relacionada con Ras) y están asociadas con filamentos intermedios de las células del TU18. La formación de CBI ocurre en tres etapas: estado temprano (formación), estado intermedio (maduración) y estado tardío (eflujo y liberación por las células del TU)19. La interacción del lipopolisacárido (LPS) con el receptor tipo Toll 4 (TLR-4, por sus siglas en inglés) favorece el aumento de monofosfato cíclico de adenosina (cAMP, por sus siglas en inglés) y la expulsión de UPEC envueltas en vesículas RAB27b+18),(20),(21. La activación de TLR-4 por UPEC (LPS, FimH y PapG) genera un estado oxidativo intracelular, el cual promueve la filamentación por la inhibición de la división bacteriana22. El crecimiento de los filamentos de UPEC promueve la lisis celular del huésped, el eflujo de la bacteria y el inicio de un nuevo ciclo de infección23),(24. UPEC puede entrar en un estado quiescente por periodos prolongados en los exosomas, un mecanismo que favorece a la bacteria para pasar desapercibida por el sistema inmunitario25. El canal 3 tipo mucolínico TRP (TRPML3, por sus siglas en inglés) se expresa en la superficie del exosoma y puede ser activado por UPEC, promoviendo la neutralización y la exocitosis de los exosomas con bacterias en estado quiescente26. La salida de UPEC envuelta en vesículas fusiformes es probablemente promovida por la fusión con la membrana celular del uroepitelio utilizando vías alternas, las cuales tienen como finalidad el aumento de la superficie celular y la distención de la vejiga27. La salida del estado quiescente de la bacteria favorece el proceso de reinfección del TU por la misma bacteria, lo que se define como ITU recurrente. Esta recurrencia favorece la presencia de pielonefritis y urosepsis28. La patogenicidad de UPEC por diferentes mecanismos promueve la colonización, la persistencia y la recurrencia de la infección, aunque el huésped también establece una respuesta inmunitaria contra las ITU (Figura 1).
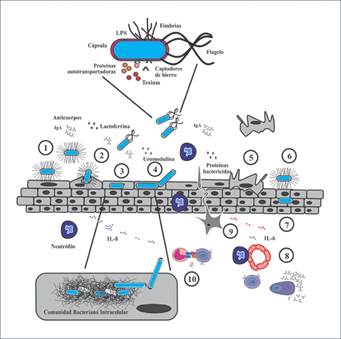
Figura 1 Mecanismo de patogenicidad de Escherichia coli uropatogénica (UPEC) en el tracto urinario (TU). La principal E. coli extraintestinal es UPEC, la cual puede colonizar el TU usando factores de virulencia (fimbrias, flagelo, cápsula, lipopolisacárido [LPS], proteínas autotransportadoras, toxinas y sideróforos). El mecanismo de patogenicidad se inicia por la adherencia íntima a las células superficiales del TU (1) activando un proceso de invasión (2), el cual permite a la bacteria permanecer intracelularmente para formar comunidades bacterianas intracelulares (3). La interacción de UPEC con la célula promueve un estado de oxidación intracelular, promoviendo la filamentación de la bacteria y su posterior eflujo por la lisis de la célula (4). La interacción célula-bacteria estimula un proceso de apoptosis y el desprendimiento de las células protectoras del TU, como un mecanismo de defensa en el TU (5). El epitelio intermedio del TU permanece expuesto y UPEC coloniza nuevamente para un nuevo ciclo de infección (6). Después de la reinfección, UPEC puede permanecer intracelularmente en estado quiescente hasta por varios meses (7). El eflujo de UPEC es estimulado por la misma bacteria o a través de la célula del huésped, saliendo y colonizando el TU. Por otro lado, la lactoferrina, la uromodulina, los anticuerpos IgA, la catelicidina y las defensinas son secretados por diversos tipos celulares del huésped para inhibir la unión de UPEC al TU. El uroepitelio produce IL-6 e IL-8, estimulando la migración de células de la respuesta inmunitaria, principalmente de neutrófilos (8). La activación de las células presentadoras del antígeno (APC, por sus siglas en inglés) por la captación de antígenos asociados a UPEC (9) permite la presentación de péptidos a las células T y la diferenciación de células B a células plasmáticas (CP) que producen inmunoglobulinas (10).
Respuesta inmunitaria en el tracto urinario
La vejiga es una mucosa constituida por tejido estratificado de tres a seis capas uroteliales, clasificadas en basal (5-10 µm de diámetro), intermedia (20 µm de diámetro) y de superficie (25-250 µm de diámetro); además, la submucosa contiene vasos sanguíneos y linfáticos29. Las células presentadoras de antígeno (APC, por sus siglas en inglés), las células que expresan el complejo principal de histocompatibilidad (MHC, por sus siglas en inglés) de clase II positivas a la proteína de diferenciación celular 11c (CD11c+, por sus siglas en inglés), las células F480+, las células dendríticas (DC, por sus siglas en inglés), los macrófagos y las células T-ab y -gd, han sido descritas como células residentes del sistema inmunitario en la mucosa30. Las células del revestimiento del TU son la primera línea de defensa contra los uropatógenos y se caracterizan principalmente por secretar proteínas solubles, como la uromodulina. Esta proteína estimula la liberación de las interleucinas (IL) -1, -6 y -8, siendo las primeras moléculas detectadas en el TU después de la infección, las cuales generan la maduración de DC mieloides y la migración de fagocitos a la vejiga y al riñón31),(32. La uromodulina evita la adherencia de UPEC al TU por la inducción de agregados bacteria-uromodulina, facilitando la eliminación de la bacteria por el flujo de orina33)-(35.
Los TLR-2, TLR-4, TLR-5 y TLR-11 son receptores para el reconocimiento de patrones (PRR, por sus siglas en inglés) que son expresados en las células del TU y son capaces de iniciar una fuerte respuesta inmunitaria proinflamatoria30),(36. La activación temprana (2 horas posinfección) de PRR en las células del TU por UPEC favorece la liberación de IL-8, un quimioatrayente que genera la migración de neutrófilos a la vejiga para el aclaramiento de la bacteria32. Los macrófagos residentes que no expresan el complejo 6 del antígeno linfocitario (LY6C− locus C1, por sus siglas en inglés) en la submucosa del TU actúan como células vigía de uropatógenos; una vez activados, secretan el ligando 1 de la quimiocina motivo C-X-C (CXCL1, por sus siglas en inglés) y el factor de migración de macrófagos (MIF, por sus siglas en inglés), que reclutan un mayor número de neutrófilos. Mientras, el ligando 2 de la quimiocina motivo C-C (CCL2, por sus siglas en inglés) es secretado por macrófagos LY6C− para su propio reclutamiento37. Por debajo del uroepitelio se localizan células cebadas (mastocitos), que actúan como inmunomoduladoras durante las ITU, induciendo la liberación de citocinas proinflamatorias, como el factor de necrosis tumoral (TNF, por sus siglas en inglés) y la histamina38. De 6 a 12 horas posinfección, los mastocitos producen IL-10, que suprime la respuesta inmunitaria39. Existen otras células del sistema inmunitario, conocidas como asesinas naturales (NK, por sus siglas en inglés), DC y T-gd; sin embargo, su función ha sido poco estudiada en el TU. Modelos in vivo utilizando ratones deficientes en células NK mostraron que son más susceptibles a la infección por UPEC, probablemente por la liberación deficiente de TNF40. De manera similar, ratones deficientes en el receptor de células T-gd son más susceptibles a las ITU comparados con ratones silvestres, debido a que estas células son fuente de IL-1741. Las DC identificadas en el TU han mostrado una amplia actividad durante las ITU, y su contribución en la respuesta inmunitaria aún no se ha definido específicamente42. La inmunidad adaptativa en la vejiga es limitada; en el riñón, se ha sugerido que puede generar la producción de anticuerpos específicos contra UPEC43.
Cepas clínicas de UPEC multirresistentes y extremorresistentes
El aumento de cepas de UPEC multirresistentes (MDR, por sus siglas en inglés) y extremorresistentes (XDR, por sus siglas en inglés) ha complicado el tratamiento de las ITU, y ello ha impactado directamente en el costo y en la estancia hospitalaria44. Se ha descrito la caracterización (perfil de resistencia, integrones y betalactamasas de espectro extendido [BLEE]) y la tipificación (genes de virulencia y grupos filogenéticos) de cepas clínicas de UPEC MDR y XDR aisladas de niños con ITU complicada. Brevemente, las cepas clínicas de UPEC MDR se agruparon dentro del filogrupo D y se asociaron con la presencia de integrones de clase 1 y 2. Las cepas de UPEC XDR se agruparon principalmente en el grupo de filogenéticos B2 y mostraron un fenotipo de BLEE. La distribución de los genes que codifican las adhesinas fimbriales FimH, CsgA y PapG variante II se identificaron en ambos grupos de cepas clínicas de UPEC45. Es importante señalar que una disminución significativa de las ITU requiere la contribución de nuevas vacunas viables que generen una protección eficiente contra las cepas de UPEC MDR y XDR.
Vacunación
Las vacunas disponibles son dirigidas principalmente a la respuesta inmunitaria sistémica, debido a la dificultad de estimular la inmunidad de la mucosa46. Diferentes antígenos de UPEC (antígeno O, FimCH [FimH unida a la chaperona FimC], PapDG [PapG unida a la chaperona PapD], HlyA e IroN) han sido evaluados después de la inmunización parenteral en modelos animales, generando una respuesta específica sistémica y no en la mucosa47)-(50. La inmunogenicidad en la mucosa es inducida eficazmente por la administración de antígenos por vía intranasal, intravaginal y oral, mientras que con la administración parenteral se obtiene una respuesta no eficiente51. La vacuna SolcoUrovac® (lisados de uropatógenos), administrada por vía vaginal, reduce significativamente las ITU recurrentes en fase clínica II52. Sin embargo, con la administración de la vacuna por vía vaginal se han observado reacciones adversas manifestadas por dolor e irritación del epitelio vaginal53. La administración oral del inmunomodulador UROstim estimula una respuesta celular y humoral, pero sin generar protección contra la infección54. La administración diaria de OM-89/Uro-Vaxom® por vía oral logra una reducción de las ITU recurrentes; sin embargo, esta vía de inmunización genera tolerancia inmunitaria y manifestaciones gastrointestinales55. La inmunización por vía transuretral con cepas de UPEC atenuadas en ratones no es persistente en el TU y da lugar a una protección inespecífica56. La inmunización intranasal con diferentes antígenos de UPEC (ChuA, Hma, Iha, IreA, IroN, IutA y FimH) activa la liberación de altas concentraciones de IgA en la saliva, la vagina y la orina57),(58. Recientemente se ha demostrado que los anticuerpos contra las adhesinas fimbriales generan una disminución en la adherencia y la invasión bacteriana, y por lo tanto una protección en las células de vejiga humana contra la colonización por UPEC59. La vacunación intranasal con adhesinas fimbriales puede ser la mejor vía para generar una respuesta inmunitaria humoral con anticuerpos IgA en la mucosa del TU para proteger al huésped contra las ITU por UPEC.
Vacunación intranasal
El tejido linfoide asociado a mucosas (MALT, por sus siglas en inglés) incluye NALT (tejido linfoide asociado a nasofaringe), BALT (tejido linfoide asociado a bronquios), GALT (tejido linfoide asociado a intestino, incluyendo placas de Peyer y folículos linfoides), órganos genitourinarios, además de las glándulas mamaria y salival. Estas mucosas están funcionalmente conectadas como un sistema inmunitario de mucosas común, con un sitio inductor (células T y B inactivas) y un sitio efector (células T y B efectoras)60),(61.
La administración de vacunas por vía intranasal con dosis bajas de antígeno induce una respuesta inmunitaria en la mucosa nasal, oral y urogenital, en comparación con otras vías de inmunización62. La inmunización intranasal en ratones con una proteína de fusión basada en adhesinas de UPEC y de la bacteria Proteus ha estimulado la producción de anticuerpos IgG e IgA en muestras de suero, lavado nasal, lavado vaginal y orina63. Por otro lado, seis proteínas relacionadas con la captación de hierro de UPEC administradas a ratones CBA/J por vía intranasal generaron una respuesta sistémica y de mucosa con títulos altos de anticuerpos IgM, IgG y IgA, así como una respuesta celular caracterizada por la inducción de interferón gamma (IFN-g) y de IL-1758. El tipo de adyuvante es importante para obtener una inmunización efectiva; sin embargo, en esta revisión, el enfoque se centra en describir únicamente el compuesto monofosforil lípido A (MPL) derivado del LPS de Salmonella64. El MPL es un adyuvante efectivo con propiedades inmunoestimuladoras, como el LPS, pero carece de toxicidad65. Las vacunas formuladas con las proteínas de superficie del virus de la hepatitis B, toxoide tetánico y antígenos de influenza suplementados con el adyuvante MPL han mostrado altos títulos de anticuerpos IgA en muestras de lavados de la mucosa vaginal66. Adicionalmente, se han observado altos títulos de anticuerpos IgG1 e IgG2 en sueros de ratones inmunizados por vía intranasal; los anticuerpos IgA también se han localizado en el sitio efector (lavado traqueal) y en la mucosa distal (lavado vaginal). Las vacunas formuladas con MPL inducen una inmunidad sistémica característica de una respuesta tipo Th166.
Adhesinas fimbriales y respuesta inmunitaria
Diversos estudios han descrito la patogenicidad de la bacteria, la respuesta inmunitaria en el TU y las vacunas evaluadas contra las ITU. Estos datos se han empleado para el desarrollo de estrategias efectivas en la prevención, el tratamiento y el manejo de las ITU causadas por la aparición de cepas de UPEC MDR y XDR. Las vacunas contra las ITU son generadas a partir de proteínas de UPEC (adhesinas fimbriales, autotransportadores, toxinas, sideróforos, flagelo y proteínas de la membrana externa) localizadas en la superficie de la bacteria, involucradas en el mecanismo de patogenicidad, expresadas durante la infección y consideradas como estimuladoras de la respuesta inmunitaria del hospedero67. UPEC produce las adhesinas FimH localizada en la parte distal de la fimbria tipo 1, PapG en la fimbria P, SfaS en la fimbria S, Focl en la fimbria F1C, DraA en la fimbria Dr y CsgA en la fimbria curli. Estas adhesinas fimbriales participan en gran medida en la adherencia y la colonización de las células del TU11. La fimbria tipo 1 está ampliamente distribuida (80-90%) en las cepas de UPEC, y relacionada con procesos de adherencia, invasión y formación de CBI en el TU68. El gen csgA, que codifica la proteína CsgA de la fimbria curli, se ha identificado en la mayoría (≥ 95%) de las cepas de UPEC, y se caracteriza por participar en procesos de cistitis y urosepsis69)-(71. La fimbria P tiene una distribución del 35-45% en cepas de UPEC y participa en la colonización del riñón mediante la interacción con globoceramidas, que son expresadas en la superficie de las células renales. La diversidad de globoceramidas ha favorecido la aparición de tres variantes alélicas del gen papG: papG J96 (variante I), papG AD/IA2 (variante II) y prsG J96 (variante III)72. Es importante mencionar que las adhesinas FimH, CsgA y PapG (variante II) son relevantes en la patogénesis de UPEC, además de tener una amplia distribución en comparación con otras adhesinas fimbriales. Por lo tanto, estas adhesinas pueden ser consideradas biomoléculas viables para la generación de una vacuna eficaz que estimule una respuesta inmunitaria.
Inmunogenicidad de FimH
La adhesina FimH de la fimbria tipo 1 es ampliamente utilizada como vacuna en modelos animales. El suero de ratones C3H/HeJ inmunizados con FimH y la fimbria tipo 1 inhibe la adherencia a células humanas de vejiga73. El dominio de unión a la manosa de FimH, la proteína completa y en asociación con FimC (chaperona) reducen significativamente la adherencia en la vejiga y el riñón de ratones y de monos cynomolgus. Estos datos sugieren que los anticuerpos específicos anti-FimH inhiben la colonización de UPEC49),(74)-(76. Las vacunas multivalentes generadas con diversos factores de virulencia de la superficie bacteriana son consideradas biomoléculas funcionales por su capacidad inmunógena. La proteína recombinante FimH fusionada con FliC induce un aumento de la respuesta inmunitaria celular y humoral contra las ITU en un modelo de ITU en ratón. Además, se han identificado valores altos de inmunoglobulinas (IgG1 e IgG2a) y la liberación de citocinas (IFN-g e IL-4) por las células T (Th1 y Th2) después de la inmunización subcutánea77. La proteína de fusión de FimH (UPEC) y MrpH (Proteus mirabilis) induce significativamente la expresión de anticuerpos IgG e IgA en diversas muestras de ratón (suero, orina, lavado nasal y vaginal) después de la inmunización por vía intranasal. La inmunidad celular de tipo Th1 y Th2, generada por las proteínas FimH/MrpH con o sin adyuvante MPL, sugiere que una de estas proteínas funciona como molécula adyuvante63. La proteína FimH interacciona con el TLR-4 a través de un correceptor a-manosilado que favorece la activación de las células epiteliales CD4− mediante la vía Tirap-MyD88 para el reclutamiento de neutrófilos en la mucosa78),(79.
Inmunogenicidad de CsgA
La proteína CsgA ha sido considerada como una adhesina involucrada en la adherencia de UPEC a las células de la vejiga71. Los títulos altos de anticuerpos anti-CsgA identificados en sueros de pacientes convalecientes de sepsis sugieren que esta proteína es expresada in vivo. Sin embargo, la inmunogenicidad de esta proteína en UPEC no ha sido estudiada, aunque la fimbria curli de otras E. coli induce significativamente la liberación de citocinas proinflamatorias, como TNF-a, IL-6 e IL-8, en células de macrófagos80. La proteína recombinante CsgA de Salmonella y la fimbria curli de E. coli MC4100 participan en la liberación de IL-8 en células de macrófagos humanos THP-1 por la interacción cooperativa de TLR-1 y TLR-281. La proteína CsgA también se ha considerado como un PAMP (siglas en inglés de patrón molecular asociado a patógenos), que genera una respuesta de IL-6 e IL-1b mediante la vía del inflamosoma (NLRP3)82),(83.
Inmunogenicidad de PapG
La adhesina PapG de UPEC ha sido involucrada en procesos de pielonefritis en humanos84. La interacción de PapG con un correceptor del TLR-4 con características de esfingolípido activa la secreción de IL-6 e IL-878),(85. La inmunización intraperitoneal de la fimbria completa y de un complejo proteico de PapDG induce la producción de anticuerpos específicos en sueros de ratón y mono cynomolgus; además, cortes histológicos muestran una protección contra la inflamación del riñón47),(86. Sin embargo, se observaron diferencias no significativas entre el número de bacterias recuperadas en orina y el grupo control, probablemente por la expresión de otras fimbrias que contribuyen en la colonización bacteriana47.
Proteínas de fusión multiméricas
Las proteínas recombinantes generadas por tecnología de fusión para la incorporación de antígenos de uno o más patógenos han conferido una mayor respuesta inmunitaria y protección en modelo animal contra las ITU63),(87. Estos antígenos o biomoléculas son conocidos como quimeras o proteínas de fusión. Recientemente se han demostrado la importancia y la distribución de las fimbrias tipo 1 (FimH), curli (CsgA) y P (PapG) en cepas de UPEC aisladas de pacientes pediátricos45. Estas cepas de UPEC MDR y XDR contienen factores de resistencia a diferentes familias de antibióticos, lo cual reduce las opciones de tratamiento45.
El presente grupo de investigación ha diseñado, en el Laboratorio de Investigación de Bacteriología Intestinal, una biomolécula funcional para la generación de una vacuna viable que permita disminuir las ITU en México. La biomolécula de fusión ha sido construida a partir de las adhesinas FimH, CsgA y PapG variante II de la fimbria tipo 1, curli y P de UPEC, respectivamente (Figura 2). Los resultados teóricos de las proteínas de fusión son estables, con un alto número de epítopos lineales, conformacionales y péptidos con afinidad por el MHC de clase II (Tabla 1). Los ensayos de bioactividad de estas proteínas aumentan la liberación de IL-6 e IL-8 en células de vejiga humana HTB-5, con un máximo de 521.24 pg/ml para FCP (FimH-CsgA-PapG) y 450.4 pg/ml para FC (FimH-CsgA). La antigenicidad de las proteínas de fusión usando suero y orina de pacientes con ITU reconocen altos títulos de IgA, en comparación con las muestras de pacientes con urocultivo negativo (sin presencia de leucocitos ni nitritos en orina y sin síntomas de ITU). Los anticuerpos policlonales de conejo contra las proteínas de fusión reducen la adherencia de UPEC a las células de vejiga HTB-5, mostrando una inhibición del 73% para la proteína dimérica FC59.
Tabla 1 Análisis bioinformático de las propiedades fisicoquímicas e inmunológicas de las proteínas fusión.
| Proteínas de fusión | No. de aminoácidos | Peso molecular | ∆G (kcal/mol) | Epítopos lineales | Epítopos conformacionales | Péptidos MHC de clase II |
|---|---|---|---|---|---|---|
| FC | 417 | 43.09 | −11,912.82 | 18 | 13 | 86 |
| CP | 450 | 48.83 | −7,040.78 | 27 | 12 | 68 |
| PF | 617 | 66.4 | −7,140.54 | 32 | 8 | 147 |
| FCP | 751 | 79.85 | −13,866.68 | 32 | 17 | 149 |
| CPF | 751 | 79.85 | −13,343.83 | 33 | 14 | 152 |
| PFC | 751 | 79.85 | −13,577.65 | 33 | 13 | 159 |
C: CsgA; F: FimH; ∆G: Energía libre de Gibbs; MHC: Complejo principal de histocompatibilidad; P: PapG.
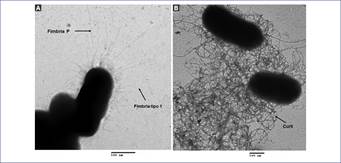
Figura 2 Visualización de las fimbrias en la cepa de UPEC U52 por microscopía electrónica de transmisión. A la izquierda se muestra una micrografía de la cepa UPEC U52 en la que pueden verse fimbrias cortas y largas, que corresponden a las fimbrias tipo 1 y P, respectivamente. Morfológicamente, ambas son rectas y delgadas. A la derecha se muestra otra micrografía en la que se observan fibras finas en forma de rizos flexibles que forman estructuras amiloideas denominadas curli. Las micrografías fueron generadas en la Central de Instrumentación de Microscopía de la Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional, bajo la asesoría del Dr. Edgar Oliver López Villegas. La barra inferior corresponde a una escala de 500 nm.
Los datos generados por nuestro grupo de trabajo mostraron que el uso de dos o más moléculas involucradas en la patogénesis de UPEC puede considerarse una nueva forma de potenciar la respuesta inmunitaria contra las ITU (Figura 3). Las vacunas multiméricas contra las ITU pueden ser diseñadas a partir de los diversos antígenos que son expresados en las cepas de UPEC. Otros estudios han mostrado que la proteína de fusión con FimH de UPEC y MrpH de P. mirabilis (MrpH/FimH) genera una respuesta inmunitaria y una protección contra ambas bacterias. De manera interesante, la inmunización intranasal de ratones BALB/c con la proteína de fusión FimH/MrpH genera una misma actividad inmunógena63. Las proteínas de fusión que incluyen PAMP inducen una respuesta específica, potente y rápida, en ausencia de adyuvante88. El reconocimiento específico de PAMP es mediado principalmente por TLR, un PRR que estimula cambios en la presentación del antígeno y la activación celular36. El TLR-4 es activado por la interacción con la proteína FimH mediante un correceptor a-manosilado que estimula la vía MyD88-NFkB, la cual estimula la liberación de IL-6 e IL-8. El TLR-4 es activado también por la interacción de la adhesina PapG con el correceptor glicoesfingolípido, la cual promueve la vía Tram/Trif-NFkB, induciendo la liberación de IL-6 e IL-8, además de la migración de neutrófilos al uroepitelio78. Ambas adhesinas generan un aumento en la liberación de citocinas, como ha sido demostrado por este grupo de trabajo59. Adicionalmente, la adhesina CsgA, otra proteína con propiedades de adhesión, puede interaccionar con el complejo TLR-1/TLR-2 y generar una mayor estimulación en la liberación de IL-6 e IL-8 mediante la vía MyD88-NFkB (Fig. 3 B)81),(83. La interacción de PRR con las proteínas de fusión generadas a partir de diferentes adhesinas (FimH, CsgA y PapG) probablemente puede generar la activación rápida y la presentación de los diferentes antígenos en la APC. En casos específicos, algunos de los PAMP pueden servir como un adyuvante eficaz y seguro. La célula B puede tener la capacidad de actuar como APC y presentar los péptidos para la activación de la célula T cooperadora89. Así mismo, puede activarse ella misma para generar una célula plasmática que secrete anticuerpos específicos contra los diferentes epítopos de las adhesinas, de los cuales se ha demostrado su presencia en sueros y orinas de pacientes con ITU (Fig. 3 C)59. La finalidad es la generación de anticuerpos de mucosa del isotipo IgA, específicos contra las principales fimbrias y con capacidad para bloquear el paso inicial de la patogenicidad de UPEC en las ITU, como se ha demostrado en los ensayos de inhibición59.
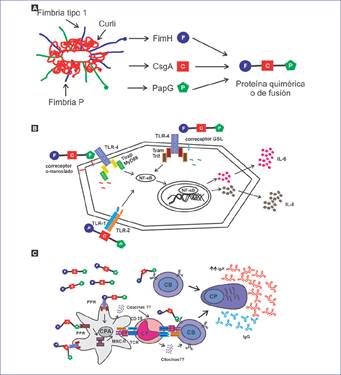
Figura 3 Propuesta de un mecanismo de interacción de las proteínas de fusión con el sistema inmunitario. A: Las adhesinas fimbriales FimH, PapG y CsgA unidas con la secuencia repetida EAAAK pueden potenciar la respuesta inmunitaria contra las infecciones del tracto urinario (ITU). B: La proteína FimH activa al TLR-4 mediante un correceptor a-manosilado por la vía MyD88-NFkB, y la adhesina PapG por la interacción con un correceptor glicoesfingolípido que promueve la vía Tram/Trif-NFkB. Ambas vías de señalización celular promueven la liberación de IL-6 e IL-8, seguido de la migración de neutrófilos al uroepitelio. La adhesina CsgA interacciona con el complejo TLR1/TLR2 generando una mayor estimulación en la liberación de IL-6 e IL-8 mediante la vía MyD88-NFkB. C: La interacción de las adhesinas FimH, CsgA y PapG con PRR puede aumentar la activación rápida y la presentación de epítopos en la APC. Algunas de estas adhesinas pueden funcionar como un adyuvante eficaz y seguro. La célula B puede actuar como APC, presentar los péptidos para la activación de la célula T cooperadora y activarse ella misma. Posteriormente, generarán células plasmáticas que secreten anticuerpos específicos contra los diferentes epítopos de las adhesinas en sueros y orinas de pacientes con ITU.
Perspectivas
Las ITU por UPEC están asociadas con la expresión de múltiples factores de virulencia ensamblados en la superficie bacteriana. La prevención de la adherencia, como el paso inicial y fundamental en la colonización del TU, puede ser la vía para la prevención de las ITU. La adherencia es mediada por adhesinas fimbriales con capacidad antigénica e inmunogénica. Sin embargo, la variedad y la regulación en la expresión de las fimbrias han limitado la eficiencia en la vacunación con formulaciones simples. El uso de biomoléculas como formulaciones multiméricas es viable por los avances de la bioinformática, la biología molecular y los protocolos de purificación de proteínas. El aumento en el número de epítopos y péptidos durante la sinapsis inmunitaria puede generar anticuerpos con capacidad protectora contra la adherencia de UPEC al TU. La ventaja de emplear componentes multiméricos en la generación de una proteína de fusión es la posibilidad de que una de esas proteínas pueda funcionar como adyuvante alterno y, por lo tanto, evitar el uso de adyuvantes sintéticos en la formulación. La inmunización por vía intranasal ha generado grandes beneficios en la inducción de una respuesta inmunitaria de mucosas distantes a la mucosa nasal. Bajo este esquema de inmunización, se considera que la administración de una proteína de fusión multimérica puede activar las células del sistema inmunitario en el NALT, migrar a su sitio efector en el TU y producir anticuerpos IgA para proteger al hospedero contra la infección por UPEC.
Conclusiones
Los antígenos localizados en la superficie bacteriana, expresados in vivo e involucrados en mecanismos de patogenicidad, son viables para la generación de proteínas de fusión multiméricas, las cuales pueden ser utilizadas para el desarrollo de nuevas vacunas contra las ITU. Los nuevos datos generados a partir de las proteínas de fusión sugieren que estas biomoléculas pueden ser consideradas como vacunas funcionales sin el uso de adyuvantes en las formulaciones contra las ITU. La inmunización intranasal de vacunas ha sido la mejor vía de administración por su capacidad de generar una respuesta inmunitaria en la mucosa del TU. Sin embargo, deben realizarse más estudios enfocados en la respuesta inmunitaria celular y humoral en el TU.











 nueva página del texto (beta)
nueva página del texto (beta)


