1. Introducción
La respiración humana es una función básica de la vida. El ser humano nace condicionado para respirar por la nariz y alimentarse por la boca, por lo que el proceso de respiración requiere el libre paso de aire por los espacios nasal y naso-oro-faríngeo. La función respiratoria asociada con la correcta masticación, deglución y acción muscular de los labios y lengua estimulará el crecimiento y desarrollo facial en su conjunto dado que el crecimiento óseo responde al adecuado funcionamiento de los músculos y tejidos blandos faciales, como está descrito en la teoría de Moss1. El crecimiento del tercio medio facial y la conformación de la arcada dental inician a partir de la primera respiración y terminan al finalizar la segunda infancia2, y están ligados a la adecuada ventilación de los senos paranasales en relación con el volumen de aire que pueda transitar por la nariz3. El tercio medio facial está integrado por los huesos que forman el techo de la boca, el suelo y las paredes laterales de la órbita, gran parte de la cavidad nasal que aloja en su interior al septum nasal, cornetes inferiores, medios y superiores, así como a las múltiples cavidades de los senos maxilares y etmoidales, que sirven de sostén y dan forma a los tejidos blandos de los que dependerá la configuración externa de la cara. Por tanto, estos tejidos tienen una gran importancia fisiológica y estética; de modo que algún padecimiento que involucre cualquiera de estas estructuras puede contribuir a una alteración en su crecimiento y desarrollo.
2. Biomecánica de la vía aérea superior
Investigaciones previas han demostrado que las alteraciones dinámicas en la permeabilidad son una función de la presión intraluminal a través de los segmentos flexibles en los conductos biológicos de los sistemas cardiovascular, gastrointestinal y genitourinario4 5 6 7 8. En el caso de las vías respiratorias superiores, el segmento permeable flexible, que corresponde a la faringe, está conectado con dos segmentos rígidos. El segmento superior corresponde a la nariz y el segmento inferior corresponde la tráquea (Fig. 1A).
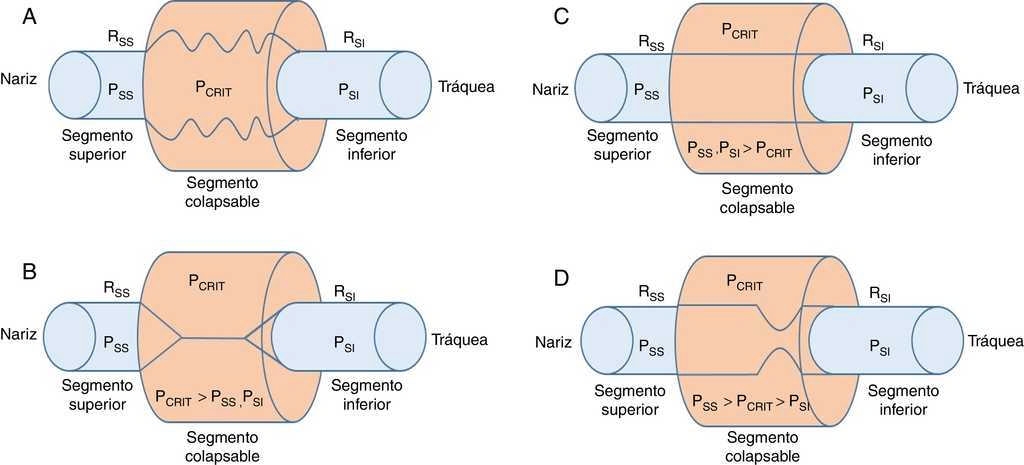
Figura 1 Modelo de resistencia de Starling de la vía aérea superior. A. Un segmento flexible está conectado con un segmento rígido superior (fosas nasales) y un segmento rígido inferior (tráquea). Estos segmentos rígidos se caracterizan por las presiones intraluminales en los segmentos superior e inferior (PSS y PSI), respectivamente, y la resistencia al flujo de aire en los segmentos superior e inferior (RSS y RSI), respectivamente. B. Cuando la PCRIT > PSS, PSI, la vía respiratoria se cierra. C. Cuando ambas, PSS y PSI se mantienen por encima de PCRIT, la vía aérea es permeable. D. Cuando PSS es mayor que PCRIT, pero PSI es menor que PCRIT, la vía aérea presenta un flujo limitado en la inspiración y puede alternar rápidamente entre un estado abierto y uno cerrado.
Los conductos aéreos de los segmentos superior e inferior al sitio flexible tienen diámetros y resistencias fijas —resistencia del segmento superior (RSS) y resistencia del segmento inferior (RSI)—, así como presiones variables —presión del segmento superior (PSS) y presión del segmento inferior (PSI)—. Es importante mencionar varias características de este modelo, conocido como el modelo de resistencia de Starling9, destacando los siguientes conceptos:
La presión fuera de los conductos rígidos y del conducto flexible es positiva, y dentro de los mismos es negativa, lo que permite que la corriente de aire fluya libremente por los conductos.
Los componentes dentro del sistema generan resistencia al paso del aire; al aumentar la resistencia, se requiere más presión para que transite el aire hacia el interior del sistema.
Los segmentos rígidos del conducto no tienen riesgo de colapsarse; solamente la porción flexible. Con base en esto se genera un nuevo concepto: la presión crítica (PCRIT), que representa el riesgo del colapso, parcial o total, de la porción flexible, y que genera como resultado una menor o mayor obstrucción.
Al obstruirse la porción superior del segmento se modifica la presión dentro del conducto, lo que incrementa la presión habitual desde el nivel de -18 a -10 cmH2O hasta el nivel de +4 cmH2O, lo que durante el sueño genera el cierre o colapso de la vía en el segmento flexible10. Cuando la PCRIT es mayor a PSS y PSI que se conectan con el segmento flexible, la presión intramural es positiva, las vías respiratorias se cierran y cesa el flujo del aire (Fig. 1B).
El flujo puede ser restablecido elevando la PSS por encima de PCRIT. Si la PSS y la PSI son mayores que la PCRIT, la presión intramural es negativa, las vías respiratorias se abren y permiten el adecuado flujo del aire (fig. 1C). En estas condiciones, el flujo a través de la vía aérea superior es proporcional a la presión gradiente a través de toda la vía aérea, y puede ser descrito por la relación tensión-corriente de la ley de Ohm:
donde VIMAX representa el volumen inspiratorio máximo.
En contraste, cuando la PSS es mayor que la PCRIT y la PSI es menor que la PCRIT, la vía aérea se encuentra en una condición limitada de flujo (Fig. 1D). Puesto que el ciclo inspiratorio varía rápidamente entre los estados de cierre y apertura, la presión en el segmento flexible permanece casi constante a la PCRIT. Si la presión en el segmento flexible es constante, el flujo de aire también se mantiene constante. Bajo estas circunstancias, el flujo se vuelve independiente de la PSI y se llega a un nivel de VIMAX. Dado que la PCRIT reemplaza a la PSI, favorece el retorno eficaz del flujo inspiratorio. Por tanto, el nivel del VIMAX se rige por el gradiente de la PSS y PCRIT entre la resistencia a través del segmento superior, de acuerdo con la siguiente ecuación:
En este modelo, la disminución de la PSI no genera la oclusión de la vía aérea superior y no puede ser un factor para el desarrollo de apneas obstructivas durante el sueño.
Es importante señalar que la limitación del flujo inspiratorio de aire tiene dos implicaciones en el sistema respiratorio. En primer lugar, la resistencia de la vía aérea aumenta notablemente en el flujo limitado en comparación con el estado normal. En ausencia de obstrucción de la vía aérea superior, las resistencias combinadas de los segmentos superior e inferior fluctúan entre 1 y 2 cmH2O/l/s, lo que representa aproximadamente la mitad de la resistencia total del sistema durante la respiración normal. En contraste, durante los periodos de flujos limitados inspiratorios, la resistencia al flujo aéreo del segmento superior puede incrementarse hasta entre 20 y 40 cmH2O/l/s. En segundo lugar, se impone una carga adicional en el sistema respiratorio durante los periodos de limitación de flujo en virtud del hecho de que los pacientes continúan ejerciendo cada vez mayor esfuerzo inspiratorio sin aumentar el flujo de aire. En esencia, una gran parte de la presión generada por los músculos inspiratorios se desperdicia al no aumentar la respiración debido al colapso dinámico de la vía aérea superior. Por tanto, el aumento en la resistencia de las vías respiratorias y el colapso dinámico de la vía aérea superior provocan un sobre-esfuerzo inspiratorio que no podrá vencer la obstrucción al flujo aéreo. Por otra parte, varios estudios han demostrado una relación directamente proporcional entre la colapsabilidad faríngea y la gravedad de la obstrucción respiratoria11 12 (Fig. 2). En la medida en que la PCRIT se eleva, clínicamente se observa un aumento en el grado de la obstrucción de las vías respiratorias superiores durante el sueño. Las elevaciones mínimas en la PCRIT se han asociado con los ronquidos, mientras que elevaciones moderadas (niveles entre -5 y 0 cmH2O) se han asociado con hipopneas y el síndrome de resistencia de la vía aérea superior (SARS). Con mayores aumentos de la PCRIT, esta se vuelve positiva y se provoca la apnea obstructiva del sueño. Por lo tanto, las diferencias cuantitativas en la PCRIT se han asociado con cambios graduales en la gravedad de la obstrucción de las vías respiratorias durante el sueño.

Figura 2 Relación entre la presión crítica (PCRIT) y los trastornos clínicos caracterizados por la obstrucción de la vía aérea superior durante el sueño. Conforme la PCRIT aumenta, la gravedad de la obstrucción de la vía aérea superior aumenta progresivamente, lo que sugiere una relación directamente proporcional entre la colapsabilidad de la vía aérea superior y el empeoramiento de la obstrucción en roncadores asintomáticos, pacientes con síndrome de resistencia a las vías respiratorias superiores (SARS), hipopneas obstructivas y apneas obstructivas.
3. Consideraciones anatómicas
Dada la importancia funcional de la nariz en la respiración, la presencia de una válvula nasal permeable, un septum tanto óseo como cartilaginoso posicionados en la línea media, cornetes inferiores y medios de volúmenes adecuados, y un tejido linfoide adenoideo no hipertrófico, facilitará dicha función sin alterar el desarrollo del tercio medio facial.
Diferentes investigadores han identificado una variedad de factores anatómicos que contribuyen al aumento de la colapsabilidad de las vías respiratorias superiores. Varias características craneofaciales relacionadas con la morfología del esqueleto facial o del tejido blando faríngeo pueden predisponer al colapso de la vía aérea superior. El tamaño de la mandíbula, la altura del maxilar superior y la posición del hioides se han asociado con el riesgo del síndrome de apnea-hipopnea obstructiva del sueño (SAHOS)13 14. La disminución de la zona del velo del paladar y la hipertrofia adenoidea y amigdalina son características de los tejidos blandos que han sido asociadas con un aumento en la colapsabilidad de la vía aérea superior15. En general, se cree que estas variantes anatómicas incrementarán la PCRIT al restringir el tamaño del recinto óseo alrededor la faringe y aumentar la cantidad de tejido blando contenida en el mismo16. La obesidad es también un factor de riesgo anatómico especialmente importante para las vías respiratorias superiores y su obstrucción durante el sueño. Las vías aéreas superiores de individuos obesos son más susceptibles a colapsar,17 ya que la PCRIT aumenta 1.0 y 1.7 cmH2O por cada 10 kg/m2 de aumento en el índice de masa corporal (IMC) de mujeres y hombres, respectivamente. El aumento de los depósitos de grasa alrededor de la faringe y las vías respiratorias16 puede aumentar la presión del tejido extraluminal y, por tanto, la colapsabilidad de la vía aérea superior18. Además, los volúmenes pulmonares disminuyen en las personas obesas, lo que lleva a una disminución del flujo en la vía aérea superior al generarse una positivización de la PCRIT19. Estas reducciones en el flujo son más pronunciadas en pacientes con abdomen adiposo, en los que puede disminuir el volumen pulmonar hasta casi el nivel de volumen residual20. A la inversa, las mejoras en el SAHOS con la pérdida de peso se deben probablemente a la reducción de presión del tejido circundante y el aumento del flujo aéreo al generarse la negativización de la PCRIT17.
4. Fisiopatología asociada con el desarrollo del tercio medio facial
La respiración nasal es saludable ya que el aire es tratado de muchas maneras en las diferentes estructuras de la nariz, los senos paranasales y la mucosa nasal. Las funciones fisiológicas nasales, como el calentamiento y la humidificación, son esenciales para la función de la vía respiratoria. Se calcula que un adulto inspira un promedio de 10,000 litros de aire en 30,000 respiraciones al día21.
Filtración. El primer filtro de partículas ambientales es la cavidad nasal. El moco nasal y los vellos nasales, o vibrisas, son los encargados de atrapar las partículas entrantes.
Humidificación. La humectación es otro proceso importante de la fisiología nasal. La gran vascularización de la mucosa nasal y los cornetes humedecen el aire entrante, aumentando su humedad relativa hasta en el 80% antes que el aire alcance la nasofaringe21.
Calentamiento. El aire inhalado debe tener una temperatura de al menos 33-35 °C para no originar reacciones patológicas en los alveolos. Nuevamente, debido a la turbulencia, el aire frío se ve forzado a contactarse con el vapor de agua emanado por la mucosa y sub-mucosa de los cornetes, aumentando hasta en 10 °C su temperatura. Se producen también una serie de reflejos neurovasculares de manera que, en caso necesario, los capilares se dilatan y calientan la mucosa que los cubre aportando más calor al aire21.
Olfato. La aerodinámica nasal contribuye también al sistema olfativo al permitir que las partículas ambientales lleguen a las cintillas olfatorias situadas en la base del cráneo21.
La cavidad nasal como caja de resonancia. La nariz y los senos paranasales actúan como factores que contribuyen a modificar la intensidad de la voz.
De acuerdo con lo anterior, cualquier trastorno que genere dificultades permanentes al flujo aéreo nasal durante la respiración causará alteraciones secundarias a la ausencia de las funciones descritas así como un hipodesarrollo de la amplitud requerida en la vía aérea nasal, puesto que disminuirá la estimulación del crecimiento de las cavidades sinusales y alterará el desarrollo del tercio medio facial1. Las diferentes características clínicas (Tabla 1) dependen de la región de la vía aérea alterada así como del momento en que se haga el diagnóstico, ya que los niños presentan picos de crecimiento del tercio medio facial. El 60% de este crecimiento sucede durante los primeros 4 años de la vida. Por tanto, una historia clínica adecuada, interrogando intencionadamente acerca de los signos asociados, permitirá sospechar tempranamente de esta alteración (Tabla 2).
Tabla 1 Enfermedades más comunes que alteran el flujo aéreo nasal.
| • Obstrucción de la válvula nasal |
| • Desviación septum nasal |
| • Hipertrofia de cornetes |
| • Hipertrofia adenoidea |
| • Hipertrofia amigdalina |
| • Hipertrofia de la amígdala lingual |
Tabla 2 Características clínicas asociadas comúnmente a la obstrucción nasal
| • Síndrome de respiración bucal |
| • Alteración en la fonación |
| • Trastorno de segunda dentición |
| • Trastorno de masticación y deglución |
| • Dificultad para iniciar el sueño |
| • Despertares nocturnos frecuentes |
| • Somnolencia diurna |
| • Dificultad de concentración |
| • Irritabilidad |
| • Síndrome de hiperactividad y agresividad |
| • Cefalea |
| • Enuresis |
En conclusión, la condición fundamental para que existan los trastornos respiratorios del sueño reside en la obstrucción de la vía aérea; la disminución del flujo a través del su segmento superior, que es la nariz, es el factor definitivo. Si dicha obstrucción se prolonga hasta el final de la segunda infancia, dará como resultado que este segmento sea permanentemente insuficiente en el adolescente y el adulto, desencadenando los factores que generarán una PCRIT positiva y provocarán la obstrucción del segmento flexible de la vía aérea durante el sueño, lo que se podría nombrar como síndrome obstructivo nasal en pediatría. La hipótesis que se propone establece que si en algún momento se puede impedir el estrechamiento definitivo del segmento superior, es durante el desarrollo del tercio medio facial, etapa fundamental, finita e irrepetible. Si se acepta que hasta el 60% de este desarrollo se realiza en los primeros 4 años de vida, resulta clara la imperativa necesidad de un diagnóstico y desobstrucción definitiva tempranos, para lograr un adecuado desarrollo que permita el libre tránsito del flujo aéreo necesario que favorezca la negativización de la PCRIT y aleje la posibilidad de desarrollar cualquier trastorno respiratorio del sueño y, de particular importancia, el desarrollo del SAHOS.











 nueva página del texto (beta)
nueva página del texto (beta)


