Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Boletín médico del Hospital Infantil de México
Print version ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.70 n.3 México May./Jun. 2013
CASO CLÍNICO-PATOLÓGICO
Escolar con insuficiencia tricuspídea posterior al cierre de comunicación interventricular
Tricuspid regurgitation in a child after closure of a ventricular septal defect
Sergio Ruiz González,1 Alexis Arévalo Salas,2 Jorge Luis Villatoro Hernández,2 Ma de Lourdes Marroquín Yáñez,3 Begoña Segura Stanford,2 Julio Erdmenger Orellana,4 Marco Antonio Sarmiento Abril,5 Mario Pérezpeña-Díazconti6
1 Servicio de Cirugía Cardiovascular
2 Servicio de Hemodinamia
3 Servicio de Terapia Intensiva
4 Servicio de Cardiología
5 Departamento de Radiología
6 Departamento de Patología
Hospital Infantil de México Federico Gómez
México, D.F., México
Autor de correspondencia:
Dr. Sergio Ruiz González
Correo electrónico: lulymarroquin@yahoo.com.mx
Fecha de recepción: 21-03-13
Fecha de aceptación: 26-03-13
Resumen de la historia clínica (A-10-09)
Escolar de sexo femenino que ingresó programada para una corrección quirúrgica de defecto en la válvula tricúspide.
Antecedentes perinatales y patológicos. Producto de G IV. Parto hospitalario a las 37 semanas de gestación, pesó 3350 g, midió 51 cm, se desconoce Apgar, sin complicaciones. Con varicela al año, sin complicaciones. En 2005, en un hospital de III nivel se diagnosticó persistencia de conducto arterioso (PCA) y comunicación interventricular (CIV) a los dos años de edad. Se detectó, por cateterismo, enfermedad vascular pulmonar y disfunción biventricular. No se consideró candidata a cirugía y se manejó con sildenafil 0.5 mg/kg/dosis c/8 h y oxígeno continuo.
06 septiembre 07 (Consulta Externa Cardiología). Acudió por primera vez al Hospital Infantil de México Federico Gómez (HIMFG) por cardiopatía congénita cianógena, disnea de medianos esfuerzos relacionada a actividad física, clase funcional II NYHA. Mediante ecocardiograma se encontró situs solitus , levocardia, retorno venoso y sistémico normales, conexión atrioventricular y ventrículo arterial concordante. Anillo pulmonar 20 mm, rama derecha de la arteria pulmonar 13 mm, rama izquierda de laarteria pulmonar 12.4 mm, presión sistólica de ventrículo derecho 75 mmHg, con oxígeno disminuye a 56 mmHg, comunicación interventricular (CIV) por desalineación de 14 x 10 mm, gradiente a través de la CIV de 12 mmHg y con flujo bidireccional, persistencia de conducto arterioso (PCA) boca pulmonar 6 mm, cabalgamiento aórtico del 30%, arco aórtico izquierdo sin obstrucción, prolapso tricuspídeo. Inició furosemide, espironolactona y captopril. En octubre de 2007 cursó con neumonía adquirida en la comunidad tratada con amoxicilina 150 mg/kg/día, sin complicaciones.
21 octubre-13 noviembre 07 (Cirugía Cardiovascular). Edad 4 años, peso 11,5 kg, talla 95 cm. Se realizó cierre quirúrgico de comunicación interventricular (CIV), ligadura de conducto arterioso y plastía tricuspídea con plicatura de cuerda tendinosa de valva anterior. Se encontró CIV infundibular de 15 mm, PCA de 1 cm, insuficiencia tricuspídea grave por elongación de cuerdas tendinosas. Se realizó pinzamiento de aorta de una hora. El tiempo de perfusión fue de 1 hora con 40 minutos. En el ecocardiograma se observó CIV residual de 3.3 x 4.4 mm con flujo bidireccional, insuficiencia tricuspídea de moderada a importante, presión sistólica de ventrículo derecho 48 mmHg. Egresó por buena evolución, con espironolatona, furosemide y captopril. En julio 2008, a los 5 años de edad, presentó hepatitis A. Fue tratada en forma conservadora, sin complicaciones.
11 junio 09 (Cardiología). Se presentó en Sesión Conjunta porque continuó con clase funcional II NYHA y falta de ganancia ponderal como operada de comunicación interventricular, comunicación interventricular residual, insuficiencia tricuspídea grave, obstrucción de venas pulmonares derechas por el septum interauricular. Se acordó realizar plastía de tricúspide (o sustitución), parche en tabique interauricular (rígido). Alto riesgo postoperatorio por hipertensión pulmonar.
Padecimiento actual. Ingresó el 7 de febrero de 2010 en forma programada para la corrección quirúrgica.
A la exploración física se encontró peso de 14.9 kg, talla 95 cm, frecuencia cardiaca (FC) 89/min, frecuencia respiratoria (FR) 20/min, TA 90/50 mmHg, temperatura 36.5°C, Glasgow 15.
Femenino de edad aparente similar a la cronológica, íntegra, sin facies características. Cráneo sin hundimientos ni exostosis, ojos simétricos con pupilas de 3 mm isocóricas, normorrefléxicas, reactivas a la luz. Narinas permeables, pabellones auriculares bien implantados, conductos auditivos permeables, membranas timpánicas íntegras sin alteraciones. Cavidad oral con mucosa bien hidratada, faringe hiperémica, sin descarga retro nasal. Cello sin alteraciones. Tórax normolíneo con adecuados movimientos respiratorios, buena entrada y salida de aire, sin integrar síndrome pleuropulmonar. Ruidos cardiacos con soplo sistólico grado III/VI en cuarto espacio intercostal izquierdo. Abdomen con borde hepático a 2-2-2 cm de borde costal derecho, peristalsis normal. Genitales femeninos Tanner I, sin alteraciones. Pulsos palpables en las cuatro extremidades, tono y fuerza conservados. Pares craneales sin alteraciones. Saturación O2 entre 88 y 92%.
Laboratorio y gabinete. Hemoglobina (Hb) 14.4 g/dl, hematócrito (Hto) 43%, plaquetas (Plaq) 214,000, leucocitos (Leu) 6600 U/L, neutrófilos (Neu) 45%, linfocitos (Linf) 26%, monocitos (Mon) 24%, bandas (Ban) 3%, tiempo de protrombina (TP) 14.4 seg, tiempo parcial de tromboplastina (TPT) 30.3 seg.
Ecocardiograma. Ritmo sinusal, FC 100/min, eje de P +70, bloqueo izquierdo de la rama derecha del Haz de His.
Rx de tórax. Situs solitus , levocardia, índice cardiotorácico 0.78 a expensas de crecimiento auricular y ventricular derechos. Se continuó manejo. Se suspendió ácido acetil salicílico. Permaneció estable, hospitalizada, en espera de tiempo quirúrgico.
09 febrero 10 (Ingreso). Ingresó a quirófano. Se realizó recambio valvular tricuspídeo por válvula biológica Edwards y cierre de comunicación interventricular residual. Al inicio de la cirugía presentó hipotensión 42/32 mmHg (36 mmHg), FC 25/min, saturación O2 0% y paro cardiorrespiratorio de 3 minutos de duración, que se manejó con 300 ug de adrenalina, bicarbonato 10 mEq y un gramo de calcio. Sangrado de 1400 ml, gasto urinario (GU) 3.5 ml/kg/h. Salió de bomba al primer intento con una desfibrilación a 1 J/kg, dopamina 8 mcg/kg/min, dobutamina 8 mg/kg/min, milrinona 0.5 ug/kg/min y adrenalina 0.33 ug/kg/min. Pinzamiento aórtico: 1 hora con 10 minutos. Tiempo del paro circulatorio: 65 min. Ingresó a terapia quirúrgica con TA media 55 mmHg, FC 132/min, PVC 12 mmHg, Temp 36.4ºC. Presentó sangrado activo por cánula orotraqueal, transfundiendo concentrado eritrocitario a 15 ml/kg/dosis, plasma fresco congelado, crioprecipitados y plaquetas.
Gasometría. pH 7.37, PaO2 105, PaCO2 29.9, HCO3 17.1, EB -6.7, SatO2 98.3%, Anión Gap 20.3, Lact 8.7, Na 140 mEq/l, K 2.9 mEq/l, Cl 105 mEq/l, Ca iónico 0.97 mEq/l.
Ecocardiograma Postquirúrgico. Insuficiencia ventricular derecha grave. Hígado a 4 cm de borde costal derecho e hipotensión. Inició vasopresina, intubación orotraqueal, FiO2 100%, PIM 20, PEEP 4, hipoventilación derecha, herida quirúrgica con evidencia de sangrado. Sonda pleural y mediastinal con drenaje hemático.
Rx tórax. Opacidad total de hemitórax derecho con congestión leve. Abdomen silente, borde hepático a 4-4-5 cm, sedada con midazolam y fentanyl, anisocoria con midriasis derecha de 1.5 mm mayor que la izquierda. Presentó fibrilación ventricular, se manejó con desfibrilación con salida a actividad eléctrica sin pulso, reanimación cardiopulmonar por 27 minutos, seis dosis de adrenalina, reposición de bicarbonato en dos ocasiones, sin respuesta a maniobras avanzadas de reanimación.
Laboratorio y gabinete. Hemoglobina (Hb) 10.5 g/dl, hematocrito (Hto) 31%, plaquetas (Plaq) 94,000, leucocitos (Leu) 6600 U/L, neutrófilos (Neu) 69.7%, linfocitos (Linf) 23.6%, monocitos (Mon) 6%, bandas (Ban) 0%, tiempo de protrombina (TP) 19.1 seg, tiempo parcial de tromboplastina (TPT) 39.7 seg.
Gasometría. pH 7.06, PaO2 67.7, PaCO2 35.3, HCO3 9.6, EB -19.2, SatO2 87.5%, Anión Gap 28.4, Lact 15, Na 139 mEq/l, K 5.2 mEq/l, Cl 106 mEq/l, Ca iónico 0.86 mEq/l.
Presentación del caso
Servicio de Hemodinamia
(Dr. Jorge Luis Villatoro Hernández)
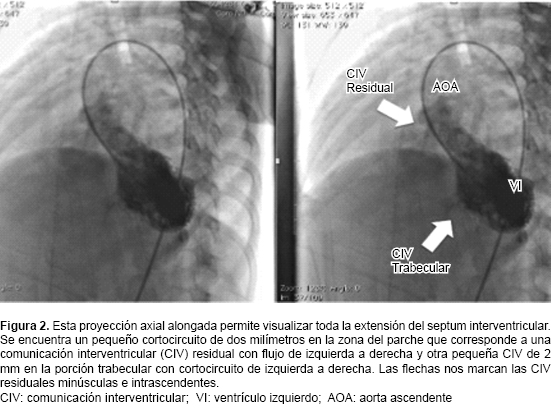
Se presentan las imágenes en las que se observa insuficiencia tricuspídea grave (Figura 1) y la comunicación interventricular (Figura 2).

Discusión
Servicio de Hemodinamia
(Dr. Luis Alexis Arévalo Salas)
El caso del día de hoy es abierto y los diagnósticos están claramente descritos en la historia clínica, ante lo cual disertaré sobre las condiciones fisiopatológicas que ocurrieron hasta su fallecimiento.
No existen antecedentes heredofamiliares de importancia, pero es de relevancia que esta paciente fue evaluada en otra institución, en la cual se estableció el diagnóstico de enfermedad vascular pulmonar asociada a comunicación interventricular (CIV) y persistencia del conducto arterioso (PCA) a los 2 años de edad, lo que, si bien no es improbable, es muy difícil que ocurra. Existen muchas revisiones reportadas en la literatura médica que datan de la década de los 70 en los cuales estudiaban a los niños pequeños con CVI y llegaron a conclusiones muy interesantes. Por ejemplo, los doctores Kirklin y Barrat-Boyes reportan, en su libro clásico de Cirugía Cardiaca,1 que lactantes menores de 1 año de edad pueden tener resistencia vascular pulmonar (RVP) elevada, incluso mayor a 7 unidades Wood (uW) sin que los cambios histopatológicos de la vasculatura pulmonar sean compatibles con enfermedad vascular pulmonar, según la descripción clásica de Heath y Edwards.2 Cabe mencionar que esta descripción data de 1958 y perdura hasta la actualidad porque no hay nada que haya mejorado la clasificación histopatológica de las lesiones pulmonares para hablar de enfermedad vascular pulmonar. En este momento es necesario mencionar una condición importante. Frecuentemente, se habla de hipertensión arterial pulmonar, pero se debe comprender que esta es la manifestación del grado de resistencia vascular pulmonar, que está condicionada por las características anatómicas y la reactividad de los vasos pulmonares. Por lo tanto, cuando existe vasoconstricción periférica se establece un aumento en la presión pulmonar proximal condicionando entonces hipertensión arterial pulmonar. Si estos vasos pulmonares conservan la capacidad de dilatarse, se debe considerar como reactiva, siendo los estímulos principales el oxígeno y algunos fármacos. En este momento es importante también mencionar que la enfermedad vascular pulmonar es el daño irreversible de la vasculatura pulmonar. Está marcada por diversos cambios histopatológicos que van desde el aumento del grosor de la capa muscular media, el acúmulo de células parecidas a fibroblastos que invaden la lámina elástica, hasta el desarrollo de fibrosis, lesiones plexiformes y necrosis con pérdida de la capacidad vasodilatadora. En este momento se establece una condición clínica llamada síndrome de Eisenmenger, en el cual los cortocircuitos inicialmente de izquierda a derecha se invierten y aparece cianosis.
La paciente mostraba dos cortocircuitos de izquierda a derecha, uno el conducto arterioso y el otro la comunicación interventricular, que ocasionaban un hiperaflujo pulmonar -principal estímulo para el desarrollo del daño inicial de la vasculatura pulmonar- y, por ende, de la hipertensión arterial pulmonar. Sin embargo, cuando se recibió a esta paciente, no había cianosis y en los ecocardiogramas se referían cortocircuitos de izquierda a derecha por ambas lesiones, por lo que no había criterios clínicos ni ecocardiográficos para sustentar inoperabilidad. Ante la presencia de hipertensión arterial pulmonar grave, es muy difícil precisar clínica y por hemodinámica si ya ha iniciado un proceso de enfermedad vascular pulmonar que siga su progreso, aun cuando se hayan reparado los defectos.
Al revisar los datos clínicos de esta paciente, se nota que prevalece un soplo holosistólico con intensidad III/VI y hepatomegalia. La presencia de un soplo intenso nos habla de un cortocircuito masivo de izquierda a derecha puesto que, cuando la presión pulmonar alcanza el nivel de la presión sistémica en respuesta a un aumento de resistencia vascular pulmonar, las presiones ventriculares se igualan y el soplo tiende a desaparecer, pero condiciona un segundo tono muy intenso que no está referido en la historia clínica. Se cita, además, la presencia de un retumbo apical que es de gran relevancia clínica para el cardiólogo. La traducción de este signo es que, cuando existe un aumento en el hiperaflujo pulmonar por grandes cortocircuitos, se establece un aumento en el retorno venoso pulmonar y aumenta el volumen de sangre en el atrio izquierdo. En este momento, la válvula mitral se vuelve relativamente estenótica y se establece el soplo diastólico. Cuando la resistencia vascular es elevada y por ende la presión arterial pulmonar es alta, se pierde la capacidad de vasodilatación, disminuye el flujo pulmonar y, por consiguiente, el retorno venoso pulmonar es menor. Así pues, la presencia de un retumbo apical sugiere que los vasos pulmonares aún conservan capacidad para vasodilatarse. Hasta este momento podemos asegurar que esta paciente no tenía enfermedad vascular pulmonar puesto que no tenía cianosis y los ecocardiogramas demostraban cortocircuitos de izquierda a derecha. A los 4 años de edad y ante la condición clínica mencionada, se decidió enviar a cirugía para el cierre de los defectos. Cabe hacer mención que desde el primer ecocardiograma se describen ciertas alteraciones en la válvula tricúspide; concretamente, un prolapso. Es importante mencionarlo en este momento, puesto que las lesiones anatómicas tricuspídeas son inusuales en la edad pediátrica. No así las alteraciones funcionales, es decir, que exista cierto grado de insuficiencia tricuspídea en una válvula anatómicamente competente, por ejemplo, en neonatos con resistencia vascular pulmonar elevada o bien en cardiopatías congénitas que incrementan la presión ventricular derecha. En este caso se observó una alteración anatómica que condicionaba insuficiencia tricuspídea y que debió considerarse para su reparación durante la intervención quirúrgica.
Posterior a la cirugía hubo un evento que puede ser considerado como una crisis hipertensiva. La niña tenía hipertensión arterial pulmonar y permaneció desaturada, por lo que fue necesario tratarla con ventilación mecánica y vasodilatadores pulmonares para que cediera la crisis. Cabe mencionar que, de ninguna manera, es un evento inusual, ya que es la causa más frecuente para esta complicación. Tal vez porque la CIV es una de las cardiopatías congénitas que se opera en el mundo con más frecuencia, aunque se ha descrito también en el canal atrioventricular completo, tronco arterioso, conexión anómala total de venas pulmonares o en la D-transposición de grandes arterias.3 Además de la hipertensión arterial pulmonar ya conocida, se describe un pinzamiento aórtico de poco más de una hora, que puede considerarse prolongado y que, cuando ambas condiciones se conjugan, se promueve la secreción de sustancias vasoconstrictoras, como el tromboxano, leucotrienos y otras antiinflamatorias que mantienen un estado de hipertensión. En este caso se resolvió con el manejo convencional a base de oxígeno y vasodilatadores. De hecho, en el ecocardiograma de control al alta de cuidados intensivos, se documentó una presión pulmonar de 42 mmHg. Ante esta evolución se puede inferir que la presión pulmonar elevada era reactiva, porque la resistencia vascular pulmonar no era fija. Durante la evolución postoperatoria se describe un cuadro de hepatitis A con anticuerpos positivos, pero que parece intrascendente en la historia clínica de esta paciente. Pero, lo que es totalmente anormal es que continuara con hepatomegalia y se mantiene aún después de la corrección de los defectos. Si bien la asociación de hepatomegalia con cardiomegalia nos habla de insuficiencia cardiaca, en este caso, una vez corregidas las lesiones cardiacas, la hepatomegalia debió desaparecer. Ante esta situación se decidió practicar un cateterismo cardiaco que reportó una resistencia vascular pulmonar normal -considerando como normal entre 2 y 4 uW- con presión pulmonar elevada y dos pequeñas comunicaciones interventriculares que ocasionaban un gasto pulmonar de 1.2 (que puede considerarse como muy poco significativo, ya que cuando es mayor de 1.5 los niños suelen ser sintomáticos). Un defecto estaba localizado en las márgenes del parche quirúrgico y otro, en el septum trabecular distante de dicho parche, pero realmente la patología estribaba en una grave insuficiencia tricuspídea.
En este momento es oportuno disertar en el papel del ventrículo derecho. Maneja el mismo volumen que el izquierdo; sin embargo, guarda profundas diferencias anatómicas y funcionales con respecto a este. Si recordamos la anatomía del ventrículo izquierdo, es de aspecto cónico que es musculoso, lo que le brinda una capacidad contráctil circunferencial y le permite mantener presiones capaces de sobrellevar una resistencia sistémica de entre 12 a 16 uW contra las 2 a 4 uW que mantiene en condiciones normales el ventrículo derecho. Por su parte, este último consta de 3 porciones llamadas de entrada, trabecular y de salida, conformando una estructura helicoidal. Por lo tanto, su contractilidad es longitudinal, conformando una cámara de baja presión que permite el paso de un volumen similar al izquierdo. Cuando la insuficiencia cardiaca es grave, como en este caso, el ventrículo pierde en gran medida su capacidad contráctil. Tiene menos capacidad para manejar el volumen hacia la arteria pulmonar y se establece un lecho sanguíneo entre la arteria pulmonar y el atrio derecho, condicionando la hepatomegalia con la que cursó esta paciente. En la actualidad, debe considerarse a la insuficiencia tricuspídea como un factor de muerte asociado a la corrección de defectos cardiacos, máxime si no se hace una reparación concomitante.4
Finalmente, ante la condición de esta niña con insuficiencia tricuspídea grave, era obligado someterla a un reemplazo valvular tricuspídeo. Sin embargo, el advenimiento postquirúrgico era predecible ante la presencia de un ventrículo derecho disfuncional durante años. Mis diagnósticos finales son el de una insuficiencia tricuspídea grave que condicionó disfunción ventricular derecha, hipertensión arterial pulmonar moderada residual con resistencias vasculares pulmonares bajas sin evidencia de enfermedad vascular pulmonar y dos comunicaciones interventriculares minúsculas, una residual y otra congénita, sin repercusión clínica.
Departamento de Patología
(Dr. Mario Pérezpeña-Díazconti)
Los datos de somatometría del estudio post mortem revelaron desnutrición crónica acentuada con peso de 14.9 kg, para un esperado de 22 kg. La talla fue de 104 cm, con referencia para su edad de 117 cm. En el tórax anterior, sobre la línea media esternal, se observó una herida suturada de 12.5 cm de longitud. Al abrir la cavidad torácica, la cavidad pleural derecha contenía 10 cc de líquido serohemático; la cavidad izquierda contenía 20 cc de líquido con las mismas características. Del mediastino se retiró un hematoma de 4 x 3 cm. El pericardio (Figura 3) mostraba múltiples adherencias y coágulos sanguíneos. En este estudio, el órgano principal es el corazón, que se encontró aumentado de tamaño y peso. El bloque cardiopulmonar pesó 450 g, con referencia de 343 g. Las aurículas se encontraron dilatadas. En la vista posterior del corazón se puede observar la vena cava inferior muy dilatada (Figura 4). Por otra parte, la superficie de los pulmones es de color gris claro, excepto en las bases (que es de un color rojizo). En la base del pulmón derecho observamos dos ampollas que no representaron mayor alteración. La aorta y tráquea no mostraron cambios. El corte del corazón reveló la válvula protésica aurículo-ventricular derecha, de 2.5 cm de diámetro (Figura 5). Ambos ventrículos estaban hipertróficos; el derecho, además, estaba dilatado, y había una comunicación interventricular infundibular de 0.1 cm. El conducto arterioso estaba ocluido quirúrgicamente. Histológicamente, los ventrículos mostraron hipertrofia, con leve desorganización de las cardiomiofibrillas, los núcleos eran hipercromáticos y con variación en su forma (Figura 6). La cardiopatía motivó los cambios observados en los pulmones, con espacios alveolares con macrófagos con hemosiderina y que representan eventos repetidos de edema y hemorragia, y cambios menos aparentes en los lóbulos superiores, asociados a insuficiencia cardiaca de lado izquierdo. Muy notable es el daño vascular, donde se observan las paredes de los vasos engrosadas debido a la hipertensión pulmonar. También se observaron cambios más aparentes en los vasos pequeños y medianos, con muscularización de la pared (Figura 7), hallazgos que no son uniformes en todos los vasos. El daño es más acentuado en otros campos, con proliferación de fibroblastos, muscularización y proliferación de la íntima en disposición concéntrica (Figura 8). En todos los vasos estudiados, no se encontraron lesiones plexiformes ni necrosis en su pared. Con la tinción de fibras elásticas fue posible hacer evidente el daño a la pared vascular (Figura 9). Estos cambios se integran en el grado III de la clasificación de Heath y Edwards (Cuadro 1), con cambios en diferentes estadios en los diferentes vasos.








Un hallazgo, que es relativamente frecuente, es la presencia de material plástico en la luz de los vasos, que puede corresponder a fragmentos de catéter, acompañado de una célula gigante multinucleada tipo cuerpo extraño. El hígado mostró patrón en nuez moscada (Figura 10). Estaba aumentado de peso y tamaño (800 g para un peso referido de 680 g), debido a la congestión asociada con la insuficiencia cardiaca derecha. Histológicamente, los espacios porta no presentaron alteración, y no se encontraron datos de hepatitis A, que tenía diagnosticada dos años previos de acuerdo con la historia clínica. El bazo estaba aumentado de tamaño, congestivo, con datos de insuficiencia cardiaca derecha. De la misma manera, los riñones estaban aumentados de tamaño, con congestión intensa en corteza y médula. La pared de la vejiga mostró bandas de contracción. Los vasos del cerebro estaban congestivos, aunque estructuralmente no se encontraron alteraciones. Histológicamente, algunas neuronas presentaron datos de hipoxia con citoplasma rojo intenso denso y núcleos hipercromáticos y condensados. Los diagnósticos anatómicos finales se enumeran en el Cuadro 2.


Los pacientes con hipertensión arterial pulmonar grave se descompensan frecuentemente en el postoperatorio inmediato. La causa de esta descompensación se encuentra en el ventrículo derecho, incapaz de vencer la resistencia periférica aumentada.
Comentarios finales
Servicio de Terapia Intensiva
(Dra. Ma. de Lourdes Marroquín Yáñez)
Los pacientes que, para la corrección de su cardiopatía, requieren del uso de circulación extracorpórea pueden presentar como complicación el síndrome de bajo gasto cardiaco (SBGC). Este consiste, principalmente, en una disfunción cardiaca. Su pico de presentación es de las 16 a 18 horas postquirúrgicas. La incidencia en centros de Norteamérica es de alrededor de 27%.5 En nuestra institución, se reporta la incidencia alrededor de 35% y la mortalidad de 6%. Nuestra paciente presentó, como factor principal para desarrollar este síndrome, la falla ventricular derecha crónica por la insuficiencia tricuspídea que, aunado a una hemorragia postoperatoria profusa que requirió grandes cantidades de líquido para la reposición de volumen y unas resistencias pulmonares elevadas, condicionaron una falla biventricular que condicionó la muerte de la paciente. El tratamiento del SBGC requiere del uso de medicamentos vasoactivos diversos. Aunque el consenso general, a nivel mundial, coincide en el uso de milrinona, inodilatador con efectos tanto en vasculatura pulmonar como sistémica que mejoran la función diastólica.6 En un estudio multicéntrico en Estados Unidos, se reportó el uso profiláctico de la milrinona, reduciendo el riesgo de presentación del SBGC en 64%. De ser irreversible la falla ventricular, la opción final es la utilización de ECMO.
Servicio de Hemodinamia
(Dra. Begoña Segura Stanford)
Existen tres grupos de pacientes con cardiopatía acianógena de flujo pulmonar aumentado: aquellos que clínica y radiográficamente tienen el cortocircuito de izquierda a derecha, saturación normal y datos de congestión con cardiomegalia y son perfectamente operables; los que ya tienen hipertensión pulmonar establecida por enfermedad vascular pulmonar irreversible con desaturación, cianosis, sin cardiomegalia y con flujo pulmonar disminuido que no son candidatos a corrección quirúrgica; y, el tercer grupo, aquellos pacientes que se encuentran en la mitad del camino hacia la enfermedad vascular pulmonar con presión pulmonar elevada pero aún con cardiomegalia, flujo pulmonar aumentado y congestión. A este tipo de pacientes se les realiza una prueba de reactividad vascular pulmonar en el laboratorio de hemodinamia, que consiste en la administración controlada de fármacos o gases vasodilatadores. Inicialmente y hasta la fecha se utiliza la administración de oxígeno al 100% para provocar una caída de la presión media de la arteria pulmonar con respecto a la presión sistémica de 10 mmHg o más. De no haber buena respuesta al oxígeno, en nuestra institución se está realizando un doble reto farmacológico con levosimendán, que es un inodilatador con efecto vasodilatador pulmonar, e iloprost que es un vasodilatador pulmonar selectivo, con la intención de disminuir las resistencias vasculares pulmonares al menos 20% o si se presenta una caída de la presión media de la arteria pulmonar (al menos de 10 mmHg con respecto a las basales). De presentarse estas reducciones, se considera una prueba positiva que indica la operabilidad del paciente. En otros sitios se realizan pruebas con óxido nítrico.
Servicio de Cardiología
(Dr. Julio Erdmenger Orellana)
Me parece que, con base en los estudios de ecocardiografía y hemodinamia, nuestra paciente era claramente operable en cuanto al concepto de enfermedad vascular pulmonar. Aunque se cierren los defectos interventriculares, una vez que se han establecido los mecanismos de daño vascular pulmonar, este no es reversible. En el peor de los casos, continúa la evolución de la enfermedad vascular pulmonar. En la autopsia se observa gran daño pulmonar en comparación con la evaluación hemodinámica. Por ello, considero que a pesar de que se cerró la comunicación interventricular, la enfermedad vascular pulmonar continuó su evolución. La insuficiencia tricuspídea generalmente es bien tolerada (a excepción de aquella insuficiencia que es grave postquirúrgica, donde se incrementa el volumen en el ventrículo derecho). Me parece que el daño principal de la paciente fue la disfunción ventricular derecha, agravada por la enfermedad vascular pulmonar. De este caso hemos aprendido que está perfectamente documentado y lo estamos llevando a cabo en nuestra institución el ecocardiograma transesofágico operatorio en el quirófano a todos los pacientes que son sometidos a plastías valvulares. De persistir la insuficiencia valvular moderada o grave se decide la reintervención. Otro punto importante es reducir el tiempo entre la primera y la segunda cirugía, para evitar el desarrollo de la disfunción ventricular. Es necesario que en la institución se cuente con ECMO. A pesar de que la mortalidad global en cirugía cardiaca es alrededor de 10%, el ECMO puede ayudar a rescatar un número importante de pacientes que de otra forma invariablemente fallecerán.
REFERENCIAS
1. Kouchoukos N, Blackstone E, Doty D, Hanley F, Karp R. Ventricular septal defect. En: Kouchoukos N, Blackstone E, Doty D, Hanley F, Harp R, eds. Kirklin/Barrat-Boyes Cardiac Surgery. Philadelphia: Churchill Livingstone; 2003. pp. 850-909. [ Links ]
2. Heath D, Edwards JE. The pathology of hypertensive pulmonary vascular disease: a description of six grades of structural changes in the pulmonary arteries with special reference to congenital cardiac septal defects. Circulation 1958;18(4 Part 1):533-547. [ Links ]
3. Nichols D, Ungerleider R, Spevak P, Greeley W, Cameron D, Lappe D, Wetzel R. Critical Heart Disease in Infants and Children. Philadelphia: Mosby Elsevier; 2006. [ Links ]
4. Mascherbauer J, Maurer G. The forgotten valve: lessons to be learned in tricuspid regurgitation. Eur Heart J 2010;31:2841-2843. [ Links ]
5. Wessel DL. Managing low cardiac output syndrome after congenital heart surgery. Crit Care Med 2001;29(suppl 10):S220-S230. [ Links ]
6. Hoffman TM, Wernovsky G, Atz AM, Kulik TJ, Nelson DP, Chang AC, et al. Efficacy and safety of milrinone in preventing low cardiac output syndrome in infants and children after corrective surgery for congenital heart disease. Circulation 2003;107:996-1002. [ Links ]














