Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.70 no.3 México may./jun. 2013
Artículo de investigación
Vigilancia institucional de la susceptibilidad antimicrobiana
en patógenos de interés clínico
Institutional vigilance of antimicrobial susceptibility in pathogens of clinical interest
Briceida López-Martínez,1 Virginia Alcázar-López,1 María del Carmen Castellanos-Cruz,1 Ma. Isabel Franco-Hernández,1 Yolanda Jiménez-Tapia,1 Araceli De León-Ham,1 María Elena Mejía-Albarrán,1 Lilia Pichardo-Villalón,1 María Lucía Tapia-Madrigal,1 Sarbelio Moreno-Espinosa,2 Ernesto Calderón-Jaimes3
1 Departamento de Laboratorio Clínico
2 Departamento de Infectología
3 Subdirección de Servicios Auxiliares de Diagnóstico
Hospital Infantil de México Federico Gómez, México, D.F., México
Autor de correspondencia:
Dra. Briceida López Martínez
Correo electrónico: brisalm@yahoo.com.mx
Fecha de recepción: 10-09-12
Fecha de aceptación: 26-02-13
Introducción. El incremento en la resistencia de los microorganismos a los antibióticos ha provocado un aumento en la morbimortalidad de las infecciones, un mayor uso de antibióticos y el exceso en gastos de hospitalización. Por lo tanto, el objetivo de este trabajo fue describir la frecuencia de microorganismos patógenos y sus patrones de susceptibilidad bacteriana en cultivos de sangre, orina y de otros fluidos corporales en un hospital pediátrico de tercer nivel. Métodos. Se incluyeron en el estudio cepas de cultivos de sangre, orina, líquido cefalorraquídeo y otros, como pleural, pericárdico y peritoneal, de enero de 2010 a junio de 2011. La identificación y la susceptibilidad se obtuvieron utilizando el equipo Vitek 2XL, de acuerdo con las recomendaciones del Clinical and Laboratory Standards Institute . Resultados. Se aislaron e identificaron 7708 bacterias de 27,209 cultivos de muestras biológicas. Los microorganismos más frecuentes fueron Staphylococcus coagulasa negativa, Escherichia coli, Enterococcus spp, Staphylococcus aureus, Pseudomonas aeruginosa y Klebsiella pneumoniae . La actividad antimicrobiana en contra de los diferentes patógenos fue variable. Escherichia coli presentó la mayor resistencia a trimetoprima-sulfametoxazol (74%) y ampicilina-sulbactam (68%). Las mejores opciones resultaron nitrofurantoína e imipenen, con 84 y 100% de sensibilidad. La resistencia de Enterococcus faecium fue de 58% a vancomicina. Streptococcus pneumoniae presentó 100% de sensibilidad a vancomicina. Conclusiones. La frecuencia de patógenos provenientes de diferentes fluidos corporales no ha variado considerablemente. Sin embargo, el cambio más notable se observó en la resistencia, tanto en Gram positivos como en Gram negativos, en contra de los fármacos convencionales, así como en los considerados de amplio espectro.
Palabras clave: resistencia bacteriana, susceptibilidad antimicrobiana, cultivos de orina y sangre.
Abstract
Background. The increased resistance of microorganisms to antibiotics has led to an increase in morbidity and mortality from infections, increased use of antibiotics and excessive hospitalization costs. Therefore, the aim of this study was to describe the frequency of pathogens and bacterial susceptibility patterns in cultures of blood, urine and other body fluids in a tertiary pediatric hospital. We also aimed to determine the patterns of resistance in pathogens of clinical interest isolated in blood, urine and other sterile liquids in a pediatric teaching center and third-level hospital. Methods. The Institutional Antimicrobial Surveillance Program was established to monitor the predominant pathogens and antimicrobial susceptibility patterns of infections such as bacteremia, pneumonia and urinary infections. The species of each isolate was determined according to routine methodology and Vitek system from January 2010 to June 2011. Antimicrobial agents and susceptibility testing were determined using the Vitek 2XL according to the Clinical and Laboratory Standards Institute. Results. We recovered 7708 isolates from 27,209 cultures (28.3%). Gram negative represented 52.7%. A rank order showed Staphylococcus coagulase-negative , Escherichia coli, Enterococcus spp ., Staphylococcus aureus, Pseudomonas aeruginosa, Klebsiella pneumoniae and others. The antimicrobial susceptibility of the most frequently encountered pathogens was variable. E. coli showed the highest resistance to trimethopim-sulfamethoxazole and ampicillin-sulbactam (74 and 68%, respectively) finding the best option to be nitrofurantoin and imipenem with 84 and 100% sensitivity, respectively. Enterococcus faecium resistance was 58% vancomycin, and Streptococcus pneumoniae showed 100% sensitivity to vancomycin. Conclusions. This study emphasizes the problem of resistance and the needs to select an appropriate broad-spectrum empirical regimen guided by the knowledge of pathogen occurrences and local/regional/global resistance patterns. Such practices require the interrelation between clinical microbiology laboratories and hospital pharmacies.
Key words: antimicrobial susceptibility, multidrug-resistant Gram-negative, Gram-positive resistant patterns.
Introducción
La resistencia antimicrobiana es un problema de salud pública que, día a día, se va incrementado. Por esta razón, a nivel mundial ha sido necesaria la generación de redes de vigilancia.1-5 El incremento de la resistencia de los microorganismos a los antibióticos ha provocado un aumento en la morbimortalidad por infecciones, en los tiempos de hospitalización, en el uso de antibióticos y un exceso en los gastos de hospitalización.6
El aumento de la resistencia a los antimicrobianos se ha provocado, entre otros factores, por el uso indiscriminado de estos, que condicionan la aparición de diferentes mecanismos de resistencia única o múltiple en los patógenos tradicionales.
La presencia de patógenos bacterianos en sangre, líquido cefalorraquídeo, pleura, peritoneo y otros, es causa significativa de morbiletalidad.7-11
Las bacterias Gram positivas, como S. aureus, Staphylococcus coagulasa negativos (SCN), Enterococcus spp ., Streptococcus viridans y Streptococcus pneumoniae, ocupan un lugar definido en la patología infecciosa, que se complica por la resistencia bacteriana en contra de los antimicrobianos considerados como de elección habitual.12-15
En los últimos años, se han reconocido nuevos mecanismos de resistencia. No resulta extraño ahora considerar patógenos con resistencia múltiple o, incluso, extremadamente resistentes a más de una docena de fármacos.10-18
Se ha demostrado que el inicio temprano de un antimicrobiano apropiado es crítico para reducir la morbiletalidad en los pacientes gravemente enfermos. Este inicio es casi siempre empírico, por lo que se requiere el conocimiento del potencial patógeno, así como sus patrones usuales de susceptibilidad. En estas condiciones, la resistencia hace difícil la selección empírica de uno o varios fármacos.
El propósito del clínico, al solicitar el patrón de susceptibilidad, es predecir cómo se comportará una cepa bacteriana al ser enfrentada o retada a un antibiótico administrado. Un resultado de sensibilidad definirá que la bacteria será eliminada y que el paciente responderá al tratamiento con el antibiótico. La resistencia a un antibiótico especial indicará que el proceso infeccioso continuará y que la bacteria no será eliminada.
El Hospital Infantil de México Federico Gómez (HIMFG) es un centro de concentración de pacientes con enfermedades de elevada complejidad, donde el 60 a 65% de la población presenta alguna neoplasia (principalmente leucemias y linfomas) y recibe quimioterapia. También presentan neutropenia, desarrollan infecciones respiratorias (neumonía), infecciones urinarias, diarrea, colitis neutropénica y choque séptico, como problemas asociados.
Por lo anterior, el conocimiento de los patrones de susceptibilidad permitirá al clínico seleccionar el antibiótico más adecuado, considerando los factores clínico-biológicos del paciente. Por lo tanto, el propósito de este reporte fue describir la frecuencia de los patógenos aislados y caracterizados, así como su perfil de susceptibilidad antimicrobiana.
Métodos
El protocolo de estudio fue autorizado por la Comisión Institucional de Investigación. Se estudiaron los cultivos obtenidos de pacientes del Hospital Infantil de México Federico Gómez, institución de tercer nivel de atención pediátrica, de enero del 2010 a junio del 2011.
Se identificaron y caracterizaron los microorganismos aislados de sangre, orina y otros fluidos corporales. Se estudió el patrón de susceptibilidad en contra de diferentes fármacos antimicrobianos. Solamente se incluyó la cepa inicial de cada cultivo.
Los cultivos de sangre y otros fluidos, como el pleural, pericárdico y peritoneal, se inocularon en frascos de cultivo BacT/ALERT PF (bioMèrieux). El control de funcionalidad de los frascos se realizó inoculando cepas bacterianas de identidad y concentraciones conocidas por el American Type Culture Collection (ATCC).
Las muestras de orina consideradas para el estudio fueron de un solo cultivo urinario en el que se aisló un germen con 103-105 UFC/ml.19
Para la identificación de las cepas bacterianas aisladas de los pacientes, se emplearon las pruebas manuales básicas de identificación convencional, como la morfología colonial, la tinción de Gram, catalasa y oxidasa,20 así como el procedimiento de identificación mediante el sistema automatizado Vitek 2XL (bioMèrieux).
Las pruebas de susceptibilidad a los antibióticos se determinaron de acuerdo con los lineamientos del Instituto de Estándares de Laboratorio Clínico (CLSI, por sus siglas en inglés),21 utilizando el sistema automatizado Vitek 2XL (bioMèrieux) y el método de Kirby-Bauer para verificar Staphylococcus aureus meticilino resistentes (SAMR). Se utilizó un disco de oxacilina (1 μg) en placas de Mueller-Hinton con 2% de cloruro de sodio y discos de cefoxitina (30 μg) en placas de Mueller-Hinton. Se utilizaron las cepas de S. aureus ATCC-29213 y ATCC-BAA-1026 como referencia.
En el caso de Streptococccus pneumoniae se utilizaron los niveles de corte para cepas de origen meníngeo y no meníngeo, según CLSI.
Se determinaron cepas sensibles o resistentes de acuerdo a la concentración mínima inhibitoria, según los parámetros del CLSI.21 Las bacterias en un rango intermedio se asumieron con sensibilidad disminuida.
Para definir un caso de infección nosocomial, se consideraron 72 horas posteriores al ingreso hospitalario, durante la hospitalización y 72 horas posteriores al egreso. Los casos de infección de la comunidad fueron los pacientes que ingresaron al HIMFG con datos clínicos asociados con la infección y los indeterminados son los casos en los que no fue posible documentar el período de inicio de la infección.
Resultados
Se aislaron 7708 microorganismos de las 27,209 muestras (28.3%) de pacientes pediátricos: 74.6% de hospitalización y urgencias y 25.4% de la consulta externa, de enero del 2010 a junio del 2011.
De los cultivos positivos, 44% se obtuvieron de sangre, 46% de orina, 6% de diferentes fluidos corporales (pleural, pericárdico y peritoneal) y 4% de líquido cefalorraquídeo. La recuperación correspondió a 16% en hemocultivos, 21% en urocultivos, 22% en fluidos corporales y 8% en líquido cefalorraquídeo (Cuadro 1). Se consideró, de acuerdo con los criterios establecidos, que el origen de la infección fue nosocomial en 1772 pacientes, adquiridas en la comunidad en 3085 pacientes y en 2851 pacientes no fue posible documentar con precisión el origen de la fuente de infección.
En el Cuadro 2 se enlistan, en orden de frecuencia, los microorganismos identificados en 7708 cultivos positivos. Los menos comunes, las especies de Acinetobacter, Kluyvera ascorbata y Aeromonas, no se presentan. El primer lugar lo ocupa el grupo de Staphylococcus coagulasa negativos, con 25.8% de frecuencia. Dentro de este grupo, Staphylococcus epidermidis representó más del 85% y Staphylococcus hominis, Staphylococcus haemolyticus y Staphylococcus auricularis el 15% restante.

Se identificaron 1421 Escherichia coli en urocultivos (80%) y 355 en sangre u otros fluidos corporales. Otros patógenos de infecciones urinarias encontrados fueron Klebsiella spp ., E. faecalis y E. faecium. En 1928 hemocultivos se identificaron, en orden de frecuencia , SCN, Staphylococcus aureus, Klebsiella pneumoniae, Pseudomonas aeruginosa, E.coli, Enterococcus spp. y Streptococcus pneumoniae .
En el Cuadro 3 se describe la susceptibilidad antimicrobiana de los patógenos Gram negativos más frecuentes. Las cepas de Escherichia coli presentaron mayor resistencia frente a trimetoprima-sulfametoxazol e incluso, ampicilina-sulbactam (74 y 68%, respectivamente). Resistencias menores se encontraron para amoxicilina-ácido clavulánico (27%), así como cefuroxima 24% (no mostrada en la tabla). La resistencia a aminoglucósidos, como gentamicina, fue de 31%. Para el grupo de las cefalosporinas de tercera generación fue de 40%. Las mejores opciones de sensibilidad se encontraron para piperacilina-tazobactam (72%), nitrofurantoína (84%) e imipenem (100%).
Las cepas de Pseudomonas aeruginosa muestran una resistencia de entre el 23 y 27% frente a fármacos de amplio uso hospitalario, como cefepime e imipenem, respectivamente. La mayor resistencia encontrada fue a trimetoprima/sulfametoxazol (94%). Los antibióticos con mayor susceptibilidad para este patógeno fueron gentamicina (64%), imipenem (73%), ceftazidima (75%), ciprofloxacina (82%) y piperacilina/tazobactam (83%). Para Klebsiella oxytoca , la mayor susceptibilidad fue para los fármacos ceftazidima, ceftriaxona y cefepima, con 84%.
Para Klebsiella pneumoniae, los antibióticos con mayor susceptibilidad fueron ciprofloxacino (94%), levofloxacina (97%) e imipenem (100%), y con cifras mucho menores a otros fármacos (entre 30 y 40%).
Para Enterobacter cloacae se encontró susceptibilidad de 100% para imipenem, 90% para ciprofloxacino, cefepima y levofloxacina. La resistencia en contra de ceftriaxona y ceftazidima fue del 33 y 36%, respectivamente.
La actividad antimicrobiana específica en contra de algunos de los Gram positivos se muestra en el Cuadro 4. Enterococcus faecalis resultó con resistencia de importancia para gentamicina (53%), altamente sensible a vancomicina, así como a otros beta lactámicos. Mientras que para Enterococcus faecium, la resistencia es manifiesta para beta lactámicos, aminoglucósidos (gentamicina) y, de manera considerable, vancomicina (58%). La susceptibilidad fue total para linezolid y tigeciclina. Streptococcus pneumoniae presentó resistencia a penicilina (25%) y eritromicina (49%) y fue 100% sensible para vancomicina, linezolid y moxifloxacina. Presentó susceptibilidades aceptables para cefalosporinas de tercera y cuarta generación. Se identificaron 67 cepas de S. pneumonia, de las cuales 97% no estuvieron relacionadas con meningitis y se aislaron en hemocultivos, líquido pleural y peritoneal.
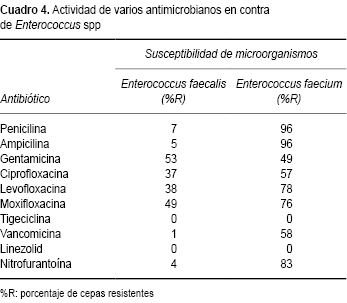
Para las 48 cepas de Streptococcus viridans la resistencia fue de 70% para penicilina, 62% para eritromicina, 43% para tetraciclinas y 42% para cefotaxima. La susceptibilidad más alta de S. viridans fue de 83% para clindamicina y 100% para vancomicina.
En el Cuadro 5 se analiza la susceptibilidad y resistencia de Staphylococcus aureus y Staphylococcus coagulasa negativa (SCN) en función de su susceptibilidad a meticilina. Staphylococcus aureus meticilino resistente (SAMR), fue prácticamente resistente a todos los beta lactámicos. Presentó resistencias variables, pero importantes, para clindamicina, ciprofloxacina y 23% para moxifloxacina. Fue altamente sensible a trimetoprima/sulfametoxazol, gentamicina, rifampicina, linezolid, tetraciclina, tigeciclina y vancomicina.
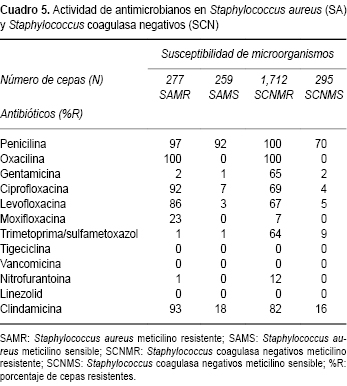
Staphylococcus aureus meticilino sensible (SAMS) presentó resistencia importante a penicilina (92%). Al resto de los fármacos la susceptibilidad varió entre 80 a 100%, sobresaliendo oxacilina, vancomicina, linezolid y tigeciclina con 100% de susceptibilidad. Las cepas de Staphylococcus coagulasa negativa meticilino resistente (SCNMR) fueron resistentes a todos los beta lactámicos. Presentaron resistencia variable para otros fármacos antimicrobianos, como clindamicina (82%), ciprofloxacina (69%), trimetoprima/sulfametoxazol (64%), gentamicina (65%), y resultaron altamente sensibles a linezolid, tigeciclina y vancomicina. De 536 cepas de Staphylococcus aureus , 51.67% fue resistente a oxacilina.
Discusión
Mucho de lo que conocemos sobre la epidemiología global de la resistencia bacteriana e, incluso, de la resistencia múltiple, proviene de grandes bases de datos sobre vigilancia organizada por la industria farmacéutica, de reportes de brotes epidémicos identificados en laboratorios de microbiología, así como de series o datos presentados por grupos de salud pública, bien sea a nivel nacional o internacional.2,5,7-10,12,15,21
Como consecuencia de la frecuencia de resistencia entre los patógenos hospitalarios, como el SAMR y Enterococcus vancomicina resistente (EVR), a partir de los 90 la atención se centró en esos microorganismos Gram positivos. Fue así como se pudo disponer en el mercado de nuevos fármacos utilizados para su tratamiento.
En los últimos años, el problema de la resistencia a los antimicrobianos se ha vuelto más complejo. Ahora, participan como protagonistas los Gram negativos: Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, Escherichia coli y otras enterobacterias.10,11,16,17
Las bacterias Gram positivas y negativas muestran mecanismos novedosos de resistencia a uno o varios antimicrobianos, lo que complica la selección inicial del tratamiento antimicrobiano que, ante pacientes con infecciones graves, debe ser iniciado a la brevedad en forma empírica.
Los programas de vigilancia epidemiológica de la resistencia bacteriana demuestran que existe una amplia variación geográfica en la prevalencia de resistencia bacteriana. Por lo anterior, estudios como este respaldan las decisiones locales para la prescripción de los antimicrobianos.
La principal etiología en pacientes con septicemia y choque séptico, de acuerdo con hemocultivos, es principalmente a cocos Gram positivos, como Staphylococcus spp., Enterococcus spp., S. pneumoniae y algunos S. viridans , situación parecida a lo informado en otras bases de datos.2-5,22
Las cepas de Staphylococcus aureus y coagulasa negativa sensibles a meticilina, son 100% sensibles a oxacilina, lo cual permite aceptar que ese fármaco se considere de elección primaria en el tratamiento de inicio. Sin embargo, en otras series hay preocupación por el aumento sostenido en la resistencia de Staphylococcus spp. a oxacilina.2-5 En cambio, cuando se trata de infecciones nosocomiales, el problema se complica por la resistencia múltiple a diversos fármacos, lo que justifica utilizar un glucopéptido asociado a un betalactámico. En los datos locales, por lo menos uno de cada cinco pacientes con hemocultivo positivo presentaba neumonía, 65% cursaba con septicemia y 15% con choque séptico. Esta situación complica la selección del esquema de tratamiento con antibióticos y respalda, por ejemplo, el esquema de combinar glucopéptidos y aminoglucósidos, con betalactámicos de tercera o cuarta generación. La justificación de estas asociaciones se tiene por la presencia de Gram negativos, principalmente Escherichia coli, Klebsiella pneumoniae, Enterobacter spp., Pseudomonas aeruginosa y otras enterobacterias. Todas estas bacterias, con diferentes sistemas de resistencia única y/o múltiple en contra de beta lactámicos,3,4,10,16,17 aminoglucósidos, glucopéptidos y otros fármacos antimicrobianos. Por esta razón, en la actualidad, se tiene la necesidad (en ocasiones urgente), de conocer algunos adjetivos que clasifiquen a estos Gram negativos como bacterias con producción de beta lactamasas de espectro ampliado, resistencia por la presencia de cefalosporinasas AmpC, betalactamasas, serín y metalo carbapenemasas, así como diferentes mecanismos para la resistencia en contra de quinolonas.10,16,17
Hay varios aspectos que resaltar en los resultados de este trabajo, fundamentalmente con base en el porcentaje de resistencia de algunos patógenos. En Staphylococcus spp., continúa aumentando la resistencia a oxacilina, clindamicina, eritromicina, ciprofloxacina y no se tiene resistencia a vancomicina, linezolid ni tigeciclina. No tenemos evidencia de que algunas cepas puedan tener aumento en las concentraciones mínimas inhibitorias ≥2 mg/ml en contra de vancomicina.23
Con Enterococcus faecalis la situación de resistencia, en general, no ha cambiado. Sin embargo, hay aumento sostenido de Enterococcus faecium resistente a vancomicina (58%), que representa cifras intermedias de las que se mencionan en la literatura.12 La resistencia a otros antimicrobianos, como gentamicina (49%) y tetraciclina (44%) es importante, ya que este patógeno se relaciona con infecciones sistémicas graves, lo que hace complicada la decisión del esquema de selección de los antimicrobianos para cada paciente.
Streptococcus pneumoniae 15 ciertamente continúa mostrando resistencia elevada a penicilina y a eritromicina. La mayoría de nuestros aislamientos no fueron de meningitis. La susceptibilidad para amoxicilina y cefalosporinas de amplio espectro fue mayor a 90% y continúa utilizándose la vancomicina para cepas con resistencia múltiple. El informe Regional del SIREVA-2010 presenta las variaciones geográficas de la resistencia a diferentes fármacos antimicrobianos de este patógeno en infecciones sistémicas.24
Escherichia coli es el Gram negativo más frecuente en los aislamientos, y representa la bacteria más frecuente en infecciones urinarias (80%). Esto resulta diferente de lo reportado por Mathai y colaboradores y en otras series publicadas.25,26 La menor participación de E.coli se puede deber a que la mayoría de los pacientes con infección urinaria cursaban con neutropenia, fiebre y foco urinario de infección. Esta puede ser la misma explicación para la frecuencia aumentada de otras bacterias, como Klebsiella spp., Pseudomonas spp., Enterobacter spp. y Proteus spp. Muchas de estas bacterias igualmente fueron aisladas en hemocultivos de pacientes con septicemia y choque séptico, con patrones de resistencia elevada semejantes a lo que se informa en la literatura en los últimos años, incluyendo las quinolonas.10,16,17,27 En los cultivos de líquido pleural se identificó con mayor frecuencia Pseudomonas aeruginosa ; en líquido sinovial, Staphylococcus aureus y en el líquido peritoneal, mezclas de Escherichia coli, Staphylococcus epidermidis y Klebsiella pneumoniae .
La resistencia para cefalosporinas de tercera y cuarta generación es alrededor de 70% para Klebsiella pneumoniae y de 40% para Escherichia coli, ambas importantes productoras de beta lactamasas de espectro extendido, AmpC cefalosporinasas y serin-metalo carbapenemasas,10,16,17 lo que, como consecuencia, reduce en forma importante las posibilidades de selección del esquema antimicrobiano. Esta situación es muy semejante con lo que ocurre con los bacilos no fermentadores, como Pseudomonas aeruginosa, que complican la resistencia a muchos otros fármacos, como los aminoglucósidos y a piperacilina-tazobactam.
Es importante considerar que los estudios de vigilancia de la resistencia antimicrobiana tienen limitaciones reconocidas y repetidas en los diferentes estudios. Este trabajo no fue la excepción.1
Finalmente, el conocer la información, de forma general, de las cepas aisladas en muestras clínicas y los patrones de resistencia, permitió confirmar que la emergencia de la resistencia a los antimicrobianos es un problema real en la atención de pacientes con infecciones graves. Por ello, los clínicos deben considerar la resistencia antimicrobiana como un problema de salud pública, que representa uno de los mayores desafíos para el futuro. Por otro lado, tomando en cuenta las limitaciones de nuestro estudio, se debe fortalecer, dentro de la institución, la red de vigilancia antimicrobiana, establecer las tendencias en tiempo real, correlacionar la información con los datos de infecciones nosocomiales y analizar las medidas de control y consumo de antimicrobianos.
Conflicto de intereses
Los autores declaramos no tener conflicto de intereses.
REFERENCIAS
1. Rempel OR, Laupland KB. Surveillance for antimicrobial resistant organisms: potential sources and magnitude of bias. Epidemiol Infect 2009;137:1665-1673. [ Links ]
2. Diekema DJ, Pfaller MA, Jones RN, Doern GV, Winocur PL, Gales AC, et al. Survey of bloodstream infections due to gram-negative bacilli: frequency of occurrence and antimicrobial susceptibility of isolates collected in the United States, Canada, and Latin America for the SENTRY Antimicrobial Surveillance Program, 1997. Clin Infect Dis 1999;29:595-607. [ Links ]
3. Fluit AC, Jones ME, Schmitz FJ, Acar J, Gupta R, Verhoef J. Antimicrobial susceptibility and frequency of occurrence of clinical blood isolates in Europe from the SENTRY Antimicrobial Surveillance Program, 1997 and 1998. Clin Infect Dis 2000;30:454-460. [ Links ]
4. Diekema DJ, Pfaller MA, Jones RN, Doern GV, Kugler KC, Beach ML, et al. Trends in antimicrobial susceptibility of bacterial pathogens isolated from patients with bloodstream infections in USA, Canada, and Latin America. SENTRY Participants Group. Int J Antimicrob Agents 2000;13:257-271. [ Links ]
5. Jones RN. Global epidemiology of antimicrobial resistance among community-acquired and nosocomial pathogens: a five-year summary from the SENTRY Antimicrobial Surveillance Program (1997-2001). Sem Respir Crit Care Med 2003;24:121-134. [ Links ]
6. Harbarth S, Samore MH. Antimicrobial resistance determinants and future control. Emerg Infec Dis 2005;11:794-801. [ Links ]
7. Cornaglia G, Akova M, Amicosante G, Cantón R, Cauda R, Docquier JD, et al. ESCMID Study Group for Antimicrobial Resistance Surveillance (ESGARS). Metallo-β-lactamases as emerging resistance determinants in Gram-negative pathogens: open issues. Int J Antimicrob Agents 2007;29:380-388. [ Links ]
8. Miriagou V, Cornaglia G, Eldestein M, Galani I, Giske CG, Gniadkowski M, et al. Aquired carbapenemases in Gram-negative bacterial pathogens: detection and surveillance issues. Clin Microbiol Infect 2010;16:112-122. [ Links ]
9. Bush K, Jacobi GA. Updated functional classification of β-lactamases. Antimicrob Agents Chemother 2010;54:969-976. [ Links ]
10. Gales AC, Jones RN, Forward KR, Liñares J, Sader HS, Verhoef J. Emerging importance of multidrug-resistant Acinetobacter species and Stenotrophomonas maltophilia as a pathogens in seriously ill patients: geographic patterns, epidemiological features, and trends in the SENTRY Antimicrobial Surveillance Program (1997-1999). Clin Infect Dis 2001;32(suppl 2):S104-S113. [ Links ]
11. Gales AC, Jones RN, Turnidge J, Ronnie R, Ramphal R. Characterization of Pseudomonas aeruginosa isolates: ocurrence rates, antimicrobial susceptibility patterns, and molecular typing in the global SENTRY Antimicrobial Surveillace Program, 1997-1999. Clin Infect Dis 2001;32(suppl 2):S146-155. [ Links ]
12. Low DE, Keller N, Barth A, Jones RN. Clinical prevalence, antimicrobial susceptibility, and geographic resistance patterns of Enterococci : results from the SENTRY Antimicrobial Surveillance Program, 1997-1999. Clin Infect Dis 2001;32(suppl 2):S133-S145. [ Links ]
13. Milstone AM, Goldner BW, Ross T, Shepard JW, Carroll KC, Perl TH. Methicillin-resistant Staphylococcus aureus colonization and risk of subsequent infection in critically ill children: importance of preventing nosocomial methicillin-resistant Staphylococcus aureus transmission. Clin Infect Dis 2011;53:853-859. [ Links ]
14. Liu C, Bayer A, Cosgrove SE, Daum RS, Fridkin SK, Gorwitz RL, et al. Clinical practice guidelines by the Infectious Diseases Society of America for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children: executive summary. Clin Infect Dis 2011;52:285-292. [ Links ]
15. Hoban DJ, Doern GV, Fluit AC, Roussel-Delvallez M, Jones RN. Worldwide prevalence of antimicrobial resistance in Streptococcus pneumoniae , Haemophilus influenzae, and Moraxella catarrhalis in the SENTRY Antimicrobial Surveillace Program, 1997-1999. Clin Infect Dis 2001;32(suppl 2):S81-S93. [ Links ]
16. Cornaglia G, Giamarellou H, Rossolimi GM. Metallo-b-lactamases: a last frontier for β-lactams? Lancet Infect Dis 2011;11:381-393. [ Links ]
17. Winokur PL, Canton R, Casellas JM, Legakis N. Variations in the prevalence of strains expressing an extended-spectrum β-lactamase phenotype and characterization of isolates from Europe, the Americas, and the Western Pacific Region. Clin Infect Dis 2001;32(suppl 2):S94-S103. [ Links ]
18. Pfaller MA, Acar J, Jones RN, Verhoef J, Turnidge J, Sader HS. Integration of molecular characterization of microorganisms in a global antimicrobial resistance surveillance program. Clin Infec Dis 2001;32(suppl 2):S156-S167. [ Links ]
19. Burd EM, Kehl KS. A critical appraisal of the role of the clinical microbiology laboratory in the diagnosis of urinary tract infections. J Clin Microbiol 2011;49:S34-S38. [ Links ]
20. Control de calidad de los frascos de hemocultivo, mielocultivo y líquido peritoneal HIM-LC-BAC-IT.03-2011.
21. Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing. Twentieth Informational Supplement. CLSI document M100-S20U. Wayne, PA: Clinical and Laboratory Standards Institute; 2010. [ Links ]
22. Diekema DJ, Pfaller MA, Jones RN, the SENRY Participants Group. Age-related trends in pathogen frequency and antimicrobial susceptibility of bloodstream isolates in North America: SENTRY Antimicrobial Surveillance Program, 1997-2000. Int J Antimicrob Agents 2002;20:412-418. [ Links ]
23. Holland TL, Fowler VG Jr. Vancomycin minimum inhibitory concentration and outcome in patients with Staphylococcus aureus bacteremia: pearl or pellet? J Infect Dis 2011;204: 329-331. [ Links ]
24. Organización Panamericana para la Salud. Informe Regional de SIREVA II, 2010: Datos por país y por grupos de edad sobre las características de los aislamientos de Streptococcus pneumoniae, Haemophilus influenzae y Neisseria meningitidis , en procesos invasores. Washington, DC: OPS; 2011. [ Links ]
25. Mathai D, Jones RN, Pfaller MA; SENTRY Participant Group North America. Epidemiology and frequency of resistance among pathogens causing urinary tract infections in 1,510 hospitalized patients: a report from the SENTRY Antimicrobial Surveillance Program (North America). Diagn Microbiol Infect Dis 2001;40:129-136. [ Links ]
26. Sahuaquillo-Arce JM, Selva M, Perpiñan H, Gobernado M, Armero C, López-Quílez A, et al. Antimicrobial resistance in more than 100,000 Escherichia coli isolates according to culture site and patient age, gender, and location. Antimicrob Agents Chemother 2011;55:1222-1228. [ Links ]
27. Finnell SM, Carroll AE, Downs SM; Subcommittee on Urinary Tract Infection. Diagnosis and management of on initial UTI in febrile infants and young children. Pediatrics 2011;128:e749-e770. [ Links ]














