Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Boletín médico del Hospital Infantil de México
Print version ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.70 n.2 México May./Apr. 2013
ARTÍCULO DE INVESTIGACIÓN
El ecocardiograma y su papel en niños con cáncer
Role of echocardiogram in children with cancer
Elsy Maureen Navarrete-Rodríguez,1 Marta Margarita Zapata-Tarrés,2 Alfredo Vizcaíno-Alarcón,3 Juan Garduño-Espinosa,4 Elisa Dorantes-Acosta,5 Miguel Ángel Palomo-Colli5
1 Residente de Alergia e Inmunología Clínica Hospital Infantil de México Federico Gómez
2 Servicio de Oncología Instituto Nacional de Pediatría
3 Médico adscrito al Servicio de Cardiología Hospital Infantil de México Federico Gómez
4 Subdirector de Investigación Hospital Infantil de México Federico Gómez
5 Médico adscrito al Servicio de Oncología Hospital Infantil de México Federico Gómez
México D.F., México
Autor de correspondencia: Dra. Elsy Maureen Navarrete Rodríguez
Correo electrónico: elsiee21@hotmail.com
Fecha de recepción: 05-02-13
Fecha de aceptación: 05-03-13
Resumen
Introducción. Actualmente las antraciclinas se han incorporado en más de 50% de los protocolos de tratamiento para cáncer en la población infantil. La utilidad clínica de estos agentes queda limitada por la aparición de cardiomiopatías, cuya presencia depende de la dosis total del fármaco y suele ser irreversible. El ecocardiograma es el estudio más utilizado para la detección de cardiotoxicidad por antraciclinas. El objetivo de este trabajo fue describir la evolución de los índices de funcionamiento cardiaco reportados por ecografía durante el tratamiento de niños con cáncer con esquemas que contenían antraciclinas.
Métodos. Se incluyeron pacientes pediátricos con diagnóstico de osteosarcoma y leucemia mieloide aguda tratados entre enero del 2006 y mayo del 2011 en el Hospital Infantil de México Federico Gómez. En el expediente clínico se documentaron los valores de las fracciones de eyección y acortamiento reportadas antes de cada ciclo. Se utilizó estadística descriptiva para el reporte de los resultados.
Resultados. La fracción de eyección prácticamente no sufrió variaciones hasta el sexto ciclo de tratamiento a una dosis acumulada de 332.5 mg/m2SC, para posteriormente decaer de forma acelerada. En la fracción de acortamiento el mayor cambio se produjo después del séptimo ciclo, a una dosis acumulada de 450 mg/m2SC.
Conclusiones. Reconocer el daño que se produce en etapas tempranas es un paso fundamental en la prevención de complicaciones. El reto es implementar nuevas herramientas que nos permitan alcanzar el objetivo de prevención o de diagnóstico de enfermedad subclínica.
Palabras clave: antraciclinas, prueba de función cardiaca, cardiotoxicidad, ecocardiograma.
Abstract
Background. Currently, anthracyclines have been used in >50% of cancer treatment protocols in children. The clinical usefulness of these agents is limited by the onset of cardiomyopathy whose presence depends on the total dose of drug and usually is irreversible. Echocardiography is used to study anthracycline cardiotoxicity detection. The aim of this study was to describe the evolution of cardiac function reported by echocardiography for treatment of children with cancer whose medications contain anthracyclines.
Methods. We included pediatric patients diagnosed with osteosarcoma and acute myeloid leukemia treated between January 2006 and May 2011 in the Hospital Infantil de México Federico Gómez. In the clinical files, values were documented for ejection fraction and shortening reported before each cycle, using descriptive statistics for reporting results.
Results. The ejection fraction experiences virtually no changes until the 6th cycle of treatment to a cumulative dose of 332.5 mg/m2/sc, afterwards it demonstrates an accelerated decline. According to the shortening fraction, the most significant change occurs after the seventh cycle to a cumulative dose of 450 mg/m2/sc.
Conclusions. Recognizing the damage that occurs during the early stages is a critical step in preventing complications. The challenge is to implement new tools that will allow us to achieve the objective of preventing or diagnosing subclinical disease.
Key words: anthracyclines, cardiac function test, cardiotoxicity, echocardiogram.
Introducción
Los avances en los tratamientos farmacológicos para el cáncer han conducido, en los últimos años, a una mejora significativa en el pronóstico de los pacientes oncológicos. Sin embargo, para lograr estos resultados se ha pagado un costo considerable en términos de efectos secundarios cardiacos asociados con el tratamiento.1
Las antraciclinas, consideradas hoy en día como de los fármacos antitumorales más importantes, tienen precisamente esta limitante. Su utilidad clínica se ve restringida por la aparición de cardiomiopatías.2,3
Estos compuestos se intercalan con el ADN, inhibiendo la síntesis tanto de ADN como de ARN. Se producen roturas en sus filamentos. Por tanto, las antraciclinas son mutágenas y carcinógenas. Se cree que la ruptura del ADN es mediada por la unión del fármaco al ADN y a la topoisomerasa II, acción que evita el resellado de roturas de ADN creadas por la enzima. En virtud de sus grupos quinona, las antraciclinas también generan radicales libres en solución y en tejidos, tanto normales como malignos. Las antraciclinas reaccionan con la reductasa del citocromo P450 en presencia de fosfato de dinucleótido de adenina y nicotinamida reducido (NADPH), para formar productos intermediarios radicales de semiquinona que, a su vez, reaccionan con oxígeno y producen radicales de anión superóxido. Éstos generan peróxido de hidrógeno y radicales hidroxilo (-OH), que atacan al ADN y oxidan las bases del mismo.3-5
El efecto citotóxico en los cardiomiocitos es irreversible y dependiente de la dosis acumulada, por lo que el corazón resulta uno de los órganos más vulnerables al daño por su bajo nivel de enzimas antioxidantes.2,3
La cardiotoxicidad por antraciclinas corresponde a todas aquellas alteraciones estructurales que se presentan en los cardiomiocitos, secundarias al uso de estos fármacos. Existe una definición clínica que valora el funcionamiento del miocardio después del uso de antraciclinas. Se define como una disminución de la fracción de eyección del ventrículo izquierdo (FEVI) en más de 20% en pacientes con FEVI normal o como una disminución de la FEVI de más de 10%, en valores basales menores de 50% o manifestaciones clínicas con signos y síntomas de insuficiencia cardiaca congestiva.6,7
Aproximadamente 1 de cada 4 pacientes presenta falla miocárdica cuando la dosis de antraciclinas excede los 500 mg/m2; 50% presenta eventos cardiacos con dosis acumuladas arriba de 600 mg/m2 y, prácticamente, todos los pacientes con dosis mayores de 800 mg/m2 presentan cardiotoxicidad.8
La frecuencia de alteraciones miocárdicas subclínicas reportada después del tratamiento con antraciclinas, alcanza hasta 57% y de las alteraciones cardiacas sintomáticas, hasta 16%.9
En la actualidad, el enfoque recomendado para detectar el daño cardiaco inducido por antraciclinas se basa principalmente en una evaluación sistemática de la función cardiaca al inicio del estudio y durante el tratamiento quimioterapéutico, por medio de la medición de la FEVI, utilizando ecocardiograma transtorácico 2D y la angiografía con radionúclidos.10-12
La principal limitación de este enfoque es su baja sensibilidad para la detección de cardiotoxicidad en una etapa temprana.1
Métodos
El estudio se realizó en el Departamento de Oncología del Hospital Infantil de México Federico Gómez (HIMFG). El objetivo fue describir la evolución de los índices de funcionamiento cardiaco reportados por ecografía de niños con cáncer en tratamiento con antraciclinas.
Se incluyeron pacientes en tratamiento menores de 18 años, con osteosarcoma (OS) o leucemia mieloide aguda (LMA). Se excluyeron los pacientes con cardiopatías congénitas adquiridas o previas y aquellos que recibieron tratamiento con radioterapia.
En el Departamento de Archivo Clínico se obtuvo el censo de los pacientes con estos diagnósticos que fueron dados de alta del servicio de Oncología del HIMFG de enero de 2006 a mayo de 2011. Se realizó un muestreo aleatorio simple estratificado para formar dos grupos de 25 integrantes de los dos diagnósticos incluidos en el estudio. Se inició la recolección de la información de acuerdo con el muestreo para su posterior análisis. Se utilizó estadística descriptiva para las variables demográficas.
Para la descripción de la dosis acumulada de antraciclinas, se dividió el tratamiento por ciclos de administración, obteniéndose el promedio de la dosis administrada en cada ciclo. Así mismo, se promediaron los valores de fracciones de eyección y acortamiento para su mejor visualización.
Resultados
Se incluyeron 30 pacientes que recibieron tratamiento con antraciclinas: 16 con diagnóstico de OS y 14 con diagnóstico LMA. De estos, 90% se encontraba aún bajo tratamiento y 3% había fallecido (uno de estos últimos por cardiotoxicidad secundaria a antraciclinas).
La media de edad fue de 143 meses, con un intervalo de 15 a 353 meses (Cuadro 1).

Descripción de la población estudiada
Del grupo con OS, 12 pacientes presentaban metástasis al momento del estudio y en 4 no se pudieron evidenciar. Del grupo con LMA, el diagnóstico predominante fue el tipo M2 con 50% de los participantes, de los cuales 57% se encontraba en inducción a la remisión.
La dosis acumulada de antraciclinas que se encontró en los pacientes incluidos fue de una media de 192 y un rango de 60 a 450 mg/m2SC (Cuadro 2). Se agruparon los pacientes por número de ciclo de quimioterapia recibido, secundario a las semejanzas encontradas en los esquemas de tratamiento. Para cada ciclo se realizó un promedio de la dosis acumulada de antraciclinas de los pacientes que se encontraban en esa etapa del tratamiento (Figura 1), y se obtuvieron los promedios de la fracción de eyección y de acortamiento por separado (Cuadro 3).

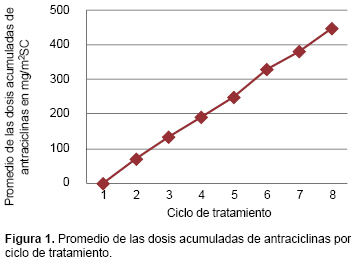
La Figura 2 muestra la asociación entre la progresión de las dosis acumuladas de antraciclinas con la fracción de eyección (FE) y la fracción de acortamiento (FA) promedio determinada para cada ciclo. Se observó que la variación de estos dos índices de función cardiaca no cambia de forma importante con los ciclos de quimioterapia subsecuentes del primero al sexto. Sin embargo, a partir del sexto ciclo, con una dosis acumulada promedio de 332.5 mg/m2SC, ambos parámetros disminuyeron considerablemente y de forma acelerada.

Discusión
Los resultados del presente trabajo reflejan una idea de los cambios en los valores de la fracción de eyección y de acortamiento conforme aumenta la dosis de antraciclinas, a través del ecocardiograma. Se ha descrito que la mayor frecuencia de cardiotoxicidad se encuentra con una dosis acumulada mayor de 450 mg/m2SC. Sin embargo, se ha visto que con dosis menores ya existe daño miocárdico.
Se observó que 10% de la población analizada había fallecido para el momento del estudio. En uno de estos pacientes (3.3%) se documentó el diagnóstico de insuficiencia cardiaca secundaria al uso de antraciclinas. Si bien se ha reportado una mortalidad por cardiomiopatía por antraciclinas de 7.5% con porcentaje de eventos cardiovasculares de hasta 50%, estos índices se han obtenido en pacientes con dosis acumulada mayor de 550 mg/m2SC. El valor más alto que se observó en este estudio fue de 450 mg/m2SC. La dosis acumulada en este grupo fue de 192.5 mg/m2SC (con un rango de 60 a 450 mg/m2SC, considerado ya como límite de seguridad para la presencia de cardiotoxicidad).
En la población que se estudió, la fracción de eyección prácticamente no sufrió variaciones hasta el sexto ciclo de tratamiento, lo que equivaldría a una dosis acumulada en promedio de 332.5 mg/m2SC. Sin embargo, comenzó a decaer de forma acelerada para el siguiente ciclo, con una disminución de 8% entre uno y otro. Con respecto a la fracción de acortamiento, el mayor cambio se produjo después del séptimo ciclo de tratamiento, donde se observó una disminución de 9% a una dosis acumulada de 450 mg/m2SC. De acuerdo con la definición clínica de cardiotoxicidad, que se puntualiza como una disminución de la fracción de eyección del ventrículo izquierdo (FEVI) en más de 20% en pacientes con FEVI normal o una disminución de la FEVI por más de 10% en valores basales menores del 50%, solo se encontró un paciente que cubría esta descripción. Sin embargo, las manifestaciones clínicas no fueron evaluadas ya que no eran parte de los objetivos planteados en esta investigación.
La insuficiencia cardiaca secundaria a cardiotoxicidad por uso de antraciclinas se ha documentado ampliamente en la literatura. Se relaciona con la dosis, y el riesgo permanece durante toda la vida a pesar de ya no estar bajo tratamiento con antraciclinas. Se ha observado que la mortalidad por este padecimiento rebasa el 50%, una vez instalada la enfermedad.
Los resultados de biopsias miocárdicas muestran evidencia fuerte de que el daño comienza en el momento de la exposición inicial, a pesar de que las reservas cardiacas impiden el reconocimiento clínico hasta que un daño suficiente ha tenido lugar para superar la compensación del corazón.
En el Hospital Infantil de México Federico Gómez se observó que los reportes de ecocardiograma que se realizan a la población en riesgo prácticamente permanecen sin cambios durante dosis acumuladas promedio de 300 mg/m2SC. Sin embargo, posteriormente se inicia el descenso progresivo e irreversible de sus valores, hasta llegar a la insuficiencia cardiaca franca.
Si bien, en esta institución, la dosis de antraciclinas que se utiliza es menor a las reportadas en la literatura como de mayor riesgo, se ha visto que los cambios microscópicos y, por ende, de la función miocárdica se establecen mucho antes de un deterioro clínico franco. El reto es reconocer el daño que se produce en etapas tempranas, ya que es un paso fundamental en la prevención de la aparición de insuficiencia cardiaca.
El pronóstico de los niños con cáncer ha mejorado sustancialmente con el paso del tiempo. Sin embargo, el aumento en las tasas de supervivencia ha revelado un aumento en las tasas de eventos adversos secundarios. El reto es identificar nuevas herramientas que permitan la prevención de patologías agregadas al cáncer y secundarias al tratamiento, como la cardiotoxicidad por uso de antraciclinas, y poder mejorar el pronóstico y la calidad de vida de estos niños.
Agradecimientos
Los autores del proyecto agradecen al Programa de Becas Carlos Slim por otorgar el apoyo a Elsy Maureen Navarrete Rodríguez.
REFERENCIAS
1. Colombo A, Cipolla C, Beggiato M, Cardinale D. Cardiac toxicity of anticancer agents. Curr Cardiol Rep 2013;15:362-73. [ Links ]
2. Kucharska W, Negrusz-Kawecka M, Gromkowska M. Cardiotoxicity of oncological treatment in children. Adv Clin Exp Med 2012;21:281-288. [ Links ]
3. Allen H, Driscoll D, Shaddy R, Feltes T. Moss and Adams' Heart Disease in Infants, Children, and Adolescents: Including the Fetus and Young Adults. Philadelphia: Lippincott Williams & Wilkins; 2008. [ Links ]
4. Floyd JD, Nguyen DT, Lobins RL, Bashir Q, Doll DC, Perry MC. Cardiotoxicity of cancer therapy. J Clin Oncol. 2005;23:7685-7696. [ Links ]
5. Roca-Alonso L, Pellegrino L, Castellano L, Stebbing J. Breast cancer treatment and adverse cardiac events: what are the molecular mechanisms? Cardiology 2012;122:253-259. [ Links ]
6. Kremer LC, Caron HN. Anthracycline cardiotoxicity in children. N Engl J Med 2004;351:120-121. [ Links ]
7. Iarussi D, Indolfi P, Casale F, Martino V, Di Tullio MT, Calabrò R. Anthracycline-induced cardiotoxicity in children with cancer: strategies for prevention and management. Paediatr Drugs 2005;7:67-76. [ Links ]
8. Kremer LC, van der Pal HJ, Offringa M, van Dalen EC, Voûte PA. Frequency and risk factors of subclinical cardiotoxicity after anthracycline therapy in children: a systematic review. Ann Oncol 2002;13:819-829. [ Links ]
9. Rahman AM, Yusuf SW, Ewer MS. Anthracycline-induced cardiotoxicity and the cardiac-sparing effect of liposomal formulation. Int J Nanomed 2007;2:567-583. [ Links ]
10. Jones A, Barlow M, Barrett-Lee PJ, Canney P, Gilmour IM, Robb SD, et al. Management of cardiac health in trastuzumab-treated patients with breast cancer: updated United Kingdom National Cancer Research Institute recommendations for monitoring. Br J Cancer 2009;100:684-692. [ Links ]
11. Bovelli D, Plataniotis G, Roila F, ESMO Guidelines Working Group. Cardiotoxicity of chemotherapeutic agents and radiotherapy-related heart disease: ESMO Clinical Practice Guidelines. Ann Oncol 2010;21(suppl 5):v277-v282. [ Links ]
12. Eschenhagen T, Force T, Ewer MS, de Keulenaer GW, Suter TM, Anker SD, et al. Cardiovascular side effects of cancer therapies: a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2011;13:1-10. [ Links ]














