Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.70 no.1 México ene./feb. 2013
CASO CLÍNICO-PATOLÓGICO
Agranulocitosis congénita
Congenital agranulocytocis
Io Daiela Castillo Martínez,1 Iván Rivas Rivera,2 Pedro Bazán Santos,3 Máshenka Moreno González,1 Sarbelio Moreno Espinosa,4 Félix Gaytán Morales,5 María Argelia Escobar Sánchez6
1 Hematología
2 Cirugía General
3 Radiología e Imagenología
4 Infectología
5 Departamento de Oncología
6 Departamento de Patología
Hospital Infantil de México ''Federico Gómez'' México, D.F., México
Autor de correspondencia: Dra. María Argelia Escobar Sánchez
Correo electrónico: bsnhim20091@hotmail.com
Fecha de recepción: 17-04-12
Fecha de aceptación: 23-01-13
Resumen de la historia clínica (A-09-54)
Se trata de una niña de 7 años con neutropenia crónica que ingresó por rinorrea, fiebre y una lesión dérmica en puente nasal. Inicialmente mejoró; sin embargo, persistió febril, con inestabilidad hemodinámica y falleció por choque séptico con foco abdominal.
Hallazgos de imagenología
(Dr. Pedro Bazán Santos)
En este corte coronal de tomografía se observa el engrosamiento de la mucosa de ambos antros maxilares, etmoidales y esfenoidales. No hay niveles hidroaéreos (Figura 1).

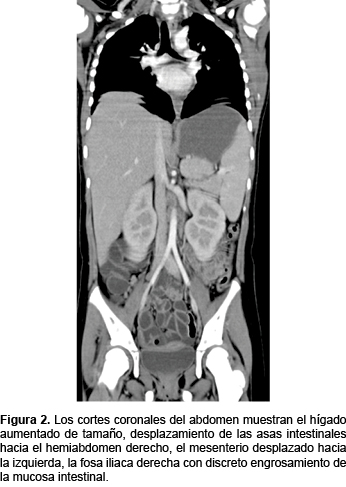
Por otra parte, los cortes coronales del abdomen muestran el hígado aumentado de tamaño, el desplazamiento de las asas intestinales hacia el hemiabdomen derecho, el mesenterio desplazado hacia la izquierda, la fosa iliaca derecha con discreto engrosamiento de la mucosa intestinal (Figura 2).
En los cortes axiales se observan campos pulmonares con imagen de vidrio esmerilado y en su interior se observa la trama broncovascular. No hay evidencia de condensación ni neumotórax (Figura 3).

Lamentablemente, no se contaba con radiografías en el archivo de cuando se diagnosticó a la niña con colitis neutropénica.
Presentación del caso
(Dr. Iván Rivas Rivera)
El día de hoy discutiremos el caso de una paciente de sexo femenino de 7 años de edad referida de un hospital de segundo nivel desde los tres meses de edad.
Como antecedente de importancia tenemos que, a los 15 días de vida, presentó un cuadro de síndrome anémico, caracterizado por palidez e ictericia de tegumentos, así como de concentración de hemoglobina por debajo de los niveles normales para la edad. Requirió una transfusión de paquete globular. Se desconoce el abordaje diagnóstico y los signos o síntomas acompañantes.
A los tres meses de edad presentó un cuadro similar, motivo por el cual es referida a nuestro hospital.
A su ingreso se encontró una anemia normocítica, normocrómica de tipo arregenerativa, que provocaba un síndrome anémico conformado por palidez de tegumentos y hemoglobina fuera de niveles normales, por lo que, nuevamente, requirió de una transfusión de concentrado eritrocitario. Fue valorada por el Servicio de Hematología, ya que se sospechó el diagnóstico de anemia de Diamond Blackfan.
Los criterios diagnósticos para esta patología, determinados por consenso internacional, incluyen la edad menor a un año, la anemia macrocítica sin otra citopenia, reticulocitopenia, aspirado de médula ósea con disminución de precursores de línea roja y cuenta de neutrófilos y plaquetas normales.1
En nuestra paciente, la biometría hemática de ingreso contaba con 410 neutrófilos totales y no se refiere en el resumen clínico si se realizó aspirado de médula ósea para determinar la presencia de precursores de las líneas celulares.
A pesar de esto, se inició tratamiento con esteroides. Presentó mejoría clínica y con resultados de una biometría hemática dentro de parámetros normales a los dos meses de iniciado el tratamiento.
Es importante notar que en el primer aspirado de médula ósea del que se hace referencia en el resumen clínico, se documentan precursores de las tres series celulares; incluso con hiperplasia de la serie roja y maduración de la serie mieloide hasta bandas, persistiendo con neutropenia en la biometría de control. Estos datos se contraponen con el diagnóstico de falla medular congénita, sugerido durante su internamiento, lo que nos hace pensar en una etiología probablemente autoinmune.
Se intentó estudiar esta alteración, solicitando anticuerpos antineutrófilos, los cuales no se realizaron sin especificar el motivo.
La paciente tuvo un seguimiento irregular en la consulta externa de hematología, debido a la inasistencia de la paciente a sus citas de control. Además, se solicitaron diversos estudios de laboratorio que tampoco se realizaron.
A los 7 años de edad, la paciente ingresó al servicio de urgencias con un síndrome rinosinusal basado en la presencia de rinorrea hialina -que posteriormente se tornaría amarillenta-, fiebre de hasta 38.5°C y a la exploración física con mucosa nasal violácea, abundante secreción purulenta, cuello con adenomegalias de 2 cm localizadas en la cadena cervical anterior y una lesión en el dorso nasal de 0.5 cm de diámetro, con aspecto necrótico y coloración violácea circundante.
Durante la valoración inicial se integró un síndrome de respuesta inflamatoria sistémica con datos de choque séptico, conformado por la presencia de taquicardia, taquipnea, hipotensión, retardo en el llenado capilar y pulsos periféricos débiles, ameritando intubación endotraqueal, detectándose como foco aparente el proceso rinosinusal descrito anteriormente.
Ante la presencia de pancitopenia, alteraciones en los tiempos de coagulación, hepatomegalia, exantema generalizado y hemofagocitosis en el aspirado de médula ósea, se integró el diagnóstico de síndrome hemofagocítico secundario.2
Se realizó una impronta en la lesión nasal, y se encontraron blastoconidias por lo que se inició manejo a base de anfotericina B, además de cefalosporinas de tercera generación y un aminoglucósido como parte del tratamiento contra choque séptico.
Debido a los hallazgos en los estudios de imagen, laboratorio y el cuadro clínico se diagnosticó una pansinusitis micótica, esperada en una paciente con neutropenia grave de larga evolución que ingresa con datos de choque séptico.
Para su manejo, se colocó un catéter venoso central, y durante su internamiento presentó datos de sepsis relacionada a catéter, ya que persistió con datos de respuesta inflamatoria sistémica aunados a un crecimiento en el hemocultivo de un coco Gram positivo, el cual posteriormente se identificaría como un S. epidermidis .
Idealmente, se debiera hacer un cultivo cuantitativo diferencial entre el cultivo periférico y el central, para determinar si el dispositivo es el foco infeccioso. Sin embargo, debido a que no se contó con el recurso en este caso, se decidió retirar el catéter e iniciar terapia a base de vancomicina.
Debe hacerse notar que los pacientes con alteraciones hematológicas graves requieren de accesos vasculares centrales, por lo que un inadecuado manejo en estos dispositivos lleva a complicaciones graves que ponen en peligro la vida.
Es necesario llevar a cabo todas las medidas de asepsia y antisepsia para evitar la colonización de los dispositivos, y así brindar una atención de calidad.
Ante la mala evolución de la paciente y por persistir con fiebre a pesar de múltiples esquemas antibióticos, se decidió realizar drenaje quirúrgico de senos paranasales. Se reportó un cultivo positivo de mucosa nasal para Candida albicans . Con este resultado, la paciente recibió tratamiento a base de anfotericina B por 21 días.
Como complicación de una neutropenia prolongada, la paciente presentó datos de colitis neutropénica sustentados en un engrosamiento de la pared colónica de hasta 9 mm y acompañado por dolor abdominal, fiebre, vómito y evacuaciones disminuidas de consistencia. La colitis neutropénica o tiflitis es un síndrome caracterizado por la triada clásica de dolor abdominal, fiebre y neutropenia, datos que, como ya se mencionó, presentaba la paciente.
Ante un paciente con factores predisponentes y sospecha diagnóstica basada en el cuadro clínico, es necesario solicitar estudios de imagen que confirmen el diagnóstico. Actualmente, las mejores opciones son el ultrasonido y la tomografía computada, ambas herramientas que, al detectar un engrosamiento de la pared intestinal mayor a 4 mm, confirman la sospecha. Existe controversia sobre cuál de los dos estudios de imagen es el que permite de mejor manera medir la pared intestinal. McCarville y colaboradores describen, en su artículo publicado en el 2005, al ultrasonido (US) de alta definición como la mejor opción para medir la pared intestinal en pacientes pediátricos.3 La decisión sobre realizar US o TAC debe basarse en la disponibilidad del estudio, la experiencia y la confiabilidad del radiólogo que llevará a cabo el estudio.
La fisiopatología no ha sido completamente entendida. Se cree que su causa es multifactorial, involucrando un compromiso en la integridad de la pared colónica, infección de la misma, bacteremia, necrosis, hemorragia y perforación.4 En edad pediátrica no es exclusiva de pacientes oncológicos. También puede presentarse en pacientes inmunocomprometidos. En la mayoría de los casos pueden manejarse efectivamente con descompresión, reposo intestinal, soluciones intravenosas y antibióticos de amplio espectro.
El uso empírico inicial de antibióticos se rige por las recomendaciones del tratamiento del paciente febril con neutropenia de alto riesgo: cefalosporina de tercera generación con cobertura antipseudomonas + vancomicina + metronidazol, o monoterapia con carbapenem, agregando un antimicótico si la fiebre y la neutropenia severa duran más de 5 días.5
Es importante hacer notar que los pacientes que persisten con neutropenia por más de 7 días cuentan con mal pronóstico, al presentar una mayor incidencia de complicaciones secundarias a la colitis neutropénica. En nuestra paciente se describió una lesión sugestiva de absceso perianal, por lo que se agravo aún más su pronóstico.
Los criterios quirúrgicos en pacientes con diagnóstico de colitis neutropénica fueron descritos en 1986, por Schamberg y colaboradores, y aún son vigentes.4 Éstos incluyen la presencia de sangrado de tubo digestivo a pesar de la corrección de coagulopatía, trombocitopenia y neutropenia, la evidencia de aire libre intraabdominal, estado de choque refractario a manejo intensivo y la presencia de un proceso intraabdominal que requeriría manejo quirúrgico en un paciente no neutropénico. Con base en esto, se descartó el manejo quirúrgico durante el primer cuadro de colitis neutropénica.
La paciente continuó con pancitopenia, deterioro hemodinámico y respiratorio, requiriendo nuevamente de intubación endotraqueal. Posteriormente, presentó datos compatibles con un síndrome compartimental abdominal, basado en la distensión abdominal de 6 cm, el deterioro ventilatorio manifestado por la necesidad de ventilación mecánica y los datos de choque. Con todos estos datos se decidió colocar un catéter rígido intraabdominal. Un diagnóstico temprano de este síndrome permite la aplicación de una serie de medidas no quirúrgicas que han demostrado la elevación en la tasa de sobrevida. Los pacientes que manifiestan elevación de la presión intraabdominal y disfunción orgánica refractaria a estas medidas no quirúrgicas, se han beneficiado de una descompresión temprana mediante la colocación de un catéter rígido. Según el artículo de revisión sobre síndrome compartimental abdominal, publicado por Carlotti y Carvalho en 2009, la descompresión por medio de la colocación de un catéter percutáneo puede evitar la resolución quirúrgica del mismo.6
La paciente continuó con deterioro hemodinámico a pesar del tratamiento intensivo, por lo que fue necesario realizar una laparotomía exploradora, encontrando abundante ascitis, apéndice isquémica y una zona de perforación en sigmoides, por lo que se realizó colectomía total e ileostomía. Durante el transoperatorio presentó dos eventos de paro con duración de 22 y 3 minutos, respectivamente, los cuales respondieron al manejo establecido.
Durante la laparotomía los segmentos intestinales necróticos o perforados deben ser resecados, ya que realizar una ileostomía solamente para desfuncionalizar el colon, no elimina la fuente del choque séptico. A pesar del manejo quirúrgico, del uso de aminas vasoactivas y la transfusión de hemoderivados, la paciente persistió con inestabilidad hemodinámica, con datos de choque persistente que finalmente la llevaron al paro cardiorrespiratorio sin respuesta a maniobras avanzadas de reanimación.
Recapitulando, se trató de una paciente que presentó neutropenia prolongada, choque séptico secundario a infección fúngica con mala evolución, evolucionó a una colitis neutropénica con síndrome compartimental abdominal que requirió tratamiento quirúrgico, persistió con inestabilidad hemodinámica y, finalmente, paro cardiorrespiratorio.
Los diagnósticos finales son los siguientes:
• Escolar femenino eutrófico
• Neutropenia probablemente autoinmune
• Pansinusitis fúngica invasiva por Candida albicans
• Sepsis relacionada al catéter por S. epidermidis
• Colitis neutropénica
• Síndrome compartimental abdominal
• Choque séptico
Hallazgos anatomopatológicos
(Dra. Ma. Argelia Escobar Sánchez)
Esta paciente contaba con varias biopsias previas y una citología.
La primera biopsia que se recibió en el hospital es la Q-2006-1528, en la cual se observaron fragmentos de hueso trabecular sin alteraciones y varios espacios intertrabeculares con celularidad aproximada de 90%. Las tres series hematopoyéticas están presentes. La serie mieloide madura normalmente hasta bandas y segmentados. La serie eritroide es escasa y los megacariocitos no muestran alteraciones. No hay células neoplásicas ni mielofibrosis (Figura 4).

La segunda biopsia corresponde a la Q-2007-732, muy semejante a la anterior, con una celularidad aproximada de 80 a 90% y presencia de las tres series con maduración normal. Hay maduración de la serie mieloide y no hay células neoplásicas ni mielofibrosis.
Posteriormente, se recibió una nueva biopsia (Q-09-1608), en la que hay disminución de la celularidad, aproximadamente de 80%. La serie mieloide sigue presentando maduración hasta bandas y hay detención en la maduración de la serie eritroide. Se observan algunos macrófagos de citoplasma claro y no hay células neoplásicas. Se recibió también tejido identificado como mucosa de cornete y vestíbulo que mostraba fragmentos de tejido revestidos por epitelio respiratorio ulcerado, fibrosis y extenso infiltrado inflamatorio mononuclear no había neutrófilos y no se observaron hongos ni otros microorganismos.
En 2009 se recibió otra biopsia (Q-09-1775) que correspondía a tejido identificado como mucosa de septum y cornetes con necrosis isquémica, trombosis e inflamación crónica. No se observaron hongos ni otros microorganismos (Figura 5).

Se recibió también una citología (C-09-347) que correspondía a líquido de aspirado bronquial sin evidencia de infección por Pneumocystis jirovecci .
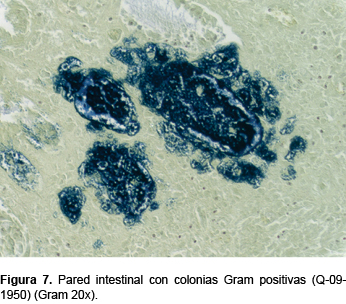
Finalmente, recibimos el producto de resección de íleon, válvula ileocecal, apéndice cecal y colon, que mostraban necrosis coagulativa extensa de la mucosa (Figura 6), con escaso infiltrado inflamatorio mononuclear, sin evidencia de infiltrado neutrofílico y numerosas colonias bacterianas Gram positivas y negativas (Figura 7). No había otros microorganismos (Q-09-1950).

Los diagnósticos de las biopsias y citología se resumen de la siguiente manera:
• Q-06-1528 y Q-07-732. Médula ósea con celularidad de 90% y maduración de la serie mieloide. Negativa para microorganismos y células neoplásicas
• Q-09-1608. Médula ósea con celularidad de 80%. Mucosa de cornetes y vestíbulo con inflamación crónica. Negativas para hongos
• Q-09-1775. Mucosa de septum y cornetes con necrosis isquémica, trombosis e inflamación crónica, negativas para hongos
• Q-09-1950. Íleon, válvula ileocecal, apéndice cecal y colon. Enterocolitis neutropénica con colonias bacterianas Gram positivas y negativas
• C-09-347. Citología de broncoaspirado negativa para Pneumocystis jirovecci
Posteriormente, se recibió, en el Departamento de Patología, el cuerpo de una niña con una facies normal, con una herida reciente suturada con grapas de 20 cm de longitud, localizada en la línea media abdominal y los orificios de los estomas. La médula ósea mostró una celularidad disminuida en relación a las biopsias previas, de aproximadamente 50% (Figura 8). Las tres series estaban disminuidas; sin embargo, continuó la maduración de la serie mieloide. Hay, además, numerosas células plasmáticas y macrófagos de citoplasma claro. Se realizaron tinciones de inmunohistoquímica. La mieloperoxidasa mostró la presencia de serie mieloide y su maduración (Figura 9). La tinción de CD138 evidenció la presencia de células plasmáticas aumentadas en número.


El resto de los órganos del sistema fagocítico mononuclear mostraron ganglios linfáticos con disminución importante del tejido linfoide cortical y paracortical y numerosos macrófagos localizados en los senos medulares, algunos de citoplasma claro y otros con hemofagocitosis. El timo mostraba disminución del tejido linfoide, infiltración adiposa y calcificación de los corpúsculos de Hassall.
El bazo estaba aumentado de tamaño, con un peso de 174 g contra un esperado de 66 g. Macroscópicamente mostraba algunas áreas de congestión y microscópicamente había disminución del tejido linfoide, congestión de la pulpa roja y hemofagocitosis. Se realizaron tinciones de inmunohistoquímica para linfocitos B con CD20, que resultó positiva en los centros germinales y zona del manto, lo que descarta razonablemente una alteración de la inmunidad humoral.
El hígado también estaba aumentado de peso, 1500 g contra un esperado de 680 g para la edad. Había congestión y, desde el punto de vista histológico, se observó que los espacios porta no presentaban alteraciones. En el lobulillo, los sinusoides dilatados, congestivos, con depósito de hemosiderina.
Con estos hallazgos, se determinó que la enfermedad principal fue neutropenia grave, ya que la médula ósea no presenta alteraciones. La serie mieloide estaba presente con maduración, por lo que se sugiere que el problema era periférico, con destrucción después de su liberación. Las causas pueden ser secundarias a enfermedades autoinmunes o procesos infecciosos. En este caso, dadas las características, se considera como una probable causa un proceso autoinmune del tipo de neutropenia autoinmune primaria congénita con destrucción de los neutrófilos. Sin embargo, no se contó el resultado de los anticuerpos antineutrófilos, por lo que solamente puede proponerse.7-10
Las alteraciones concomitantes son:
• Plasmocitosis reactiva
• Hemofagocitosis
• Hiperplasia sinusal reactiva en los ganglios linfáticos peritraqueales y mesentéricos
• Esplenomegalia congestiva (174 versus 66 g)
• Hepatomegalia congestiva (1500 versus 680 g)
• Involución del timo
En el presente artículo se han descrito varias causas de neutropenia congénita, en la que están involucradas diversas alteraciones moleculares con implicación de varios genes. Existen diversas etiologías relacionadas a procesos infecciosos, medicamentos y causas autoinmunes que es la más probable en este caso, sin embargo, es necesaria la determinación de anticuerpos como GAT, GIFT, anticuerpos Ig G HNA-1 y HNA-2. 7
Entre otros hallazgos, esta pieza corresponde a un fragmento de colon que muestra mucosa con numerosas ulceras pequeñas y extensas áreas de necrosis y congestión. El intestino delgado mostró mucosa congestiva y adelgazada. Los cortes histológicos con necrosis isquémica extensa de la mucosa, escaso infiltrado inflamatorio mononuclear que se extiende hasta la serosa y numerosas colonias bacterianas Gram positivas y Gram negativas. No hay infiltrado inflamatorio neutrofílico.
El esófago y estómago con congestión de la mucosa y edema. Histológicamente íntegros con congestión y bandas de contracción en la pared muscular. El páncreas, vesícula biliar y resto del intestino delgado sin alteraciones. Con estos hallazgos se integraron los siguientes diagnósticos:
• Enterocolitis necrosante con numerosas colonias bacterianas Gram positivas y negativas
• Peritonitis aguda
• Status post laparotomía exploradora y colectomía total (27 octubre 2009)
• Status postileostomía (27 octubre 2009)
Los pulmones tuvieron un peso de 650 g contra un esperado de 253 g, macroscópicamente con algunas áreas de congestión y hemorragia de predominio en el pulmón izquierdo (Figura 10). Microscópicamente, se observó hemorragia y edema intraalveolar (Figura 11).


El corazón tuvo un peso de 175 g contra un esperado de 100 g. Se observó estructuralmente normal, con zonas de congestión en la adventicia de los grandes vasos. Los diferentes cortes mostraron datos de hipoxia a nivel de los cardiomiocitos.
En el sistema nervioso central, se observó que el encéfalo tuvo un peso dentro de lo esperado, de 1260 versus 1263 g; el patrón de circunvoluciones es normal, con congestión de los vasos subaracnoideos tanto en la convexidad como en la base, de predominio parietooccipital izquierdo. Microscópicamente con congestión importante de los vasos subaracnoideos y datos de hipoxia neuronal con retracción del núcleo e hipereosinofilia del citoplasma de las neuronas.
Los riñones estaban aumentados de peso, de 380 versus 139 g. La relación cortico medular conservada con congestión de la médula y edema de la mucosa vesical. Histológicamente con congestión de los capilares glomerulares y pérdida del epitelio tubular, es decir, una necrosis tubular aguda secundaria a choque. El sistema endocrino, con paratiroides congestivas. Las glándulas suprarrenales con congestión. Los ovarios mostraron quistes foliculares primarios y secundarios dilatados. Se integraron los siguientes datos anatómicos de choque:
• Encefalopatía hipóxico isquémica
• Necrosis tubular aguda
• Daño alveolar agudo
• Congestión multivisceral
En cuanto a los cultivos post mortem , se observaron en el hemocultivo, intestino delgado, colon e hígado, Enterococcus faecium y Pseudomonas aeruginosa (dos morfotipos).
Pulmón izquierdo, derecho, bazo y LCR: Negativos.
Comentario de hematología
(Dra. Máshenka Moreno González)
En cuanto a la neutropenia que presentó esta paciente se deben considerar tres diagnósticos diferenciales: neutropenia congénita severa, síndrome linfoproliferativo autoinmune y neutropenia autoinmune.
La neutropenia congénita severa es muy poco frecuente11 y causa infecciones severas desde el primer mes de vida, sin remisión espontánea de la neutropenia (como se presentó en este caso después del tratamiento con esteroides) y en el aspirado de médula ósea se encuentra una detención en la maduración de la serie mieloide en promielocitos, criterios que tampoco presentó esta paciente.
El síndrome linfoproliferativo autoinmune se puede sospechar ante los resultados de la médula ósea que sí presentó la paciente, ya que se trataba de una médula reactiva con hiperplasia de las tres series, así como las adenomegalias. Sin embargo, no se contó con el resto de estudios para confirmar el diagnóstico (como exámenes de laboratorio para descartar procesos autoinmunes y, sobre todo, una citometría de flujo para cuantificación de linfocitos T dobles negativos). Así mismo, el reporte de patología de los ganglios, que mencionó la doctora Escobar, no fue compatible con este diagnóstico, ya que se esperaría hiperplasia folicular con expansión paracortical, no encontrado en la paciente.12-15
Por lo anterior, se considera que el diagnóstico más probable fue una neutropenia autoinmune, ya que es una causa más frecuente y adquirida. La neutropenia de esta paciente no inició desde el nacimiento. Llama la atención que tuvo respuesta a esteroides, los cuales se administraron para la aplasia pura de serie roja. Sin embargo, como se mencionó en la biometría de control, la recuperación se dio también en los neutrófilos. Se ha demostrado en algunos pacientes que el desencadenante para la neutropenia autoinmune es una infección por parvovirus B19. En su primer ingreso, esta paciente presentó aplasia pura de serie roja, que pudo ser causada por parvovirus B19 y, posteriormente, desencadenar la neutropenia autoinmune.9,16
Comentario de infectología
(Dr. Sarbelio Moreno Espinosa)
En este caso, ya que la neutropenia era grave y crónica, se hizo el comentario acerca de si ella se hubiera beneficiado acerca de un esquema de antibiótico profiláctico para disminuir el riesgo de infección; sin embargo, la mayoría de los expertos coincide en que no existe mayor ventaja en iniciar profilaxis antibiótica que tratar la infección cuando esta ocurra.17
Como medida preventiva, en estos pacientes se recomienda también una buena higiene bucal con cepillado y masaje cuidadoso, además de visitas regulares al odontólogo.18
El otro punto a discutir fue que, en alguna ocasión, se decidió el retiro de antibióticos, por considerarse que la fiebre se asociaba a estos.
Se considera fiebre asociada a antibióticos cuando ocurre una elevación gradual o abrupta de la temperatura corporal durante la terapia antibiótica, a pesar de la falta de evidencia de exacerbación de la infección. A pesar de que se desconoce por completo el mecanismo mediante el cual la fiebre es inducida por un antibiótico, se sugiere fuertemente un involucro inmunológico, o en otras palabras una reacción alérgica a una droga.19
En este caso se trata de una paciente con una neutropenia corroborada, que justificaría la presencia de fiebre por una causa infecciosa, por lo que no se cumple la definición de fiebre asociada a antibiótico. Esto se corroboró con la remisión de la fiebre en el momento en que se escaló a un mayor espectro.
Recientemente se ha demostrado, mediante estudios retrospectivos clínicos no controlados y dos ensayos clínicos controlados, el beneficio potencial de la combinación de nuevos agentes antifúngicos en el tratamiento de infecciones sistémicas por hongos filamentosos. Las combinaciones empleadas han sido un polieno (como anfotericina B) más una equinocandina (como caspofungina), anfotericina B con un azol (como voriconazol) y voriconazol más caspofungina. En algunos casos, se ha corroborado antagonismo entre anfotericina B y voriconazol, pero en otros reportes no se ha reportado esta situación.20 En cuanto a las infecciones por Candida , existe un reporte exitoso de la combinación de anfotericina B con caspofungina en infección por Candida glabrata .21
Comentario de trasplantes de células progenitoras hematopoyéticas
(Dr. Félix Gaytán Morales)
El trasplante de células progenitoras hematopoyéticas es un procedimiento actualmente utilizado para la curación de una gran diversidad de problemas malignos y no malignos. En su mayoría, problemas con indicación de trasplante desde el diagnóstico.
Cabe mencionar que, efectivamente, hay patologías en las cuales, al presentar una recaída posterior al inicio del tratamiento (como por ejemplo leucemias de riesgo habitual) o en el caso de enfermedades con refractariedad al tratamiento (linfomas, enfermedades autoinmunes como lupus eritematoso, VIH, neutropenias congénitas), tienen indicación de trasplante de células progenitoras hematopoyéticas.22-27
En el caso particular de esta paciente, y como se realiza en el protocolo de estudio en nuestro servicio, la primera consulta -o interconsulta si es paciente hospitalizado- es para evaluar si el paciente tiene la indicación del trasplante con base en las características biológicas, inmunológicas y genéticas del padecimiento, y así iniciar dicho protocolo de estudio. No debe tomarse la decisión de trasplantar a un paciente si no tiene un diagnóstico establecido y está en condiciones inestables, por lo que considero que la valoración de realizar el trasplante en esta paciente fue de forma apresurada, de acuerdo con lo explicado anteriormente.
Comentario final
(Dra. Io Daiela Castillo Martínez)
En esta paciente se presentaron varias situaciones que hay que tomar en cuenta. Antes que nada, la importancia de realizar un diagnóstico oportuno y certero de la neutropenia, estudiando múltiples causas y considerando distintas opiniones, sin encasillarse en una sola patología. De este abordaje, indudablemente dependerá el tratamiento dirigido y el pronóstico del paciente.
La colitis neutropénica que presentó la paciente debe hacernos reflexionar acerca de la valoración clínica, tanto médica como quirúrgica, minuto a minuto. Tampoco se deben pasar por alto las indicaciones de cirugía temprana radical para poder lograr una mayor sobrevida y mejora en el pronóstico del choque séptico.
Finalmente, la determinación de si un paciente es candidato a trasplante de progenitores hematopoyéticos debe hacerse con un diagnóstico adecuado y en condiciones óptimas, no cuando se encuentra inestable.
REFERENCIAS
1. Vlachos A, Ball S, Dahl N, Alter BP, Sheth S, Ramenghi U, et al. Diagnosing and treating Diamond Blackfan anaemia: results of an international clinical consensus conference. Br J Haematol 2008;142:859-876. doi: 10.1111/j.1365-2141.2008.07269.x [ Links ]
2. Henter JI, Horne A, Aricó M, Egeler RM, Filipovich AH, Imashuku S, et al. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis. Pediatr Blood Cancer 2007;48:124-131. [ Links ]
3. McCarville MB, Adelman CS, Li C, Xiong X, Furman WL, Razzouk BI, et al. Typhlitis in childhood cancer. Cancer 2005;104:380-387. [ Links ]
4. Schamberger RC, Weinstein HJ, Delorey MJ, Levey RH. The medical and surgical management of typhlitis in children with acute nonlymphocytic (myelogenous) leukemia. Cancer 1986;57:603-609. [ Links ]
5. Hughes WT, Armstrong D, Bodey GP, Bow EJ, Brown AE, Calandra T, et al. 2002 guidelines for the use of antimicrobial agents in neutropenic patients with cancer. Clin Infect Dis 2002;34:730-751. [ Links ]
6. Carlotti AP, Carvalho WB. Abdominal compartment syndrome: a review. Pediatr Crit Care Med 2009;10:115-120. doi: 10.1097/PCC.0b013e31819371b2 [ Links ]
7. Boztug K, Klein C. Novel genetic etiologies of severe congenital neutropenia. Curr Opin Immunol 2009;21:472-480. doi: 10.1016/j.coi.2009.09.003 [ Links ]
8. Starkebaum G. Chronic neutropenia associated with autoimmune disease. Semin Hematol 2002;39:121-127. [ Links ]
9. Bruin MC, von dem Borne AE, Tamminga RY, Kleijer M, Buddelmeijer L, de Haas M. Neutrophil antibody specificity in different types of childhood autoimmune neutropenia. Blood 1999;94:1797-1802. [ Links ]
10. Bellanné-Chantelot C, Clauin S, Leblanc T, Cassinat B, Rodrigues-Lima F, Beaufils S, et al. Mutations in the ELA2 gene correlate with more severe expression of neutropenia: a study of 81 patients from the French Neutropenia Register. Blood 2004;103:4119-4125. [ Links ]
11. Berliner N. Lessons from congenital neutropenia: 50 years of progress in understanding myelopoiesis. Blood 2008;111:5427-5432. doi: 10.1182/blood-2007-10-077396. [ Links ]
12. Oliviera JB, Bleesing JJ, Dianzani U, Fleisher TA, Jaffe ES, Lenardo MJ, et al. Revised diagnostic criteria and classification for the autoimmune lymphoproliferative syndrome (ALPS): report from the 2009 NIH International Workshop. Blood 2010;116:e35-e40. doi: 10.1182/blood-2010-04-280347. [ Links ]
13. Bleesing JJ, Brown MR, Novicio C, Guarraia D, Dale JK, Straus SE, et al. A composite picture of TcR alpha/beta(+) CD4(-)CD8(-) T Cells (alpha/beta-DNTCs) in humans with autoimmune lymphoproliferative syndrome. Clin Immunol 2002;104:21-30. [ Links ]
14. Rieux-Laucat F, Blachere S, Danielan S, De Villartay JP, Oleastro M, Solary E, et al. Lymphoproliferative syndrome with autoimmunity: a possible genetic basis for dominant expression of the clinical manifestations. Blood 1999;94: 2575-2582. [ Links ]
15. Sneller MC, Straus SE, Jaffe ES, Jaffe JS, Fleisher TA, Stetler-Stevenson M, et al. A novel lymphoproliferative/autoimmune syndrome resembling murine lpr/gld disease. J Clin Invest 1992;90:334-341. [ Links ]
16. Bux J, Behrens G, Jaeger G, Welte K. Diagnosis and clinical course of autoimmune neutropenia in infancy: analysis of 240 cases. Blood 1998;91:181-186. [ Links ]
17. Fioredda F, Calvillo M, Bonanomi S, Coliva T, Tucci F, Farruggia P, et al. Congenital and acquired neutropenias consensus guidelines on therapy and follow-up in childhood from the Neutropenia Committee of the Marrow Failure Syndrome Group of the AIEOP (Associazione Italiana Emato-Oncologia Pediatrica). Am J Hematol 2012;87:238-243. [ Links ]
18. Dale DC. ELANE-Related Neutropenia. En: Pagon R, ed. GeneReviews™. Bookshelf ID: NBK1533. Disponible en: http://www.ncbi.nlm.nih.gov/books/NBK1533/ [ Links ]
19. Oizumi K, Onuma K, Watanabe A, Motomiya M. Clinical study of drug fever induced by parenteral administration of antibiotics. Tohoku J Exp Med 1989;159:45-56. [ Links ]
20. Rojas R, Molina JR, Jarque I, Montes C, Serrano J, Sanz J, et al. Outcome of antifungal combination therapy for invasive mold infections in hematological patients is independent of the chosen combination. Mediterr J Hematol Infect Dis 2012;4:e2012011. doi:10.4084/MJHID.2012.011 [ Links ]
21. Kiraz N, Dag I, Yamac M, Kiremitci A, Kasifoglu N, Akgun Y. Antifungal activity of caspofungin in combination with amphotericin B against Candida glabrata: comparison of disk diffusion, etest, and time-kill methods. Antimicrob Agents Chemother 2009;53:788-790. [ Links ]
22. Apperley J, Keating A. Stem cell transplant organizations. En: Apperley J, Carreras E, Gluckman E, Masszi T, eds. Haematopoietic Stem Cell Transplantation. EBMT-ESH handbook; 2008. pp. 18-33. Disponible en: http://www.ebmt.org/Contents/Resources/Library/EBMTESHhandbook/Documents/EBMT2008_Cap1.pdf [ Links ]
23. Ljungman P, Gratwohl A for the European Group for Blood and Marrow Transplantation. Indications and current practice for allogeneic and autologous HSCT for haematological diseases, solid tumors and immune disorders. En: Apperley J, Carreras E, Gluckman E, Masszi T, eds. Haematopoietic Stem Cell Transplantation. EBMT-ESH handbook; 2008. pp. 318-327. Disponible en: http://www.ebmt.org/Contents/Resources/Library/EBMTESHhandbook/Documents/EBMT2008_Cap17.pdf [ Links ]
24. Gluckman E, Wagner JE. HSCT for hereditary bone marrow failure syndromes. En: Apperley J, Carreras E, Gluckman E, Masszi T, eds. Haematopoietic Stem Cell Transplantation. EBMT-ESH handbook; 2008. pp. 554-565. Disponible en: http://www.ebmt.org/Contents/Resources/Library/EBMTESHhandbook/Documents/EBMT2008_Cap42.pdf [ Links ]
25. Vela-Ojeda J, García-Ruiz Esparza MA, Borbolla-Escoboza JR. Trasplante de Células Hematopoyéticas. México: Prado; 2008. pp. 1-25, 437-464. [ Links ]
26. Joint Accreditation Committe-ISCT & EBMT-EuroISHAGE (JACIE). Accreditation Manual. Disponible en: http://www.jacie.org/ [ Links ]
27. Link H, Schmitz N, Gratwohl A. Standards for specialist units undertaking blood and marrow stem cell transplants-recommendations from the EBMT. Accreditation Sub-Committee of the European Group for Blood and Marrow Transplantation (EBMT). Bone Marrow Transplant 1995;16:733-736. [ Links ]














