Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Boletín médico del Hospital Infantil de México
Print version ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.69 n.5 México Sep./Oct. 2012
Artículo de revisión
Participación de la prolactina en la respuesta inmune
Role of prolactin in the immune response
Francisco Blanco-Favela,1 María Victoria Legorreta-Haquet,1 Yunuen Rocío Huerta-Villalobos,1 Karina Chávez-Rueda,1 Eduardo Montoya-Díaz,1 Luis Chávez-Sánchez,1 Edgar Zenteno-Galindo2
1 Unidad de Investigación Médica en Inmunología, Unidad Médica de Alta Especialidad, Hospital de Pediatría, Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social.
2 Departamento de Bioquímica, Facultad de Medicina, Universidad Nacional Autónoma de México, México D.F., México.
Autor de correspondencia:
Dr. Francisco Blanco-Favela
Correo electrónico: fblanco1@terra.com.mx
Fecha de recepción: 24-05-12
Fecha de aceptación: 05-09-12
RESUMEN
Existen evidencias de la relación entre el sistema inmune y el endocrino vía múltiples factores de comunicación, como citocinas, neuropéptidos, neurotransmisores y hormonas. Se ha demostrado la participación de la hormona prolactina en la respuesta inmune innata y adaptativa. Además de ser producida por la glándula pituitaria, también es producida y secretada por las células del sistema inmunológico. El objetivo de esta revisión fue puntualizar acerca de la participación de la prolactina secretada por estas células en la respuesta inmune.
Palabras clave: prolactina, receptor de prolactina, respuesta inmune, respuesta Th1, células T reguladoras, células T efectoras.
ABSTRACT
Evidence exists about the relationship between the immune and the endocrine systems through communication of multiple factors such as cytokines, neuropeptides, neurotransmitters and hormones. Among the hormones, prolactin (PRL) has been shown to participate in the innate and adaptive immune response. In addition to being produced by the pituitary gland, PRL is also produced and secreted by cells of the immune system. The aim of this review is to update information about the involvement of PRL secreted by immune system cells in the immune response.
Key words: Prolactin, PRL-R, immune response, Th1, Treg and Teff cells.
INTRODUCCIÓN
La prolactina (PRL) es una hormona polipeptídica con múltiples funciones, que incluyen el mantenimiento del embarazo, el desarrollo mamario, la homeostasis de fluidos e inmunomodulación,1-3 la regulación de la diferenciación de glándulas secretoras, la lactancia y la formación y actividad del cuerpo lúteo.4 Es sintetizada y secretada por células de la hipófisis anterior (lactotropos). El estímulo para ser secretada puede ser inducido por diversos factores, como la succión, la estimulación directa de la piel de la areola, el estrés, o sustancias como serotonina, colecistoquinina, angiotensina II, hormona liberadora de tirotropina y péptido intestinal vasoactivo. Es inhibida por dopamina y opiáceos.5-11
Se le ha asociado con más de 300 funciones biológicas diferentes que pueden agruparse en cinco categorías: 1) reproducción, 2) osmorregulación, 3) desarrollo y crecimiento 4) metabolismo de carbohidratos y lípidos e 5) inmunoregulación.12-14 En el sistema inmunológico se le ha involucrado en la proliferación de linfocitos T, la protección contra apoptosis y la supervivencia celular. Actúa como molécula de adaptación al estrés contra mediadores inflamatorios importantes para mantener la homeostasis del sistema inmunológico4 y participa en el tránsito de IgA a través del epitelio celular durante el desarrollo de la glándula mamaria.15
Además, se ha demostrado que la síntesis y secreción de esta hormona no se restringe a la hipófisis, sino que las células de otros órganos y tejidos tienen esta capacidad, entre ellas las células del sistema inmunológico.5,8,16,17
Prolactina
La prolactina es una proteína globular de una sola cadena con 199 aminoácidos (aa) y tres puentes disulfuro intramoleculares (Cys4-Cys11, Cys58-Cys174 y Cys191-Cys199). El 50% de los aminoácidos en la cadena conforman una estructura secundaria de -hélice (Figura 1). Aunque la principal forma de prolactina que se ha encontrado en hipófisis y suero tiene un peso molecular de 23 kDa, se han descrito distintas isoformas que resultan de modificaciones post-transcripcionales, post-traduccionales o modificaciones químicas en su cadena de aminoácidos: la glucosilada (25 kDa), que presenta una menor actividad biológica;12,18 20 la macroprolactina (big-big PRL >100 kDa) y la big PRL (4060 kDa), dos isoformas de alto peso molecular que surgen de la dimerización o polimerización de la misma21 o de la unión con otras proteínas, como anticuerpos (150 kDa);22 y la de 16 kDa (potente factor angiolítico), producto de la degradación enzimática de la PRL de 23 kDa.8,23
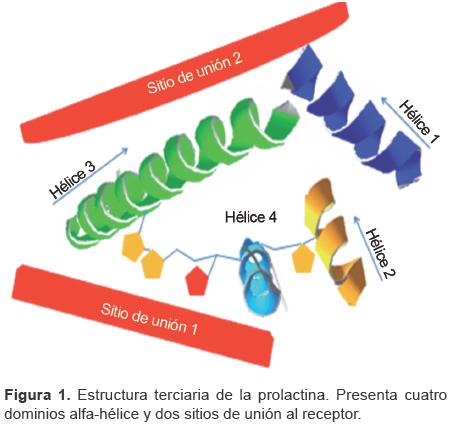
Por sus características genéticas, estructurales y funcionales, la prolactina pertenece a la misma familia que la hormona de crecimiento y el lactógeno placentario, los cuales provienen de un mismo gen ancestral. El gen que codifica para PRL se localiza en el brazo corto del cromosoma 6 y está compuesto por cinco exones y cuatro intrones con un tamaño aproximado de 10 kb.12,24-27 La expresión de este gen se ha identificado en varias regiones del cerebro, miometrio, timo, bazo, médula ósea, células epiteliales mamarias, endometrio, en algunas líneas de células tumorales, en células del sistema inmunológico (linfocitos T y B), en fibroblastos y en glándulas sudoríparas.5,12,17,28 La PRL ejerce distintas acciones, y esto puede depender tanto de su polimorfismo estructural como de la amplia distribución de su receptor.15
Receptor de prolactina
El receptor de PRL (PRL-R) es una proteína transmembranal. Su gen se encuentra en el cromosoma 5. A diferencia del gen de prolactina —que codifica para una sola proteína— este codifica para tres diferentes isoformas. Estas isoformas difieren en el tamaño (corto, intermedio y largo) y la composición de la porción intracelular (Figura 2). Exhiben un dominio extracelular idéntico de aproximadamente 200 aa. El dominio transmembranal posee 24 aa, mientras el intracelular presenta diferentes tamaños y composiciones, dependiendo de la isoforma del receptor. La isoforma larga posee 598 aminoácidos de longitud; la isoforma intermedia, 325 aminoácidos y 2 isoformas pequeñas de 352 y 264 aminoácidos cada una.29 En esta porción existen dos regiones conservadas denominadas caja 1 y caja 2. La región próxima a la membrana, denominada caja 1, presenta una zona rica en prolinas, mientras que la caja 2 es una región menos conservada que se pierde en la isoforma corta. Las isoformas corta y larga del PRL-R se expresan de manera diferencial en distintos tejidos, sugiriendo efectos y activación de rutas de señalización diferentes.30 La isoforma larga es la más frecuente en el humano. A las isoformas pequeñas se les ha atribuido una regulación negativa de la función de la isoforma larga.29 La prolactina pituitaria podría participar en la regulación de la expresión del gen del receptor de prolactina en las células del sistema inmunológico humano. La expresión del gen del receptor de PRL del linfocito se suprimió significativamente en madres que amamantan. Esta nueva evidencia sugiere que el nivel de receptor de PRL de los linfocitos circulantes puede ser regulado de manera negativa por los elevados niveles de PRL sérica, y que la PRL secretada por la adenohipófisis puede regular la expresión del receptor de PRL de las células inmunes, específicamente en el período postparto. Estos datos apoyan la evidencia que hay un rol de la PRL secretada por la adenohipófisis en el sistema inmunológico en circunstancias fisiológicas.31

La estructura terciaria del receptor, determinada por cristalografía, muestra que los dominios extracelulares contienen siete cadenas b plegadas en antiparalelo (Figura 3).12,32
Se ha demostrado la expresión del receptor en células de cerebro, retina, cartílago, piel, pulmón, corazón, páncreas, hígado, bazo, timo, tracto intestinal, riñón, sistema reproductivo, linfocitos (T y B), macrófagos, etcétera.12,33-35 El receptor de PRL, junto con los de IL2 (cadena b y g), IL3, IL4, IL6, IL7, IL9, IL12, IL15, GM-CSF, G-CSF, EPO, LIF y hormona del crecimiento, pertenece a la superfamilia de receptores de citocinas hematopoyéticas.19,35-37
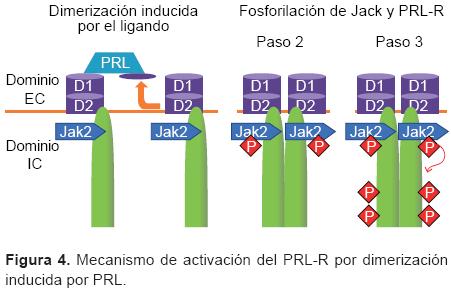
La unión de la PRL con su receptor induce la fosforilación de tirosinas (Tyr) de distintas proteínas intracelulares, incluyendo al receptor. La región intracelular próxima a la membrana se encuentra constitutivamente asociada a JAK2, que se fosforila un minuto después de la interacción PRL-PRL-R (Figura 4). La proteína JAK2 fosforila a STAT, que presenta cinco diferentes dominios: a) de unión al DNA, b) parecido a SH2, c) similar a SH3, d) amino terminal y e) carboxilo terminal. Las Tyr fosforiladas de JAK2 se unen al dominio SH2 de STAT, el cual es fosforilado por la asociación PRL-R-JAK2. Al encontrarse fosforilado, STAT se disocia del receptor formando un homo o heterodímero que es traslocado al núcleo, activando el domino de unión al DNA; la secuencia que reconoce el homo o heterodímero de STAT1, STAT3 y STAT5 en el núcleo es una secuencia que activa IFNg (GAS) y consiste en una secuencia palindrómica (TTCxxxGAA), presente en diferentes promotores.8,12,34,38-40 Por esta vía se activa la transcripción de genes clave en el desarrollo de la respuesta Th1, como el factor T-bet el cual se incrementa a bajas dosis de PRL y se inhibe a altas dosis en linfocitos T CD4+.41
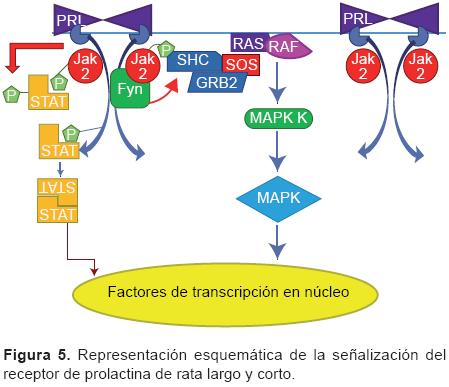
Otras proteínas tirosíncinasas (PTK) son activadas por la estimulación con PRL, incluyendo Fyn, Src, Ras y Raf, y seríntreonín cinasas como ZAP-70, PI3, Akt, MAPK, JNK y PKC. La coordinación de cascadas paralelas de cinasas con la vía de señalización JAK/STAT puede determinar el patrón de expresión de genes de diversos tejidos y células en respuesta a PRL (Figura 5). Las acciones pleiotrópicas de PRL relacionadas con proliferación celular, diferenciación, apoptosis o supervivencia celular dependen de las interacciones entre estas cascadas paralelas de cinasas.13
Prolactina y sistema inmunológico
La relación entre la PRL y el sistema inmunológico se evidenció en 1930, cuando PE Smith observó atrofia en el timo de ratas hipofisectomizadas.42 Posteriormente, Nagy y Bercy publicaron su trabajo acerca de la inmunodeficiencia en ratas hipofisectomizadas, donde la administración de PRL, de hormona de crecimiento y de lactógeno placentario restableció la actividad inmunológica.43 En 1983 se realizaron experimentos similares utilizando bromocriptina (agonista dopaminérgico D2) para inhibir selectivamente la secreción de PRL, y se encontraron resultados similares al trabajo anterior. Es decir, la disminución en la respuesta inmune tanto celular como humoral, que se restablece al suspender la bromocriptina.44 Además, se ha encontrado que el sistema inmunológico es capaz de regular la secreción de prolactina.19 Las citocinas IL1, IL6 y TNFa pueden actuar como reguladores endócrinos en la liberación de PRL hipofisiaria.45,46
En 1987 se demostró que los sobrenadantes del cultivo de esplenocitos murinos activados con concanavalina A (Con A) inducían proliferación en células Nb2 (dependientes de PRL), y su efecto fue revertido en presencia de anticuerpos antiprolactina.7 Esto sugirió que los linfocitos pueden sintetizar una proteína con actividad biológica similar a la PRL hipofisiaria, y se demostró con el análisis de hibridación in situ, que reveló la expresión del RNA mensajero (RNAm) de la PRL en diferentes tejidos linfo-citarios.15 47 Utilizando la técnica de Northern blot en una línea linfoblastoide de células B, también se demostró la presencia del RNAm de PRL y, posteriormente, mediante la técnica de RT-PCR se encontró que no solamente en líneas celulares linfoides se expresa el mensajero de PRL, sino también en células linfocitarias normales, como timocitos y células mononucleares de sangre periférica humana.15
Por inmunofluorescencia, se observó que el receptor de PRL se expresa en células NK CD56+ uterinas in situ, y mediante RT-PCR y Western blot se demostró su expresión en células NK CD56+ deciduales. Además de la fosforilación de ERK1 y 2 en células NK CD56+ en cultivos adicionados con PRL, se ha sugerido que PRL estimula la vía de ERK en múltiples compartimentos celulares del endometrio humano, identificando a las células NK CD56+ de útero como un nuevo sitio blanco para PRL.48
La expresión del receptor de prolactina en las células NK de humano es una clara indicación de que estas células potencialmente responden al estímulo con PRL, hecho que solo se había corroborado en rata. En humanos, la prolactina incrementa la expresión del IL-2Ra en la superficie celular, así como la expresión del RNAm de IL-2, lo que indica que PRL sobreregula la función de las células NK, favoreciendo la retroalimentación entre IL-2 y su receptor. Resultados similares se han reportado en cuanto a IL-15 e IL-15R.49 La PRL también se encuentra implicada en la diferenciación celular y la expresión de distintos factores durante la diferenciación de las células NK; se expresa y es requerida para conducir a una respuesta de células LAK. Estos datos indican un posible papel de la prolactina en la modulación de la función de las células NK en humanos.50
La administración de prolactina recombinante en ratones con transplante de médula induce un incremento en la linfopoyesis.51 En ratones knock out para prolactina y su receptor no se encuentran defectos en la producción de linfocitos. Sin embargo, el número absoluto de linfocitos B y sus precursores se encuentra ligeramente disminuido, lo que demuestra la participación de PRL en la linfopoyesis.4,52 Además, el hecho de que en líneas celulares de linfocitos Pro-B (B220lowCD43+) transfectados con el PRL-R, así como en linfocitos Pro-B de ratón, la PRL aumenta la diferenciación hacia linfocitos Pre-B (B220+CD43-).53 Con respecto a la expresión de moléculas coestimulatorias, no se han reportado diferencias entre la expresión de CD40 y CD86 en linfocitos B provenientes de individuos sanos o de pacientes con hiperprolactinemia.54
En esplenocitos murinos, se ha encontrado que la prolactina incrementa la viabilidad y la capacidad estimuladora de las células dendríticas (DC), sobreregula la expresión de MHC-II y CD40, mientras disminuye los niveles de CD54 en DC. Además, disminuye los niveles de NF-kappaBp65 y la capacidad endocítica de las DC, e incrementa la secreción de IL-6, IL-10, IL-12 y TNF-a en estas células. Esto sugiere que la PRL puede regular la respuesta inmune, ya sea fisiológica o patológica, mediante cambios en la viabilidad del fenotipo, capacidad endocítica y estimuladora de las DC, así como en la expresión de citocinas.55
La prolactina aumenta la expresión de CD69 y CD25 en células mononucleares56 e interviene en la expresión de las moléculas CD69 y CD154 en linfocitos T CD4+ ya que, al activarlos con PMA y bloquear la prolactina autócrina con un anticuerpo anti-PRL, la expresión de estas moléculas disminuye marcadamente,57 así como en la secreción de IL2 e IFNg.54 Por otra parte, las células mononucleares activadas con LPS más PRL incrementan la secreción de IL12 y TNFα.58 De igual forma, las citocinas afectan la expresión del RNAm de prolactina en linfocitos T, e IL4 e IL1b reducen la expresión de dicho mensajero.59
Al bloquear la prolactina, específicamente con un anticuerpo anti-PRL, se inhibe la proliferación de las células mononucleares y los linfocitos T activados con Con A, así como de los linfocitos B activados con LPS y la secreción de citocinas como IL2, que actúa como factor de crecimiento en células Nb2.60,61 La adición de PRL exógena —y no de HC— evita la acción inhibitoria del anticuerpo en cultivos de linfocitos.17 Además, en estudios donde se utilizaron líneas celulares dependientes de IL2 e IL4, se demostró que el mismo anticuerpo anti-prolactina inhibió la respuesta proliferativa hacia estas citocinas,60 y la adición de prolactina combinada con IL2, fitohemaglutinina o Con A estimuló la proliferación de linfocitos T, B y células NK mantenidas en cultivo.7 En granulocitos, linfocitos y células del endometrio, la PRL induce la transcripción del gen del factor de transcripción regulador del interferón (IRF-l), que es un regulador importante de la diferenciación y la maduración de los linfocitos T y B. Además, regula la síntesis de la sintasa de óxido nítrico inducible (iNOS), mediando la respuesta inmune y la inflamación. La PRL también estimula la síntesis de la IL2 y su receptor en esplenocitos y timocitos, además de colaborar en las acciones de la IL2 e IL12 estimulando la síntesis de IFNy en linfocitos T y células NK. Algunos estudios han sugerido que la PRL participa en la actividad hematopoyética y en el desarrollo y mantenimiento de la masa ósea.49 Por otro lado, la PRL previene la apoptosis inducida por óxido nítrico y dexametasona en la línea celular Nb2,62 y modula tanto la expresión de genes implicados en la apoptosis (bax y bcl-2) como en la activación de la caspasa-3.62-64 Estudios realizados en modelos animales muestran que la prolactina induce la expresión del receptor de IL2 en linfocitos de ratas ovariectomizadas.65 Se ha reportado también que la prolactina favorece la sobrevida y diferenciación de progenitores linfoides,66 y la importancia de la PRL en el proceso de activación y proliferación de linfocitos.2,60
Se ha demostrado la regulación autócrina de la señalización de PRL en el desarrollo y activación de los linfocitos T, lo que refuerza la hipótesis de un mecanismo por el cual la prolactina autócrina participa en la inmunoregulación de los linfocitos modulando la expresión de moléculas coestimulatorias y citocinas.54,67 Por ejemplo, se sabe que la prolactina es producida y secretada por las propias células del sistema inmunológico y actúa justo después de la primera señal de activación de una forma autócrina; en buena medida, la secreción de IL-2, IFNgamma y la expresión de las moléculas CD69 y CD154 depende parcialmente de la PRL.56 Nuestro grupo ha reportado la participación de la PRL en la función supresora de los linfocitos T reguladores.68 Los linfocitos T reguladores (Treg) son células T CD4+ que surgen durante el desarrollo en el timo y tienen características supresoras.69 El desarrollo de las células T en el timo está regido por dos procesos principales: el de selección positiva —que es particularmente crítico en el desarrollo de los linfocitos T ab que reconocen al antígeno asociado a las moléculas de MHC, lo que garantiza que la célula T sea capaz de responder— y el de selección negativa, donde los linfocitos T con receptores altamente afines son eliminados y se previenen reacciones autoinmunes.70 En la periferia, los requerimientos estrictos de señalización regulan intrínsecamente la activación de las células T, mientras que la regulación extrínseca la llevan a cabo los linfocitos T . Estas células han sido implicadas en el control de los eventos iniciales de activación, proliferación, diferenciación y función efectora de las células blanco, las cuales pueden ser más susceptibles o resistentes a los distintos mecanismos reguladores de las células Treg, dependiendo de su estadio funcional o de activación.71
Casi todas las publicaciones científicas acerca de los linfocitos T , tanto naturales como inducidos, especulan acerca de sus posibles aplicaciones clínicas. Por ejemplo, si hay una respuesta inmunológica excesiva, como en el caso de una enfermedad autoinmune, asma, alergia, rechazo en un transplante o ciertos casos de pérdida prematura del producto en el embarazo, se supone que incrementar la cantidad o función de los linfocitos T tendría un efecto benéfico.72-73
El remover o reducir las células Treg también provoca una efectiva inmunidad humoral en animales no respondedores y un incremento de la inmunidad antimicrobiana en infecciones crónicas, favoreciendo la erradicación de microbios y tumores.73 Por lo anterior, sería interesante explorar el papel de la prolactina en el fenómeno de regulación entre las células T efectoras y las reguladoras. Recientemente, se ha demostrado, por primera vez, que la expresión del receptor de la prolactina es constitutiva en las células T reguladoras, a diferencia de las células T efectoras, que requieren del estímulo con anti-CD3/CD28 para inducir la expresión dicho receptor. También se ha demostrado que la prolactina inhibe la función de células T reguladoras, aparentemente a través de la inducción de un perfil de secreción de citocinas tipo Thl,68 lo que concuerda con los hallazgos reportados por otros autores respecto a que la prolactina favorece la secreción de citocinas Thl in vivo e in vitro.59,74
La capacidad de ejercer diversas acciones relevantes en la función del sistema inmunológico ha resultado en que la PRL sea considerada como citocina, proteínas que se distinguen por compartir diversas características, entre ellas participar en la respuesta inmune, ser sintetizadas por múltiples tipos celulares, ser pleiotrópicas, presentar efectos redundantes y actuar en conjunto con otras citocinas para producir efectos de adición, sinergismo o antagonizar mutuamente sus acciones. La PRL cumple con gran parte de estas características.15 La PRL y su receptor son moduladores importantes de la respuesta inmune y podrían participar en la regulación de esta.2
Diversos estudios han demostrado que la PRL participa en la respuesta inmune al interaccionar con su receptor, cuya presencia se ha descrito en diversas células del sistema inmune.12,49 La PRL influye en la proliferación, activación y secreción de citocinas por las células T.41,56,57 En modelos murinos se ha demostrado que la PRL juega un papel relevante en la linfopoyesis de células B.4,51,52
Así mismo, se ha demostrado la expresión diferencial del receptor de PRL en las subpoblaciones de células T, donde las células T reguladoras (CD4+CD25hiCD127low/-) expresan de manera constitutiva el receptor de PRL, a diferencia de las células T efectoras (CD4+CD25CD127+) que requieren de un estímulo previo, vía CD3/CD28, para inducir la expresión de dicho receptor. Además, la PRL desregula la función supresora de las células Treg, probablemente por la inducción de un perfil de secreción de citocinas tipo Thl.68 Lo anterior ayudaría a explicar, al menos parcialmente, la relación entre la hiperprolactinemia y la actividad de la enfermedad en pacientes con lupus eritematoso sistémico, donde los altos niveles de PRL podrían afectar la función supresora de la células Treg y favorecer un perfil de secreción de citocinas tipo Th1, y con esto, perpetuar la respuesta autoinmune y exacerbar la actividad de la enfermedad. Otra posibilidad de aplicación de este conocimiento podría ser la inducción de hiperprolactinemia para el control de algunas enfermedades infecciosas. Sin embargo, se requiere profundizar más en los mecanismos de acción llevados a cabo por la PRL sobre la respuesta inmune.
AGRADECIMIENTOS
Este trabajo fue financiado en parte por el Fondo de Investigación en Salud del Instituto Mexicano del Seguro Social (número de registro FIS-IMSS-PROT-G10-834) y por el Consejo Nacional de Ciencia y Tecnología (CONACYT-113815).
REFERENCIAS
1. Gala RR. Prolactin and growth hormone in the regulation of the immune system. Proc Soc Exp Biol Med 1991;198:513-527. [ Links ]
2. Reber PM. Prolactin and immunomodulation. Am J Med 1993;5:637-644. [ Links ]
3. Yu-Lee LY, Luo G, Book ML, Morris SM. Lactogenic hormone signal transduction. Biol Reprod 1998;58:295-301. [ Links ]
4. Horseman ND, Zhao W, Montecino Rodriguez E, Tanaka M, Nakashima K, Engle SJ, et al. Defective mammopoiesis, but normal hematopoiesis, in mice with target disruption of the prolactine gene. EMBO J 1997;16:6926-6935. [ Links ]
5. Maslar IA, Riddick DH. Prolactin production by human endometrium during the normal menstrual cycle. Am J Obstet Gynecol 1979;135:751-754. [ Links ]
6. Lee DW, Markoff E. Synthesis and release of glycosylated prolactin by human decidua in vitro. J Clin Endocrinol Metab 1986;62:990-994. [ Links ]
7. Montgomery DW, Zukoski CF, Shah GN, Buckley AR, Pacholczyk T, Russell DH. Concanavalin A-stimulated murine splenocytes produce a factor with prolactin-like bioactivity and immunoreactivity. Biochem Biophys Res Commun 1987;145:692-698. [ Links ]
8. Freeman M, Kanycska B, Lerant A, Nagy G. Prolactin: structure, function, and regulation of secretion. Physiol Rev 2000;80:1523-1631. [ Links ]
9. Hiestand PC, Mekler P, Nordmann R, Grieder A, Permmongkol C. Prolactin as a modulator of lymphocyte responsiveness provides a possible mechanism of action for cyclosporine. Proc Natl Acad Sci USA 1986;83:2599-2603. [ Links ]
10. Pellegrini I, Lebrun J-J, Ali S, Kelly PA. Expression of prolactin and its receptor in human lymphoid cells. Mol Endocrinol 1992;6:1023-1031. [ Links ]
11. DiMattia GE, Gellersen B, Duckworth ML, Friesen HG. Human prolactin gene expression. The use of an alternative non coding exon in decidual and the IM-9-P3 lymphoblast cell line. J Biol Chem 1990;265:16412-16421. [ Links ]
12. Bole-Feysot C, Goffin V, Edery M, Binart N, Kelly PA. Prolactin (PRL) and its receptor: actions signal transduction pathways and phenotypes observed in PRL receptor knockout mice. Endocr Rev 1998;19:225-268. [ Links ]
13. Yu-Lee LY. Prolactin modulation of immune and inflammatory responses. Recent Prog Horm Res 2002;57:435-455. [ Links ]
14. Goffin V, Binart N, Touraine P, Kelly PA. Prolactin: the new biology of an old hormone. Annu Rev Physiol 2002;64:47-67. [ Links ]
15. Méndez I, Cariño C, Díaz L. Prolactin in the immunological system: synthesis and biological effects. Rev Invest Clin 2005;57:447-456. [ Links ]
16. Matera L. Endocrine, paracrine and autocrin actions of prolactin on immune cells. Life Sci 1996;59:599-614. [ Links ]
17. Montgomery DW. Prolactin production by immune cells. Lupus 2001;10:665-675. [ Links ]
18. Nicoll CS, Mayer GL, Russell SM. Structural features of prolactin and growth hormones that can be related to their biological properties. Endocr Rev 1986;7:169-203. [ Links ]
19. Matera L. Action of pituitary and lymphocyte prolactin. Neuroimmunomodulation 1997;4:171-180. [ Links ]
20. Brue T, Caruso E, Marange I, Hoffmann T, Evrin M, Gunz G, et al. Immunoradiometric analysis of circulating human glycosilated and nonglycosilated prolactin forms: spontaneous and stimulated secretions. J Clin Endocrinol Metab 1992;75:1338-1344. [ Links ]
21. Fahie-Wilson MN, John R, Ellis AR. Macroprolactin; high molecular mass forms of circulating prolactin. Ann Clin Biochem 2005;42:175-192. [ Links ]
22. Leanos A, Pascoe D, Fraga A, Blanco-Favela F. Anti-prolactin autoantibodies in systemic lupus erythematosus patients with associated hyperprolactinemia. Lupus 1998;7:398-403. [ Links ]
23. Ferrara N, Clapp C, Weiner R. The 16K fragment of prolactin specifically inhibits basal or fibroblast growth factor stimulated growth of capillary endothelial cells. Endocrinology 1991;129:896-900. [ Links ]
24. Troung AT, Duez C, Belayew A, Renard A, Pictet R, Bell Gl, et al. Isolation and characterization of the human prolactin gene. EMBO J 1984;3:429-437. [ Links ]
25. Goffin V, Shiverick KT, Kell PA, Martial JA. Sequence-function relationships within the expanding family of prolactin, growth hormone, placental lactogen and related proteins in mammals. Endocrinol Rev 1996;17:385-410. [ Links ]
26. Owerbach D, Rutter WJ, Cooke NE, Martial JA, Shows TB. The prolactin gene is located on chromosome 6 in humans. Science 1981;212:815-816. [ Links ]
27. Bazan JF. A novel family of growth factor receptors: a common binding domain in the growth hormone, prolactin, erythropoie-tin and IL-6 receptors, and the p75 IL-2 receptor beta-chain. Biochem Biophys Res Commun 1989;164:788-795. [ Links ]
28. DiMattia GE, Gellersen B, Bohnet HG, Friesen HG. A human B-lymphoblastoid cell line produces prolactin. Endocrinology 1988;122:2508-2517. [ Links ]
29. Tan D, Walker A. Short form 1b human prolactin receptor down-regulates expression of the long form. J Mol Endocrinol 2010;44:187-194. [ Links ]
30. Binart N, Barchelot A, Bouilly J. Impact of prolactin receptor isoforms on reproduction. Trends Endocrinol Metab 2010;21:362-368. [ Links ]
31. Maeda H, Izumi S, Kato Y, Cai LY, Kato T, Suzuki T, et al. Gene expression of lymphocyte prolactin receptor was suppressed in lactating mothers. Tokai J Exp Clin Med 2010;35:62-65. [ Links ]
32. Broutin I, Jomain JB, Tallet E, van Agthoven J, Raynal B, Hoos S, et al. Crystal structure of an affinity-matured prolactin complexed to its dimerized receptor reveals the topology of hormone binding site 2. J Biol Chem 2010;285:8422-8433. [ Links ]
33. Dardenne M, de Morales MC, Kelly PA, Gagnerault MC. Prolactin receptor expression in human hematopoietic tissues analyzed by flow cytofluorometry. Endocrinology 1994;134:2108-2114. [ Links ]
34. Clevenger CV, Freier DO, Kline JB. Prolactin receptor signal transduction in cell of the immune system. J Endocrinol 1998;157:187-197. [ Links ]
35. Xie YL, Hassan SA, Qazi AM, Tsai-Morris CH, Dufau ML. Intramolecular disulfide bonds of the prolactin receptor short form are required for its inhibitory action on the function of the long form of the receptor. Mol Cell Biol 2009;29:2546-2555. [ Links ]
36. Yu-Lee LY. Molecular actions of prolactin in the immune system. Proc Soc Exp Biol Med 1997;215:35-52. [ Links ]
37. Ben-Jonathan N, LaPensee CR, LaPensee EW. What can we learn from rodents about prolactin in humans? Endocr Rev 2008;29:1-41. [ Links ]
38. Too CK. Induction of Sp1 activity by prolactin and interleukin-2 in Nb2 T cells: differential association of Sp1-DNA complexes with Stats. Mol Cell Endocrinol 1997;129:7-16. [ Links ]
39. Gilmour KC, Reich NC. Receptor to nucleus signaling by prolactin and interleukin 2 via activation of latent DNA-binding factors. Proc Natl Acad Sci USA 1994;91:6850-6854. [ Links ]
40. Schindler C, Darnell JE Jr. Transcriptional responses to polypeptide ligands: the JAK-STAT pathway. Annu Rev Biochem 1995;64:621-651. [ Links ]
41. Tomio A, Schust DJ, Kawana K, Yasugi T, Kawana Y, Mahalingaiah S, et al. Prolactin can modulate CD4+ T-cell response through receptor-mediated alterations in the expression of T-bet. Immunol Cell Biol 2008;86:616-621. [ Links ]
42. Smith PE. The effect of hypophysectomy upon the involution of the thymus in the rat. Anatom Rec 1930;47:119-129. [ Links ]
43. Nagy E, Berczi I. Immunodeficiency in hypophysectomized rats. Acta Endocrinol (Copenh) 1978;89:530-537. [ Links ]
44. Nagy E, Berczi I, Wren GE, Asa SL, Kovacs K. Immunomodulation by bromocriptine. Immunopharmacology 1983;6:231-243. [ Links ]
45. Spangelo BL, Macleod RM. The role immunopeptides in the regulation of anterior pituitary hormone release. Trends Endocrinol Metab 1990;1:408-412. [ Links ]
46. Theas MS, De Laurentis A, Lasaga M, Pisera D, Duvilanski BH, Seilcovich A. Effect of lipopolysaccharide on tumor necrosis factor and prolactin release from rat anterior pituitary cells. Endocrine 1998;8:241-245. [ Links ]
47. Wu H, Devi R, Malarkey WB. Expression and localization of prolactin messenger ribonucleic acid in the human immune system. Endocrinology 1996;137:349-353. [ Links ]
48. Gubbay O, Critchley HO, Bowen JM, King A, Jabbour HN. Prolactin induces ERK phosphorylation in epithelial and CD56 (+) natural killer cells of the human endometrium. J Clin Endocrinol Metab 2002;87:2329-2335. [ Links ]
49. Kelley KW, Weigent DA, Kooijman R. Protein hormones and immunity. Brain Behav Immun 2007;21:384-392. [ Links ]
50. Sun R, Li AL, Wei HM, Tian ZG. Expression of prolactin receptor and response to prolactin stimulation of human NK cell lines. Cell Res 2004;14:67-73. [ Links ]
51. Sun R, Gault RA, Welniak LA, Tian ZG, Richards S, Murphy WJ. Immunologic and hematopoietic effects of recombinant human prolactin after syngeneic bone marrow transplantation in mice. Biol Blood Marrow Transplant 2003;9:426-434. [ Links ]
52. Bouchard B, Ormandy C, Di Santo JP, Kelly PA. Immune system development and function in prolactin receptor-deficient mice. J Immunol 1999;163:576-582. [ Links ]
53. Morales P, Carretero MV, Geronimo H, Copín SG, Gaspar ML, Marcos MA, et al. Influence of prolactin on the differentiation of mouse B-lymphoid precursors. Cell Grow Differ 1999;10:583-590. [ Links ]
54. Chávez-Rueda K, Hernández J, Zenteno E, Leaños-Miranda A, Legorreta-Haquet MV, Blanco-Favela F. Identification of prolactin as a novel immunomodulator on the expression of co-stimulatory molecules and cytokine secretions on T and B human lymphocytes. Clin Immunol 2005;116:182-191. [ Links ]
55. Yang L, Hu Y, Li X, Zhao J, Hou Y. Prolactin modulates the functions of murine spleen CD11c-positive dendritic cells. Int Immunopharmacol 2006;6:1478-1486. [ Links ]
56. Takizawa K, Kitani S, Takeuchi F, Yamamoto K. Enhanced expression of CD69 and CD25 antigen on human peripheral blood mononuclear cells by prolactin. Endocr J 2005;52:635-641. [ Links ]
57. Chávez-Rueda K, Legorreta-Haquet MV, Cervera-Castillo H, Sánchez L, Jara LJ, Zenteno E, et al. Prolactin effect on CD69 and CD154 expression by CD4+ cells from systemic lupus erythematosus patients. Clin Exp Rheumatol 2005;23:769-777. [ Links ]
58. Brand JM, Frohn C, Cziupka K, Brockmann C, Kirchner H, Luhm J. Prolactin triggers pro-inflammatory immune responses in peripheral immune cells. Eur Cytokine Netw 2004;15:99-104. [ Links ]
59. Gerlo S, Veerdood P, Hooghe-Peters EL, Kooijman R. Modulation of prolactin expression in human T lymphocytes by cytokines. J Neuroimmunol 2005;162:190-193. [ Links ]
60. Hartmann DP, Holaday JW, Bernton EW. Inhibition of lymphocyte proliferation by antibodies to prolactin. FASEB J 1989;3:2194-2202. [ Links ]
61. Clevenger CV, Russell DH, Appasamy PM, Prystowsky MB. Regulation of interleukin 2-driven T-lymphocyte proliferation by prolactin. Proc Nati Acad Sci USA 1990;87:6460-6464. [ Links ]
62. Fernández ML, Iglesias MM, Biron VA, Wolfenstein-Todel C. Protective effect of prolactin and placental lactogen on NO-induced Nb2 lymphoma cell apoptosis. Arch Biochem Biophys 2003;416:249-256. [ Links ]
63. Minn AJ, Vélez P, Schendel SL, Liang H, Muchmore SW, Fesik SW, et al. Bcl-xL forms an ion channel in synthetic lipid membranes. Nature 1997;385:353-357. [ Links ]
64. Mukherjee P, Mastro M, Hymer WC. Prolactin induction of interleukin-2 receptors on rat splenic lymphocytes. Endocrinology 1990;126:88-94. [ Links ]
65. Buckley AR, Buckley DJ. Prolactin regulation of apoptosis-associated gene expression in T cells. Ann NY Acad Sci 2000;917:522-533. [ Links ]
66. Carreño PC, Sacedón R, Jiménez E, Vicente A, Zapata AG. Prolactin affects both survival and differentiation of T-cell progenitors. J Neuroimmunol 2005;160:135-145. [ Links ]
67. Xu D, Lin L, Lin X, Huang Z, Lei Z. Immunoregulation of autocrine prolactin: suppressing the expression of costimulatory molecules and cytokines in T lymphocytes by prolactin receptor knockdown. Cell Immunol 2010;263:71-78. [ Links ]
68. Legorreta-Haquet MV, Chávez-Rueda K, Montoya-Díaz E, Arriaga-Pizano L, Silva-García R, Chávez-Sánchez L, et al. Prolactin down-regulates CD4+CD25hiCD127low/- regulatory T cell function in humans. J Mol Endocrinol 2012;48:77-85. [ Links ]
69. Le NT, Chao N. Regulating regulatory T cells. Bone Marrow Transplant 2007;39:1-9. [ Links ]
70. Murphy K, Travers P, Walport M, Janeway C. Janeway's Immunobiology. Michigan: Garland Science; 2008. [ Links ]
71. Sojka DK, Huang YH, Fowell DJ. Mechanisms of regulatory T-cell suppression —a diverse arsenal for moving target. Immunology 2008;124:13-22. [ Links ]
72. Damoiseaux J. Regulatory T cells: back to the future. Neth J Med 2006;64:4-9. [ Links ]
73. Sakaguchi S, Yamaguchi T, Nomura T, Ono M. Regulatory T cells and immune tolerance. Cell 2008;133:775-787. [ Links ]
74. Dimitrov S, Lange T Fehm HL, Born J. A regulatory role of prolactin, growth hormone, and corticosteroids for human T-cell production of cytokines. Brain Behav Immun 2004;18:368-374. [ Links ]














