Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Boletín médico del Hospital Infantil de México
Print version ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.69 n.4 México Jul./Aug. 2012
Artículo de investigación
Factores asociados con un mayor riesgo de retinopatía del prematuro en recién nacidos prematuros atendidos en un hospital de tercer nivel
Risk factors associated with retinopathy of prematurity in preterm infants treated at a tertiary level hospital
Yolanda Vázquez Lara,1 Juan Carlos Bravo Ortiz,1 Claudia Hernández Galván,1 Narlly del Carmen Ruiz Quintero,2 Carlos Augusto Soriano Beltrán1
1 Servicio de Oftalmología, Unidad Médica de Alta Especialidad, Hospital de Pediatría, Centro Médico Nacional SXXI, Instituto Mexicano del Seguro Social.
2 Asociación para Evitar la Ceguera, Hospital Dr. Luis Sánchez Bulnes, México D.F., México.
Autor de correspondencia:
Dra. Yolanda Vázquez Lara
Correo electrónico: prettyolis@hotmail.com
Fecha de recepción: 24-05-12
Fecha de aceptación: 24-08-12
RESUMEN
Introducción. La retinopatía del prematuro se define como una vitreorretinopatía proliferativa periférica en que la inmadurez —determinada por la edad gestacional y el peso al nacimiento— y el oxígeno son factores determinantes. El objetivo de este trabajo fue analizar el riesgo relativo para el desarrollo de la retinopatía del prematuro con respecto a la edad gestacional y el peso al nacimiento en prematuros.
Métodos. Se realizó un estudio retrospectivo, análitico, transversal y unicéntrico en recién nacidos prematuros con una edad gestacional menor de 37 semanas y un peso al nacimiento menor de 2,000 g. Se realizó la exploración del fondo de ojo con oftalmoscopia binocular indirecta en diferentes tiempos de acuerdo con la edad gestacional. Las lesiones se registran siguiendo la clasificación internacional.
Resultados. Se incluyeron dos grupos: uno de individuos sanos (grupo I) y otro de individuos con retinopatía del prematuro (grupo II). Se estudiaron 217 individuos sanos (91 femeninos y 126 masculinos) con una edad gestacional promedio de 30.95 ± 2.07 semanas y peso de 1,291.98 ± 255.93 g (620-2035 g). En el grupo II se estudiaron 127 pacientes (65 femeninos y 62 masculinos) con una edad gestacional promedio de 29.37 ± 1.77 semanas y peso de 1,089.31 ± 194.74 g (630-1650g). Predominó la retinopatía estadio 1 (70.1%), seguida de la retinopatía de estadio 2 (21.3%) y estadio 3 (7.1%). El 9.4% presentó retinopatía preumbral tipo 1 y el 4.7%, umbral. El grupo de 28-29 semanas presentó 2.37 veces más riesgo de desarrollar retinopatía del prematuro. Resultó el grupo con mayor incidencia (64.13%); a partir de las 30-31 semanas, el riesgo comenzó a disminuir.
Conclusiones. Los recién nacidos prematuros con edad gestacional entre las 28 y 29 semanas tienen un riesgo mayor para desarrollar retinopatía del prematuro.
Palabras clave: retinopatía del prematuro, oftalmoscopia, oxigeno.
ABSTRACT
Background. Retinopathy of prematurity (ROP) is defined as a peripheral proliferative vitreoretinopathy in which immaturity (determined by gestational age and birth weight) and oxygen are more decisive factors. We undertook this study to analyze the relative risk for development of ROP in relation to gestational age and birth weight in infants.
Methods. We carried out a retrospective, analytical, cross-sectional, single center trial in preterm infants with a gestational age <37 weeks and a birth weight <2,000 g. We performed fundus examination with binocular indirect ophthalmoscopy at different times according to gestational age. Injuries are accounted for using the international classification.
Results. We included two groups: I) healthy individuals and II) those with retinopathy of prematurity. Group I included 217 healthy subjects, 91 females and 126 males, with a mean gestational age of 30.95 ± 2.7 weeks and a weight of 1291.98 ± 255.93 g (range: 620-2035). Group II was comprised of 127 patients, 65 females and 62 males with a mean gestational age of 29.37 ± 1.77 weeks (range: 26-34) and a weight of 1089.31 ± 194.74 g (range: 630-1650). Stage 1 retinopathy predominated (70.1%), followed by stage 2 (21.3%) and stage 3 (7.1%); 9.4% presented a type 1 prethreshold retinopathy and 4.7% threshold. The group of 28-29 weeks showed a factor of 2.37 times more risk of developing ROP and was the group with the highest incidence with 64.13% at 30-31 weeks after which the risk begins to decrease.
Conclusions. Preterm infants with gestational age between 28 and 29 weeks are at increased risk for developing ROP.
Key words: retinopathy of prematurity, ophthalmoscopy, oxygen.
INTRODUCCIÓN
La fibroplasia retrolental, conocida actualmente como retinopatía del prematuro (ROP), fue descrita por primera vez en 1942 por T. Terry.1 En 1951, K. Campbell sugirió que la ROP podía estar temporalmente relacionada con la introducción de la terapia de oxígeno en la cirugía de los prematuros.2 Es P. Heath, en 1952, quien la nombró retinopatía del prematuro.3
En los 50, Kinsey y Hemphill reportaron la primera epidemia de niños ciegos por ROP.4 En los 80, se presentó una segunda epidemia, y en las últimas dos décadas, a pesar del conocimiento de la enfermedad y de los avances tecnológicos, nos enfrentamos a la tercera epidemia de ceguera por ROP.5
En la actualidad, se estima que hay aproximadamente 60,000 niños ciegos en el mundo como resultado de la retinopatía del prematuro. La mitad de estos niños viven en Latinoamérica.610 En los Estados Unidos, es la segunda causa principal de ceguera en la infancia.11
El concepto actual de la ROP se define como una vitreorretinopatía proliferativa periférica que se desarrolla en niños prematuros y presenta una etiología multifactorial. La inmadurez (determinada por la edad gestacional y el peso al nacimiento)12 y el oxígeno son los factores que con más frecuencia se han implicado en su patogenia.13,14 El diagnóstico temprano y el tratamiento oportuno, así como el conocimiento de los factores de riesgo, permiten evitar la ceguera en más de 50% de estos pacientes. 1516De acuerdo con la literatura, en nuestro país no existe información relacionada al riesgo relativo para el desarrollo de la ROP con respecto a la edad gestacional y el peso al nacimiento en prematuros, motivo por el que se generó el presente estudio.
MÉTODOS
Se realizó un estudio retrospectivo, observacional, descriptivo, transversal, unicéntrico y abierto de los recién nacidos prematuros con una edad gestacional menor de 37 semanas y un peso al nacimiento menor de 2,035 g. Los pacientes fueron enviados del Hospital de Gineco-Pediatría N° 4 del Instituto Mexicano del Seguro Social (IMSS) o remitidos de otros centros, a la unidad de cuidados intensivos neonatales (UCIN) del Hospital de Pediatría del Centro Médico Nacional Siglo XXI del IMSS. Se atendieron en el servicio de Oftalmología Pediátrica del mismo hospital entre el 1° de noviembre de 2008 y el 31 de diciembre de 2009.
La primera exploración del fondo de ojo se realizó entre la cuarta y la sexta semana de vida en aquellos pacientes con una edad ≥ 28 semanas de edad gestacional al nacimiento y a los de < 28 semanas, a partir de cumplir las 32 semanas de edad gestacional corregidas, y posteriormente cada dos o tres semanas, hasta que la retina completó su vascularización. En aquellos pacientes que desarrollaron algún grado de retinopatía del prematuro, se revisaron a la semana o dos semanas siguientes de acuerdo al estadio, hasta que se observaron signos de regresión o sin progresión de la retinopatía en las siguientes dos revisiones, o hasta que la retinopatía progresó a un estadio preumbral tipo 1 o umbral, que requirieron tratamiento con láser o crioterapia.
El examen retiniano se realizó en la consulta externa del Hospital de Pediatría, con oftalmoscopia binocular indirecta tras dilatar la pupila con la mezcla comercial de tropicamida y fenilefrina diluida a 50%, una gota en cada ojo cada 10 minutos en tres ocasiones. Se utilizó tetracaína como anestésico local, un blefarostato pediátrico e indentación de la retina periférica. Siempre se contó con el apoyo de un médico pediatra o neonatólogo y una enfermera, para la monitorización del paciente; así mismo, se realizaron revisiones en la sala de cuidados intensivos neonatales la unidad bajo las mismas condiciones.
Las lesiones se registran siguiendo la clasificación internacional (Cuadro 1, Figura 1).
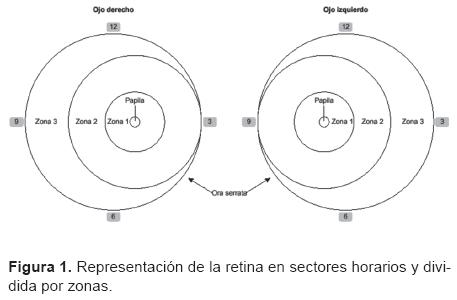
En los casos en los que se desarrollo ROP, se valoró el estadio y la edad gestacional de la aparición de la retinopatía. Aquellos pacientes con estadio preumbral tipo 1 o umbral, se les realizó ablación de la retina avascular con láser de argón o crioterapia en quirófano y bajo anestesia general.
Se analizó la influencia de las siguientes variables sobre el desarrollo de la retinopatía del prematuro: peso, edad gestacional al nacimiento, sexo, el uso de oxígeno, sepsis, broncodisplasia pulmonar, sepsis, antecedentes respiratorios (que incluyeron el síndrome de dificultad respiratoria, neumonía, atelectasia), antecedentes cardiovasculares (principalmente la persistencia del conducto arterioso), anemia y antecedentes gastrointestinales (como enterocolitis necrotizante, ictericia).
El análisis estadístico se efectuó con el programa SPSS para Windows. Se realizó estadística descriptiva de todas las variables y regresión lineal. La significación estadística se calculó mediante el método de máxima verosimilitud, con un valor para p < 0.05.
RESULTADOS
Se incluyeron todos los recién nacidos prematuros < 37 semanas y con peso < 2,030 g, nacidos en el Hospital de Gineco-Pediatría, de noviembre de 2008 a diciembre 2009. Se dividieron en dos grupos, los individuos sanos y aquellos con algún grado de retinopatía del prematuro.
En el grupo de pacientes sanos se estudiaron 217 ojos, 91 de pacientes de sexo femenino y 126 de sexo masculino, con edad gestacional promedio de 30.95 ± 2.07 semanas (25-37 semanas) y peso de 1,291.98 ± 255.93 g (620-2,035 g), y edad gestacional corregida al momento del diagnóstico de 36.22 ± 2.51 semanas (30-42 semanas).
En el grupo de pacientes que desarrollaron ROP se estudiaron 127 ojos, 65 de pacientes de sexo femenino y 62 de masculino, con una edad gestacional promedio de 29.37 ± 1.77 semanas (26-34 semanas) y peso de 1,089.31 ± 194.74 g (630-1,650 g), y edad gestacional corregida de 35.52 ± 2.01 semanas (32-42 semanas).
El grado de retinopatía que predominó fue el estadio 1 (70.1%), el estadio 2 (21.3%), el estadio 3 (7.1%), no tuvimos pacientes con estadio 4 y 1.6% para el estadio 5. El 9.4% de nuestra población presentó una retinopatía preumbral tipo 1 y el 4.7%, umbral que ameritaron tratamiento con láser o crioterapia.
Con respecto a la edad gestacional al nacimiento se encontró que el grupo de 28-29 semanas presentó un factor de riesgo 2.37 veces más de desarrollar ROP; así mismo, fue el grupo con mayor incidencia (64.13%). El grupo de 26-27 semanas también existe un riesgo de 1.65 veces más de desarrollar ROP. Ambos resultaron significativos, y a partir de las 30-31 semanas el riesgo comienza a disminuir (Cuadro 2).
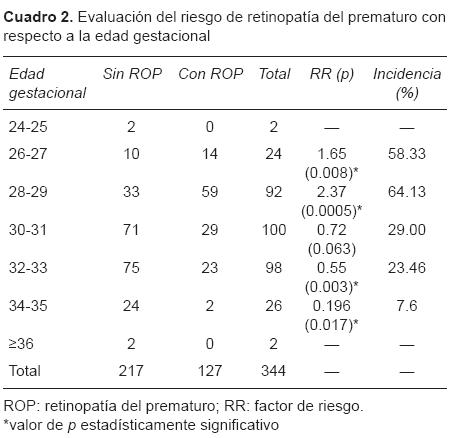
En cuanto al peso al nacimiento, se encontró que el peso de 751-1,000 g puede ser un factor de riesgo de 1.86 veces más de desarrollar ROP (Cuadro 3).
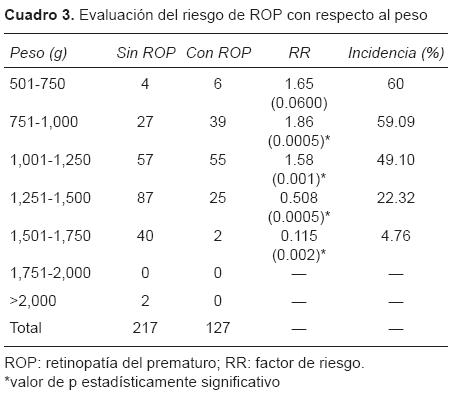
En nuestra población, 59.09% de todos los pacientes recién nacidos prematuros de 751-1,000 g desarrollaron ROP. El resto de nuestra población, dependiendo del peso, presentó riesgo relativo menor de desarrollar ROP al incrementar el peso al nacimiento.
Los factores que se encontraron relacionados con un riesgo mayor para desarrollar ROP fueron el oxígeno, con un riesgo de 1.30 más veces de desarrollar ROP; la ventilación mecánica asistida, con 1.67 veces más riesgo; la broncodisplasia pulmonar, con 1.60 veces más; y la sepsis, con 1.27 veces más de desarrollar ROP. Todos estos valores resultaron estadísticamente significativos. El resto de los factores analizados no presentaron un riesgo significativo pero se deben de considerar para su seguimiento.
DISCUSIÓN
La retinopatía del prematuro es una vitreorretinopatía proliferativa periférica que se desarrolla en niños prematuros y que en sus formas más graves puede provocar ceguera. La supervivencia de los recién nacidos prematuros ha aumentado en la última década y, a pesar de ello, parece que ha disminuido la prevalencia de la retinopatía del prematuro.17,18
Es imprescindible utilizar sistemas de tamizaje que detecten todos los casos de retinopatía del prematuro grave y adaptarlos a los cambios que se presentan a la epidemiología de la enfermedad.
Es difícil tratar de unificar criterios en cuanto a la incidencia de la retinopatía del prematuro entre diversas poblaciones, ya que pueden influir diversas variables en los resultados, como la inmadurez y la tasa de supervivencia, así como la raza de los pacientes estudiados.17,19,20
En este estudio, la incidencia de ROP fue de 36.9%, similar a la observada por Bossi y Koerner21 y Pallás y colaboradores,22 que hallaron una incidencia entre 25 y 35%. En un estudio comparativo, Blair y colaboradores23 reportaron una incidencia de 36.1% y en el Reino Unido se reportó una incidencia de ROP, en general, de 31.2%.12
Sin embargo, nuestro estudio mostró una incidencia menor a la encontrada en los trabajos de Holmström y colaboradores, Palmer y colaboradores y Párraga y colaboradores, quienes reportaron incidencias de entre 40 y 60%.24-26
En el estudio realizado entre 2000 y 2002 por el Grupo ETROP, se reportó una incidencia de 68%, similar a la reportada por el grupo CRYO-ROP en 1986 y 1987.25,27
El número de pacientes estudiados y los parámetros de tamizaje son diferentes entre los distintos estudios analizados, lo que hace difícil las comparaciones.
El tamizaje de la retinopatía del prematuro no debe tener en cuenta únicamente la edad gestacional y el peso al nacimiento, sino que debe ampliarse a otros pacientes cuya enfermedad perinatal suponga un riesgo elevado de desarrollar retinopatía del prematuro. Una atención eficaz exige ahora que los niños en situación de riesgo reciban exámenes de retina, cuidadosamente sincronizados por un oftalmólogo con experiencia en el examen de los recién nacidos prematuros con riesgo de retinopatía ,y que todos los pediatras que atienden a estos pacientes en situación de riesgo sean conscientes de la necesidad de una revisión oportuna.28
En países desarrollados, como EUA y en el reino Unido, se han establecido guías para el tamizaje de estos niños. Sin embargo, se debe tener presente que cada región puede tener diferentes parámetros de tamizaje, debido a que las características de los pacientes y de los manejos son diferentes en cada lugar. En estas guías se recomienda el tamizaje para los niños menores de 32 semanas de gestación y menores de 1,500 g. En los lineamientos nacionales en México se recomienda el tamizaje en los niños prematuros con edad gestacional ≤ 34 semanas y peso al nacer ≤ 1,750 g.29
En nuestro estudio, se encontró una incidencia de 7.6% de retinopatía en aquellos pacientes mayores de 33 semanas de gestación al nacimiento; sin embargo, este porcentaje correspondió al estadio 1, cuyo pronóstico es la tendencia a la remisión hasta en 90%.25 En cuanto al peso al nacimiento, la incidencia de retinopatía en los pacientes mayores de 1,500 g fue tan solo de 4.76%, aunque resultó estadísticamente significativa, aún comparado con el 22.32% correspondiente a aquellos pacientes menores de 1,500 g. Además, se trató de una retinopatía estadio 3 con alto riesgo de desarrollar retinopatía umbral. Por lo anterior, estamos de acuerdo con los nuevos criterios de tamizaje descritos en el lineamiento técnico para el manejo de la retinopatía del prematuro.29
Los criterios de tamizaje deben ser revisados de forma periódica, de acuerdo con los cambios observados en la epidemiología de la enfermedad o en los posibles tratamientos preventivos que se pueden desarrollar.
En nuestra población encontramos que el grupo de 501-750 g presentó un riesgo relativo de desarrollar ROP de 1.65 veces, a pesar de que el riesgo publicado es mayor para este grupo. En nuestro estudio, el mayor riesgo lo presentó el grupo de 751-1,000 g. Probablemente porque, en nuestra población, los pacientes con un menor peso al nacimiento tienen una mortalidad elevada.
El grupo con mayor riesgo de desarrollar ROP y mayor incidencia correspondió al grupo de 28-29 semanas de edad gestacional al nacimiento. Igualmente, esperaríamos encontrar estos resultados en los menores de 28 semanas, pero por debajo de esa edad implica una alta tasa de mortalidad.
Podemos resaltar que el porcentaje de pacientes que presentaron criterios para tratamiento, incluyendo la retinopatía preumbral tipo 1 y la umbral, fue pequeño; sin embargo, estos resultados son suficientes para considerar una alternativa terapéutica que permita prevenir la ceguera en estos pacientes.
La retinopatía del prematuro sigue siendo una causa importante de ceguera en niños en el mundo. Un número significativo de niños que desarrollan ROP grave tendrán resultados visuales (14.5%) y estructurales (9.1%) desfavorables, a pesar de la terapia ablativa con láser o crioterapia.30,31
Es importante enfatizar que el control oftalmológico de estos pacientes no se debe limitar al diagnóstico y seguimiento de la retinopatía hasta que regrese o hasta que se indique tratamiento. Debemos controlar a estos niños durante los primeros años, por la mayor incidencia de defectos de refracción, estrabismo y desprendimientos de retina tardíos.32-35
Con base en los resultados, podemos concluir que los recién nacidos prematuros con edad gestacional entre las 28 y 29 semanas tienen un riesgo de hasta 2.37 veces más de desarrollar ROP. En los recién nacidos prematuros con peso al nacimiento de 751-1,000 g el riesgo es de hasta 1.6 veces más de desarrollar ROP. El oxígeno suplementario, la ventilación mecánica asistida y la sepsis constituyen factores de riesgo de hasta 1.6 veces más para el desarrollo de ROP en recién nacidos prematuros.
REFERENCIAS
1. Terry T. Extreme prematurity and fibroblastic overgrowth of persistent vascular sheath behind each crystalline lens. I. Preliminary report. Am J Ophthalmol 1942;25:203-204. [ Links ]
2. Campbell K. Intensive oxygen therapy as a possible cause for retrolental fibroplasia. A clinical approach. Med J Aust 1951;2:48-50. [ Links ]
3. Heath P. Pathology of the retinopathy of prematurity: retrolental fibroplasia. Am J Ophthalmol 1951;34:1249-1259. [ Links ]
4. Kinsey VE, Hemphill FM. Etiology of retrolental fibroplasia and preliminary report of cooperative study of retrolental fibroplasia. Trans Am Acad Ophthalmol Otolaryngol 1955;59:15-24. [ Links ]
5. Gibson DL, Sheps SB, Uh SH, Schechter MT, McCormick AQ. Retinopathy of prematurity-induced blindness: birth weight-specific survival and the new epidemic. Pediatrics 1990;86:405-412. [ Links ]
6. Gilbert C, Fielder F, Gordillo L, Quinn G, Semiglia R, Visintin P, et al; for the International NO-ROP Group. Characteristics of infants with severe retinopathy of prematurity in countries with low, moderate, and high levels of development: implications for screening programs. Pediatrics 2005;115:e518-e525. [ Links ]
7. Gilbert CE, Foster A. Childhood blindness in the context of VISION 2020—the right to sight. Bull WHO 2001;79:227-232. [ Links ]
8. Gilbert C, Rahi J, Eckstein M, O'Sullivan J, Foster A. Retinopathy of prematurity in middle-income countries. Lancet 1997;350:12-14. [ Links ]
9. Zimmermann CJ, Fortes FJB, Tartarella MB, Zin A, Dorneles JI Jr. Prevalence of retinopathy of prematurity in Latin America. Clin Ophthalmol 2011:5 1687-1695. [ Links ]
10. Zepeda RLC, Gutiérrez PJA, De la Fuente TMA, Angulo CE, Ramos PE, Quinn GE. Detection and treatment for retinopathy of prematurity in Mexico: need for effective programs. J AAPOS 2008;12:225-226. [ Links ]
11. Steinkuller PG, Du L, Gilbert C, Foster A, Collins ML, Coats DK. Childhood blindness. J AAPOS 1999;3:26-32. [ Links ]
12. Mathew MR, Fern AI, Hill R. Retinopathy of prematurity: are we screening too many babies? Eye (Lond) 2002;16:538-542. [ Links ]
13. Holmstrbm G, Broberger U, Thomassen P. Neonatal risk factors for retinopathy of prematurity —a population-based study. Acta Ophthalmol Scand 1998;76:204-207. [ Links ]
14. Olea JL, Corretger FJ, Salvat M, Frau E, Galiana C, Fiol M. Factores de riesgo en la retinopatía del prematuro. An Esp Pediatr 1997;47:172-176. [ Links ]
15. Cryotherapy for Retinopathy of Prematurity Cooperative Group. Multicentre trial of cryotherapy for retinopathy of prematurity. Preliminary results. Arch Ophthalmol 1988;106:471-479. [ Links ]
16. Early Treatment for Retinopathy of Prematurity Cooperative Group. Revised indications for the treatment of retinopathy of prematurity: results of the early treatment for retinopathy of prematurity randomized trial. Arch Ophthalmol 2003;121:1684-1694. [ Links ]
17. Lim J, Fong DS, Dang Y. Decreased prevalence of retinopathy of prematurity in an inner-city hospital. Ophtalmic Sur Lasers 1999;30:12-16. [ Links ]
18. Termote J, Schalij-Delfos NE, Brouwers HAA, Donders ART, Cats BP. New developments in neonatology: less severe retinopathy of prematurity? J Pediatr Ophthalmol Strabismus 2000;37:142-148. [ Links ]
19. Ng YK, Fielder AR, Shaw DE, Levene MI. Epidemiology of retinopathy of prematurity. Lancet 1988;2:1235-1238. [ Links ]
20. Hameed B, Shyamanur K, Kotecha S, Manktelow B, Woodruff G, Draper ES, et al. Trends in the incidence of severe retinopathy of prematurity in a geographically defined population over a 10-year period. Pediatrics 2004;113:1653-1657. [ Links ]
21. Bossi E, Koerner F. Retinopathy of prematurity. Intensive Care Med 1995;21:241-246. [ Links ]
22. Pallás CR, Tejada P, Medina MC, Martín MJ, Orbea C, Barrios MC. Retinopatía del prematuro: nuestra experiencia. An Esp Pediatr 1995;42:52-56. [ Links ]
23. Blair BM, O'Halloran HS, Pauly TH, Stevens JL. Decreased incidence of retinopathy of prematurity, 1995-1997. JAAPOS 2001;5:118-122. [ Links ]
24. Holmström G, El Azazi M, Jacobson L, Lennerstrand G. A population-based, prospective study of the development of ROP in prematurely born children in the Stockholm area of Sweden. Br J Ophthalmol 1993;77:417-423. [ Links ]
25. Palmer EA, Flynn JT, Hardy RJ, Phelps DL, Phillips CL, Schaffer DB, et al. Incidence and early course of retinopathy of prematurity. The Cryotherapy for Retinopathy of Prematurity Cooperative Group. Ophthalmology 1991;98:1628-1640. [ Links ]
26. Párraga QMJ, Sánchez PR, Barreiro LJC, Cañete ER, Fernández GF, Zapatero MM, et al. Retinopatía del prematuro. Resultados tras un año de seguimiento. An Esp Pediatr1996;44:482-484. [ Links ]
27. Good WV, Hardy RJ, Dobson V, Palmer EA, Phelps DL, Quitos M, et al; for the Early Treatment for Retinopathy of Prematurity Cooperative Group. The incidence and course of retinopathy of prematurity: findings from the early treatment for retinopathy of prematurity study. Pediatrics 2005;116:15-23. [ Links ]
28. American Academy of Pediatrics, Section on Ophthalmology; American Academy of Ophthalmology; American Association for Pediatric Ophthalmology and Strabismus. Screening examination of premature infants for retinopathy of prematurity. Pediatrics 2006;117:572-576. [ Links ]
29. Secretaría de Salud. Manejo de la retinopatía del recién nacido prematuro. Lineamiento técnico. Disponible en: http://saludmaternamedicos.blogspot.mx/2011/09/lineamiento-tecnico-manejo-de-la.html#!/2011/09/lineamiento-tecnico-manejo-de-la.html [ Links ]
30. Smith LE. Pathogenesis of retinopathy of prematurity. Growth Horm IGF Res 2004;14 (suppl A):S140-S144. [ Links ]
31. Msall ME, Phelps DL, Hardy RJ, Dobson V, Quinn GE, Summers CG, et al. Educational and social competencies at 8 years in children with threshold retinopathy of prematurity in the CRYO-ROP multicenter study. Pediatrics 2004;113:790-799. [ Links ]
32. Holmström G, El Azazi M, Kugelberg U. Ophthalmological long term follow up of preterm infants: a population based, prospective study of the refraction and its development. Br J Ophthalmol 1998;82:1265-1271. [ Links ]
33. Ricci B. Refractive errors and ocular motility disorders in preterm babies with and without retinopathy of prematurity. Ophthalmologica 1999;213:295-299. [ Links ]
34. Good WV. Early treatment for Retinopathy of Prematurity Cooperative Group. The Early Treatment for Retinopathy of Prematurity Study: structural findings at age 2 years. Br J Ophthalmol 2006;90:1378-1382. [ Links ]
35. Larsson EK, Holmström GE. Development of astigmatism and anisometropia in preterm children during the first 10 years of life: a population based study. Arch Ophthalmol 2006;124:1608-1614. [ Links ]














