Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.69 no.3 México abr./jun. 2012
Artículo de investigación
Comparación de las características clínicas al diagnóstico de niños con leucemia linfoblástica aguda afiliados al Seguro Popular, con respecto al desenlace
Comparison, in relation to outcome, of the clinical characteristics at diagnosis of children with acute lymphoblastic leukemia affiliated with the Seguro Popular insurance program
Elisa Dorantes-Acosta,1 Marta Zapata-Tarrés,1 América Miranda-Lora,2 Aurora Medina-Sansón,1 Alfonso Reyes-López,2 Humberto Peña del Castillo,3 Gabriel Cortés-Gallo,4 Onofre Muñoz-Hernández,2 Juan Garduño-Espinosa2
1 Departamento de Oncología, México Hospital Infantil de México Federico Gómez, México, D.F.
2 Dirección de Investigación, México Hospital Infantil de México Federico Gómez, México, D.F.;
3 Servicio Social, Universidad de Sonora, Hermosillo, Sonora;
4 Comisión Nacional de Protección Social en Salud
Autor de correspondencia:
Dr. Juan Garduño Espinosa
Correo electrónico: juangardunoe@gmail.com
Fecha de recepción: 03-05-12
Fecha de aceptación: 11-05-12
RESUMEN
Introducción. La leucemia linfoblástica aguda es el tipo de cáncer infantil más frecuente. Los pacientes son clasificados de acuerdo con los hallazgos clínicos, biológicos, moleculares y de respuesta a la terapia inicial. Este trabajo tuvo como objetivo caracterizar los hallazgos al diagnóstico de una muestra de pacientes mexicanos e identificar las diferencias clínicas de acuerdo con la mortalidad cruda.
Métodos. Se revisaron 391 expedientes de pacientes pediátricos con leucemia linfoblástica aguda en nueve hospitales afiliados al Seguro Popular en la República Mexicana.
Resultados. Se incluyeron 296 pacientes vivos y 95 fallecidos. La media de edad fue de 6.48 años en los vivos y 8.31 años en los fallecidos. Los signos y síntomas para solicitar la atención médica fueron fiebre, palidez, astenia y adinamia. Las principales alteraciones hematológicas fueron anemia y trombocitopenia. La mayor proporción de blastos en sangre periférica se observó en el grupo de los fallecidos (28.3 vs 40.7, p=0.030). El 86.4% de la muestra contaba con inmunofenotipo y 11.2% tenía estudio citogenético. En cuanto al riesgo, 148 pacientes se clasificaron como de riesgo habitual y 230 como de alto riesgo.
Conclusiones. Caracterizar la población de niños con leucemia linfoblástica aguda permite a los sistemas de salud conocer sus peculiaridades e implementar acciones específicas para mejorar la atención, como el desarrollo de estrategias para realizar los inmunofenotipos y la citogenética.
Palabras clave: leucemia linfoblástica aguda infantil, características clínicas, diagnóstico, México.
ABSTRACT
Background. Acute lymphoblastic leukemia (ALL) is the most common cancer in childhood. Patients are classified according to clinical, biological, and molecular characteristics as well as their response to initial therapy. The objective of this study is aimed to characterize the diagnostic findings in a sample of Mexican patients with ALL and to identify clinical differences according to crude mortality.
Methods. We reviewed clinical records of 391 pediatric ALL patients in nine hospitals in Mexico affiliated with the Seguro Popular insurance program.
Results. Included in this study were 296 living patients and 95 deceased patients. Mean age was 6.48 years and 8.31 years for living and deceased patients, respectively. Signs and symptoms associated with seeking medical care were fever, pallor, fatigue and weakness. The main hematologic abnormalities were anemia and thrombocytopenia. The largest proportion of blasts in peripheral blood was observed in the group of deceased patients; 86.4% of the sample had immunophenotype in the clinical record and only 11.2% had cytogenetic study. One hundred forty eight patients were classified as standard risk and 230 patients as high risk.
Conclusions. To characterize the population of children with ALL allows health systems to be aware of the features of patients with ALL and to implement specific actions and to develop strategies so that all patients have access to immunophenotype and cytogenetic studies.
Key words: acute lymphoblastic leukemia, children, clinical features, Mexico.
INTRODUCCIÓN
La leucemia linfoblástica aguda (LLA) es el tipo de cáncer más frecuente en la edad pediátrica y representa el 23% de los diagnósticos de cáncer en menores de 15 años,1 con una incidencia anual de 30 a 40 por millón.2 En Pediatría, la edad más frecuente de presentación es el grupo de 3 a 5 años.3,4 Aproximadamente 2,400 niños y adolescentes menores de 20 años son diagnosticados con LLA cada año en Estados Unidos. Esta incidencia ha aumentado gradualmente en los últimos 25 años.
Algunas alteraciones genéticas están relacionadas con la aparición de LLA, como son la neurofibromatosis,5 el síndrome de Shwachman,6 el síndrome de Bloom,7 la ataxia telangiectasia8 y, especialmente, el síndrome de Down.9 Este último síndrome presenta un mayor riesgo acumulativo de desarrollar LLA, con 2.1% al llegar a los cinco años de edad y de 2.7% a los 30 años.10,11
En América Latina se ha reportado que la incidencia de LLA es mayor a la descrita en otras partes del mundo, con tasas de hasta 120 pacientes por millón por año.12,13 Es probable que los pacientes con LLA en América Latina sean portadores de variaciones genéticas que predisponen al desarrollo de esta neoplasia.
La sospecha diagnóstica de LLA se basa en la identificación de los síndromes que clásicamente integran el cuadro clínico (infiltrativo, hemorrágico, anémico y febril). La sospecha clínica debe ser complementada con pruebas hematológicas y metabólicas. El estándar de oro para el diagnóstico es el aspirado de médula ósea, de donde se obtiene muestra para realizar estudios de morfología, citoquímica, fenotipo, cariotipo y de biología molecular. Además, deben realizarse la punción lumbar para análisis de líquido cefalorraquídeo y la radiografía de tórax para la búsqueda de masas mediastinales.14
Con base en las características morfológicas de los linfoblastos, la LLA se clasifica en L1, L2 y L3, de acuerdo al Grupo Cooperativo Franco-Americano-Británico (FAB).15 El fenotipo más común en pacientes con LLA corresponde al de células precursoras B y representa el 80-85% de los casos de LLA infantil. El inmunofenotipo T se asocia con características clínicas de mal pronóstico.16
Se han identificado alteraciones citogenéticas que se relacionan con el pronóstico de estos pacientes. Algunas alteraciones numéricas (hiperdiploidia y las trisomías 4, 10 y 17) se asocian con un pronóstico favorable, mientras que otras se relacionan con un resultado adverso (hipodipoidia, tetraploidia).17 De igual manera, existen traslocaciones que se asocian con un buen pronóstico, como el caso de la t(12;21), mientras que otras, como la t(9;22), t(4;11), y t(1;19), parecen influir adversamente en la respuesta al tratamiento y, por ende, en el pronóstico.18-20
Como resultado de estudios epidemiológicos, se sabe que los pacientes con edades de 1 año a 9 años 11 meses presentan mejor supervivencia que los que se encuentran fuera de este rango de edad.21 El pronóstico también resulta desfavorable para los pacientes con cuenta leucocitaria de más de 50,000/mm3 al diagnóstico.22
Con base en lo anterior, además de la respuesta a la quimioterapia, se establece el riesgo de falla al tratamiento en cada paciente. A cada paciente se le asigna una categoría de riesgo, cuya nomenclatura tiene variaciones entre los distintos grupos internacionales que se dedican al estudio de esta neoplasia. El protocolo XV del St. Jude Children's Research Hospital estratifica a los pacientes en cuatro grupos de riesgo: bajo, habitual o estándar, alto y muy alto.23 En nuestro país, dadas las limitantes para aplicar técnicas de biología molecular, la mayoría de los centros estratifican a los pacientes en dos grupos de riesgo: bajo o habitual y alto, aunque algunos incluyen también la categoría de muy alto riesgo. Esto, a pesar de que el Protocolo Nacional del Seguro Popular distingue los cuatro grupos de riesgo descritos por el St. Jude Children's Research Hospital.
Los signos y síntomas reportados en la literatura internacional incluyen fiebre (en 61% de los pacientes), hemorragias (en 48%), dolor óseo (en 23%), linfadenopatías (en 50%), esplenomegalia (en 63%) y hepatomegalia (en 68%).24
Con los protocolos actuales de tratamiento para niños con LLA, que incluyen terapias sistémicas y específicas del SNC,25 es posible obtener la remisión en más de 95% de los casos, y una supervivencia libre de recaída de 75 a 85% a cinco años del diagnóstico. En un estudio anterior realizado por nuestro grupo de investigadores (Pérez Cuevas, 2009; datos no mostrados), encontramos variabilidad entre la supervivencia global de los pacientes con LLA en las diversas unidades hospitalarias. Por esta razón, de manera inicial, decidimos identificar las características clínicas de la población que atiende el Seguro Popular y conocer el impacto de estas características sobre la mortalidad cruda.
MÉTODOS
Se realizó un estudio retrospectivo, descriptivo y, posteriormente, comparativo de expedientes de pacientes pediátricos mexicanos con LLA. En el mes de septiembre del 2010 se revisaron 391 expedientes de pacientes vivos y fallecidos, tratados en nueve unidades acreditadas por la Dirección General de Calidad para la atención de pacientes pediátricos con LLA dentro de la República Mexicana e inscritos al Fondo de Protección contra Gastos Catastróficos del Seguro Popular. Los hospitales que se incluyeron fueron el Hospital Infantil de México Federico Gómez, el Instituto Nacional de Pediatría (en el D.F.), el Hospital Universitario Dr. José Eleuterio González (en Nuevo León), el Hospital del Niño DIF (Desarrollo Integral de la Familia, en Hidalgo), el Hospital Civil de Guadalajara Dr. Juan I. Menchaca (en Jalisco), el Instituto Materno Infantil del Estado de México (en el Estado de México), el Hospital de Especialidades del Niño y la Mujer (en Querétaro), el Hospital para el Niño Poblano (en Puebla) y el Hospital del Niño Dr. Rodolfo Nieto Padrón (en Tabasco).
El tamaño de la muestra fue proporcional al número de usuarios de cada unidad médica, y la inclusión de los pacientes en el estudio se realizó mediante un muestreo sistemático de los casos diagnosticados entre enero de 2008 y septiembre de 2010.
Los expedientes fueron revisados por personal médico capacitado (pediatras y oncólogos pediatras). El instrumento de recolección de información incluyó variables sociodemográficas, clínicas y de laboratorio al diagnóstico, recolectadas de una revisión cuidadosa del expediente clínico para reconstruir los signos y síntomas al inicio de la enfermedad, citogenética, inmunofenotipo, así como la categoría de riesgo asignada.
El estudio fue aprobado por el Comité de Investigación del Hospital Infantil de México Federico Gómez. Los datos fueron analizados mediante el programa estadístico SPSS v18.0. Se calcularon frecuencias relativas de las variables categóricas y medidas de tendencia central y dispersión de las variables continuas mediante pruebas paramétricas. Se realizó un análisis bivariado para identificar diferencias en cada una de las variables de acuerdo al desenlace. Se consideró como desenlace al estado vivo o fallecido. Adicionalmente, se realizó una estimación del riesgo de muerte mediante Razones de Momios (RM) en aquellas variables que demostraron diferencias estadísticas significativas en el análisis bivariado.
RESULTADOS
La muestra incluyó 391 pacientes (296 vivos y 95 fallecidos). Del total de pacientes, 57.9% correspondió al sexo masculino, con una relación hombre-mujer de 1.3:1. La edad promedio al diagnóstico fue de 6.48 años en los pacientes vivos y 8.31 años en los fallecidos (Cuadro 1). Los pacientes se clasificaron de acuerdo con el grupo de riesgo asignado en el expediente. El 39% (n=148) fue catalogado como de riesgo habitual y el 61% (n=230), como de alto riesgo. En 13 pacientes no se hallaba el riesgo asignado en el expediente.

Independientemente del desenlace (vivo o fallecido), predominaron los pacientes de alto riesgo. Se analizó la condición nutricional utilizando el índice de masa corporal (IMC) ponderado por puntuación Z. Los valores deseables son cercanos al cero (-1 a +1). Aquellos valores que se registraron por debajo del límite inferior, se interpretaron como desnutrición y los valores que se registraron por arriba del valor superior, como sobrepeso y obesidad. El grupo de pacientes vivos presentó una media de puntuación Z de 0.32 y, en el grupo de fallecidos, se obtuvo una media de 0.05.
El tiempo promedio de evolución de la sintomatología de los pacientes fue de 40.6 ± 55.5 días en el grupo de vivos, y de 30.1 ± 30.7 días en los fallecidos.
En 338 pacientes (86.4%) se encontraron los resultados del inmunofenotipo en el expediente. El 91% de las leucemias fueron de precursores de células B; 6%, de células T; y 2%, bifenotípicas (Cuadro 1).
De los pacientes estudiados, 11.2% (44 pacientes) contaba con estudio citogenético o molecular en el expediente (tres pacientes del grupo de fallecidos y 41 pacientes del grupo de vivos) (Cuadro 1).
En esta muestra no se identificaron pacientes con inmunodeficiencias congénitas o adquiridas. Se identificaron con síndrome de Down, dos pacientes en el grupo de vivos y uno en el grupo de fallecidos.
Los principales síntomas y signos que motivaron la consulta fueron fiebre, palidez, astenia y adinamia, presentes en más de 50% de los pacientes vivos y en más de 40% de los fallecidos (Cuadro 2). Al comparar los hallazgos de la exploración física al ingreso al centro oncológico, destacaron por su mayor frecuencia (20%) las adenomegalias (cervicales, inguinales y axilares) y la hepatomegalia en el grupo de pacientes vivos, y la presencia de fiebre, adenomegalias cervicales y hepatoesplenomegalia, en el grupo de fallecidos (Cuadro 3).
Con respecto a los estudios de laboratorio de importancia diagnóstica y clínica, en la biometría hemática se encontró que la anemia microcítica hipocrómica fue la alteración más frecuente en los eritrocitos (Cuadro 4). La media para la hemoglobina (Hb) en el grupo de vivos fue de 7.11 g/dL y en el grupo de fallecidos, de 7.56 g/dL. Se observaron valores anormales del hematocrito (HCT) en ambos grupos (vivos, 20.56% y fallecidos, 22.46%). En cuanto a las plaquetas, se observó trombocitopenia en ambos casos (media de 50,360/μL para los vivos y media de 50,350/μL en los fallecidos).
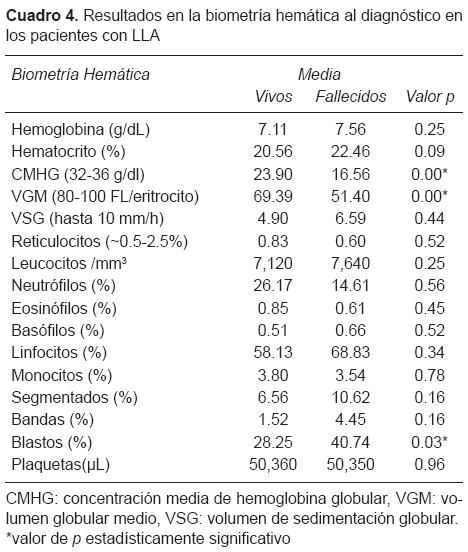
En cuanto a la fórmula blanca, se detectó la presencia de blastos en ambos casos, sin embargo, el porcentaje fue mayor en el grupo de los que fallecieron (40.74% vs. 28.25% en los vivos, p = 0.030) (Cuadro 4).
DISCUSIÓN
Este trabajo surge después de investigaciones previas (Pérez Cuevas, 2009; datos no mostrados), donde se observó que, en nuestro país, existen diferencias significativas en la supervivencia global de los pacientes con LLA al estratificarlos por hospital. El objetivo fue conocer las características de nuestra población, para identificar si influyen en la variabilidad de los resultados en salud. Se incluyeron todos los pacientes, independientemente de la zona geográfica de residencia, para saber si hay características al diagnóstico de LLA que les confieran alguna peculiaridad, y compararlas con lo reportado en la literatura. Como variable de resultado, se analizó el desenlace al momento de revisar el expediente (vivo o fallecido). Se incluyeron 391 pacientes. Al revisar las características generales de la población, se encontró predominio del sexo masculino, como se reporta en otras series.26 La edad promedio de presentación de la leucemias de los pacientes vivos y fallecidos en esta serie fue mayor a la que se reporta en la literatura internacional.27 Cabe destacar que en el grupo de los pacientes que fallecieron existe la tendencia de presentar LLA a edades más tardías, lo cual incrementa el riesgo y, con ello, la mortalidad.28
De acuerdo con el riesgo asignado en el expediente, predominó el alto riesgo, a diferencia de lo descrito en la literatura internacional.29 Sin embargo, en algunos expedientes (n=13) no se determinó el tipo de riesgo. Esto representa una oportunidad de mejorar en el establecimiento de un diagnóstico adecuado y, en consecuencia, en la asignación de un tratamiento específico.
Al analizar la condición nutricional con la valoración del IMC ponderado por la puntuación-Z, no existieron diferencias estadísticamente significativas entre el grupo de vivos y muertos. Sin embargo, la media en los pacientes que fallecieron fue menor, lo que se traduce como una tendencia a la mortalidad relacionada con la desnutrición.
Al analizar el tiempo promedio de evolución de la sintomatología de los pacientes se observó que la media, en días, en el grupo de los pacientes que fallecieron fue menor. Esto se podría explicar porque, probablemente, estos pacientes se encontraban más sintomáticos o más graves, lo cual motivó a sus padres o tutores a solicitar atención antes que el otro grupo.
Los principales síntomas y signos que motivaron la consulta fueron fiebre, palidez, astenia y adinamia. Se presentaron con mayor frecuencia en el grupo de los pacientes vivos, probablemente porque estas manifestaciones fueron más evidentes de forma inicial o los familiares y el personal de salud tuvieron más sensibilidad en detectarlos. Ahora bien, comparando los hallazgos en la exploración física al ingreso al centro oncológico por grupos, destacan por su mayor frecuencia las adenomegalias cervicales, inguinales y axilares, y la hepatomegalia en el grupo de pacientes vivos. En el grupo de los pacientes fallecidos se observó la presencia de fiebre, adenomegalias cervicales y hepatoesplenomegalia. Esto debe alertar al médico de primer contacto para realizar diagnósticos diferenciales que incluyan el cáncer infantil.
Otra situación interesante fue que en el grupo de pacientes que fallecieron se presentó en mayor proporción hipertensión, por lo que en estudios posteriores habría que analizar si los pacientes cursan con comorbilidades previas a la presentación de LLA que los hace más susceptibles a la mortalidad.
Llama la atención la presencia, significativamente mayor, de epistaxis en el grupo de los fallecidos. Es posible que esto pudiera relacionarse con el grado de infiltración medular por células neoplásicas, y tal vez refleje mayor gravedad de los pacientes al diagnóstico.
Todos los pacientes contaron con biometría hemática al diagnóstico. En este estudio observamos que los pacientes presentaron promedios en la serie roja en en rango de anemia microcítica hipocrómica y aunque no hubo diferencias estadísticamente significativas entre los dos grupos, los índices eritrocitarios se encontraron más disminuidos en el grupo de los que fallecieron. Si bien, la anemia que se reconoce en los pacientes con LLA es normocítica normocrómica,24 es posible que, en nuestra muestra, los pacientes, sobre todo el grupo de los que fallecieron, hayan cursado de manera concomitante con anemia por deficiencia de hierro, lo cual concuerda con los resultados obtenidos que mostraron una tendencia a la malnutrición en este grupo. Tampoco se encontraron diferencias significativas en los niveles de trombocitopenia ni en el número de leucocitos en ambos grupos.
Un hallazgo importante fueron las alteraciones en la fórmula blanca. En especial, el hallazgo de blastos en sangre periférica, ya que estas células normalmente no se encuentran en la circulación periférica, y el hecho de encontrarlas podría traducir una gran carga tumoral. Se detectó la presencia de blastos en ambos casos, sin embargo, fue mayor en el grupo de los que fallecieron (p = 0.030).
Al analizar los expedientes en busca de la clasificación de la leucemia por fenotipo, identificamos que, del total de la muestra, solo 86.4% tenía reportado el fenotipo en el expediente. Esto significa que aún falta 13.6% de la población de caracterizarse adecuadamente. Esto representa otra oportunidad de mejorar para los hospitales que atienden a estos pacientes, ya que actualmente es indispensable contar con este estudio que complementa el diagnóstico de los pacientes con LLA.30
Otras situación importante fue la falta de resultados de estudio citogenético en los expedientes de los pacientes. Solo 11.2% de la muestra (44 pacientes) contaba con este estudio. Por esta razón, no podemos concluir que los resultados de estos estudios representan al total de la población. Es muy importante incorporar este estudio a los diagnósticos, ya que esto permitirá estratificar correctamente a los pacientes y ofrecerles un tratamiento adecuado. En conclusión, en este estudio encontramos que, a diferencia de lo que se reporta en otras partes del mundo, al menos en esta muestra, los pacientes de alto riesgo predominan en esta población. Además, identificamos oportunidades de mejorar la caracterización de nuestros pacientes. Particularmente hacemos énfasis en las herramientas diagnósticas, como el inmunofenotipo y el análisis citogenético, que contribuirán a estratificar mejor a los pacientes con LLA afiliados al SP.
Financiamiento. El presente estudio recibió financiamiento por el Sistema de Protección Social en Salud.
REFERENCIAS
1. Howlader N, Noone AM, Krapcho M, Neyman N, Aminou R, Waldron W, et al. Cancer statistics review 1975-2008. National Cancer Institute. Online Surveillance Epidemiology and End Results. Disponible en: http://seer.cancer.gov/csr/1975_2008/#contents [ Links ]
2. Ries LA, Smith MA, Gurney JG, Linet M, Tamra T, Young JL, et al. Cancer incidence and survival among children and adolescents: United States SEER Program 1975-1995. National Cancer Institute. Online Surveillance Epidemiology and End Results. Disponible en: http://seer.cancer.gov/publications/childhood/. [ Links ]
3. Xie Y, Davies SM, Xiang Y, Robison LL, Ross JA. Trends in leukemia incidence and survival in the United States (19731998). Cancer 2003;97:2229-2235. [ Links ]
4. McNeil DE, Coté TR, Clegg L, Mauer A. SEER update of incidence and trends in pediatric malignancies: acute lymphoblastic leukemia. Med Pediatr Oncol 2002;39:554-557. [ Links ]
5. Stiller CA, Chessells JM, Fitchett M. Neurofibromatosis and childhood leukaemia/lymphoma: a population-based UKCCSG study. Br J Cancer 1994;70:996-972. [ Links ]
6. Woods WG, Roloff JS, Lukens JN, Krivit W. The occurrence of leukemia in patients with the Shwachman syndrome. J Pediatr 1981;99:425-428. [ Links ]
7. Passarge E. Bloom's syndrome: the German experience. Ann Genet 1991;34:179-197. [ Links ]
8. Taylor AM, Metcalfe JA, Thick J, Mak YF. Leukemia and lymphoma in ataxia telangiectasia. Blood 1996;87:423-438. [ Links ]
9. Whitlock JA. Down syndrome and acute lymphoblastic leukaemia. Br J Haematol 2006;135:595-602. [ Links ]
10. Bassal M, La MK, Whitlock JA, Sather HN, Heerema NA, Gaynon PS, et al. Lymphoblast biology and outcome among children with Down syndrome and ALL treated on CCG-1952. Pediatr Blood Cancer 2005;44:21-28. [ Links ]
11. Whitlock JA, Sather HN, Gaynon P, Robinson LL, Wells RJ, Trigg M, et al. Clinical characteristics and outcome of children with Down syndrome and acute lymphoblastic leukemia: a Children's Cancer Group study. Blood 2005;106:4043-4049. [ Links ]
12. Pérez-Zaldívar ML, Fajardo-Gutiérrez A, Bernáldez-Ríos R, Martínez-Ávalos A, Medina-Sansón A, Espinosa-Hernández L, et al. Childhood acute leukemias are frequent in Mexico City: descriptive epidemiology. BMC Cancer 2011;11:355-366. [ Links ]
13. Kadan-Lottick NS, Ness KK, Bhatia S, Gurney JG. Survival variability by race and ethnicity in childhood acute lymphoblastic leukemia. JAMA 2003;290:2008-2014. [ Links ]
14. Tefferi A, Killmann NM. Globalization of treatment strategies in leukemia: challenges and responsibilities. Leukemia 2008;22:1093-1094. [ Links ]
15. Bennett JM, Catovsky D, Daniel MT, Flandrin G, Galton DA, Gralnick HR, et al. The morphological classification of acute lymphoblastic leukaemia: concordance among observers and clinical correlations. Br J Haematol 1981;4:553-561. [ Links ]
16. Shuster JJ, Wacker P, Pullen J, Humbert J, Land VJ, Mahoney DH Jr, et al. Prognostic significance of sex in childhood B-precursor acute lymphoblastic leukemia: a Pediatric Oncology Group Study. J Clin Oncol 1998;16:2854-2863. [ Links ]
17. Raimondi SC, Pui CH, Hancock ML, Behm FG, Filatov L, Rivera GK. Heterogeneity of hyperdiploid (51-67) childhood acute lymphoblastic leukemia. Leukemia 1996;10:213-224. [ Links ]
18. McLean TW, Ringold S, Neuberg D, Stegmaier K, Tantravahi R, Ritz J, et al. TEL/AML-1 dimerizes and is associated with a favorable outcome in childhood acute lymphoblastic leukemia. Blood 1996;88:4252-4258. [ Links ]
19. Borkhardt A, Cazzaniga G, Viehmann S, Valsecchi MG, Ludwig WD, Burci L, et al. Incidence and clinical relevance of TEL/AML1 fusion genes in children with acute lymphoblastic leukemia enrolled in the German and Italian multicenter therapy trials. Associazione Italiana Ematologia Oncologia Pediatrica and the Berlin-Frankfurt-Münster Study Group. Blood 1997;90:571-577. [ Links ]
20. Pui CH, Frankel LS, Carroll AJ, Raimondi SC, Shuster JJ, Head DR, et al. Clinical characteristics and treatment outcome of childhood acute lymphoblastic leukemia with the t(4;11)(q21;q23): a collaborative study of 40 cases. Blood 1991;77:440-447. [ Links ]
21. Pui CH, Relling MV, Downing JR. Acute lymphoblastic leukemia. N Engl J Med 2004;350:1535-1548. [ Links ]
22. Pui CH, Sandlund JT, Pei D, Campana D, Rivera GK, Ribeiro RC, et al. Improved outcome for children with acute lympho-blastic leukemia: results of Total Therapy Study XIIIB at St Jude Children's Research Hospital. Blood 2004;104:2690-2696. [ Links ]
23. Pui CH, Carroll WL, Meshinchi S, Arceci RJ. Biology, risk stratification, and therapy of pediatric acute leukemias: an update. J Clin Oncol 2011;29:551-565. [ Links ]
24. Margolin JF, Rabin KR, Steuber CP, Poplack DG. Acute lymphoblastic leukemia. En: Pizzo PA, Poplack DG, eds. Principles and Practice of Pediatric Oncology. Philadelphia: Lippincot Williams & Williams; 2011. pp. 518-565. [ Links ]
25. Pui CH, Evans WE. Treatment of acute lymphoblastic leukemia. N Engl J Med 2006;354:166-178. [ Links ]
26. Pui CH, Boyett JM, Relling MV, Harrison PL, Rivera GK, Behm FG, et al. Sex differences in prognosis for children with acute lymphoblastic leukemia. J Clin Oncol 1999;17:818-824. [ Links ]
27. Schafer ES, Hunger SP. Optimal therapy for acute lymphoblastic leukemia in adolescents and young adults. Nat Rev Clin Oncol 2011;8:417-424. doi:10.1038/nrclinonc.2011.77 [ Links ]
28. Ribera JM, Oriol A. Acute lymphoblastic leukemia in adolescents and young adults. Hematol Oncol Clin North Am 2009;23:1033-1042. [ Links ]
29. Pieters R, Carroll WL. Biology and treatment of acute lymphoblastic leukemia. Hematol Oncol Clin North Am 2010;24:1-18. [ Links ]
30. Nemecek ER, Matthews DC. Antibody-based therapy of human leukemia. Curr Opin Hematol 2002;9:316-321. [ Links ]














