Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.68 no.4 México jul./ago. 2011
Artículo de revisión
Resistencia antimicrobiana del Staphylococcus aureus en México
Antimicrobial resistance in Staphylococcus aureus in Mexico
María Guadalupe Miranda Novales
Unidad de Investigación en Epidemiología Hospitalaria Coordinación de Investigación en Salud, Instituto Mexicano del Seguro Social México D.F., México
Autor de correspondencia:
María Guadalupe Miranda Novales
Correo electrónico: guadalupe.mirandan@imss.gob.mx
Fecha de recepción: 01-02-11
Fecha de aceptación: 16-06-11
Resumen
Desde su aparición, las cepas de Staphylococcus aureus resistentes a la meticilina se diseminaron por todo el mundo y, aunque se mantuvieron como un problema asociado al ambiente hospitalario, en los años 90 aparecieron los primeros casos en pacientes sin antecedentes de hospitalización, por lo que estas nuevas cepas recibieron la denominación de cepas de adquisición en la comunidad. Debido al comportamiento descrito en los hospitales (incremento de resistencia de 2 a 64% en 30 años) se teme que la diseminación se lleve a cabo eficientemente y se convierta en un problema grave de salud pública en este siglo. Los mecanismos que dieron lugar a la aparición de las cepas de adquisición en la comunidad siguen siendo motivo de controversia. En México, la información sobre la magnitud del problema se ha centrado en reportes de centros hospitalarios de tercer nivel. La frecuencia de cepas de Staphylococcus aureus resistentes a meticilina es elevada (50-85%). Las opciones de tratamiento antimicrobiano son múltiples, pero deben seleccionarse tomando en cuenta el tipo de infección y los factores de riesgo del paciente. Hasta el momento, la única medida de prevención que ha demostrado ser útil para disminuir la resistencia antimicrobiana es el uso adecuado de antibióticos.
Palabras clave: resistencia antimicrobiana, Staphylococcus aureus resistente a meticilina, uso adecuado de antibióticos.
Abstract
Since the beginning of their selection, methicillin-resistant Staphylococcus aureus strains (MRSA) have disseminated worldwide. Although the problem was restricted at first to hospitals (HA-MRSA, hospital-acquired methicillin-resistant Staphylococcus aureus), in the 1990s the first cases in patients with no history of hospitalization were reported. These new strains were referred to as CA-MRSA (community-acquired MRSA). As a result of the increasing resistance in hospitals (from 2% to 64% in 30 years), there is a current threat to public health in the community. The mechanisms that contributed to the selection of CA-MRSA are still controversial. In Mexico, information regarding this problem has been reduced to reports from tertiary-care level hospitals. Frequency of MRSA strains is high (50-85%). Therapeutic options are multiple, but a careful selection of the type of infection and patient risk factors must be acknowledged. Until now, the only useful preventive measure to contain bacterial resistance is appropriate antimicrobial use.
Keywords: antimicrobial resistance, MRSA, appropriate antibiotic use.
Dos años después del inicio del uso masivo de la penicilina para el tratamiento de infecciones bacterianas (en 1940) aparecieron las primeras cepas de Staphylococcus aureus productoras de penicilinasa. En 1960 prácticamente 100% de las cepas ya eran resistentes a penicilina. Los mecanismos de resistencia fueron descritos en detalle para S. aureus. El aislamiento del precursor de la penicilina en 1959, el ácido 6-aminopenicilanílico, permitió la producción de penicilinas semisintéticas. La meticilina y la isoxazolil-penicilina (oxacilina) fueron las primeras penicilinas semisintéticas, resistentes a la hidrólisis por las betalactamasas, que se utilizaron en el tratamiento de las infecciones por estafilococos a principios de 1960.1,2 En poco tiempo, nuevos compuestos menos tóxicos como la nafcilina, la cloxacilina y la dicloxacilina estuvieron disponibles; sin embargo, un año después se identificaron las primeras cepas resistentes a meticilina gracias a la producción de enzimas fijadoras de penicilina de baja afinidad. En Staphylococcus spp. la proteína denominada PBP 2' o 2a es la responsable de la resistencia. Esta proteína está codificada por el gen mecA, que forma parte del llamado SCCmec (casete cromosómico estafilocócico), localizado en la región mec del cromosoma bacteriano. Esta región es una isla de resistencia que contiene al gen estructural para la PBP2a y a los genes mecI (represor) y mecR1 (inactivador de mecI) que actúan como elementos reguladores de la transcripción. A pesar de que la región mec está altamente conservada, la expresión fenotípica de la resistencia muestra gran variabilidad.3 La resistencia a meticilina en Staphylococcus spp. es sinónimo de la resistencia a todos los betalactámicos, incluyendo penicilinas, cefalosporinas y carbapenémicos; se asocia a la resistencia múltiple a antibacterianos no relacionados estructuralmente como tetraciclinas, macrólidos, quinolo-nas y aminoglucósidos. Como medida de solución a este problema en diferentes partes del mundo se inició el uso de vancomicina en el tratamiento de infecciones por cepas meticilino resistentes; como consecuencia se produjo un incremento en la resistencia a glucopéptidos en cepas de Enterococcus spp. y, 25 años después, finalmente se encontró en Staphylococcus spp.4,5 Esta revisión describe la evolución del problema de resistencia antimicrobiana en S. aureus a escala mundial, con el énfasis en la información disponible en México.
Problema del siglo XXI
Desde su aparición, las cepas de Staphylococcus aureus resistentes a meticilina (S ARM) se diseminaron por todo el mundo y, aunque se mantuvieron como un problema asociado al ambiente hospitalario (Hospital-acquired meticillin-resistant Staphylococcus aureus, HA-MRSA), en los años 90 aparecieron los primeros casos en pacientes sin antecedentes de hospitalización. Estas nuevas cepas recibieron la denominación de CA-MRSA (Community-acquired MRS A). Debido al comportamiento descrito en los hospitales (incremento de la resistencia de 2 a 64% en 30 años) se teme que la diseminación se lleve a cabo eficientemente y se convierta en un problema grave de salud pública en este siglo. La alarma se suscitó al encontrar un mayor número de infecciones graves de la piel y de los tejidos blandos entre niños y adultos jóvenes sin factores de riesgo.6
De acuerdo con los registros, durante 2005 fallecieron enEstados Unidos 18 650 personas en hospitales debido a infecciones graves por SARM; se consideró que en 14% de los casos no hubo un antecedente de atención hospitalaria o algún factor de riesgo en el hospedero que explicara la presencia de la infección.6 Los mecanismos que dieron lugar a la aparición de las cepas CA-MRSA siguen siendo motivo de controversia.7
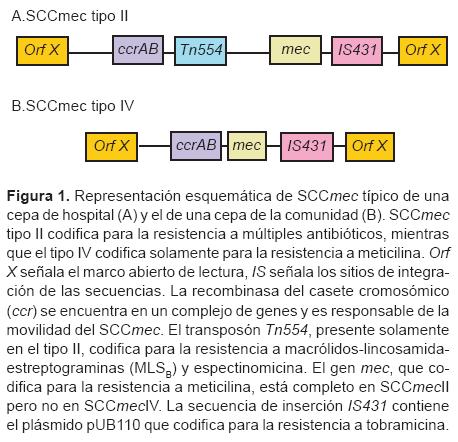
Los estudios de epidemiología molecular han demostrado las diferencias entre las cepas CA-MRSA y las HA-MRSA. La principal diferencia es que las CA-MRSA son resistentes a betalactámicos aunque, por lo general, sensibles a los otros fármacos activos contra estafilococos. Gracias a estos estudios y al avance de la biología molecular las cepas se han podido caracterizar con mayor detalle. Básicamente, la caracterización se efectúa con la determinación de los diferentes tipos y variantes del casete cromosómico SCCmec de acuerdo con los genes de su recombinasa (alotipos ccrAB) y a su composición genética en general.8-12 Los tipos I al V de SCCmec se definen con base en la combinación de uno, dos o tres pares de genes ccrAB y la clase del complejo mec-A, B, C y D. Al parecer el tipo IV emergió de la comunidad (Figura 1).
El problema en México
En México no se tiene un registro del número de infecciones graves ni del desenlace de las infecciones por SARM hospitalario o de adquisición en la comunidad. Los reportes de infecciones por CA-MRSA en niños se limitan a series de casos o estudios en portadores. Velázquez y sus colaboradores investigaron la presencia de portadores de SARM en 2 345 niños de guarderías del norte y sur de México.13 En 10% encontraron colonización de S.aureus y en 0.93% de SARM. La resistencia a la eritromicina, la clindamicina, el trimetoprim/sulfametoxazol, la gentamicina y la ciprofloxacina fue de 72, 32, 22.7, 18.1 y 4.5%, respectivamente. Las 22 cepas de SARM fueron separadas en seis clonas mediante electroforesis en gel por campos pulsados (PFGE); uno de los perfiles presentó similitud con la clona USA100, una clona resistente de origen hospitalario en Estados Unidos. Esto refleja la capacidad de diseminación, gracias a la migración de las poblaciones, de este tipo de microorganismos.
En un estudio similar Ammons y sus colaboradores investigaron la presencia de SARM y de los elementos del SCCmec en sujetos adultos en la frontera de México con el sur de Texas. A partir de 375 cultivos nasales encontraron 57 aislamientos, de entre los cuales hubo seis cepas de SARM. El análisis de los elementos de SCCmec reveló el tipo IV en cinco de las seis cepas; este tipo también fue el predominante entre las cepas que no eran S. aureus. Además, encontraron el tipo spa, que corresponde a las clonas USA300 y USA600. Los autores consideran que la presencia de estos elementos se debe a la facilidad que existe para cruzar la frontera a México y adquirir antimicrobianos sin receta (lo cual era posible en el periodo del estudio) y que gracias a ello existe selección y transferencia horizontal de los mecanismos de resistencia entre bacterias que colonizan la nasofaringe.14
Esencialmente, las descripciones de la movilización de las clonas de SARM en el país provienen de centros hospitalarios de tercer nivel de atención, tanto de pacientes adultos como pediátricos. En un estudio efectuado de 1999 a 2003, en un hospital universitario de tercer nivel, se encontró la existencia de una clona de SARM con spa tipo 2, SCCmec tipo II y la presencia de varios genes de virulencia. Esta clona fue la predominante en todo el hospital a lo largo de los años con pequeñas variaciones en su patrón genómico analizadas por PFGE.15 En cambio, en otro hospital pediátrico, durante un periodo similar, se detectó la presencia de una clona de S. aureus a la que se denominó "M" (por su origen en México) con un SCCmec tipo IV, al igual que la clona internacional multirresistente Nueva York/Japón con SCCmec tipo II, que reemplazó a la clona M y que al final del periodo del estudio (7 años) logró eliminarse gracias al control en el uso de los antimicrobianos.16
En una revisión publicada recientemente se puede notar que la información sobre las clonas de SARM en países de América Latina se encuentra en 32 artículos (hasta el 2008); estos destacan la existencia, a partir de 1990, de clonas resistentes en Brasil, Argentina, Chile, Colombia, México y Paraguay, con diversos perfiles de susceptibilidad a los antimicrobianos. Aparentemente en México hay una mayor frecuencia de la clona Nueva York/Japón. Sin embargo, en la mayoría de los reportes solamente existe información de los aislamientos en hospitales y se señala muy poco el problema en la comunidad.17
La resistencia y el entorno hospitalario
Si bien los antimicrobianos son indispensables para la medicina, humana y veterinaria, se considera también que son responsables del surgimiento de la resistencia en todo tipo de microorganismos. Hace apenas cuatro a cinco décadas se iniciaron las campañas para mejorar el uso de los antimicrobianos; actualmente, esta mejora se considera como una prioridad para la salud pública. La aparición de la resistencia es inevitable; después del uso de un antimicrobiano por tiempo prolongado los microorganismos más aptos sobreviven gracias a la adquisición de los mecanismos de resistencia (ya sea por alguna mutación o por aceptar material genético de otros microorganismos similares) que les permiten evadir la acción del medicamento. Este tiempo es diferente para cada bacteria; sin embargo, a lo largo de varios años de exposición se espera que surja un microorganismo resistente a múltiples fármacos y se convierta en una amenaza para los hospitales que atienden a pacientes de alto riesgo. Aún no se definen las mejores estrategias para la prevención de la diseminación y el tratamiento de las infecciones por bacterias resistentes en hospitales pediátricos, por lo que queda un mayor número de preguntas que deben resolverse.18
Afínales de 1990 la Pediatric Prevention Network evaluó laprevalencia de colonizaciones por microorganismos resistentes a múltiples fármacos en niños hospitalizados mediante un estudio de prevalencia en las unidades de cuidado intensivo (UCI) pediátricas y neonatales. Se encontró una frecuencia baja de SARM tanto en la colonización (3%) como en la infección (2%).19 En Europa la frecuencia reportada fue similar.20 La información en los siguientes años demuestra porcentajes en alarmante incremento. Los Centros para la Prevención y Control de Enfermedades (CDC) reportaron un aumento de 300% en la resistencia de SARM en las UCI neonatales de 1995 a 2004;21 la Red Nacional de Seguridad y Cuidado de la Salud (NHSN)22 encontró que aproximadamente 5 a 10% de los microorganismos causantes de las infecciones asociadas con los dispositivos médicos en pacientes pediátricos son resistentes a múltiples fármacos, pero no existe información detallada con respecto al desenlace de la infección, los costos, la estancia hospitalaria atribuible y el uso de antimicrobianos. En comparación con los datos del NHSN de 2006-2007, Rosenthal y sus colaboradores y el Consorcio Internacional para el Control de las Infecciones Nosocomiales (INICC), en su reporte de 2003 a 2008, encontraron que el problema de resistencia es mayor en los patógenos de las UCI que participaron en el estudio (incluyendo también las unidades de terapia intensiva pediátricas y neonatales de México)23 ya que la frecuencia de SARM fue de 84.1% en comparación con 56.8% respecto de las infecciones relacionadas con dispositivos intravasculares.
Cuando Milstone y sus colaboradores realizaron una encuesta transversal descriptiva, en diferentes UCI pediátricos, encontraron que hasta 70% de éstas no cuentan con los procedimientos establecidos para la detección de colonias de SARM al momento del ingreso.18 En las que sí se realiza la detección sólo la mitad lo hace al ingreso en las UCI y únicamente 7% lo realiza para la hospitalización. Solamente 30% de las instituciones utilizan las definiciones del NHSN para los microorganismos aislados en cultivo, que son responsables de las infecciones nosocomiales, y 28% respondió que aplicaba las definiciones para muestras de cualquier sitio anatómico. Estos resultados demuestran la diversidad de criterios de interpretación de las definiciones y la falta de conocimiento de los estudios microbiológicos de vigilancia epidemiológica que sonbásicos en los hospitales.
Es una realidad que S. aureus es un patógeno que se ha adaptado de manera excelente a su entorno y que la heterogeneidad de las cepas existentes es el resultado de la interacción con los hospederos, tanto humanos como animales.24 La cantidad de material genético que se puede adquirir e intercambiar es numerosa e incluye genes de virulencia; genes específicos de plásmidos que codifican para resistencia: tetA, cat, str, smr, aadD, ble, ermC, blaZ, arsB, arsC, cadA, merAB, ermB, cadB, aacA-aphD; elementos de inserción: IS431, IS257, IS256, IS1181, IS1182; transposones: Tn551, Tn552, TN554, Tn4001, Tn4002, Tn2491, Tn5405, Tn916 y muchos otros aún por describirse.
Desde el punto de vista clínico las opciones de tratamiento son numerosas ya que, después de lavancomicinay la teicoplanina para el tratamiento de SARM, aparecieron los siguientes antibióticos: linezolid, quinupristina/dalfopristina, daptomicina, tigeciclina, ceftobiprole, ceftarolina, telavancina, dalbavancina, oritavancinay razupenem (PZ-601, aún en estudios fase II). Pero estos fármacos, además de implicar un mayor costo, no ofrecen ventajas sobre los glucopéptidos para el tratamiento de las infecciones por SARM. Los ensayos clínicos han demostrado que son equivalentes pero no superiores y, en pocos casos, como en el caso del tratamiento con linezolid para pacientes con neumonía, se ha podido encontrar una ventaja estadísticamente significativa sobre la vancomicina.
Debido a las características particulares del genoma del S. aureus no es raro leer los primeros reportes sobre la aparición de cepas resistentes a linezolid. En el Hospital Infantil de México Federico Gómez se encontró una cepa resistente (de 45 cepas de SAMR), con una CMI (concentración mínima inhibitoria) de 8 μg/ml.25 Los aislamientos fueron recolectados de 2003 a 2007, por lo que se espera un incremento en los siguientes años. Una de las ventajas que lleva al uso más frecuente de linezolid es que no requiere de la monitorización de los niveles séricos, lo que sí se recomienda para optimizar las dosis de vancomicina, sobre todo en pacientes graves; sin embargo, existe poca evidencia a favor de la necesidad de contar con dichos niveles para alcanzar las "dosis óptimas".26
En México la información sobre las prácticas de prescripción de antimicrobianos, tanto en la medicina humana como en la veterinaria y en la agricultura, es insuficiente para establecer estrategias puntuales y disminuir el problema de resistencia.27 Se mencionan varios factores como la calidad de los antimicrobianos, la venta libre de los mismos (hasta agosto de 2010) o la disponibilidad de medicamentos "similares", entre otros, que propician que México sea un lugar ideal para la selección de microorganismos cada vez más resistentes.
Antes de utilizar un nuevo antibiótico se ha olvidado un recurso que consiste en el tratamiento combinado con diversos antimicrobianos para obtener el efecto sinérgico. En un estudio que se realizó con 10 cepas de SARM de pacientes pediátricos se encontró que las combinaciones de dicloxacilina más amikacina y cefalotina más amikacina tuvieron actividad sinérgica o sinergia parcial en 90 y 100% de las cepas probadas, respectivamente.28 La sinergia de la combinación de vancomicina más amikacina solamente se encontró para una cepa; para 40% de las cepas el resultado fue indiferente. Cuando se combinó vanco-micina más un betalactámico (cefalotina o imipenem) el efecto fue aditivo. Si bien las concentraciones requeridas para alcanzar el efecto sinérgico son las obtenidas con las dosis habituales, debe existir una evaluación cuidadosa de las combinaciones, el tipo de infección y los factores de riesgo en el paciente. Estos resultados explican el comportamiento clínico de los pacientes que fueron tratados con la combinación de cefalotina más amikacina antes de realizar los ensayos en el laboratorio.29 En este estudio, efectuado en el Hospital de Pediatría, Centro Médico Nacional SXXI, el cambio de antimicrobiano se efectuó en la unidad de cuidados intensivos neonatales (UCIN) y consistió en la sustitución de dicloxacilina por cefalotina, en combinación con amikacina como esquema empírico de sepsis neonatal tardía. Durante los dos años de vigilancia estricta se encontró la disminución de la concentración mínima inhibitoria 50 (CMI50) para la dicloxacilina al final del estudio con una diferencia estadísticamente significativa (p < 0.05). La resistencia a cefalotina se incrementó en los primeros seis meses pero disminuyó a 8.3% al final y también disminuyó la resistencia a amikacina. No se seleccionaron cepas resistentes a múltiples fármacos que permanecieran como endémicas en la UCIN, lo cual es frecuente en este tipo de unidades. Una repercusión no anticipada en el resto del hospital fue el cambio en las clonas de SARM que se habían registrado desde 1997. La frecuencia de SARM disminuyó de 20 a 4% en 2002 y 200316 y continúa por debajo de 20% en los últimos años; de igual forma, el número de aislamientos disminuyó significativamente (100 versus 35-40 aislamientos por año en hemocultivos). Los resultados de estos estudios no pretenden modificar las recomendaciones terapéuticas para el uso de vancomicina, únicamente describen la experiencia en el hospital al aplicar un tratamiento diferente al que se había utilizado durante muchos años. Las modificaciones en los esquemas empíricos son necesarias cuando se detectan microorganismos resistentes a múltiples fármacos, requieren de una vigilancia estrecha y un plan anticipado de opciones, alternativas y criterios de prescripción ante la posible selección de clonas resistentes. No es posible extrapolar las intervenciones, las estrategias de rotación o el ciclado de esquemas empíricos y terapéuticos a todos los hospitales por igual, ya que los resultados dependen del tipo de hospital, del cuadro básico de los antibióticos disponibles y de los datos locales de resistencia antimicrobiana, por lo que la vigilancia debe ser activa con la evaluación de los resultados al final de periodos previamente determinados.30
Opciones terapéuticas
Existen múltiples opciones para el tratamiento de pacientes con infecciones por SARM. Recientemente la Sociedad de Enfermedades Infecciosas de América (IDSA) publicó las guías terapéuticas para adultos y para niños porque incluyen diferentes condiciones clínicas y opciones de tratamiento para las cepas adquiridas en la comunidad y en el hospital.31,32
Para los pacientes que tienen una cepa de SARM adquirida en la comunidad el tratamiento antimicrobiano se recomienda después del drenaje del absceso en los siguientes casos:
• Enfermedad grave o diseminada (por ejemplo, con múltiples sitios de infección) o progresión rápida de la infección y celulitis asociada.
• Comorbilidad asociada o inmunosupresión (diabetes mellitus, infección por VIH/SIDA, neoplasias).
• Signos y síntomas de infección sistémica.
• Extremos de la vida.
• Abscesos en lugares de difícil acceso para drenaje.
• Flebitis séptica asociada.
• Falta de respuesta al drenaje inicial.
Las opciones de tratamiento para las infecciones de la piel y de los tejidos blandos no son diferentes a las habi-tualmente utilizadas para los pacientes ambulatorios. Ala fecha no existen estudios que apoyen el uso de rifampicina en combinación con alguno de los fármacos recomendados en forma rutinaria, y ésta no debe utilizarse como mono-terapia por la emergencia de cepas resistentes (Cuadro I). Si el tratamiento por vía oral no funciona y la infección avanza, el paciente deberá ser hospitalizado. Debido al incremento en el riesgo de la mortalidad en pacientes tratados con tigeciclina, en comparación con otros fármacos, este medicamento no se incluyó en estas guías de tratamiento. La ceftarolina, una nueva cefalosporina, estará disponible en un futuro próximo. El tiempo de tratamiento varía de acuerdo con la respuesta del paciente, pero en general es de 7 a 14 días.
El tratamiento para la bacteriemia (sin focalización) en adultos puede efectuarse con vancomicina o daptomicina, por al menos dos semanas (Cuadro II). En los casos de endocarditis o bacteriemia complicada el tiempo de tratamiento se prolonga de 4 hasta 6 semanas.
En pacientes que cursan con bacteriemia, es recomendable tomar hemocultivos de control a los 2-4 días del inicio del tratamiento para verificar la curación microbiológica. En adultos se recomienda monitorizar los niveles séricos de vancomicina y ajustar la dosis para mantener un nivel valle de 15-20 μg/ml en infecciones graves por SARM, y considerar las variaciones en pacientes obesos, con alteraciones renales o en el volumen de distribución. Aún no se establece la utilidad de estos estudios en niños; sin embargo, deberían considerarse como auxiliar para pacientes con infecciones graves o bacteriemia persistente. Cuando se utiliza un fármaco diferente a la vancomicina deberá contarse con el reporte de susceptibilidad. Si el microorganismo es sensible a los betalactámicos, será la terapia ideal para el tratamiento por su mayor efecto bactericida, a menos que el paciente sea alérgico.
En resumen, las infecciones por SARM han transcendido la barrera hospitalaria y es posible encontrarlas en la comunidad. Aparentemente, el problema aún no es de gran magnitud en México; sin embargo, por el número de cepas resistentes reportadas en los centros hospitalarios que atienden pacientes de riesgo, se espera que exista la diseminación y la transferencia eficiente de los mecanismos de resistencia hacia las cepas sensibles. Hasta el momento, una de las medidas de prevención más eficaces, que ha demostrado ser de utilidad para disminuir la resistencia antimicrobiana, es el uso adecuado de antibióticos, con la intención de mantener la vida útil de estos por el mayor tiempo posible.
REFERENCIAS
1. Maranan MC, Moreira B, Boyle-Vavra S, Daum RS. Antimicrobial resistance in staphylococci. Epidemiology, molecular mechanisms and clinical relevance. Infect Dis Clin North Am 1997; 11:813-849. [ Links ]
2. Crisóstomo MI, Westh H, Tomasz A, Chung M, Oliveira DC, de Lencastre H. The evolution of methicillin resistance in Staphylococcus aureus: similarity of genetic backgrounds in historically early methicillin-susceptible and -resistant isolates and contemporary epidemic clones. Proc Natl Acad Sci USA 2001 ;98:9865-9870. [ Links ]
3. Archer GL, Climo MW. Antimicrobial susceptibility of coagulase-negative staphylococci. Antimicrob Agents Chemother 1994;38:2231-2237. [ Links ]
4. Moore PC, Lindsay JA. Genetic variation among hospital isolates of methicillin-sensitive Staphylococcus aureus: evidence for horizontal transfer of virulence genes. J Clin Microbiol 2001 ;39:2760-2767. [ Links ]
5. Dickinson TM, Archer GL. Phenotypic expression of oxacillin resistance in Staphylococcus epidermidis: roles of mecA transcriptional regulation and resistant-subpopulation selection. Antimicrob Agents Chemother 2000;44:1616-1623. [ Links ]
6. Napolitano LM. Severe soft tissue infections. Infect Dis Clin North Am. 2009;23: 571-591. [ Links ]
7. Tacconelli E, Venkataraman L, De Girolami PC, D'Agata EMC. Methicillin-resistant Staphylococcus aureus bacteraemia diagnosed at hospital admission: distinguishing between community-acquired versus healthcare-associated strains. J Antimicrob Chemother 2004;53:474-479. [ Links ]
8. Katayama Y, Ito T, Hiramatsu K. A new class of genetic element, staphylococcus cassette chromosome mec, encodes methicillin resistance in Staphylococcus aureus. Antimicrob Agents Chemother 2000;44:1549-1555. [ Links ]
9. Gradelsky E, Valera L, Aleksunes L, Bonner D, Fung-Tomc J. Correlation between genotype and phenotypic categorization of staphylococci based on methicillin susceptibility and resistance. J Clin Microbiol 2001 ;39:2961-2963. [ Links ]
10. Nishi J, Miyanohara H, Nakajima T, Kitajima I, Yoshinaga M, Maruyama I, et al. Moleculartyping of the methicillin resistance determinant (mec) of clinical strains of Staphylococcus based on mec hypervariable region length polymorphisms. J Lab Clin Med 1995;126:29-35. [ Links ]
11. Ito T, Katayama Y, Asada K, Mori N, Tsutsumimoto K, Tien-sasitorn C, et al. Structural comparison of three types of staphylococcal cassette chromosome mec integrated in the chromosome in methicillin-resistant Staphylococcus aureus. Antimicrob Agents Chemother 2001 ;45:1323-1336. [ Links ]
12. van Belkum A. Molecular epidemiology of methicillin-resistant Staphylococcus aureus strains: state of affairs and tomorrow's possibilities. Microb Drug Resist 2000;6:173-188. [ Links ]
13. Velázquez-Guadarrama N, Martínez-Aguilar G, Galindo JA, Zúñiga G, Arbo-Sosa A. Methicillin-resistant S. aureus colonization in Mexican children attending day care centres. Clin Invest Med 2009;32:E57-E63. [ Links ]
14. Ammons DR, Puttagunta R, Granados JC, de la Garza G, Eyambe GS, Rampersad J. An exploratory study of methicillin-resistant Staphylococcus aureus and SCCmec elements obtained from a community setting along the Texas border with Mexico. Curr Microbiol 2010;60:321-326. [ Links ]
15. Echániz-Aviles G, Velázquez-Meza ME, Aires-de-Sousa M, Morfín-Otero R, Rodríguez-Noriega E, Carnalla-Barajas N, et al. Molecular characterisation of a dominant methicillin-resistant Staphylococcus aureus (MRSA) clone in a Mexican hospital (1999-2003). Clin Microbiol Infect 2006;12:22-28. [ Links ]
16. Velázquez-Meza ME, Aires de Sousa M, Echániz-Aviles G, Solórzano-Santos F, Miranda-Novales G, Silva-Sanchez J, et al. Surveillance of methicillin-resistant Staphylococcus aureus in a pediatric hospital in Mexico City during a 7-year period (1997 to 2003): clonal evolution and impact of infection control. J Clin Microbiol 2004;42:3877-3880. [ Links ]
17. Rodríguez-Noriega E, Seas C, Guzmán-Blanco M, Mejía C, Álvarez C, Bavestrello L, et al. Evolution of methicillin-resistant Staphylococcus aureus clones in Latin America. Int J Infect Dis 2010;14:e560-e566. [ Links ]
18. Milstone AM, Bryant KA, Huskins C, Zerr DM. The past, present, and future of healthcare-associated infection prevention in pediatrics: multidrug-resistant organisms. Infect Control Hosp Epidemiol 2010;31 (suppl 1 ):S18-S21. [ Links ]
19. Siegel JD, Krisher KK, Levine GL, Herchline TE, Botelho C, Jarvis WR, et al. Prevalence of antimicrobial resistant bacteria in pediatric prevention networks intensive care units. En: Abstracts of the Infectious Diseases Society of America 39th Annual Meeting ; October 25-28, 2001; San Francisco, CA (abstract 311. p. 1141). [ Links ]
20. Raymond J, Aujard Y. Nosocomial infections in pediatric patients: a European, multicenter prospective study. European Study Group. Infect Control Hosp Epidemiol 2000;21:260-263. [ Links ]
21. Lessa FC, Edwards JR, Fridkin SK, Tenover FC, Horan TC, Gorwitz RJ. Trends in incidence of late-onset methicillin-resistant Staphylococcus aureus infection in neonatal intensive care units: data from the National Nosocomial Infections Surveillance System, 1995-2004. Pediatr Infect Dis J 2009;28:577-581. [ Links ]
22. Hidron AI, Edwards JR, Patel J, Horan TC, Sievert DM, Pollock DA, et al. NHSN annual Update: antimicrobial-resistant pathogens associated with healthcare-associated infections: annual summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2006-2007. Infect Control Hosp Epidemiol 2008;29:996-1011. [ Links ]
23. Rosenthal VD, Maki DG, Jamulitrat S, Medeiros EA, Todi SK, Gomez DY, et al. International Nosocomial Infection Control Consortium (INICC) report, data summary for 2003-2008, issued June 2009. Am J Infect Control 2010;38:95-104.e2. [ Links ]
24. Livermore DM. Has the era of untreatable infections arrived? J Antimicrob Chemother 2009;64(suppl 1):i29-i36 [ Links ]
25. Velázquez-Guadarrama N, Vigueras-Galindo JC, Escalona-Venegas G, Arellano-Galindo J, Giono-Cerezo S, Nava-Frías M. Resistencia a linezolid en Staphylococcus aureus resistente a meticilina y enterococos con elevada resistencia a aminoglucósidos en un hospital pediátrico de tercer nivel. Bol Med Hosp Infant Mex 2010;67:19-26. [ Links ]
26. Gould IM. Is vancomycin redundant for serious staphylococcal infection? Int J Antimicrob Agents. 2010;36(suppl 2):S55-S57. [ Links ]
27. Amábile-Cuevas C. Antibiotic resistance in Mexico: a brief overview of the current status and its causes. J Infect Dev Countries 2010;4:126-131. [ Links ]
28. Miranda-Novales G, Leaños-Miranda BE, Vilchis-Pérez, Solórzano-Santos F. In vitro activity effects of combinations of cephalothin, dicloxacillin, imipenem, vancomycin and amikacin against methicillin-resistant Staphylococcus spp. strains. Ann Clin Microbiol Antimicrob 2006;5:25;doi:10.1186/1476-0711-5-25. [ Links ]
29. Peregrino-Bejarano L, Villegas-Silva R, Leaños-Miranda B, Solórzano-Santos F, Miranda-Novales MG. Cefalotina y amikacina para tratamiento de sepsis neonatal de adquisición nosocomial en una Unidad de Cuidados Intensivos Neonatales. Bol Med Hosp Infant Mex 2004;61:393-401. [ Links ]
30. Cook E, Marchaim D, Kaye KS. Building a successful infection prevention program: key components, processes, and economics. Infect DisClin North Am 2011 ;25:1-19. [ Links ]
31. Liu C, Bayer A, Cosgrove SE, Daum RS, Fridkin SK, Gorwitz R, et al. Clinical practice guidelines by the Infectious Diseases Society of America for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children. Clin Infect Dis 2011 ;52:e18-e55. [ Links ]
32. Liu C, Bayer A, Cosgrove SE, Daum RS, Fridkin SK, Gorwitz R, et al. Clinical practice guidelines by the Infectious Diseases Society of America for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children: executive summary. Clin Infec Dis 2011 ;52:285-292. [ Links ]














