Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.68 no.2 México mar./abr. 2011
Artículo
Leishmaniasis visceral: veinte años de experiencia clínica en población pediátrica en un hospital de referencia en Chiapas
Visceral leishmaniasis: 20 years of clinical experience in a pediatric population of a reference hospital in Chiapas, Mexico
Sandra Luz Beltrán Silva,1 Rosa Martínez–Domínguez,1 Moisés Enríquez–Gallegos,2 José Ignacio Santos–Preciado3
1 Departamento de Pediatría, Hospital General Dr. Rafael Pascasio Gamboa, Tuxtla Gutiérrez, Chiapas
2 Departamento de Epidemiología, Hospital General Dr. Rafael Pascasio Gamboa, Tuxtla Gutiérrez, Chiapas
3 Departamento de Medicina Experimental, Facultad de Medicina, Universidad Nacional Autónoma de México, México D.F., México
Autor de correspondencia:
Dra. Sandra Luz Beltrán Silva
Correo electrónico: drasandrabeltran@yahoo.com.mx
Fecha de recepción: 08–02–11
Fecha de aceptación: 09–02–11
Resumen
Introducción. El objetivo de este trabajo fue describir la experiencia clínica en el diagnóstico y el tratamiento de la leishmaniasis visceral en pacientes menores de 15 años atendidos, durante el periodo 1990–2010, en el Hospital General Dr. Rafael Pascasio Gamboa de Tuxtla Gutiérrez, Chiapas.
Métodos. Este fue un estudio descriptivo retrospectivo que se llevó a cabo a través de la revisión de los expedientes clínicos existentes, los reportes epidemiológicos del archivo del servicio de epidemiología y los resúmenes clínicos archivados en el servicio de Pediatría del Hospital General Dr. Rafael Pascasio Gamboa de Tuxtla Gutiérrez, Chiapas. Se incluyeron todos los pacientes con diagnóstico de leishmaniasis visceral confirmado por serología, por inmunofluorescencia indirecta y por la presencia de amastigotos en el aspirado de medula ósea. Se recolectaron los datos clínicos y los epidemiológicos.
Resultados. Durante el periodo 1990–2010 se registraron 72 niños con el diagnóstico de leishmaniasis visceral. Se descartaron 9 casos por no reunir los datos indispensables para el análisis. Los 63 casos que se analizaron presentaron una edad comprendida entre 2 meses y 13 años; 56 (88%) fueron menores de 5 años. La relación con respecto al género (femenino–masculino) fue de 1:1.2. Se presentó fiebre en el 100% de los casos; esplenomegalia en 97%, hepatomegalia en 87% y pancitopenia en 95%. La serología para leishmania por inmunofluorescencia indirecta fue > 1:32, positiva en 98% de los casos y la presencia de amastigotos en 79% de los aspirados de médula ósea. En cinco niños se identificó Leishmania chagasi en medio de cultivo 3N (Nicolle–Novy–McNeal). Se presentó desnutrición en 75% de los niños.
Conclusiones. En el estado de Chiapas, se debe considerar el diagnóstico de leishmaniasis visceral en pacientes con fiebre, hepatoesplenomegalia y pancitopenia y se debe iniciar precozmente la búsqueda del parásito para evitar el desgaste que sufren los niños, lo que los conduce a la desnutrición y los pone en riesgo de muerte.
Palabras clave: leishmaniasis visceral, Chiapas, hepatoespelnomegalia, pancitopenia.
Abstract
Background. We undertook this study to describe the clinical experience in diagnosis and treatment of visceral leishmaniasis in patients <15 years of age who were treated from 1990–2010 in the Hospital General Dr. Rafael Pascacio Gamboa of Tuxtla Gutiérrez, Chiapas.
Methods. This was a retrospective descriptive study. We reviewed the clinical files and epidemiological reports from the Department of Pediatrics of the Hospital General Dr. Rafael Pascacio Gamboa of Tuxtla Gutiérrez, Chiapas. All patients with a diagnosis of visceral leishmaniasis confirmed by serology, indirect immunofluorescence and the presence of amastigotes in the bone marrow aspirate were included. Epidemiological and clinical data were collected.
Results. From 1990–2010, 72 children with the diagnosis of visceral leishmaniasis were reported. Nine cases were discarded because necessary data for the analysis were not collected. Sixty three subjects who were analyzed were between 2 months and 13 years of age; 56 (88%) were <5 years of age. Female:male ratio was 1:1.2. Fever was present in 100% of the cases, splenomegaly in 97%, hepatomegaly in 87% and pancytopenia in 95%. Serology for leishmania by indirect immunofluorescence was >1:32, positive in 98% of cases. The presence of amastigotes was found in 79% of the bone marrow aspirates. Leishmania chagasi was identified in culture medium 3N (Nicolle–Novy–McNeal) in five children; 75% of the children presented malnutrition.
Conclusions. In the state of Chiapas, diagnosis of visceral leishmaniasis should be considered in patients with fever, hepatosplenomegaly, and pancytopenia. The search for the parasite should be begun early to avoid clinical deterioration and pain, which leads to malnutrition and puts patients at risk of dying.
Key words: visceral leishmaniasis, Chiapas, hepatoespelnomegaly, pancytopenia.
INTRODUCCIÓN
La leishmaniasis visceral (LV) es una enfermedad parasitaria potencialmente fatal que prevalece en países como Bangladesh, India (Estado de Bihar), África Oriental y en Sudamérica, principalmente en Brasil.1
La LV está directamente asociada con la pobreza y, por lo tanto, se encuentra incluida dentro del grupo de enfermedades tropicales desatendidas o del rezago (ETR). La magnitud de este problema de salud está influenciada también por factores sociales como: malas condiciones de vivienda y saneamiento ambiental, la desnutrición, la presencia de otras enfermedades infecciosas como el VIH y la atención médica inoportuna que retarda el diagnóstico y el tratamiento; de esta forma, se acentúan la morbilidad y mortalidad debidas a esta enfermedad.2,3
El primer caso de LV descrito en México fue en 1952; hasta 1988 sólo se habían reportado 9 casos y, únicamente, 4 casos pediátricos.4–7 Desde entonces se ha sospechado que la carga de la enfermedad por LV es significativa en nuestro país. En 1990 se diagnosticó el primer caso de LV en el estado de Chiapas. A partir de entonces se ha identificado una serie de casos que, solamente en el Hospital General Dr. Rafael Pascacio Gamboa, de Tuxtla Gutiérrez, Chiapas, suman 72. Así mismo, existe un mayor número de pacientes con LV diagnosticados y tratados en hospitales comunitarios y algunos en los Centros Hospitalarios de la Ciudad de México.8 Estos datos confirman que la LV es una ETR con un importante impacto en poblaciones de México, particularmente en el sureste.
Chiapas está localizado en la frontera con Guatemala. Esta zona es bien conocida como zona de alta endemia para la leishmaniasis cutánea (LC). Desde 1950 la LC en la región noroeste, y a partir de 1994 también en la región selvática, surge debido a los movimientos poblacionales secundarios al Movimiento Zapatista. De forma análoga la región de los valles, que corresponde a la Cuenca del Río Grijalva, se conoce como la zona de la LV desde 1990.9 El Hospital General Dr. Rafael Pascacio Gamboa de Tuxtla Gutiérrez, Chiapas, atiende principalmente a poblaciones que viven en riesgo de contraer LV. Es por ello que el objetivo de este artículo fue presentar un análisis descriptivo de las manifestaciones clínicas y epidemiológicas de la LV en la población pediátrica atendida en el Hospital General Dr. Rafael Pascacio Gamboa.
MÉTODOS
Se realizó un estudio descriptivo retrospectivo sobre los casos de LV en niños en el Hospital General Dr. Rafael Pascacio Gamboa, de Tuxtla Gutiérrez, Chiapas, durante el periodo 1990–2010. Se revisaron los expedientes clínicos existentes, los reportes epidemiológicos del archivo del servicio de Epidemiología, los resúmenes clínicos archivados en el servicio de Pediatría y las libretas de egresos del área de hospitalización pediátrica. Se incluyeron aquellos pacientes que cumplieron con los criterios clínicos y en los que se confirmó el diagnóstico mediante pruebas de laboratorio. El diagnóstico se definió con el cuadro clínico caracterizado por fiebre, hepatoesplenomegalia y la presencia de una o más pruebas microbiológicas positivas, como serología >1:32 por inmunofluorescencia indirecta (IFI) o por la detección del parásito con la tinción de Giemsa en el aspirado de médula ósea (AMO).
Los datos que se recolectaron y analizaron fueron: el año de ingreso, la edad, el sexo, el lugar de procedencia, el tiempo de evolución previo al ingreso, los síntomas como fiebre, distensión abdominal, la presencia de hepatomegalia o esplenomegalia, el estado nutricional, ictericia e invasión a mucosas; hallazgos de laboratorio como: anemia, leucopenia y plaquetopenia, hipoalbuminemia, hipergammaglobulinemia, transaminasas, elevación de bilirrubinas y los resultados de los análisis parasitológicos.
Los estudios de serología y visualización del parásito en el AMO y cultivo en el medio 3N (Novy–Nicolle–Mc Neal) se realizaron en el departamento de Parasitología del InDRE (Instituto Nacional de Referencia Epidemiológica) entre 1990 y 2005; en los últimos 5 años se realizaron en el Laboratorio Estatal de Salud Pública (LESP) de Chiapas.
RESULTADOS
Durante el periodo de estudio se estableció el diagnóstico de LV en 72 niños, además de los registros epidemiológicos y los archivos de los resúmenes clínicos del servicio de Pediatría del hospital. Para este informe se descartaron 9 casos porque no reunieron los requisitos indispensables para el diagnóstico de LV o porque no se contó con los datos completos en los archivos y expedientes. Por esto se incluyeron solamente 63 casos para el análisis. El rango de edad de estos pacientes fue de 2 meses a 13 años, con una edad promedio de 2 años 4 meses; 56 (88%) de los pacientes eran menores de 5 años, con una relación de género femenino–masculino de 1:1.2. Los datos completos del cuadro clínico y los resultados de laboratorio se encontraron en únicamente 31 casos.
Manifestaciones clínicas. El tiempo de evolución de la LV varió desde 10 días hasta 8 meses; la fiebre fue el síntoma inicial que se presentó en todos los pacientes (100%).
En el Cuadro I se observan las manifestaciones clínicas presentes en 20 casos en los cuales se recopilaron detalladamente los síntomas. En la mayoría de los casos los cuadros de fiebre se acompañaron de escalofríos y diaforesis importante con distensión abdominal progresiva; en 6 casos la madre palpó un "tumor abdominal". La mitad de los pacientes cursó con cuadros diarreicos frecuentes, vómitos, epistaxis e ictericia.

Se realizó la exploración física de 31 pacientes y se encontró esplenomegalia en 97% (30/31) que se consideró gigante ya que en varios alcanzaba la línea media. La hepatomegalia tuvo un rango de 2–9 cm y se presentó en 87% de los casos (27/31).
Se obtuvieron datos sobre el estado nutricional de 31 pacientes; se encontraron 23 niños afectados nutricional–mente (75%), 17 de los cuales presentaban desnutrición de moderada a grave, según la clasificación de Federico Gómez.
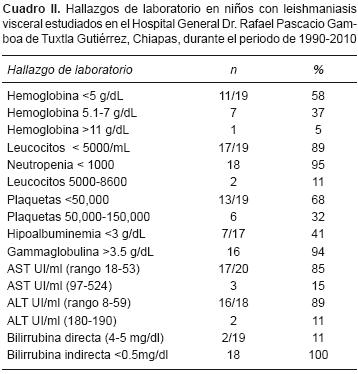
Hallazgos de laboratorio. Se presentan los datos de 19/20 pacientes en los cuales se valoraron los índices de la biometría hemática de ingreso y las químicas sanguíneas (Cuadro II). Se encontró que más de la mitad de los pacientes tenían hemoglobina (Hb) <5 g/dL, 7 con Hb de 5.1–7 g/dL, un paciente con Hb de 11.7 g/dL. Así mismo, se encontró leucopenia <4000 en 14 niños. Se identificaron 19/20 pacientes con plaquetopenia y en más de 50% de los casos con cifras menores a 50,000. La hipoalbuminemia se encontró en 8/18 y la hipergammaglobulinemia en 16/18 de los casos estudiados. A partir del 2006 se realizó ELISA para VIH a la madre y/o al paciente, y sólo se identificó un caso de coinfección por VIH y LV.
Confirmación parasitológica. Se considero un valor de IFI positivo para Leishmania cuando el título era igual o superior a 1:32, el cual fue establecido por el InDRE para leishmaniasis visceral: el 96% de los pacientes obtuvo este valor.
El AMO se realizó en todos los pacientes considerados con el diagnóstico de LV. Fue obtenido por el servicio de Hematología y enviado para tinción y lectura a los laboratorios del InDRE y el LESP. Se encontraron los resultados de 39 casos, en 31 (79%) se observaron amastigotos.
Se realizó el cultivo de médula ósea en medio 3N a 5 niños en el laboratorio de Parasitología del InDRE. En 1993 el Dr. Velasco–Castrejón y su equipo aislaron y confirmaron taxonómicamente, por anticuerpos monoclonales e isoenzimas, Leishmania chagasi en una niña de 2 años proveniente de Ocozocuatla, Chiapas.
Curso clínico. Todos los pacientes han sido tratados con Glucantime® (antimoniato de meglumina) a dosis de 20 mg/kg/día, intramuscular por 20 días. Se tiene reportada la recaída en un niño de 14 meses de edad, 6 meses después del primer tratamiento, que respondió al segundo tratamiento con Glucantime®. Un paciente fue tratado con anfotericina B por intolerancia a Glucantime®.
Se realizó la esplenectomía en los 5 casos ya que, en ese tiempo, se les trasfundía y esto empeoraba la esplenomegalia por secuestro. De estos 5 niños uno murió en 1993 por fiebre purpúrica, sin aislamiento microbiológico; no tenemos datos de los demás después de 17 años.
En el 2003 se trató al bebé más pequeño del grupo, masculino de 2 meses edad, que inició con los síntomas 10 días antes de su ingreso; clínicamente presentó fiebre de hasta 40°C, hepatoesplenomegalia, sangrados en sitios de punción, pancitopenia, hiperbilirrubinemia de BD 5.6 mg/ dL, BI 0.5 mg/dL; en el AMO se encontró una parasitemia muy importante y una IFI 1:16. Este paciente falleció al segundo día de tratamiento con Glucantime®.
En el 2007 se presentó una niña de 2 años edad con coinfección VIH/leishmania, presentaba un IFI 1:256 y no se observaron amastigotos en el AMO, recibió tratamiento con Glucantime® pero no recibió tratamiento antiviral por rechazo de la familia al diagnóstico de VIH; falleció 4 meses después.
Dos hermanos fallecieron, ambos fueron tratados con Glucantime®; el primero en 2003 con IFI negativo, AMO sin parásitos, con fiebre, hepatoesplenomegalia y pancitopenia, proveniente de Venustiano Carranza (una de las zonas con mayor número de casos); en el 2007, en la niña de 2 años de edad se identificó un IFI de 1:32 y AMO positivo para amastigotos; fallece a los primeros 5 días del tratamiento después de haber estado comiendo con buen apetito.
En total en este hospital fallecieron 4 de los 63 niños en nuestra cohorte de pacientes con LV. Por falta de recursos, ninguno de los niños con LV ha sido monitorizado cardiológicamente durante el tratamiento con Glucantime®.
DISCUSIÓN
La LV es un problema de salud pública muy importante en varios países de América Latina, principalmente en Brasil en el Cono Sur y en Honduras y El Salvador en Centroamérica,10–11 estas últimas regiones muy próximas al estado de Chiapas.
En México, hasta 1990, sólo se habían reportado 9 casos de LV principalmente en 4 estados del país: Guerrero, Oaxaca, Puebla y Morelos. De estos casos, cuatro fueron descritos en población pediátrica.4–7 En septiembre de 1990 se diagnosticó el primer caso de LV en Chiapas en una niña de 2 años proveniente de Pijijiapan, en la costa del estado de Chiapas. En 1992 se confirmó el segundo caso en Chiapas y, al mismo tiempo, se reportaron dos casos de niños chiapanecos en el Centro Médico Nacional.8 A partir de entonces Chiapas se colocó como el principal foco de LV en México ya que, actualmente, se tienen 72 casos registrados en el Hospital General Dr. Rafael Pascacio Gamboa en Tuxtla Gutiérrez, hospital de referencia en la región de la Cuenca del Río Grijalva.
En esta serie de casos se observó que el grupo de lactantes y preescolares es el más afectado, con un discreto predominio del sexo masculino. De los 63 niños reportados 88% fueron menores de 5 años, al igual que lo descrito para la LV de la zona del Mediterráneo.12–15 Sin embargo, Brasil es el país que tiene 90% de los casos del continente16 y los pacientes están distribuidos en todos los grupos de edad, con variaciones regionales internas, donde 21 a 43% de los casos pertenece al grupo etario de 20–49 años de edad.13
En nuestra población 75% de los niños (23/31) presentó algún grado de desnutrición, y de estos, 54% presentó desnutrición de moderada a grave, según la clasificación de Federico Gómez. Los factores determinantes de la desnutrición son, probablemente, la evolución clínica prolongada (en muchos de los casos condicionada por una disminución de la ingesta de alimentos), así como el desgaste energético ante la enfermedad y las malas condiciones de vida que sufren las familias de cara a la pobreza, pues la mayoría provinieron de zonas rurales, de familias de campesinos.
En nuestra experiencia, los pacientes han sido manejados exitosamente con Glucantime®. Únicamente se han presentado cuatro fallecimientos durante el curso de la enfermedad en los primeros días del tratamiento con Glucantime®. En un estudio reciente, en Brasil, en el que se reportaron factores de riesgo de muerte en 546 niños con LV, se encontró una tasa de letalidad de 10%, muy similar a nuestra experiencia. Los factores de mortalidad identificados en un análisis de regresión logística fueron: sangrado de mucosas, ictericia, disnea, infección bacteriana confirmada o sospechada, neutrófilos <500/mL, plaquetas <50 000/mL (este dato fue el más importante con un valor OR 11.7).17 En nuestra serie de casos se identificó un fallecimiento como resultado de la fiebre purpúrica, probablemente secundario a la inmunosupresión adquirida por la esplenectomía.
A pesar de la hepatomegalia en 87% de los casos las enzimas hepáticas se mantuvieron, generalmente, normales. Algunos pacientes pueden desarrollar colestasis, hipertensión portal, hepatomegalia persistente y fibrosis hepática, condiciones que han sido poco evaluadas.18 En zonas endémicas como Chiapas es importante considerar la LV en el estudio de los niños con probable hepatitis viral, particularmente aquéllos con fiebre e ictericia aunque con valores relativamente normales de transaminasas.
Otra situación que nos desvía de los cuadros clínicos característicos es la coinfección VIH/ leishmaniasis. La LV está ganando importancia clínica en los individuos infectados con VIH ya que ambas enfermedades coinciden regionalmente y estos casos de coinfección VIH/leismaniasis se esperan con un comportamiento más atípico.19 La coinfección VIH/leishmania aumenta el riesgo de desarrollar LV más de 100 veces en áreas endémicas, disminuye la respuesta al tratamiento y aumenta la probabilidad de recaída. De manera reciproca, la LV aumenta la progresión del VIH, sobre todo en casos de falta de tratamiento antiviral altamente activo.20 En el caso de coinfección que estudiamos la paciente no recibió tratamiento antiviral y falleció 4 meses después en su domicilio.
En nuestra serie de casos, todos los pacientes fueron manejados inicialmente con Glucantime®. Sólo se suspendió en uno de ellos por aumento de la fiebre y datos de toxicidad; este paciente fue subsecuentemente manejado con anfotericina B con buena respuesta clínica. Consideramos que el Glucantime® ha sido efectivo en el tratamiento de nuestros pacientes, pero tiene los inconvenientes de la toxicidad y la probable prolongación del tratamiento. La anfotericina B liposomal tiene menor toxicidad y el tratamiento es más simple pero su costo es mayor. Existen también aspectos logísticos que deben de ser considerados en el manejo de la LV: ambos tratamientos son parenterales y exigen personal de salud calificado tanto para la administración como para la vigilancia de la toxicidad.
En conclusión, nuestra serie de casos demuestra que la LV es un padecimiento frecuente en nuestra población y es un determinante de desnutrición infantil. En nuestro hospital la LV ha sido identificada principalmente en población pediátrica y, en los casos en los que hemos podido identificarlo, se ha aislado L. chagasi como el agente infeccioso. Esto es importante desde un punto de vista epidemiológico ya que puede haber otros focos de infección en el sureste mexicano en los cuales la LV puede ser ocasionada por L. mexicana. Es fundamental continuar con estudios para precisar la historia natural de la LV, el manejo clínico ideal y, preponderantemente, la epidemiología de la LV en México.
REFERENCIAS
1. World Health Organization. Leishmaniasis. Magnitude of the problem. Geneva. Disponible en: http://www.who.int/leishmaniasis/burden/magnitude/burden. [ Links ]
2. Alvar J, Yactayo S, Bern C. Leishmaniasis and poverty. Trends Parasitol 2006;22:552–557. [ Links ]
3. Boelaert M, Meheus F, Robays J, Lutumba P. Socio–economic aspects of neglected diseases: sleeping sickness and visceral leishmaniasis. Ann Trop Med Parasitol 2010;104:535–542. [ Links ]
4. Baez–Villaseñor J, Ruiloba J, Rojas LE. Presentación de un caso de Kala–azar en México. Rev Inv.Clin 1952;4:57–58. [ Links ]
5. Aguirre A, Biagi F, Hernandez–Nieto A. Segundo caso autóctono de Kala–azar en México. Bol Med Hosp Infant Mex 1963;20:317–333. [ Links ]
6. Dorantes–Mesa S. Cinco casos de Kala–azar colectados en México. Bol Med Hosp Infant Mex 1988;45:546–551. [ Links ]
7. Velasco–Castrejón O, Guzmán–Bracho C, Rivas–Sánchez B, Aguilar–Torrentera F. Las leishmaniasis con especial referencia a México. Colección de Cuadernos Técnicos, InDRE, SSA. México D.F.; 1994. [ Links ]
8. Trejo–Pérez JA, Miranda–Novales M, Solórzano–Santos F, Cabrera–Muñoz L, Díaz–Ponce H. Kala–azar en México: informe de dos casos. Bol Med Hosp Infant Mex 1993;50:662–665. [ Links ]
9. SSA, Instituto de Salud del Estado de Chiapas, Dirección de Servicios de Salud, Depto. De Prevención y Control de Enfermedades Trasmitidas por Vector. Manual para la Vigilancia Epidemiológica de la Leishmaniasis. México; 1999. [ Links ]
10. Desjeux P. Leishmaniasis: current situation and new perspectives. Comp Immunol Microbiol Infect Dis 2004;27:305–318. [ Links ]
11. Bueso–Engelhardt A, Ortega–Iglesias JC, Lopez–Aguilar A, Lanza–Fernández TO, de León–Lozano JC. Leishmaniasis visceral en Honduras. Estudio de 54 casos en un hospital infantil de referencia. Bol Med Hosp Infant Mex 1994;51:15–21. [ Links ]
12. Prieto–Tato LM, La Orden–Izquierdo E, Guillén–Martín S, Salcedo–Lobato E, García–Esteban C, García–Bermejo I, et al. Diagnóstico y tratamiento de la leishmaniasis visceral infantil. An Pediatr (Barc) 2010;72:347–351. [ Links ]
13. Valcárcel Y, Bastero R, Anegón M, González S, Gil A. Epidemiología de los ingresos hospitalarios por leishmaniasis en España (1999–2003). Enferm Infecc Microbiol Clin 2008;26:278–281. [ Links ]
14. Maltezou HC, Siafas C, Mavrikou M, Spyridis P, Stavrinadis C, Karpathios T, et al. Visceral leishmaniasis during childhood in southern Greece. Clin Infect Dis 2000;31:1139–1143. [ Links ]
15. Cascio A, Colomba C, Antinori S, Orobello M, Paterson D, Titone L. Pediatric visceral leishmaniasis in Western Sicily, Italy: a retrospective analysis of 111 cases. Eur J Clin Microbiol Infect Dis 2002;21:277–282. [ Links ]
16. Bern C, Maguire JH, Alvar J. Complexities of assessing the disease burden attributable to leishmaniasis. PloS Negl Trop Dis 2008;2:e313. [ Links ]
17. Sampaio MJA, Cavalcanti NV, Alves JB, Fernandez Filho MJ, Correia JB. Risk factors for death in children with visceral leishmaniasis. PloS Negl Trop Dis 2010;4:e877. [ Links ]
18. Salomao F, Tavares J, D'Olveira JrA, Paraná R. Alteraciones hepáticas en la leishmaniasis visceral (Kala–azar) en niños: revisión sistemática de la literatura. Acta Gastroenterol Latinoam 2007;37:150–157. [ Links ]
19. Paredes R, Munoz J, Diaz I, Domingo P, Gurgui M, Clotet B. Leishmaniasis in HIV infection. J Postgrad Med 2003;49:39–49. [ Links ]
20. Alvar J, Aparicio P, Aseffa A, Den Boer M, Cañavate C, Dedet JP, et al. The relationship between leishmaniasis and AIDS: the second 10 years. Clin Microbiol Rev 2008;21:334–359. [ Links ]














