Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Boletín médico del Hospital Infantil de México
versão impressa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.68 no.1 México Jan./Fev. 2011
Caso clínico patológico
Lactante con neumonía
Pneumonia in a lactanting infant
Aarón Pacheco-Ríos,1 José Luis Lezana-Fernández,2 Daniel Ibarra-Ríos3, Io Daiela Castillo-Martínez,4 Arely Flores-Munguía,5 Yolanda Rocío Peña-Alonso6
1 Dirección de Enseñanza y Desarrollo Académico
2 Servicio de Neumología y Fisiología Pulmonar
3 Residente de segundo año de Pediatría
4 Residente de tercer año de Pediatría
5 Departamento de Trabajo Social
6 Departamento de Patología Clínica y Experimental; Hospital Infantil de México Federico Gómez, México, D.F., México
Autor de correspondencia:
Dra. Yolanda Rocío Peña Alonso
Correo electrónico: rociopena@hotmail.com
Fecha de recepción: 25-10-10
Fecha de aceptación: 26-10-10
RESUMEN DE LA HISTORIA CLÍNICA (A-06-52)
Lactante del sexo masculino de un mes de edad que acude al servicio de urgencias del hospital por tos, dificultad respiratoria y rechazo a la alimentación.
Antecedentes heredofamiliares. Madre de 22 años sana, con carrera técnica, ama de casa, sin toxicomanías. Padre de 25 años, con primaria completa, desempleado, con alcoholismo social. Tres hermanos del sexo masculino de tres y un año de edad con cuadro de vías respiratorias altas de diez días de evolución y hermano gemelo sano.
Antecedentes no patológicos. Originario y residente del Estado de México, de nivel socioeconómico bajo, habita departamento con todos los servicios. Alimentación al seno materno desde el nacimiento y, quince días antes del ingreso, leche entera. Desarrollo psicomotor: presenta succión adecuada. Inmunizaciones: BCG a los 13 días de vida.
Antecedentes perinatales y patológicos. Producto de GIII de embarazo gemelar que cursó con control prenatal regular sin complicaciones. Nació por cesárea a las 36 semanas de gestación, fue el segundo gemelo, pesó 2,400 g, midió 47 cm, Apgar 8/9. Egresó a los cuatro días de vida sin haber presentado complicaciones.
Padecimiento actual. Inició su padecimiento seis días antes del ingreso con tos en accesos cortos, disneizante, cianozante y no productiva. Tres días después presentó aumento de la frecuencia respiratoria y pausas respiratorias de diez segundos de duración; tres horas antes de su ingreso rechazó la alimentación. El día previo a su ingreso acudió a un hospital de segundo nivel donde se le diagnosticó rinofaringitis que se manejó con ampicilina, ambroxol, paracetamol, teofilina y micronebulizaciones con solución salina y N-acetilcisteína.
A la exploración física se encontró: peso 3,000 g, talla 47 cm, perímetro cefálico 34 cm, frecuencia cardiaca 170/minuto, frecuencia respiratoria 55/minuto, TA 70 mmHg (palpatoria), temperatura 35.5°C. Hipoactivo, sin facies característica, presentaba cianosis en extremidades. Cráneo sin hundimientos ni exostosis, fontanela anterior normotensa y posterior puntiforme, pupilas isocóricas, normorrefléxicas, pabellones auriculares, cavidad oral y faringe sin alteraciones. Cuello sin alteraciones. Tórax simétrico, con tiros intercostales y disociación toracoabdominal, estertores crepitantes diseminados basales. Sin alteraciones cardiacas. Abdomen blando, comprimible, hígado a 3 cm del borde costal; peristalsis presente. Genitales masculinos, testículos en bolsas escrotales. Sin alteraciones neurológicas. Los resultados de los exámenes de laboratorio al ingreso se muestran en el Cuadro 1.
Una radiografía del tórax mostró infiltrado broncoalveolar bilateral de predominio izquierdo. Se manejó con ayuno, soluciones de base a 150 mL/kg/día, glucosa 6 mg/kg/min, sodio y potasio 3 mEq/kg/día, calcio 100 mg/ kg/día, ampicilina 200 mg/kg/día, amikacina 15 mg/kg/ día. Dos horas después presentó apnea que revirtió parcialmente con un ciclo de presión positiva intermitente (PPI), por lo que se intubó con cánula del número tres y se inició ventilación mecánica controlada (VMC). Se realizó punción lumbar que mostró líquido cefalorraquídeo (LCR) sin alteraciones (Cuadro 1).
A las 3 horas del ingreso la TA era 70 mm Hg por lo que se le administraron tres cargas de solución fisiológica 0.9% a 20 mL/kg. Tres horas después, debido a lactato elevado (6.1), se le administró una carga de solución Hartman a 20 mL/kg; se inició midazolam a 0.4 ug/kg/miny se agregó bicarbonato a 3 mEq/kg/dosis para pasar en 8 horas.
Fue valorado por el servicio de infectología y se inició cefotaxima a 150 mg/kg/díay dicloxacilina a 100 mg/kg/ día por neumonía de focos múltiples. La punción capilar mostró glucemia de 461 mg/dL por lo que se manejó con insulina rápida y posteriormente se administró bicarbonato de sodio En el Cuadro 2 se muestra el resultado de las gasometrías.
Al segundo día de su ingreso se le trasladó a la terapia intensiva donde se le encontró con llenado capilar de tres segundos, FC 176/min, FR 54/min. TA media 28 mm Hg. Se colocó línea arterial y catéter venoso central, se dejó en ayuno, con soluciones de base, dobutamina, milrinona, norepinefrina y epinefrina. La presión venosa central (PVC) era de 6 cm/H2O por lo que se administró concentrado eritrocitario a 15 mL/kg/dosis. Presentó anuria durante 12 horas por lo que se le administró infusión de furosemida y dos bolos de bumetanida. El gasto urinario fue de 0.5 mL/kg/h. Por hipotensión persistente se le administró vasopresina en infusión, se agregó claritromicina y se indicó bicarbonato de sodio a 3 mEq/kg/dosis. Unas horas después presentó hipoxemia persistente, parámetros altos de ventilador (asisto/controlada), FiO2100%, PIM24, PEEP 4, TI 0.5 seg, FR 35/min, relación I:E 1:2.4, se inició ventilación de alta frecuencia y se administró óxido nítrico.
Al tercer día su de ingreso, tenía un llenado capilar de 3 seg, FC 178/min, TA media 37 mm Hg y PVC 10 cm/ H2O. Debido a taquicardia supraventricular se le administró lidocaína, presentó paro cardiaco que se manejó con maniobras avanzadas de reanimación durante 5 minutos y epinefrina. Presentó crisis convulsivas que se controlaron con midazolam 0.15 mg/kg/dosis. El ultrasonido transfontanelar mostró datos de edema cerebral grave con disminución importante del sistema ventricular. El niño se deterioró progresivamente y presentó paro cardiaco sin respuesta a maniobras de reanimación al tercer día de su ingreso (Cuadro 3).
El estudio posmortem fue autorizado por los padres.
Presentación del caso clínico
Dr. Aarón Pacheco Ríos. Antes de iniciar quisiera hacer algunas aclaraciones a la historia de este paciente. El niño llegó a nuestro hospital a las 11:45 am; a las 5:00 pm el examen general de orina presentaba pH de 6, sangre ++, glucosuria de 250 mg/dL y densidad urinaria de 1010. Al día siguiente se le realizaron diversas densidades urinarias que oscilaron entre 1007 y 1015, así como labstix en orina con pH de 5, sangre alta y proteínas altas; el día del fallecimiento un examen general de orina mostró pH de 5, proteínas de 30 g/dL, sangre altay densidades urinarias entre 1005 y 1010.
Le pido a la doctora Marissa Minutti Palacios nos indique en forma práctica cómo podría un médico evaluar si un niño de esta edad está orinando normalmente.
Dra. Marissa Minutti Palacios (Médico Interno de Pregrado). Le preguntaría a la mamá cuántos pañales moja durante el día, lo cual es un indicador para saber si está orinando bien (un niño debe de mojar de 6 a 8 pañales al día). Lo anterior puede ser interrogado en la consulta; sin embargo, si quisiéramos cuantificar la orina, tendríamos que colocarle al paciente una bolsa recolectora de orina o una sonda vesical para medir la cantidad y de esta forma conocer el gasto urinario.
Dr. Aarón Pacheco Ríos. Le pido a la doctora Michelle Segundo Zavala que describa en un enunciado breve cuál es el problema principal del paciente.
Dra. Michelle Segundo Zavala (Residente de primer año de Pediatría). En este paciente hay datos específicos de neumonía y deshidratación que se complican con un choque séptico y se genera después falla orgánica múltiple.
Dr. Aarón Pacheco Ríos. Le solicito al doctor Carlos Rafael Bañuelos Ortiz que defina en un enunciado breve cuál es el problema principal del paciente.
Dr. Carlos Rafael Bañuelos Ortiz (Residente de quinto año de Terapia Intensiva Pediátrica). El problema es claramente infeccioso; el paciente acudió por una neumonía adquirida en la comunidad complicada con choque séptico que condicionó acidosis metabólica secundaria a la elevación del ácido láctico. El problema principal de este niño fue un choque de tipo hipodinámico con un manejo excesivo de líquidos, lo que provocó mayor falla pulmonar, que causó congestión pulmonar e hipertensión arterial pulmonar.
Dr. Aarón Pacheco Ríos. Se habrán dado cuenta que hicimos una pregunta para que el médico estableciera su razonamiento clínico diagnóstico: el residente de primer año de pediatría es considerado un médico novato y al residente de terapia intensiva se le considera experto y seguramente notaron que existen diferencias en el razonamiento clínico de cada uno de ellos. El razonamiento clínico no es una habilidad innata del residente; el razonamiento clínico se aprende pero... ¿cómo se aprende? A través de los profesores. Sin embargo, es muy importante que tengamos en mente que el ejemplo no es suficiente para enseñar a razonar clínicamente a nuestros médicos. Debemos ser objetivos en la enseñanza del razonamiento clínico y para eso les invito a leer un artículo relacionado con las estrategias educacionales para promover el razonamiento clínico-diagnóstico,1 porque ustedes son quienes pueden enseñar a razonar clínicamente a los médicos en formación.
Es indudable que la participación de trabajo social en la atención de los pacientes permite a los médicos conocer los aspectos sociales y familiares necesarios para proveer una mejor atención, por esto le pido a la trabajadora social Arely Flores Munguía, de la Unidad de Cuidados Intensivos Pediátricos, que nos haga un comentario relacionado con el caso.
T.S. Arely Flores Munguía (Trabajo Social). Este caso es especial por la corta estancia del paciente en el hospital. Este pequeño pertenecía a una familia extensa de tres generaciones: abuelos, padres e hijos; el papá de 25 años de edad con escolaridad primaria, chofer de transporte público, estaba sujeto a una jornada laboral prolongada, por lo tanto el tiempo que dedicaba a su familia era mínimo, adjudicándole la responsabilidad total a la mamá de 22 años de edad, la cual tuvo a su primer hijo a los 19 años, y en los siguientes tres años, ya era madre de cuatro pequeños. Quienes son padres se podrán dar una idea de lo que significa cuidar a un hijo y en este caso, una mujer de 22 años está a cargo de cuatro hijos, gemelos los más pequeños; lo anterior implica una sobrecarga de responsabilidades como son la alimentación, baño, cuidados, etc. Esto nos hace suponer que para la madre implicó una sobrecarga de responsabilidades y actividades, que seguramente la tenían sometida a un desgaste físico, emocional y económico que propició periodos de estrés que no le permitieron poner la atención adecuada a los problemas de salud de sus pequeños. Como se pueden dar cuenta, es un caso en que la breve estancia del paciente actúa como limitante para una intervención social profunda. La mayoría de ustedes sabe que existe un Comité Posmortem, donde los padres, que autorizan el estudio de autopsia, reciben los resultados del mismo en un tiempo no mayor a tres o cuatro meses; esta familia llegó posteriormente a la entrega de resultados y es en ese momento donde se continuó el seguimiento social. Quiero mencionar que la intervención de trabajo social se hace en forma holística, sin dejar de lado la parte social, la cual es muchas veces determinante para que pueda tener éxito el tratamiento médico.
Dr. Aarón Pacheco Ríos. Gracias licenciado Flores, seguramente esta información va a ser importante para el doctor José Luis Lezana Fernández, a quien solicito discuta el caso.
Discusión del caso
Dr. José Luis Lezana Fernández. El caso corresponde a un lactante menor del sexo masculino, de 36 días de vida, con un padecimiento actual de 6 días de evolución, con tos, dificultad respiratoria, pausas respiratorias (apneas) y rechazo a la vía oral; fue manejado en un hospital de segundo nivel 24 horas antes de su ingreso con ampicilina, ambroxol, paracetamol, teofilina y micronebulizaciones con N-acetilcisteína. Al parecer sin mejoría, por lo que acude al Hospital Infantil de México Federico Gómez (HIMFG). A su ingreso pesaba 3,000 g (peso esperado 3,150 g) lo que se traduce como un déficit de 9% y se ubica en el percentil 15. Talla de 47 cm en percentil 3 y PC por debajo del percentil 3, aunque el índice de Miller fue de 1.38 (1.36-1.54), el mínimo esperado para su edad.2-3 El abordaje secuencial que presento está basado en problemas.
1. Neumonía adquirida en la comunidad. Con base en los datos clínicos de tos, rechazo a la vía oral, taquipnea de 55/min (31±2), insuficiencia respiratoria con cianosis por la exploración física y las imágenes radiológicas. Los agentes bacterianos causales más frecuentes en este grupo de edad son Chlamydia trachomatis, estreptococo del grupo B, Staphylococcus aureus, Haemophilus influenzae tipo B y, con menor frecuencia, Streptococcus pneumoniae. Aunque por la presencia de apneas no se descarta la presencia de agentes virales (virus sincicial respiratorio [VSR] principalmente).4
2. Sepsis grave. En niños, de acuerdo con las guías 2008, se requieren, además de los signos propios de sepsis, disfunción cardiovascular, síndrome de dificultad respiratoria aguda o disfunción de dos o más órganos.5 El paciente tenía signos sistémicos relacionados con sepsis desde su ingreso: hipotermia, dificultad respiratoria con apneas y cianosis, rechazo a la vía oral, evidencia de un proceso infeccioso respiratorio y estrés metabólico (hiperglicemia). Los criterios hematológicos para considerar sepsis incluyen: cuenta de leucocitos totales <5,000 o >18,000, cuenta de neutrófilos absolutos <1,800, bandas totales ≥1,000, trombocitopenia <100,000 plaquetas, relación bandas/neutrófilos totales >0.2 para la edad, sedimentación microeritrocítica >15 mm en la primera hora y proteína C reactiva (PCR) >1 g/dL. La presencia de dos de estos parámetros anormales se asocia a sepsis con una sensibilidad de 93% y con especificidad de 83%, con un VPP de 27% y VPN de 100%.6
El paciente, a su ingreso, tenía bandas totales de más de 3,000 y una relación bandas/neutrófilos totales de 1.0, aunque la cifra de leucocitos era limítrofe de 17,900. De acuerdo con las guías internacionales, el estándar de oro para el diagnóstico es el hemocultivo. Por otro lado, recientemente se ha sugerido que niveles elevados de procalcitonina pueden ser un marcador más específico que la PCR para el diagnóstico de sepsis con una sensibilidad de 97%.7
La respuesta metabólica inicial a la sepsis está estrechamente regulada por cambios endocrinos específicos, los cuales inactivan las vías anabólicas e incrementan la actividad pituitaria anterior. El paciente séptico se caracteriza por resistencia a la insulina y hormonas reguladoras como cortisol, glucagon, hormona de crecimiento y catecolaminas. La resistencia a la insulina inducida por el estrés impide la síntesis de glucógeno con incremento en la síntesis de piruvato, lactato, ácidos grasos libres y triglicéridos. Los trabajos de Van den Berghe y cols. establecen una relación directa entre la hiperglicemia y el aumento en la mortalidad, con mayor disfunción orgánica.8-9 En pacientes con sepsis los valores de glucosa >178 mg/dL incrementan 2.6 veces (OR) el riesgo de muerte.
En una revisión de Andersen y cols., sobre el papel de la insulina y la hiperglicemia en la patogénesis de la sepsis, se enfatizan las alteraciones metabólicas de la sepsis y su interrelación con la hiperglicemia en la liberación de cortisol, hormona de crecimiento, glucagon, metabolismo de aminoácidos y lípidos, catecolaminas, interacción funcional alterada entre leucocitos y endotelio capilar en la sobre-regulación de las moléculas de adhesión, habilidad de quimiotaxis de polimorfonucleares y producción de citocinas.10
3. Hipoperfusión tisular, insuficiencia renal, acidosis láctica y datos de choque séptico. A su ingreso, el paciente tenía hipotensión arterial con aumento de la creatinina, hipercalemia y una depuración de Schwartz de 21.4, lo que se traduce como hipoperfusión e insuficiencia renal. La gasometría de ingreso no hace referencia a la FiO2 utilizada, por lo que no fue posible determinar los índices ventilatorio y respiratorio; sin embargo, presentó acidosis mixta,11 la cual no se corrigió durante toda su evolución. La brecha aniónica fue alta, relacionada probablemente con una mayor producción de lactato por hipoxia asociada a una posible disminución en su excreción por falla renal.
La hipoperfusión con llenado capilar lento se observa en pacientes con choque y, de alguna forma, es uno de los eventos finales en los pacientes críticos. La dificultad respiratoria es una vía final de muchas afecciones puesto que, por un lado, los requerimientos energéticos están aumentados (y por lo tanto los requerimientos de oxígeno en todos los tejidos) y por otro, el mayor metabolismo lleva a mayor producción de bióxido de carbono con lo que aumenta el trabajo ventilatorio. Encaso de hipoperfusión tisular predomina el metabolismo anaeróbico con producción de ácidos, y la compensación pulmonar implica un aumento en la tasa de eliminación de CO2. En casos de infección grave, principalmente por gramnegativos, existe un aumento en la permeabilidad capilar con fuga de líquido a nivel pulmonar, disminuyendo la hematosis e incrementando el trabajo ventilatorio.7
4. Manejo. Los datos clínicos y de laboratorio sugieren que el paciente presentaba desde su ingreso datos de sepsis grave y choque. Transcurrieron 5 h hasta que se inició el manejo con cargas de cristaloides, cuando las guías internacionales las recomiendan dentro de la primera hora.7 Por otro lado, la cobertura del manejo antimicrobiano fue insuficiente.
El manejo del choque debe encaminarse a la normalización de la presión arterial y de la perfusión tisular. El diagnóstico de choque refractario a líquidos debe establecerse en los primeros 15 minutos e iniciar de inmediato con vasopresores e inotrópicos, con dopamina como el fármaco de primera elección en pacientes con hipotensión refractaria, incluso cuando la hipovolemia no ha sido resuelta. El choque refractario a dopamina requiere del uso de epinefrina o norepinefrina para mantener la ScvO2 ≥70%.7,12 Ante la falta de respuesta con resistencias vasculares sistémicas bajas la vasopresina ha sido utilizada en casos aislados, sin existir evidencia contundente respecto a su uso en pediatría. Cuando el choque es resistente a catecolaminas (60 minutos) se debe iniciar hidrocortisona por el riesgo de insuficiencia renal y considerar finalmente la oxigenación por membrana extracorpórea.7,13-15
5. Evolución. La osmolaridad sérica se mantuvo por debajo de 280 mOsm/L, con hiponatremia persistente y la eliminación de Na urinario llego a ser >60 mEq/L, probablemente debido a disfunción tubular y posiblemente a falta de respuesta a la aldosterona. Otras causas de hiponatremia pueden ser la administración de vasopresina o la hiperglicemia por desplazamiento transcelular de agua.
Independientemente del manejo el paciente continuó con datos progresivos de bajo gasto, representado por una diferencia en el contenido arterial y venoso de O2 >16, con hipoxemia refractaria por un índice respiratorio >5 y un índice de intercambio gaseoso de 0.08, con más de 23% de cortocircuitos intrapulmonares e incremento de la relación V/Q, a pesar de una FiO2 de 1.0 con un contenido de O2 en sangre de 11.1 mL/dL.15 Finalmente, el paciente desarrolló necrosis tubular, insuficiencia suprarrenal, falla orgánica y muerte.
Los diagnósticos finales son:
1. Lactante menor masculino con talla baja.
2. Neumonía de la comunidad.
3. Sepsis.
4. Acidosis metabólica e insuficiencia renal.
5. Choque séptico refractario.
6. Necrosis tubular e insuficiencia suprarrenal.
7. Edema pulmonar.
8. Edema cerebral.
9. Falla orgánica múltiple.
Dr. Aarón Pacheco Ríos. ¿Existe alguna pregunta de parte de la audiencia?
Dr. Ricardo Muñoz Arizpe. El paciente llegó con insuficiencia renal (IR) con alteraciones hidroelectrolíticas e hiponatremia que se agravó por el manejo. No estoy de acuerdo con el manejo de líquidos y electrolitos que se indicó en este caso. Este niño traía una IR aguda grave que al parecer inició súbitamente, probablemente asociada con la sepsis y con la deshidratación; primero hay que tratar el estado de choque y posteriormente tratar de dializar a la brevedad posible. Desde el punto de vista de la falla renal, pudiera tratarse de una necrosis tubular renal, pero lo más probable (de acuerdo con el grado de anemia que presentó el paciente y la rapidez con la que evolucionó, asociada con los hallazgos urinarios y los datos de IR) es que se trató de infartos renales o de una trombosis renal.
Dr. Aarón Pacheco Ríos. Un aspecto importante a tratar es cómo les enseñamos a razonar a los médicos. Le pido al doctor Daniel Ibarra Ríos, residente de segundo año de pediatría, que identifique en la historia clínica del paciente los elementos clave en el proceso de razonamiento diagnóstico clínico de este caso.
Dr. Daniel Ibarra Ríos. En esta sesión el doctor Pacheco hizo un ejercicio interesante: primero le pidió a un residente de primer año que sintetizara cuál era el problema del paciente. Después hizo la misma pregunta a un residente de quinto año de terapia intensiva, quien identificó un choque séptico hipodinámico. Esto sirve para contrastar el reconocimiento de los elementos clave de la historia al hacer un diagnóstico.
Desde el inicio del interés por la medicina basada en evidencias, resurgió la inquietud de cómo aprenden los médicos. Estamos acostumbrados a aprender de nuestros superiores pero muchas veces no nos damos cuenta que hay gente aprendiendo de nosotros. Desde el primer año, los residentes tienen internos que los observan interrogar, explorar, llegar a diagnósticos y tomar decisiones. De esta manera, todos actuamos como maestros clínicos y nuestro objetivo debe ser que el aprendiz extraiga información y razone de la misma manera que nosotros. Así podrá lograr independencia para, cuando se enfrente a un problema similar, establecer un diagnóstico y tomar las decisiones adecuadas.
Cuando se elabora la síntesis de un caso se toman en cuenta los elementos principales de la historia clínica, que se relacionan estableciendo unabase de datos que nos llevará a formular una hipótesis y, finalmente, un diagnóstico. Para unir todos estos conceptos utilizamos nexos que se conocen como calificadores semánticos, términos como: "agudo", "crónico", "recurrente", "grave", etc., que nos ayudan a diferenciar entre una enfermedad y otra; y utilizamos puntos de anclaje entre los diferentes conceptos. Un ejemplo sencillo puede ser un escolar con aparición aguda de petequias cuya biometría hemática muestra únicamente trombocitopenia; lo anterior me lleva a pensar en una púrpura trombocitopénica, probablemente idiopática. Por el contrario, si tengo un escolar con aparición aguda de petequias, cuya biometría hemática muestra anemia, trombocitopenia y además presenta hepatoesplenomegalia, me encamino hacia una ruta diagnóstica totalmente distinta. Finalmente, con todo lo que aprendemos durante nuestra formación en las ciencias básicas y cada vez que estamos en contacto con un paciente, vamos creando lo que llamamos "guiones de una enfermedad", que son el patrón de signos, síntomas y hallazgos de laboratorio que aprendemos a reconocer para identificar una enfermedad que más adelante, al estar expuestos a un patrón similar, nos permitirá establecer un diagnóstico.
Siempre partimos de la historia y exploración del paciente para adquirir una base de datos. La experiencia consiste en la adecuada interpretación de esos datos para tener una correcta representación del problema. De esta manera se genera una hipótesis que nos permite buscar y seleccionar un algoritmo pertinente para una determinada enfermedad. Generalmente pensamos cuáles son los factores predisponentes del paciente, suponemos cuál fue el dato fisiopatológico y cuáles fueron las consecuencias clínicas, que recogemos en la historia clínica.
Enfocados en este caso: recién nacido con antecedente de prematurez, tos, dificultad respiratoria y apneas; esto último es considerado como un "evento que aparentemente pone en riesgo la vida" o ALTE (por sus siglas en inglés Apparent Life Threatening Event). Debimos tener en cuenta causas primarias o secundarias que condicionaran la apnea. Al hacer la investigación de causas secundarias de apnea debimos pensar en sepsis. Probablemente, al tener los cuidados pertinentes, hubiéramos obtenido un mejor desenlace en la historia del paciente. En este abordaje, también habríamos descartado anemia, hipotermia, desequilibrio hidroelectrolítico, enfermedad por reflujo gastroesofágico, errores innatos del metabolismo, cardiopatías o anomalías neurológicas. El mensaje para llevar a casa es que muchas veces hacemos diagnósticos, tomamos decisiones o seguimos algoritmos, pero pocas veces nos preocupamos por saber si la persona que nos está observando está comprendiendo las diferentes acciones que estamos llevando a cabo (Figura 1).
Dr. Aarón Pacheco Ríos. Gracias Daniel, has puesto nuevamente sobre la mesa la importancia de la enseñanza del razonamiento clínico y no necesariamente por los médicos adscritos o profesores, los propios residentes pueden actuar como profesores y guías para que los residentes de más bajo grado logren desarrollar, de manera adecuada, el razonamiento diagnóstico clínico.
Hallazgos anatomopatológicos
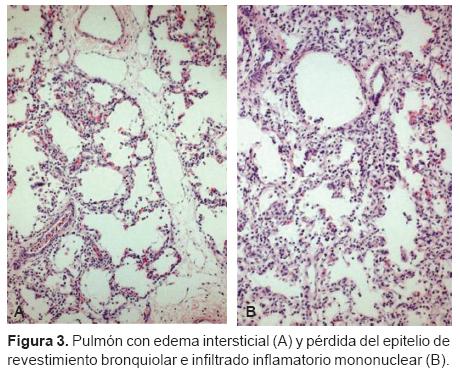
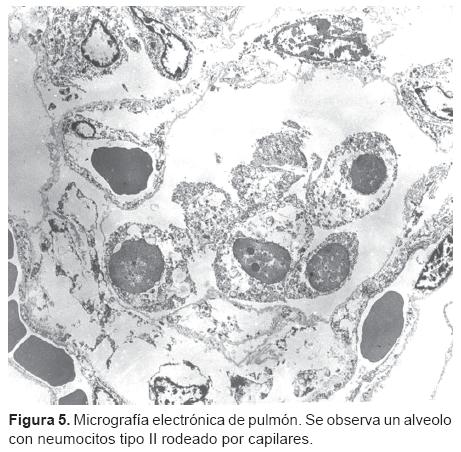
Dra. Yolanda Rocío Peña Alonso. En patología se recibió el cuerpo de este niño que pesó 5,200 g y midió 53 cm. El peso era superior al que tuvo al ingreso, que fue de 3,000 g; el cuerpo presentaba edema generalizado, había 8 mL de líquido cetrino en el pericardio, 25 mL en la pleura derecha, 10 mL en la pleura izquierda y 80 mL en la cavidad abdominal, todo esto como resultado del manejo de líquidos y la disfunción renal que tuvo el paciente. Como lo comentó el doctor Lezana, se encontró edema cerebral acentuado, el cerebro pesó 575 g vs. 440 g que es el peso normal.16 En la tráquea, la mucosa mostraba esfacelación extensa del epitelio de revestimiento con zonas de regeneración, alteraciones que corresponden a traqueítis aguda ulcerada. En los pulmones había infiltrado inflamatorio con predominio de linfocitos alrededor de vasos de pequeño calibre y bronquiolos; los tabiques interalveolares estaban engrosados por presencia de células mononucleares y edema intersticial acentuado (Figuras 2 y 3). Había descamación de neumocitos, algunos tenían núcleos homogéneos de aspecto esmerilado; los bronquiolos mostraban pérdida del epitelio de revestimiento además del infiltrado peribronquiolar. Solamente en uno de los ocho cortes de pulmón había leucocitos polimorfonucleares intraalveolares, lo cual indica una bronconeumonía incipiente (Figura 4). Debido a que estos datos histológicos sugieren una neumonía viral se procesaron cortes de pulmón para microscopía electrónica (ME) pero no se identificaron partículas virales, lo cual no excluye este tipo de infección ya que el número de fragmentos que se procesan para ME es limitado (Figura 5). Aún cuando no observamos partículas virales el diagnóstico, en este caso, es de neumonía intersticial de etiología probablemente viral en proceso de resolución y una neumonía bacteriana incipiente. Los cortes histológicos del corazón mostraron necrosis coagulativa extensa de fibras miocárdicas en la zona subendocárdica en ambos ventrículos, lo que es una manifestación de choque; había además células inflamatorias alrededor de las zonas de necrosis (Figura 6). Esto significa que el paciente sobrevivió entre 24 y 32 horas después de que ocurrió el daño del miocardio. El estudio de ME mostró destrucción de miofibrillas y mitocondrias hinchadas con pérdida de las crestas, así como cuerpos densos que se asocian con daño celular irreversible.



En el estómago había una úlcera en la unión esófagogástrica y edema de la pared gástrica. Como lo comentó el doctor Muñoz Arizpe, los riñones mostraron necrosis cortical bilateral que se corroboró con los cortes histológicos en los que se observa necrosis extensa de túbulos y glomérulos (Figura 7). La necrosis cortical renal se asocia con diversas condiciones patológicas como son cardiopatías congénitas, asfixia, sepsis, hipovolemia y choque; todas ellas comparten alteraciones como vasoespasmo, hipoxemia, acidosis y alteraciones del flujo renal que contribuyen a la patogénesis de la lesión.17 En el choque existe un daño tisular grave por isquemia pero también daño por reperfusión. Se observaron además otros datos de choque como miopatía visceral hipoxicoisquémica intestinal e involución aguda del timo.

Este paciente presentó hiponatremia, que es un factor de riesgo para que desarrollara edema cerebral. El cerebro pesó 585 g, por arriba del percentil 95 de acuerdo con las tablas de pesos y medidas de Coppoletay Wolbach. Había reblandecimiento del cerebro así como pérdida de neuronas de la capa tres de la corteza cerebral, eosinofilia y retracción de las neuronas del hipocampo, del núcleo dentado y de las neuronas de Purkinje; todas éstas manifestaciones de hipoxia aguda (Figura 8).

Los diagnósticos finales en este caso son:
• Neumonía intersticial probablemente viral
• Datos de choque prolongado:
1. Necrosis subendocárdica
2. Necrosis cortical renal
3. Edema cerebral
4. Encefalopatía hipoxicoisquémica
5. Miopatía visceral isquémica
6. Involución aguda del timo
• Anasarca (peso 5,200 g)
• Traqueítis aguda ulcerada
• Úlcera de la unión esofagogástrica
• Bronconeumonía incipiente
• Neumotórax izquierdo
• Enfisema de tejidos blandos
Dra. Liliana Worona Dibner. Me llamó la atención el poco incremento ponderal del paciente, si asumimos que nació con 2,400 g y al mes pesaba 3,000 g y la hipoalbuminemia que lo llevó a un estado de dilución. Aparte del trastorno de la función renal quisiera saber si había datos de atrofia intestinal o algo que sugiera alguna enteropatía.
Dra. Yolanda Rocío Peña Alonso. Se tomaron cortes de duodeno, yeyuno e ileon terminal y no había alteraciones histológicas sugestivas de enteropatía.
Dra. Teresa Murguía Peniche. Al leer la historia de este caso pensé que podría tratarse de un VSR porque hay diversas manifestaciones extrapulmonares asociadas con esta infección. Por ejemplo, se ha visto que hasta una tercera parte de los niños tiene hiponatremia; que pueden tener crisis convulsivas, que hasta 50% de los niños que llegan a terapia intensiva presentan arritmias, infartos y necrosis. Si este bebé empezó con síntomas seis días antes de ingresar y vivió un par de días en el hospital, ¿es factible encontrar evidencia viral después de este tiempo o ya nada más se observarían cambios inflamatorios?
Dra. Yolanda Rocío Peña Alonso. El infiltrado inflamatorio perivascular y la pérdida del epitelio bronquial de algunos bronquiolos es similar al que se observa en la infección experimental temprana por VSR, donde no necesariamente hay células multinucleadas. Los hallazgos en el corazón y en el sistema nervioso se pueden explicar por el choque. En este caso las alteraciones histológicas de los pulmones son leves y no observamos células multinucleadas, por lo que es probable que se trate de una infección incipiente o en remisión.
Dr. Aarón Pacheco Ríos. Le solicito a la doctora Io Daiela Castillo Martínez, residente de tercer año de pediatría, que nos presente la correlación clínico-patológica de este caso.
Dra. Io Daiela Castillo Martínez. Se trató un recién nacido pretérmino con peso adecuado para edad gestacional que adquirió una infección en las vías respiratorias superiores. Tuvo un tratamiento inapropiado ya que, por la edad del paciente, no debió haberse dado manejo ambulatorio; adquirió una neumonía de la comunidad, probablemente viral. El tratamiento posterior también fue inadecuado ya que el niño desarrolló un choque grave que repercutió en varios sistemas: páncreas, pulmón, riñones, corazón, hígado e intestino y, concomitantemente, tuvo una hiponatremia que pudo ser resultado del choque por el problema renal o por la ingesta de leche entera. La hiponatremia condicionó crisis convulsivas por edema cerebral, además de encefelopatía hipóxica; finalmente, el niño desarrolló una falla orgánica múltiple que lo llevó a la muerte (Figura 9).
Dr. Aarón Pacheco Ríos. Considero que no podemos olvidar aspectos fundamentales en la atención de los pacientes. En este caso hubo fallas importantes en la atención de este niño; invito, particularmente a los residentes en formación, a que lean el artículo de Profesionalismo en Pediatría, ya que debemos rescatar el humanismo en la atención de nuestros casos.18
REFERENCIAS
1. Bowen JL. Educational strategies to promote clinical diagnostic reasoning. N Engl J Med 2006;355:2217-2225. [ Links ]
2. Seidel HM, Rosenstein BJ, Pathak A. Primary Care of the Newborn. St Louis, MO: Mosby; 1997. [ Links ]
3. Hamill PV, Drizd TA, Johnson CL, Reed RB, Roche AF, Moore WM. Physical growth: National Center for Health Statistics percentiles. Am J Clin Nutr 1979;32:607-629. [ Links ]
4. American Academy of Pediatrics, Committee on Infectious Diseases and Committee on Fetus and Newborn. Revised guidelines for prevention of early-onset group B streptococcal (GBS) infection. Pediatrics 1997;99:489-496. [ Links ]
5. Levy MM, Fink MP, Marshall JC, Abraham E, Angus D, Cook D, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med 2003;31:1250-1256. [ Links ]
6. Goldstein B, Goroir B, Randolph A. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med 2005;6:2-8. [ Links ]
7. Dellinger RP, Levy MM, Carlet JM, Bion J, Parker MM, Jaeschke R, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med 2008;36:296-327. [ Links ]
8. Van den Berghe G, Wouters PJ, Weekers F, Verwaest C, Bruyninckx F, Schetz M, et al. Intensive insulin therapy in critically ill patients. N Engl J Med 2001 ;345:1359-1367. [ Links ]
9. Van den Berghe G, Wouters PJ, Bouillon R, Weekers F, Verwaest C, Schetz M, et al. Outcome benefit of intensive insulin therapy in the critically ill: insulin dose versus glycemic control. Crit Care Med 2003;31:359-366. [ Links ]
10. Andersen SK, Gjedsted J, Christiansen C, Tonnesen E. The roles of insulin and hyperglycemia in sepsis pathogenesis. J Leukoc Biol 2004;75:413-421. [ Links ]
11. Oakes DF. Clinical Practioner's Pocket Guide to Respiratory Care. USA: Health Educator Publications, Inc; 2008. [ Links ]
12. Varpula M, Tallgren M, Saukkonen K, Voipio-Pulkki LM, Pettilä V. Hemodynamic variables related to outcome in septic shock. Intensive Care Med 2005;31:1066-1071. [ Links ]
13. Masutani S, Senzaki H, Ishido H, Taketazu M, Matzunaga T, Kobayashi T, et al. Vasopressin in the treatment of vasodilatory shock in children. Pediatr Int 2005;47:132-136. [ Links ]
14. Carcillo JA, Fields AI, American College of Critical Care Medicine Task Force Committee Members. Clinical practice parameters for hemodynamic support of pediatric and neonatal patients in septic shock. Crit Care Med 2002;30;1365-1378. [ Links ]
15. Pizarro CF, Troster EJ, Damiani D, Carcillo JA. Absolute and relative adrenal insufficiency in children with septic shock. Crit Care Med 2005;33:855-859. [ Links ]
16. Shankle WR, Landing BH, Gregg J. Normal organ weights of infants and children: graphs of values by age, with confidence intervals. Pediatr Pathol 1983;1:399-408. [ Links ]
17. Lerner GR, Kurnetz R, Bernstein J, Chang CH, Fleischmann LE, Gruskin AB. Renal cortical and medullary necrosis in the first 3 months of life. Pediatr Nephrol 1992;6:516-518. [ Links ]
18. Fallat ME, Glover J, American Academy of Pediatrics, Committee on Bioethics. Professionalism in pediatrics. Pediatr 2007;120:e1123-e1133. [ Links ]














