Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.67 no.6 México nov./dic. 2010
Caso clínico
Síndrome de Pierre-Robin y hepatoblastoma: reporte de un caso
Pierre-Robin syndrome and hepatoblastoma: a case report
Luis Enrique Juárez-Villegas,1 Marta Zapata-Tarrés,1 Pablo Lezama del Valle,2 Miguel Ángel Palomo-Collí1
1 Departamento de Oncología
2 Departamento de Cirugía Pediátrica. Hospital Infantil de México Federico Gómez, México D.F., México
Autor de correspondencia:
Dr. Miguel Ángel Palomo Collí
Correo electrónico: phalomi@hotmail.com
Fecha de recepción: 12-05-09.
Fecha de aceptación: 28-08-09.
Resumen
Introducción. La secuencia de Pierre-Robin (SPR) es una afección congénita caracterizada por micrognatia, glosoptosis y fsura del paladar blando. La prevalencia es 1:8500 recién nacidos (RN) vivos. El hepatoblastoma (HB) es el tumor maligno primario de hígado más frecuente en pediatría. Afecta niños menores de 3 años.
Caso clínico. Se trata de un paciente masculino de 2 años de edad, producto de la gesta II, de término, obtenido por cesárea, peso al nacer de 2, 750 g, con diagnóstico de SPR. A los 2 años se detecta masa abdominal dependiente de hígado. Se diagnostica HB, por lo que requiere quimioterapia y cirugía (lobectomía izquierda). A 5 años de seguimiento está vivo sin actividad tumoral.
Conclusiones. La asociación de SPR y HB no se encontró reportada previamente en la literatura. Ambas presentan alteraciones en el cromosoma 2. Dado que el cáncer cursa con alteraciones citogenéticas, debemos de establecer asociaciones entre aquellos pacientes que cursan con síndromes genéticos. Esto permite evaluar blancos moleculares útiles y diseñar terapias dirigidas. También permite detectar poblaciones de riesgo de padecer cáncer y crear programas de seguimiento y evaluación que permitan una detección temprana para mejorar la sobrevida de dichos grupos.
Se trata del primer caso de asociación entre estas dos patologías reportado en nuestro instituto y en el mundo.
Palabras clave: secuencia de Pierre-Robin, hepatoblastoma, lobectomía izquierda, cisplatino, vincristina, 5-fuorouracilo.
Abstract
Background. Pierre-Robin Sequence (PRS) is a congenital disease characterized by micrognatia, glosoptosis and U-shaped posterior cleft palate. Its prevalence is 1:8500 newborns. Hepatoblastoma (HB) is the most frequent hepatic malignant tumor in childhood and affects patients <3 years of age.
Case report. A 2-year old male with PRS was diagnosed with HB. The boy was the product of the second full term pregnancy. He was born by cesarean with a birth weight of 2750 g. The patient presented with a 1-month history of abdominal mass. Diagnosis of HB was done by biopsy. The patient received chemotherapy with cisplatin, vincristin and 5-fuorouracil as well as left lobectomy. Five years later he is alive without tumor activity.
Conclusions. PRS and HB association has not been reported in the literature. Both entities have chromosome 2 alterations. Because cancer is associated with cytogenetic alterations, future considerations must be made to fnd a relationship between cancer patients and other genetic entities. This will be useful for fnding molecular targets. We can also detect the at-risk population in order to create follow-up programs that will allow an early diagnosis with an improved better survival. It is the frst case of PRS and HB reported in either the national or international literature.
Key words: Pierre-Robin Sequence, hepatoblastoma, left lobectomy, cisplatin, vincristin, 5-fuorouracil.
Introducción
La secuencia de Pierre-Robin (SPR) es una afección presente al nacer que se caracteriza por la tríada de micrognatia, glosoptosis y fisura del paladar blando. Corresponde a un tipo de los llamados síndromes craneofaciales: síndromes de Crouzon, de Apert, de Down, de Franceschetti-Treacher-Collins, de Goldenhar y microsomía hemifacial. También se incluye en los síndromes del primer arco: disostosis mandíbulofacial (síndrome de Treacher-Collins), hipoplasia mandibular y glosoptosis (síndrome de Pierre-Robin), disostosis mandibular, hipertelorismo y deformidades del oído externo y medio.
Se describió por primera vez en 1891, por Lannelongue y Menard, en dos pacientes con micrognatia, paladar hendido y retroglosoptosis, y luego, en 1923 por Pierre Robin, como un síndrome completo. En 1974 se denominó a esta triada SPR.
Se estima una prevalencia de 1:8500 recién nacidos (RN) vivos (1:2000 a 1:30,000), con un 80% de estos casos asociados a otros síndromes específicos.
La razón de su distribución por sexo es 1:1, excepto en la forma ligada al cromosoma X. La herencia es autosómica recesiva, existiendo la variante ligada al cromosoma X con malformaciones cardiacas y pie Bot.1
El hepatoblastoma (HB) es el tumor maligno primario de hígado más frecuente en la edad pediátrica. Se presenta con mayor frecuencia en pacientes menores de 3 años, con predominio en el género masculino. Representa del 1.2 al 5% de todas las neoplasias pediátricas con una incidencia de 0.5 a 1.5 casos por millón de niños menores de 15 años, por año.2,3
El HB puede estar asociado al síndrome de Becwith-Wiedemann y al síndrome alcohólico-fetal.4
Su pronóstico ha mejorado significativamente en los últimos 20 años por los progresos de las técnicas de cirugía hepática, asociado a la incorporación de fármacos antineoplásicos más efectivos que han aumentado la proporción de tumores resecables y han disminuido las recaídas.
Caso clínico
Se trata de un paciente masculino originario y residente de la ciudad de Querétaro que fue referido al Hospital Infantil de México Federico Gómez a la edad de 3 meses, con diagnóstico de SPR.
Es producto de la segunda gestación de madre de 21 años, sin control prenatal. Nació a las 38 semanas de gestación por cesárea, con peso al nacer de 2750 gramos. Se integran durante su seguimiento SPR, displasia de cadera bilateral que requiere manejo con cojín de Frejka. Tiene antecedente de tía materna con leucemia.
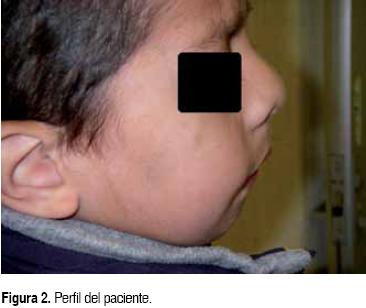
En Noviembre del 2003 se detecta masa abdominal durante consulta de seguimiento, sin otra sintomatología. A la exploración física se aprecia micrognatia (Figura 1), nariz en silla de montar, implantación baja de pabellones auriculares (Figura 2), paladar blando hendido (Figura 3), astigmatismo con hiperfunción de músculos oblicuos inferiores, abdomen con aumento del perímetro, con masa palpable en región de hipocondrio derecho y epigastrio, con borde hepático 5-5-4 cm por debajo de parrilla costal, consistencia dura, lisa, no dolorosa que rebasa la línea media, ausencia de testículo izquierdo y hernia inguinal izquierda. El ultrasonido demostró una lesión heterogénea de lóbulo hepático izquierdo. La tomografía de abdomen mostró una lesión de 74.4 x 77.8 mm, heterogénea, bien delimitada, dependiente de hígado lóbulo izquierdo, que refuerza con la aplicación de contraste (Figura 4). La biometría hemática con anemia normocrómica, normocítica (hemoglobina 10.8 g/dL, hematocrito 34%), trombocitosis (622,000 mm3). Las pruebas de función hepática se reportan sin alteraciones, las cifras de α-fetoproteína sérica 52,750 ng/dL y fracción β de hormona gonadotrofina coriónica de cero mUI/mL. La serología para diagnóstico de hepatitis fue la siguiente: anti HAV IgM negativo, HBsAg negativo, anti HBS positivo. Se realizó biopsia hepática reportando HB mixto (epitelial y mesenquimatoso).



Los estudios para detección de metástasis fueron negativos. Se inició manejo con protocolo institucional con tres fármacos: vincristina (1.5 mgm2sc), cisplatino (90 mgm2sc) y 5-fluorouracilo (1 gm2sc). Posterior a tres ciclos, se realizó lobectomía hepática izquierda y se consolidó con dos ciclos adyuvantes de mismo esquema de quimioterapia, para un total de cinco ciclos.
Inició vigilancia en Abril del 2004. Después de completar la quimioterapia, no existen alteraciones en la función renal; la valoración audiológica y potenciales evocados auditivos normales. La valoración del desarrollo general con retardo grave global (conducta motriz 36%, conducta adaptativa 36%, lenguaje 30% y social 30%).
En la evaluación posterior a 5 años de completar tratamiento, el paciente se encuentra libre de enfermedad, en seguimiento y tratamiento de las enfermedades no relacionadas con la neoplasia.
Discusión
La incidencia anual del HB es de 1.5 casos por millón en menores de 15 años.5 Existen dos subgrupos histológicos: HB y carcinoma hepatocelular. El HB ocurre generalmente antes de los 3 años de edad; alrededor de 90% de los tumores hepáticos malignos en los niños menores de 4 años son hepatoblastomas.6 La edad media al diagnóstico es de 19 meses con una predilección por el género masculino 1.4:1.0 a 2.0:1.0. La causa de los tumores hepáticos es desconocida; sin embargo, el HB ocurre en Easotec diaocciuómn ecnoton eas legluabnorsadsoín pdorro Mmedsi greanphéitcicos bien descritos, como el síndrome de Beckwith-Wiedemann, poliposis colónica familiar, síndrome de Li Fraumeni y trisomía 18, entre otros. Todas estas alteraciones tienen ya determinado el cromosoma en el cual se encuentra la alteración, así como los genes codificados.7-9
El estudio citogenético de los HB se ha realizado en casos aislados o series pequeñas; se han observado cariotipos anormales. Un estudio realizado en un periodo de 12 años, en 111 especímenes de HB, reportó cariotipos anormales en el 50% de los casos. Las alteraciones numéricas se observaron en 41 casos (36%); la alteraciones más frecuentes fueron las trisomías de los cromosomas 2, 8 y 20. Las alteraciones estructurales se observaron en 43 casos (39%); las más comunes fueron las translocaciones no balanceadas resultantes en trisomía 1q involucrando rompimientos en 1q12-21 (18%). Otros casos relacionan ganancia en cromosomas 2q y 20, así como del cromosoma 1; estas ganancias y rearreglos se asocian fuertemente a HB y pueden representar una vía de evolución genética asociada con aparición y progresión del HB. 10
Se desconocen las causas específicas del SPR pero podría ser parte de muchos síndromes genéticos. La mandíbula inferior se desarrolla lentamente en los primeros meses de vida, antes de nacer, pero su crecimiento se acelera en el primer año. Existen tres teorías para explicar su patogenia:
1. Teoría mecánica. Es la más aceptada. Hipoplasia mandibular (7ª y 11ª semana gestación), lengua alta en cavidad oral, lo que provoca una hendidura palatina. Explica la clásica hendidura palatina en U invertida y ausencia de labio leporino. Oligohidroamnios puede cumplir un rol por deformación de la mandíbula e impactación de la lengua contra el paladar.11
2. Teoría de maduración neurológica. Retraso en la maduración neurológica, evidenciada por electromiografía de la lengua, pilares faríngeos y paladar, como un retraso de la conducción nerviosa del hipogloso. La corrección espontánea de la mayoría de los casos soporta esta teoría.
3. Teoría disneurológica romboencefálica. Organización motora y reguladora del romboencéfalo se relaciona con un problema mayor de la ontogénesis.
El SPR consiste de una asociación no aleatoria de micrognatia, paladar hendido y glosoptosis lo que ocasiona dificultad respiratoria y para la alimentación. Estudios que han evaluado pacientes con esta secuencia los han dividido en sindromáticos y no sindromáticos. Se determinó que hasta el 70% de los pacientes sindromáticos presentaban un síndrome subyacente y solamente el 26% de aquéllos no sindromáticos presentaban un síndrome subyacente asociado.12
Se ha descrito la asociación del SPR con la deleción del cromosoma 2q32.3-q33.2. Al evaluar el intervalo de la deleción por análisis molecular se encontró que la región cromosómica mapeada muestra una asociación no aleatoria con paladar hendido.
No se tienen reportes previos de la asociación de SPR y HB en la literatura. Se sabe que ambas entidades tienen alteraciones cromosómicas en el cromosoma 2, cuya participación se ha sugerido en la génesis de ambos problemas. No se refiere que éste sea el determinante en todos los casos; sin embargo, sí existen casos en la literatura que reportan estas alteraciones. Se reporta el presente caso debido a que no se encontró referencia alguna que describa la asociación entre SPR y HB.
Teniendo en cuenta que el concepto actual de cáncer es que pertenece a una enfermedad determinada genéticamente, debemos establecer asociaciones entre aquellos pacientes que cursan con otros síndromes genéticos. La detallada comprensión de las alteraciones moleculares subyacentes a la génesis del tumor del hígado, así como a las alteraciones clínico-patológicas, permitirá una evaluación precisa de estos blancos moleculares, que puedan ser útiles para el pronóstico y diseño de nuevas terapias dirigidas. Así mismo, se podrán determinar poblaciones que tengan mayor riesgo de padecer cáncer y crear programas de seguimiento y evaluación que permitan una detección temprana. Con esto mejorará la sobrevida de dichos grupos.
Referencias
1. Arancibia C. Secuencia de Pierre Robin. Neumol Pediatr 2006;1:34-36. [ Links ]
2. Perilongo G, Shafford E. Liver tumours. Eur J Cancer 1999;35:953-958. [ Links ]
3. Herrera JM, Krebs A, Harris P, Barriga F. Childhood tumors. Surg Clin North Am 2000;80:747-760. [ Links ]
4. DeBaun M, Tucker MA. Risk of cancer during the first four years of life in children from The Beckwith-Wie-dermann Syndrome Registry. J Pediatr 1998;132:398-400. [ Links ]
5. Linet S, Ries L, Smith MA, Tarone RE, Devesa SS. Cancer surveillance series: recent trends in childhood cancer incidence and mortality in the United States. J Natl Cancer Inst 1999;91:1051-1058. [ Links ]
6. Darbari A, Sabin KM, Shapiro CN, Schwarz KB. Epidemiology of primary hepatic malignancies in U.S. children. Hepatology 2003;38:560-566. [ Links ]
7. Garber JE, Li FP, Kingston JE, Krush AJ, Strong LC, Fine-gold MJ, et al. Hepatoblastoma and familial adenomatous polyposis. J Natl Cancer Inst 1988;80:1626-1628. [ Links ]
8. Dasouki M, Barr M Jr. Trisomy 18 and hepatic neoplasia. Am J Med Genet 1987;27:203-205. [ Links ]
9. Mamlok V, Nichols M, Lockhart L, Mamlok R. Trisomy 18 and hepatoblastoma. Am J Med Genet 1989;33:125-126. [ Links ]
10. Tomlinson GE, Douglass EC, Pollock BH, Finegold MJ, Schneider NR. Cytogenetic evaluation of a large series of hepatoblastomas: numerical abnormalities with recurring involving 1q12-21. Genes Chomosomes Cancer 2005;44:177-184. [ Links ]
11. Aggarwal S, Kumar A. Fetal hydrocolpos leading to Pierre Robin sequence: an unreported effect of oligohydramnios sequence. J Perinatol 2003;23:76-78. [ Links ]
12. Sheffeld LJ, Reiss JA, Strohm K, Gilding M. A genetic follow-up study of 64 patients with Pierre Robin complex. Am J Med Genet 1987;28:25-36. [ Links ]














