Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.67 no.5 México sep./oct. 2010
Artículo original
Efectividad del ácido ursodesoxicólico versus fenobarbital para el tratamiento de la colestasis en prematuros. Ensayo clínico cruzado
Efectiveness of ursodeoxycholic acid versus phenobarbital for the treatment of neonatal cholestasis: a cross-randomizad clinical trial
Silvia Romero Maldonado,1 Noemí Caritina Godínez Téllez,2 Gabino Yescas-Buendía,3 Luis Alberto Fernández-Carrocera,4 María Olga Leticia Echániz Avilés,3 Edna Rocely Reyna Ríos2
1 Jefe de Terapia Intermedia al Recién Nacido
2 Ex-Residente
3 Médico adscrito a Terapia Intermedia
4 Subdirector de Neonatología, Instituto Nacional de Perinatología, México D.F., México
Autor de correspondencia:
Dra. Silvia Romero Maldonado
Correo electrónico: silviarmzeta@yahoo.com.mx
Fecha de recepción: 08-12-2009.
Fecha de aceptación: 14-04-2010.
Resumen
Introducción. La prevalencia de colestasis neonatal varía del 7-57%. Parte del manejo incluye al ácido ursodesoxicólico (UDCA) y al fenobarbital, ambos con débil sustento en la literatura. El objetivo de este trabajo es comparar la efectividad del UDCA vs fenobarbital en la reducción de las cifras de bilirrubina directa, en recién nacidos prematuros con colestasis, con peso entre 1 000-2 000 g.
Métodos. Se realizó un ensayo clínico aleatorizado cruzado en 18 pacientes. Cada individuo recibió al azar una de las dos intervenciones: UDCA (10 mg/kg/día c/12 h) o fenobarbital (a 3 mg/kg/día c/24 h) durante un período inicial de 7 días. Después de 7 días de lavado, se les asignó el tratamiento contrario. En total se realizaron 36 tratamientos. Se midieron bilirrubinas y pruebas de función hepática al inicio y final de cada tratamiento.
El análisis se realizó por medio de medidas de tendencia central y de dispersión, de acuerdo al tipo de variable. Para la comprobación de hipótesis se realizó t pareada.
Resultados. En el grupo que recibió UDCA a 10 mg/kg/día c/12 h por 7 días, disminuyeron las cifras de bilirrubina directa en 2.7 mg/dL (P<0.01).
Conclusiones. Se recomienda el uso de UDCA a dosis de 10 mg/kg/día c/12 h por vía enteral como coadyuvante para el tratamiento de colestasis neonatal.
Palabras clave: colestasis neonatal, hiperbilirrubinemia directa, ácido ursodesoxicólico, fenobarbital.
Abstract
Background. The prevalence of neonatal cholestasis varies from 7–57%. Part of the treatment includes ursodeoxycholic acid (UDCA) and phenobarbital, both with little supporting evidence in the literature.
We undertook this study to compare the effectiveness of phenobarbital vs. UDCA in reducing the direct serum bilirubin levels in patients with cholestasis and weighing from 1 000 to 2 000 g.
Methods. Using a cross-randomized clinical trial, 18 patients were included with 36 treatments. Each subject randomly received one of the two interventions: UDCA (10 mg/kg/day) every 12 h or phenobarbital (3 mg/kg/day, every 24 h for 7 days) continuing with 7 days of wash-out to return to their initial state, and to subsequently receive the other treatment. At the beginning and at the end of the administration of each medication, bilirubin concentrations and hepatic test functions were measured. Central tendency and dispersion measurements were applied according to the type of variable. For hypothesis confirmation, paired t-test was carried out.
Results. The obtained results indicate that with UDCA at a dose of 10 mg/kg/day every 12 h for 7 days, serum bilirubin levels decreased to 2.7 mg/dL (p <0.01). Phenobarbital had no effect in reducing bilirubin concentration.
Conclusion. Use of UDCA is recommended at a dose of 10 mg/kg/dose every 12 h (PO) as a coadjuvant in the treatment of neonatal cholestasis.
Key words: cholestasis, direct hyperbilirubinemia, ursodeoxycholic acid, phenobarbital.
Introducción
La colestasis se define clínicamente como la presencia de bilirrubina directa mayor de 2 mg/dL durante los 3 primeros meses de vida.1,2 Fisiológicamente, es un proceso en el que existe una disminución del flujo biliar con depósito de pigmentos biliares en los hepatocitos y conductos biliares, lo que favorece el incremento sérico de bilirrubina directa.3 El hígado del recién nacido tiene la desventaja de que el volumen de ácidos biliares y la expresión de los transportadores hepatobiliares están disminuidos en comparación con niños mayores y adultos.4 Esta disfunción hepatocelular predispone a hemorragias, encefalopatía y síndrome hepatorrenal en algunos casos, mientras que el déficit de sales biliares puede dar lugar a déficit de vitaminas liposolubles, osteopenia, hipocalcemia (déficit de vitamina D), desnutrición, hemorragia (déficit de vitamina K), resistencia a la acción de la hormona del crecimiento y neuropatía periférica (déficit de vitamina E). También es importante mencionar que la retención de sales biliares produce prurito.2,5-7
La incidencia de colestasis oscila entre 7 y 57%, aunque la frecuencia de cada trastorno individual varía según raza y género. Las causas principales son: toxicidad por nutrición parenteral (NPT),8,9 hepatitis neonatal idiopática: 1/4 800-9 000; atresia de vías biliares extrahepáticas: 1/8 000-18 000; escasez de conductos biliares intrahepáticos: 1/70 000; déficit de 1-alfa-antitripsina con colestasis neonatal: 1/10 000-20 000; enfermedad de Byler: 1/50 000-100 000; y quiste de colédoco: 1/13 000-2 000 000.10
En el Instituto Nacional de Perinatología (INPer) se estimó el 21% de incidencia de colestasis en neonatos que recibieron NPT durante los primeros 7 días. Por otro lado, los que la recibieron por más de 15 días, 31%.11
El manejo de colestasis se puede dividir en tres categorías:
1) Tratamiento específico
2) Quirúrgico y
3) Tratamiento inespecífico y/o médico, el cual incluye el tratamiento con coleréticos, orientado a mejorar el flujo biliar y a prevenir o tratar secuelas como la desnutrición. La mayoría de los pacientes con colestasis se benefician de este tratamiento sea cual sea la enfermedad causal.8,9
El fenobarbital es un inductor de las enzimas microsomales hepáticas, y tiene una acción colerética al aumentar el flujo biliar, independientemente del tipo de las sales biliares.5 No se sabe si su capacidad para reducir el prurito se debe a su acción sobre el flujo biliar o a su efecto sedante. La dosis oral es de 3-5 mg/kg/día y los efectos secundarios principales, que limitan su uso en el paciente colestático, son la sedación y la alteración del metabolismo de la vitamina D. Gleghorn, en un estudio retrospectivo, concluyó que el fenobarbital no es útil para el tratamiento de colestasis; sin embargo, el diseño del estudio carece de rigor metodológico.12
En un estudio prospectivo, Blommer incluyó 15 pacientes con colestasis (sin incluir controles) y utilizó fenobarbital a dosis de 3-5 mg/kg/día. Concluyó que el fenobarbital disminuye las cifras de bilirrubina 2 mg/dL por semana y controla el prurito.13
En el 2004, en Oregon, Sridebi y Glenn sugieren en su revisión incluir fenobarbital para el tratamiento de la colestasis;14 sin embargo, en otra revisión del grupo de gastroenterología del Hospital Infantil de México Federico Gómez, se concluye que el fenobarbital no ha sido consistentemente utilizado para disminuir el prurito, sugiriendo que su uso debe ser limitado por su efecto sedante.
El UDCA tiene un efecto citoprotector y estabilizador de la membrana del hepatocito gracias al aumento de los ácidos biliares hidrofílicos que desplazan a los hidrofóbicos, que son hepatotóxicos; es también un inductor del flujo biliar y reduce la reabsorción intestinal de ácidos biliares, además de tener un efecto antipruriginoso.15 La dosis habitual en pacientes pediátricos es de 1015 mg/kg/día. Tiene escasos efectos secundarios, entre los que se mencionan nauseas, vómito, dolor abdominal, constipación, flatulencia y diarrea, siendo este último el más frecuente.
La bibliografía existente en relación al UCDA se basa en reportes enfocados a la población pediátrica y adulta;13-15 la bibliografía neonatal carece de rigor científico, ya que la mayoría de los reportes no cuenta con controles o estos son controles históricos.
El tratamiento con UDCA puede ser tolerado en lactantes y tener un efecto significativo en la disminución de niveles de bilirrubina directa.16 Los primeros reportes del uso de UDCA se realizaron en Japón, en 1957, como terapéutica para diferentes tipos de enfermedad hepática. Chen-Yi realizó un estudio retrospectivo: incluyó 30 pacientes, 12 tratados con UDCA y 18 controles; los pacientes que recibieron UDCA a dosis de 10 a 30 mg/kg/día, duraron menos días con colestasis (62.8 vs 92.4, 0.006).17
Spagnuolo realizó un estudio piloto en el que incluyó en total 7 pacientes, 4 niños y 3 niñas, a quienes administró UDCA, sin controles, y encontró que en todos desapareció la bilirrubina sérica después de 4 semanas.18
Al-Hathol realizó un estudio retrospectivo incluyendo 13 pacientes con diagnóstico de colestasis intratable secundaria a NPT. Utilizó el UDCA a dosis de 15-20 mg/kg/día, y encontró una reducción de la bilirrubina sérica con un valor de P ≤0.0001, así como de la enzima aminotransferasa. No re-porta efectos secundarios.19
La colestasis asociada a la NPT continúa siendo una de las complicaciones más comunes; de hecho, constituye un factor limitante en el uso de este recurso. Las complicaciones relacionadas con el catéter son las únicas que la exceden en frecuencia.20,21
Por tal motivo, nos planteamos la siguiente pregunta: ¿pueden el fenobarbital y el UDCA ser igualmente efectivos en el tratamiento de la colestasis neonatal asociada a NPT? Para responderla, tenemos como objetivo el de determinar la efectividad del fenobarbital y del UDCA para reducir la cifra de bilirrubina directa en prematuros de 1 000 a 2 000 g de peso al nacimiento, sometidos a NPT y que desarrollaron colestasis.
Métodos
En un hospital de tercer nivel de la Secretaría de Salud, durante el período comprendido del 1º de julio de 2004 al 31 de junio del 2005, se llevó a cabo un ensayo clínico, aleatorizado, con controles secuenciales, cruzado; se incluyeron todos los pacientes prematuros nacidos en la Institución que recibieron NPT al menos 2 semanas y que desarrollaron colestasis (cifras de bilirrubina directa ≥2 mg/dL), con peso de 1 000 a 2 000 g durante los primeros 15 días de vida, sin malformaciones congénitas mayores ni alteraciones cromosómicas, sin malformaciones de tubo digestivo, que estuvieran recibiendo por vía enteral ≥100 mL/kg/día de leche, con información y consentimiento firmado del familiar responsable. Se excluyeron los que cursaron con hemorragia intraventricular (HIV) grado III y IV, pacientes que desarrollaron crisis convulsivas. A todos se les realizó ultrasonido hepático, tamiz neonatal, titulaciones del complejo TORCH, para descartar alguna otra causa de colestasis. Se eliminaron los pacientes que cursaron con errores innatos del metabolismo. Todos los pacientes fueron manejados con NPT 24 h posterior a su nacimiento, de acuerdo a norma institucional: proteínas 3 g/kg/día (aminoácidos al 10%), glucosa 6 mg/kg/min, lípidos 1.5 g (lípidos al 20%), gluconato de calcio a 200 mg/kg/día, elementos traza 0.3 mL, multivitamínico 2 mL/ kg/día, magnesio 0.5 mg/kg/día.
El fenobarbital (presentación en tabletas) fue preparado por el servicio del hospital, a una concentración de 3 mg por cada 0.5 mL, así como el UDCA, preparado en sobres de 5 mg. Para monitorizar el fenobarbital, se tomaron concentraciones séricas a los pacientes a las 5 vidas medias de éste.
A todos se les determinó cada semana: bilirrubina sérica total y directa, fosfatasa alcalina, alanino-aminotransferasa, aspartato-aminotransfersa, y la γ-glutamil transpeptidasa. Se registraron, también, edad gestacional, peso, talla, días de ayuno, días de inicio y días de NPT, diagnósticos como sepsis, problemas neurológicos, digestivos, respiratorios, desórdenes metabólicos, problemas anatómicos, medicamentos tóxicos.
La definición se colestasis se consideró con un bilirrubina directa sérica de ≥2 mg/dL.
El análisis estadístico se realizó de la siguiente manera: para las variables cuantitativas continuas, promedio y desviación estándar; para las variables nominales, porcentajes y para las ordinales, mediana. Para la comprobación de hipótesis, t pareada.
El tamaño de la muestra se calculó con base a la fórmula de bioequivalencias y tomando en cuenta la referencia de Blommer,13 que encontró una disminución de bilirrubina de 2 mg/dL por semana.
N =(σ)2(Z∞+Zβ)2/d2
Donde N = es el tamaño de la muestra para cada grupo del tratamiento, σ= desviación estándar de la efectividad del tratamiento (0.45), Z∞ =1.64, Zβ =1.28, d= es la diferencia entre los efectos del tratamiento normales y nuevos que se considera clínicamente significativa =15% (2 x 0.15 =0.3).
Por lo tanto
N= (0.45)2(1.64+1.28)2/(0.3)2 =19.1 pacientes
El análisis se realizó en el Programa de SPSS versión 12.
De 22 pacientes que inicialmente cumplieron con el criterio de colestasis, se eliminaron cuatro en la primera fase del estudio: dos cuando estuvieron con el grupo de fenobarbital (uno por presentar crisis convulsivas y el otro fue dado de alta), y los otros dos cuando estuvieron con el tratamiento con UDCA (uno presentó crisis convulsivas y otro sepsis secundaria al catéter). El grupo quedó conformado por 18 pacientes (36 tratamientos), quienes recibieron ambos medicamentos en diferentes tiempos; en la primera intervención 10 pacientes recibieron fenobarbital y 8 pacientes UDCA. En la segunda intervención, los 10 pacientes que iniciaron con fenobarbital, recibieron después UDCA y los otros 8 fenobarbital. Se realizó la descripción y comparación de las características de los pacientes en ambos tiempos para evaluar las condiciones en que se encontraban al momento de estar recibiendo en tratamiento.
El tratamiento coadyuvante para todos los pacientes fue semejante, considerando que el INPer cuenta con normas institucionales. Una vez diagnosticada la colestasis, los pacientes se trataron con leche humana y/o hidrolizado de proteína, se administraron vitaminas liposolubles A, E, D y K, así como vitamina C. No hubo necesidad de modificar la NPT, considerando que al momento del ingreso al estudio, los pacientes estaban recibiendo un total de 100 mL/kg/día de vía enteral.
Resultados
El grupo quedó conformado por 18 pacientes (36 tratamientos). No hubo diferencia en cuanto a las características demográficas de los pacientes durante el periodo de estudio (Tabla 1).
El 95% de los pacientes nacieron por cesárea, el 80% de los pacientes cursaron con distress respiratorio de grado variable, el promedio de días de ventilación fue de 12.9 ± 6.3, el promedio de inicio de la NPT fue de 40 ± 8 h y el promedio de duración de ésta fue de 20.3 ± 8.7 días, el promedio de inicio de la vía enteral fue de 12.23 ± 1.2 días.
Uno de los pacientes de cada grupo de tratamiento cursó con sepsis, sin haber alguna diferencia estadística.
Los resultados obtenidos de la maniobra de tratamiento indican que el fenobarbital, a dosis de 3 mg/kg/día administrado cada 24 h por vía enteral durante una semana, no ejerció ningún efecto para reducir las cifras de bilirrubina di-recta; por el contrario, durante la primera fase de tratamiento mostró un leve incremento en las cifras de bilirrubina directa (Tabla 2). Al realizar el análisis con los 18 tratamientos y compararlo con el UDCA, se comprobó nuevamente la falta de efecto para reducir las cifras de bilirrubina.
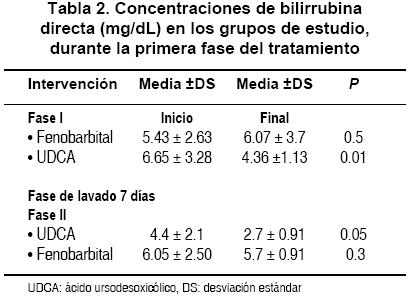
Las concentraciones séricas del fenobarbital fueron de 19 ± 7 mg/dL. Los pacientes no presentaron sedación ni otros efectos secundarios.
Con el UDCA, a dosis de 10 mg/kg/día, dividido en 2 dosis, administrados por vía enteral, se observó una reducción de las cifras séricas de bilirrubina, con una diferencia estadística significativa (P ≤0.01) (Tabla 3).

Tampoco se presentaron efectos secundarios con este medicamento.
Discusión
A nivel mundial, la incidencia acumulada y reportada de todos los procesos que causan colestasis oscila entre el 7 al 57%, aunque la frecuencia de cada trastorno individual varia según la raza y el género.
Los avances de la tecnología en las terapias neonatales llevan a utilizar de rutina la NPT. Sin embargo, el uso prolongado de ésta trae complicaciones, entre la cuales se encuentra la colestasis, que es considerada como la segunda causa más frecuente de las complicaciones de la NPT.22
Los resultados obtenidos en el presente trabajo indican que existe una reducción significativa en las cifras de bilirrubina utilizando el UDCA en comparación con fenobarbital, con una diferencia estadística significativa. Estos resultados concuerdan con otros reportes como el de Chen-Yi,19 y más recientemente el de Al-Hathlol, editado en febrero del 2006, en el que a pesar de que sus controles fueron históricos, reporta resultados satisfactorios sin reportar efectos secundarios.25 Otros reportes, a pesar de su tamaño de muestra pequeño, también concluyen que son tratamientos costo-beneficio favorable para su uso.23,24
Con respecto a las dosis utilizada del UDCA, no se conoce si hay un efecto dosis respuesta considerando que hay reportes en los que utilizan dosis de 15 a 20 mg/kg/día, o como el de Spagnuolo, quién utilizó dosis tan altas como 30 mg/kg/día sin reportar efectos secundarios en los siete pacientes tratados; la controversia es su tamaño de muestra y que no cuenta con controles.20
Con respecto a las enzimas hepáticas, el presente estudio no fue diseñado para analizar tal efecto; sin embargo, otros autores reportan mejoría en las enzimas hepáticas posterior a un periodo de 4 a 8 semanas de tratamiento.19,20 No encontramos estos resultados en el presente trabajo, ya que se pretendió demostrar el efecto temprano en la reducción de la bilirrubina directa, lo que se logró obtener con el UDCA y no así con el fenobarbital. Es importante mencionar que, una vez que concluyeron el tratamiento del protocolo, los pacientes continuaron con el su tratamiento convencional y ambos medicamentos, hasta obtener un resultado concluyente del proyecto.
En relación al fenobarbital, aunque se menciona aún como tratamiento para la colestasis,14 en los resultados del presente trabajo, a dosis de 3 mg/kg/día en una sola dosis por 7 días, no ejerció efecto alguno sobre la reducción de las cifras de bilirrubina directa, datos que concuerdan con lo reportado por Gleghorn y cols.12 Por consiguiente, no podemos sugerir la utilización de éste para reducir las cifras de bilirrubina directa. Sin embargo, queda la duda de si a dosis más elevadas pudiera ejercer algún efecto benéfico. Existe el reporte de Joseph,13 quien refiere haber utilizado dosis de 3-5 mg/kg/dosis y encontrado una reducción de los niveles de bilirrubina directa. De este mismo medicamento, no se reportaron cifras de intoxicación ni tampoco se presentó sedación en los pacientes.
Es importante mencionar que hay carencia de estudios con metodología adecuada de medicamentos coleréticos en la etapa neonatal, y los existentes están enfocados a población pediátrica o adulta.19 Por lo tanto, consideramos que el presente estudio representa un gran avance apoyado en la farmacología del medicamento, que ha sido estudiado por Williams, quien detalla los mecanismos de acción del UDCA, en los que destaca su efecto citoprotector por incorporación de la membrana celular.19 Esta terapéutica estabiliza y protege la misma, para el efecto colerético, y este provee el flujo biliar e induce excreción de ácidos biliares, favoreciendo además la reabsorción de ácidos biliares en la luz intestinal, disminuyendo la concentración intracelular de los ácidos biliares tóxicos.
En conclusión, el UDCA puede disminuir las cifras de bilirrubina directa a dosis de 10 mg/kg/día c/12 h, administrado por vía enteral por 7 días, en pacientes con colestasis neonatal secundaria a NPT. En el presente trabajo, el tamaño del efecto fue de 2.29 mg/dL. No se reportaron efectos secundarios, como vómito o estreñimiento, por lo que puede ser una alternativa segura para los pacientes con colestasis neonatal. Aun cuando no se incluyeron pacientes quirúrgicos, el UDCA puede ser útil para el tratamiento de la colestasis de estos pacientes, una vez que hayan iniciado la vía oral. El fenobarbital a dosis de 3 mg/kg/día administrado vía oral no tuvo efecto sobre la reducción de bilirrubina directa. Sin embargo, permanece la duda para saber si, a dosis más elevadas, puede ejercer algún efecto sobre la reducción de la bilirrubina, considerando que elevar la dosis puede tener el efecto secundario de sedación, lo que es su principal limitante.
Referencias
1. Peden VH, Witzleben CL, Skelton MA. Total parenteral nutrition. J Pediatr 1971;78:180-181. [ Links ]
2. Balistreri WF. Liver disease in infancy and childhood. En: Schiff ER, Sorrell MF, Madrey WC, eds. Schiff¨s Disease of the Liver. Philadelphia: Lippincott-Raven, 1999; pp. 1357-1512. [ Links ]
3. Worona-Dibner LB, García-Aranda JA. Colestasis neonatal. Bol Med Hosp Infant Mex 2003:60;334-348. [ Links ]
4. Karpen SJ. Update on the etiologies and management of neonatal cholestasis. Clin Perinatol 2002;29:159-180. [ Links ]
5. Suchy FJ. Approach to the infant with cholestasis. En: Suchy FJ, Sokol RJ, Balistreri WF, eds. Liver Disease in Children. Philadelphia, PA: Lippincott, Williams and Wilkins, 2001; pp.187-194. [ Links ]
6. Young TE. Manual de drogas neonatológicas. En: Neofax, Editorial Panamericana, 2002. [ Links ]
7. Bernstein J, Chang CH, Brough AJ, Heidelberger KP. Conjugated hyperbilirubinemia in infancy associated with parenteral alimentation. J Pediatr 1997;90:361-367. [ Links ]
8. Coger RH. Hepatic complications of parenteral nutrition. Semin Liver Dis 1983;3:216-224. [ Links ]
9. Moss RL, Das JB, Raffensperger JG. Total parenteral nutrition-associated cholestasis: clinical and histopathologic correlation. J Pediatr Surg 1993;28:12701274. [ Links ]
10. Manzanares L, Medina E. Colestasis en el recién nacido y lactante: orientación diagnóstica. Ann Pediatr 2003;58:162-167. [ Links ]
11. Romero-Maldonado S. Incidencia de colestasis neonatal asociada a nutrición parenteral total (Tesis). Instituto Nacional de Perinatología, México D.F., 2002. [ Links ]
12. Gleghorn EE, Merrit RJ, Subramanian N, Ramos A. Phenobarbital does not prevent total parenteral nutrition-associated cholestasis in noninfected neonates. J Parenter Enteral Nutr 1986;10.282-283. [ Links ]
13. Blommer JR, Boyer JL. Phenobarbital effects in cholestatic liver disease. Ann Int Med 1975;82:310-317. [ Links ]
14. Venigalla S, Gourley GR. Neonatal cholestasis. Semin Perinatol 2004:28:348-355. [ Links ]
15. Kapen S. Update on the etiologies and management of neonatal support in patients with chronic cholestasis disease. Ann Pediatr 2003;58:174-180. [ Links ]
16. Pegev RH. Tratamiento de colestasis neonatal en el síndrome de Dubin Johnson. Rev Esp 2004;96:60-73. [ Links ]
17. Chen-Yi C, Po-nen T, Huey-Ling C, Hung-Chen C, Wu-Shun H, Mei-Hwei C. Ursodeoxycholic acid (UDCA) therapy in very low birth weight infants with parenteral nutrition associated cholestasis. J Pediatr 2004;145:317-321. [ Links ]
18. Spagnuolo MI, Iorio R, Vegnete A, Guarino A. Ursodeoxycholic acid for treatment of cholestasis in children on long-term total parenteral nutrition: a pilot study. Gastroenterology 1996;111:716-719. [ Links ]
19. Al-Hathlol K, Al-Madani A, Al-Saif S, Abulaimoun B, Al-Tawil K, El-Demerdash A. Ursodeoxycholic acid therapy for intractable total parenteral nutrition-associated cholestasis in surgical very low birth weight infants. Singapore Med J 2006;47:147-151. [ Links ]
20. Rodgers BM, Hollenbeck JI, Bonnelly WH, Talbert JL. Intrahepatic cholestasis with parenteral alimentation. Am J Surg 1976;13:14-55. [ Links ]
21. Pereira GR, Sherman MS, DiGiacomo J, Ziegler M, Roth K, Jacobowski D. Hyperalimentation-induced cholestasis and severity in premature infants. Am J Dis Child 1981;135:842-845. [ Links ]
22. Benjamin DR. Hepatobiliary disfunction in infants and children associated with long-term total parenteral nutrition. A clinicopathologic study. Am J Clin Pathol 1981;76:276-283. [ Links ]
23. Scher H, Bishop WP, McCray PB. Ursodeoxycholic acid improves cholestasis in infants with cystic fibrosis. Ann Pharmacother 1997;31:1003-1005. [ Links ]
24. Pasha T, Heathcote J, Gabriel S, Cauch Dudek K, Jorgensen R, Therneau T, et al. Cost effectiveness of ursodeoxycholic acid therapy in primary biliary cirrhosis. Hepatology 1999;29:21-26. [ Links ]














