Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Boletín médico del Hospital Infantil de México
versão impressa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.67 no.2 México Mar./Abr. 2010
Tema pediátrico
Enfermedad de Lyme. Experiencia en niños mexicanos
Lyme disease. Experience in Mexican children
Ma. Guadalupe Gordillo Pérez1, Fortino Solórzano Santos2
1 Unidad de Investigación en Enfermedades Infecciosas y Parasitarias
2 Dirección Médica, Hospital de Pediatría, Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social, México D.F., México
Autor de correspondencia:
Dr. Fortino Solórzano Santos
Correo electrónico: solorzanof@terra.com.mx
Fecha de recepción: 19-01-10.
Fecha de aceptación: 21-01-10.
Resumen
La Enfermedad de Lyme o borreliosis de Lyme es una enfermedad infecciosa emergente causada por la bacteria Borrelia burgdorferi sensu lato, la cual es transmitida por la mordedura de garrapatas del género Ixodes. En esta revisión se presentan los aspectos generales de la enfermedad como los agentes etiológicos, las formas clínicas de manifestarse, los métodos de diagnóstico que se recomiendan para establecer con mayor certeza la etiología y se resume la experiencia acumulada durante 10 años en cuanto a las características clínico-epidemiológicas, serológicas y de identificación etiológica de niños atendidos en dos centros pediátricos del Distrito Federal.
Palabras clave: Borrelia burgdorferi, eritema migrans, borreliosis de Lyme, neuroborreliosis.
Abstract
Lyme disease or Lyme borreliosis is an emerging infectious disease produced by Borrelia burgdorferi sensu lato, which is a bacteria transmitted to the host organism by the bite of Ixodes ticks. In this report we present the general knowledge about the etiological agent, clinical manifestations of the disease and diagnostic laboratory tests. We offer cumulative information about Lyme disease in Mexican children treated at two children's hospitals in Mexico City during the last 10 years.
Key words: Borrelia burgdorferi, Erythema migrans, Lyme borreliosis, Neuroborreliosis.
Introducción
La Enfermedad de Lyme o borreliosis de Lyme es una enfermedad infecciosa emergente transmitida por garrapatas, muy importante en Norteamérica y Europa por el número de casos y el efecto debilitante que ocasiona como padecimiento crónico en humanos. El agente causal es Borrelia burgdorferi sensu lato, el cual es transmitido por la mordedura de garrapatas del género Ixodes.1 El riesgo de borreliosis de Lyme está directamente relacionado con la prevalencia de garrapatas y de los reservorios infectados, así como con la exposición del hombre en zonas endémicas.2
La borreliosis de Lyme está distribuida en la mayoría de los países europeos, algunos países de Asia y tres zonas enzoóticas de Estados Unidos de América (EUA) (Costa Noreste, Minnesota y California).1,3 En Australia y Sudamérica (Chile y Brasil) se ha reportado una enfermedad similar a borreliosis de Lyme sin que se haya aislado B. burgdorferi de garrapatas, de fauna o de pacientes.4,5
En Europa, la infección es endémica. La prevalencia de ésta en trabajadores forestales, en Alemania y Suecia, es del 8 a 27%, y en la población general de 4%.6,7 En EUA la enfermedad se considera confinada a tres áreas enzoóticas (Costa Noreste, Oeste medio y California) donde la prevalencia de infección varía de 1 a 10%, aunque se ha diseminado a nuevas áreas.1
En 2002 la incidencia de la enfermedad en EUA fue de 8.2 casos por 100 000 habitantes. En los estados de Connecticut, Minnesota y Nueva Jersey, la incidencia es más alta, con 100 casos por 100 000 habitantes, mientras que en California la incidencia es menor.8
Epidemiología en México
Desde 1991 se reportaron los primeros casos sugestivos de eritema crónico migratorio en Sinaloa y Monterrey.9 En 1999, nuestro grupo reporta la Encuesta Seroepidemiológica Nacional donde se detectó una prevalencia de infección por B. burgdorferi del 1.1% en la población general y en el venado cola blanca del Noreste del país, con una frecuencia del 3%.10,11 El mismo año fueron descritos los primeros casos de pacientes con manifestaciones neurológicas en el Valle de México.12,13 En el 2003, reportamos la seroprevalencia de la infección por B. burgdorferi en la población general del Noreste de la República Mexicana y de la Ciudad de México, en 6.3 y 3.4% respectivamente.14 En el 2007 se reportaron los primeros casos confirmados en el país de enfermedad cutánea y neurológica, procedentes del Valle de México y Quintana Roo.15,16
Cuadro clínico
La enfermedad es un desorden multisistémico que involucra principalmente la piel, el sistema nervioso, el corazón y las articulaciones.1,17
La tercera parte de casos ocurre en niños menores de 18 años y el grupo de mayor riesgo es el de niños de 5 a 14 años.
La borreliosis de Lyme en humanos tiene un espectro amplio. Se puede presentar desde una infección asintomática hasta manifestaciones clínicas multisistémicas. Esta diversidad clínica está asociada con la heterogeneidad genética y antigénica de las especies de B. burgdorferi sensu lato. La artritis y el eritema crónico migrans (ECM) que ocurren en el 80% de los casos en EUA, se asocian a B. burgdorferi sensu stricto, única especie presente en este país, mientras que la neuroborreliosis se asocia a B. garinii (65%); la acrodermatitis crónica atrófica (ACA), el linfocitoma cutáneo y el escleroderma se asocian a B. afzelii; la parálisis facial y el ECM se asocian con B. valaisiana y B. spielmanii. Todas estas especies predominan en Europa.
La enfermedad se ha dividido en 2 estadios de evolución: 1,17
A) Estadio temprano localizado
B) Estadio temprano diseminado
C) Estadio crónico
A) Estadio temprano localizado. Se manifiesta como eritema migratorio (eritema migrans) (EM). Se presenta en 60 a 80% de los casos como signo inicial. Es una lesión generalmente única, eritematosa, homogénea o circular, papular, no dolorosa, con diseminación centrífuga. Se desarrolla en 3 días a 16 semanas (promedio 1.5 semanas) después de la mordedura de la garrapata y se resuelve espontáneamente en 3 a 6 semanas.17 En niños, se localiza en la cabeza, piernas, brazos y espalda. Se acompaña de fatiga y cefalea en el 50-60% de los casos, además de fiebre y artralgias en 30%. Las lesiones de EM múltiple son más pequeñas y se desarrollan cuando el paciente no recibió tratamiento.
B) Estadio temprano diseminado. Después del EM, si no se da tratamiento, en 3 a 12 semanas se presenta afección de varios órganos o sistemas, probablemente por diseminación hematógena, con manifestaciones neurológicas y/o cardiacas.17,18
Neuroborreliosis de Lyme. Inicia en la tercera semana posterior a la mordedura de la garrapata. Se presenta en 20% de casos con borreliosis de Lyme en EUA, comparado con 40% en Europa.18 En niños, la manifestación neurológica más común es la parálisis del nervio facial, parálisis del sexto par craneal y la meningitis linfocítica; las neuropatías periféricas, radiculopatías y el Síndrome de Bannwarth son raras.
Neuropatía craneal. Principalmente parálisis periférica del nervio facial (VII par craneal); es la manifestación neurológica más común en EUA; se presenta en 25 a 50% de casos con neuroborreliosis de Lyme. Puede ser bilateral y ocasionalmente se acompaña de parálisis del III, IV, V y VI pares craneales o como mononeuritis múltiple.18,19
En niños, la frecuencia de parálisis facial idiopática por infección de B. burgdorferi es del 1%.19-21
Meningoradiculoneuritis. La meningitis se manifiesta por meningismo leve y cefalea intermitente; puede asociarse neuritis craneal y radiculopatía (Síndrome de Garin-Boujadoux-Bannwarth). En líquido cefalorraquídeo (LCR), se encuentra pleocitosis (10 a 316 células/mm3) con más del 70% de linfocitos, proteínas elevadas y glucosa normal.20 Frecuentemente se acompaña de parálisis de los nervios craneales VI y VII, papiledema, aumento de la presión intracraneal o EM. El pronóstico es bueno; se recupera el 95% de los niños tratados con antibiótico.
Radiculoneuropatía. Es rara en niños: inicia de forma aguda con dolor radicular intenso localizado y/o debilidad motora con o sin pérdida sensitiva. La pérdida sensitiva y el déficit neurológico pueden ser multifocales y asimétricos; pueden presentarse como Síndrome de Garin-Boujadoux-Bannwarth. Es más común en Europa.18,19
Neuropatía periférica (neuropatía axonal crónica). Se presentan parestesias, dolor radicular poco común y déficit sensitivo, aunque es raro; la fuerza muscular y los reflejos tendinosos están conservados. Generalmente no hay meningitis o neuritis craneal. Los anticuerpos en suero contra B. burgdorferi son positivos. La electromiografía muestra neuropatía axonal leve, LCR normal sin anticuerpos intratecales; la biopsia del nervio sural muestra pérdida axonal distal e infiltrado perivascular sin depósitos de complejos inmunes: No se observa B. burgdorferi en el nervio.18,19
Manifestaciones cardiacas. Se presentan en menos de 1% en adultos y en 0.5% de la población pediátrica infectada.1,22 Inicia en la segunda a tercera semana después de la infección con palpitaciones, disnea, dolor torácico o síncope secundario a un bloqueo atrioventricular de segundo y tercer grado, miopericarditis con derrame que es raro, y/ o falla cardiaca comúnmente transitoria, que se autolimita en 10 días.22
Linfocitoma borrelial. Inicia de 6 a 180 días (en promedio 30 días) después de la mordedura por garrapata. Es una presentación rara de borreliosis de Lyme; su frecuencia es de 1.1% a 3% en Europa, y en EUA sólo hay un caso reportado. La edad promedio de presentación es de 23 años (rango 2–72 años); 44% de los casos son niños menores de 15 años. Es una lesión cutánea nodular de color rojo-violáceo, de 0.5 a 2.5 cm de diámetro, que se localiza con mayor frecuencia en el lóbulo de la oreja y la areola mamaria, y en algunos casos en cara y brazos.23 En 25% de los casos aparece al mismo tiempo que el EM. El linfocitoma borrelial no tratado puede persistir por muchos meses. Histológicamente, se caracteriza por un infiltrado linfocítico policlonal denso en la dermis y/o tejido subcutáneo, algunas veces con centros germinativos.24
Alteraciones oculares. La conjuntivitis se ha observado en menos de 5% de los pacientes con EM; además la afectación directa del ojo (uveítis, queratitis, coroiditis, panoftalmitis y neuritis óptica) ha sido asociada con el aislamiento de B. burgdorferi en cultivo.22
C) Estadio crónico. Inicia de 2 semanas a 2 años (en promedio 6 meses) después de la infección. El 60% de niños con EM u otra manifestación de la enfermedad que no son tratados, presentan artritis crónica; la encefalomielitis y acrodermatitis crónica atrófica (ACA) son otras formas poco frecuentes.17,23
Artritis. Son brotes de artritis que afectan una articulación grande. En el 90% de niños es la rodilla y en el 10% puede ser la cadera, el tobillo, el codo y/o la muñeca. Se acompaña de fiebre en el 50% de pacientes pediátricos comparado con sólo 25% en adultos. Los episodios de artritis recurrente se presentan en 50% de los niños y pueden afectar la misma articulación o diferentes. Los leucocitos en sangre periférica son normales, pero la velocidad de sedimentación globular está aumentada a más de 20 mm/h en el 75%. El líquido sinovial muestra en promedio 38 000 células/mm3 con predominio de neutrófilos en el 75%. Todos los niños con artritis tienen una serología para Borrelia burgdorferi marcadamente positiva. El pronóstico a 4 años es bueno en el 80% de los casos; sin embargo, pueden asociarse lesiones inflamatorias en ojos, incluyendo panoftalmitis, atrofia óptica isquémica o queratitis intersticial. El 10% de niños presenta dolor musculoesquelético crónico y el 3% de los casos requiere de sinovectomía por persistencia de la artritis.25
La artritis es migratoria, monoarticular u oligoarticular, asimétrica, dura en promedio 3 meses (3 días a 11.5 meses). La rodilla es afectada en algún momento de la evolución en la mayoría de los pacientes, pero otras articulaciones grandes pueden afectarse. La articulación temporomandibular se afecta en 11% de los casos. En el líquido sinovial se elevan moderadamente las proteínas y los leucocitos, en promedio 24 250 células/mm3 con predominio de polimorfonucleares; la glucosa es normal. También puede presentarse miositis con linfadenopatía regional o generalizada.17,22
Encefalomielitis. Es una enfermedad inflamatoria unifocal o multifocal, la cual es lentamente progresiva y afecta la sustancia blanca más que la gris. Se detectan anticuerpos séricos e intratecales contra B. burgdorferi; en LCR pueden presentarse pleocitosis, hiperproteinorraquia, o PCR positivo. La resonancia magnética es inespecífica y puede sugerir enfermedad de sustancia blanca. Es una manifestación rara.19,21
Acrodermatitis crónica atrófica (ACA). Es una lesión atrófica de la piel, se presenta de 6 meses a años después de que ocurre la mordedura de la garrapata en el mismo sitio. La ACA y el linfocitoma borrelial están bien documentados en pacientes europeos con borreliosis de Lyme; sin embargo, en EUA son casos raros, y se asocian más con infección por B. afzelii.23
Esclerodermia. B. burgdorferi ha sido implicada en el desarrollo de algunas formas de esclerodermia localizada y líquen escleroatrófico (LEA). La primera se clasifica por la forma y zona afectada en esclerodermia lineal (en golpe de sable o en extremidades), segmentaria (atrofia hemifacial) y en placas (mórfea). La etiología de la esclerodermia era considerada desconocida; sin embargo, estudios histológicos muestran características similares a las encontradas en ACA; se ha demostrado la presencia de la bacteria en estudios histológicos y ensayos de PCR, así como respuesta serológica, aunque los resultados han sido contradictorios en pacientes de EUA y Europa. Recientemente esta patología ha sido asociada con infección por una especie particular, B. afzelii.23
En Europa existe una mayor diversidad clínica de la enfermedad asociada a la presencia de diferentes especies. La neuroborreliosis es más frecuente, especialmente en niños, y se asocia a las especies B. garinii y B. valaisiana. Comparativamente, en EUA la artritis es la manifestación clínica más frecuente y se asocia con B. burgdorferi sensu stricto.26
Borrelia burgdorferi sensu lato
Estudios filogenéticos indican que el género Borrelia pertenece a la familia Spirochaetaceae, del orden Spirochaetales.1,27
El género Borrelia está formado por más de 20 especies. Estas especies de Borrelia se han clasificado en dos categorías mayores en base a sus características ecológicas y genéticas.27 La Borrelia de la fiebre recurrente y el complejo Borrelia burgdorferi sensu lato, formado por 13 genoespecies, 5 de las cuales son patógenas para el hombre y producen la borreliosis de Lyme.
Es un microorganismo móvil de forma helicoidal, que mide 5 a 25 µm de largo y 0.2 a 0.5 µm de ancho, y está cubierto por una membrana celular externa. Tiene 7-11 flagelos estructuralmente iguales que los de otras bacterias. Es microaerofílico y se diferencia de otras bacterias y espiroquetas por su estructura genómica conformada por un cromosoma lineal y numerosos plásmidos lineales y circulares. Es susceptible a los antibióticos β-lactámicos, tetraciclinas, cloranfenicol y eritromicina; y resistente a metronidazol, rifampicina, sulfonamidas y 5-fluoracilo1,27
B. burgdorferi tiene 6 proteínas mayores de superficie: la Osp A, B, C, D, E y F. La primera usada para desarrollo de vacunas. OspC es una proteína de 20-25 kDa que varía entre especies y es útil para diagnóstico serológico como antígeno seroreactivo durante el estadio temprano de la enfermedad.28
Métodos de diagnóstico
El diagnóstico de la enfermedad se basa en estudios microbiológicos, serológicos y de biología molecular.27,29,30 El cultivo es problemático por el bajo porcentaje de aislamiento; por esta razón, las técnicas serológicas han sido incluidas como criterios de diagnóstico y, en algunos casos, es útil la PCR.29,30
Microbiológico. El cultivo de B. burgdorferi sensu lato de especímenes clínicos es útil en biopsias de piel o de lavado cutáneo de lesiones de EM y sangre de pacientes con enfermedad temprana diseminada. En lesiones primarias de EM, la sensibilidad del cultivo es de 50% y puede aumentar a 85% en lesiones de EM secundarias; además, ha sido reportado de 48% en sangre o plasma de pacientes con enfermedad de Lyme temprana.27 El aislamiento de B. burgdorferi de otros sitios, tales como LCR y líquido sinovial, es raro; la tasa de recuperación baja, refleja el pequeño número de organismos viables presentes en estos sitios anatómicos.
Histopatología. Este método se aplica a biopsias de lesiones de EM y linfocitoma cutáneo. En este estudio de la dermis superficial y profunda se observa edema, depósitos de mucina y un infiltrado perivascular de macrófagos, linfocitos y, en ocasiones, células plasmáticas. Estos hallazgos no son específicos para borreliosis de Lyme, por lo que se han usado tinciones de plata para localizar organismos espirales en piel y otros tejidos (Warthin-Starry, Dieterle modificado, o tinción de Steiner modificado), Fas o inmunoperoxidasa. Es un estudio difícil de interpretar, por lo que el uso de estas metodologías se limita a la investigación y a situaciones clínicas específicas.27
Serología. Existe dificultad para interpretar estudios de ELISA (inmunoensayo enzimático) e IFA (inmunofluorescencia) en biopsias de piel con anticuerpos inmunofluorescentes contra B. burgdorferi.29 El resultado depende del estadio clínico de la enfermedad y su interpretación es complicada por la reactividad cruzada con otras espiroquetas como Treponemas y Borrelia spp., enfermedades autoinmunes, mononucleosis infecciosa y fiebre de las montañas rocallosas.28,29 Esto debido a que:
a) Hay variabilidad de la respuesta inmune en diferentes pacientes.29
b) El tratamiento antibiótico temprano puede abortar una respuesta inmune y dar resultados falsos negativos.29
c) Hay variabilidad de genoespecies y cepas de B. burgdorferi a nivel mundial.28,29,31
Para estudiar resultados de casos dudosos se realizan estudios de VDRL o RPR (rapid reagin card), para los que B. burgdorferi no es reactiva. Para incrementar la especificidad del serodiagnóstico, se han usado antígenos purificados o fracciones antigénicas recombinantes de B. burgdorferi para ELISA y Western-blot como: proteína de 39-kDa y 83-kDa, flagelina, OspA, OspB, OspC, OspE, OspF, p22, BBK32 y V1sE.
Recientemente un antígeno para ELISA y WB con proteína recombinante de 3 especies de B. burgdorferi sensu lato comunes en Europa: B. burgdorferi sensu stricto, B. garinii y B. afzelii, reporta en pacientes con neuroborreliosis, artritis de Lyme y EM una sensibilidad del 100, 93 y 90% respectivamente. La mayoría de los sueros reaccionaron sólo a una especie.31,32
Para confirmar un caso positivo después de ELISA con antígeno completo se debe realizar inmunotransferencia (Western-blot) que incrementa la especificidad más de 95%.28,31,32 Este es el criterio diagnóstico actualmente aceptado.26
Biología molecular. La introducción de técnicas de biología molecular en borreliosis de Lyme tiene un papel definido en los casos con manifestaciones de neuroborreliosis temprana con serología negativa, en borreliosis ocular o en recién nacidos de madres que presentaron enfermedad de Lyme activa durante su embarazo, así como en casos de diagnóstico difícil como infecciones coexistentes con Babesia y Erlichia.30,33
La PCR puede ser tres veces más sensible que el cultivo en estadio temprano de borreliosis de Lyme y podría ser un indicador de enfermedad diseminada. En biopsias de piel de pacientes con EM se logra aumentar la sensibilidad hasta 75%, con una especificidad del 97%, amplificando el gen ospA. En pacientes con manifestaciones tardías, como acrodermatitis crónica atrófica (ACA), la PCR tiene una sensibilidad del 57% comparada con el cultivo, donde la sensibilidad es de 19% y especificidad de 100%. En pacientes con artritis, se ha logrado cultivar la bacteria en líquido sinovial sólo en un caso, por lo que la PCR es de elección para la confirmación del diagnóstico con una sensibilidad del 88% y con especificidad de 100%, amplificando los genes flagelar y ospA.32,34
La PCR además se ha utilizado para detectar la bacteria en el vector por su poder para identificar este microorganismo difícil de cultivar; además, puede detectar la bacteria muerta en muestras conservadas en parafina y especímenes de colección.33
Métodos de tipificación fenotípica
En B. burgdorferi sensu lato se han usado los mismos sistemas de tipificación fenotípica que para otras especies de bacterias, como la biotipificación, tipificación de fagos y análisis de susceptibilidad a los antibióticos; sin embargo, no son factibles por el bajo crecimiento bacteriano. Por lo tanto se ha utilizado el análisis mediante electroforesis de proteínas SDS-PAGE y el perfil de ácidos grasos, pero las conclusiones basadas en estos métodos no son exactas.33
1. Serotipificación. La serotipificación es el método fenotípico más común para la tipificación de B. burgdorferi sensu lato y está basada en reactividad a diferentes anticuerpos monoclonales específicos contra OspA y OspC. La serotipificación con OspA logra definir 8 serotipos diferentes al estudiar 112 cepas aisladas de humanos y garrapatas de Europa, Norteamérica y Japón.34,35 Los serotipos 1, 2 y J11 corresponden a B. burgdorferi sensu stricto, B. afzelii, y B. japonica, respectivamente, y los serotipos 3 a 8 corresponden a B. garinii. El serotipo 2 se ha encontrado en más de 50% de pacientes con borreliosis de Lyme y el serotipo 4 ha sido detectado en LCR de pacientes con neuroborreliosis. En contraste, en más de 50% de los aislados de garrapata se detecta el serotipo 6.34 Con OspC se han definido 16 serotipos diferentes para aislados europeos y norteamericanos. De estos, 6 corresponden a B. burgdorferi sensu stricto, y 4 serotipos a B. afzelii, el resto no se han identificado. Al comparar los serotipos OspA y OspC de B. burgdorferi sensu lato se observa mayor heterogeneidad con OspC.35
2. Electroforesis enzimática multilocus (MLEE). Este método se basa en la tipificación de proteínas con el patrón electroforético y consiste en diferenciar la movilidad electroforética de enzimas metabólicas de cada cepa bacteriana.35
Métodos de tipificación genotípica
Los métodos de tipificación molecular basados en las características genéticas del microorganismo aportan información más precisa en la diversidad patogénica de la bacteria. El estudio de esta diversidad genética en Borrelia tiene implicaciones epidemiológicas, clínicas y de diagnóstico.35
Para estudiar la diversidad genética de cepas de B. burgdorferi sensu lato se han usado los siguientes métodos:
1. Análisis de hibridación DNA-DNA. Es uno de los mejores procedimientos para estudiar la relación taxonómica en Borrelia. Con este método, las cepas de Borrelia spp. que causan fiebre recurrente tienen un nivel de homología del 30 a 44% con Borrelia burgdorferi. Entre diferentes subespecies de B. burgdorferi sensu lato el nivel de homología es de 48 a 70%. La hibridación de DNA-DNA es reconocida actualmente como el método de referencia para la delineación hasta subespecie de B. burgdorferi sensu lato.35-37
Basados en este método, B. burgdorferi sensu lato se ha subdividido en 5 subespecies: B. burgdorferi sensu stricto, B. garinii, B. afzelii, B. japonica y B. andersoni.37
Recientemente se han descrito 6 especies: B. valaisiana, B. spielmanii y B. lusitaniae en Europa; el grupo americano incluye a B. bisettii 38,39 y en Asia, B. turdae y B. tanuki.40 Actualmente son reconocidas 11 subespecies de B. burgdorferi sensu lato, pero sólo 5 se reconocen como patógenas para el hombre.
2. Reacción en cadena de la polimerasa (PCR). Es un método molecular de subtipificación de DNA, con la ventaja de ser fácil, rápido y se requieren pocas células del microorganismo. Se utiliza para la tipificación de cepas e identificación de especie tanto en muestras clínicas como en el vector. Los genes más comunes para la amplificación y la secuenciación son el gen fla (flagelar) y ospA (proteína de membrana externa). Para el gen fla se han diseñado iniciadores para amplificar la región conservada, así como un fragmento interno del gen para amplificar la región central variable e identificar entre genoespecies.41-42 El gen ospA se localiza en un plásmido de 49 kb de B. burgdorferi denominado Ip54; se han diseñado iniciadores para la amplificación en muestras clínicas y el vector, mismos que han mostrado ser altamente específicos.33,41,42
3. PCR en tiempo-real. Recientemente se han propuesto nuevos métodos de PCR. Esta técnica, además de detectar la espiroqueta, puede cuantificarla en muestras clínicas y en el vector. Adicionalmente se logra tipificar a B. burgdorferi basados en la temperatura de fusión (Tm).
En los estudios realizados en DNA de piel de humanos y en el vector (Ixodes ricinus), los resultados de la Tm de B. garinii son de 2 °C debajo de B. burgdorferi sensu stricto y B. afzelii; por lo tanto se considera como una rápida alternativa de identificación y detección de las genoespecies de B. burgdorferi sensu lato.42
4. Secuenciación. Es un método de tipificación molecular de ácidos nucleicos, el cual compara directamente secuencias de DNA obtenido de cepas bacterianas o muestras clínicas y del vector. Es el mejor método cuantitativo para determinar la similitud o diferencias entre 2 cepas. Permite analizar segmentos cortos de la secuencia de bases del DNA.
Los genes secuenciados de B. burgdorferi son el gen fla (flagelar) y ospA además de el espacio intergénico entre los genes ribosomales 5S y 23S.
Su diversidad se ha aprovechado para tipificar cepas, documentando los diferentes fragmentos originados por enzimas de restricción (RFLP-PCR), basado en la organización única de B. burgdorferi.33,42,43
Algunos autores sugieren que este método podría ser utilizado para estudios de epidemiología molecular.43
Otros métodos son aplicables para estudio de cepas a nivel de especie y entre cepas de la misma especie, sin embargo, han sido poco utilizados en la identificación del complejo Borrelia burgdorferi, por la dificultad en el aislamiento de la bacteria. Estos incluyen la ribotipificación, la electroforesis en gel por campos pulsados (PEGC), la amplificación aleatoria de DNA polimórfico (RAPD-PCR) y el fingerprinting de plásmidos.33,43-48 Este último método compara cepas del complejo B. burgdorferi y Borrelia recurrente.
Borreliosis de Lyme en niños mexicanos
La borreliosis de Lyme representa más del 90% de las infecciones transmitidas por garrapata en los EUA y Europa.9 Existen evidencias de la heterogeneidad genética de las cepas de B. burgdorferi a nivel mundial, lo que muestra el alto grado de migración en la naturaleza de los agentes de la borreliosis de Lyme; así mismo, presenta un gran polimorfismo clínico relacionado con la diversidad genética de la bacteria.
En México, los vectores transmisores de la enfermedad están distribuidos desde Baja California, costa del pacífico, la zona noreste, costas del Golfo de México y la Península de Yucatán.6 En 1999, nuestro grupo reportó la infección por Borrelia burgdorferi en población de varios estados de la República Mexicana. Posteriormente detectamos la zona noreste y el Distrito Federal como áreas con alta prevalencia. Recientemente confirmamos la presencia de casos clínicos de la enfermedad de Lyme adquirida en zonas forestales cercanas a la Ciudad de México.5
Nuestro grupo de investigación ha mantenido un sistema de vigilancia para la identificación de casos de enfermedad en niños, a partir de marzo de 1999, atendidos en el Hospital de Pediatría, CMN SXXI, IMSS y del Hospital Infantil de México Federico Gómez.
Para su inclusión se han utilizado los criterios clínicos, histológicos y de inmunodiagnóstico propuestos por CDC: la presencia de EM o una manifestación crónica, y estudios de ELISA y Western-Blot positivo. Dentro de la información solicitada se registra la visita a zonas boscosas y/o la exposición a mordedura de garrapatas. A los pacientes sospechosos se les tomaron muestras de sangre para obtener suero y en los pacientes con manifestaciones neurológicas se les realizó punción lumbar para obtener LCR. Se midieron los anticuerpos IgM e IgG por ELISA y se confirmó con WB contra 3 especies de B. burgdorferi sensu lato (B. burgdorferi ss, B. afzelii y B. garinii).
La genotipificación se realizó con 3 métodos moleculares aplicados al DNA obtenido de muestras clínicas de biopsias de piel, LCR y líquido sinovial de casos seropositivos.
1) El Southern-blot (SB) se realizó con oligonucleótidos específicos del gen flagelar para las 3 especies patógenas más importantes del complejo Borrelia burgdorferi sensu lato: B. burgdorferi ss, B. garinii y B. afzelii.
2) La PCR en tiempo real. Se diseñó un iniciador para amplificar un fragmento de 230 pb del gen flagelar de B. burgdorferi y sondas con alta especificidad para cada una de las 11 genoespecies del complejo B. burgdorferi sensu lato. Se utilizó el Lightcycler 2000 ROCHE con la tecnología TaqMan o las sondas de doble hibridación y química LNA.
3) La secuenciación. Se realizó para los genes flagelar y ospA de B. burgdorferi sensu lato, utilizando el secuenciador capilar Beckman (Fullerton, CA, USA).
Hasta el momento se han estudiado 72 niños con edad promedio de 8 ± 2 años de edad. El 55% de los pacientes (40) presentaron manifestaciones cutáneas, 27% (19) tuvieron manifestaciones neurológicas, y 18% (13) presentaron artritis. En 23 niños, el estudio de ELISA fue positivo, pero se confirmó la enfermedad de Lyme con Western-blot en 20 (28%) (Tabla 1).
En el resto de niños se confirmaron los siguientes diagnósticos: eritema polimorfo asociado a medicamentos, granuloma anular, esclerodermia sistémica, esclerodermia localizada con anticuerpos antinucleares positivos, neuropatía craneal por virus del grupo herpes, síndrome de Guillain-Barré, leucemia, artritis reumatoide juvenil y artritis reactiva.
De los 20 niños que tuvieron resultado positivo, en 7 (34%) fue claro el antecedente de picadura de un insecto no volador y en 3 de estos se identificó una garrapata. La exposición a los animales domésticos y silvestres (potenciales hospederos de garrapata) ocurrió en 12 pacientes que visitaron o habitaban zonas boscosas o rurales del Estado de México, Morelos, Hidalgo y Tabasco. De los 20 pacientes, 75% presentaron manifestaciones tempranas y 25% manifestaciones tardías (Tabla 2).
Las manifestaciones tempranas se presentaron en 15 niños que tenían en promedio 28 días de evolución. La forma más frecuente fue el linfocitoma cutáneo en 3 casos y un caso de eritema migrans. De las manifestaciones neurológicas se encontraron 7 casos de meningopoliradiculoneuropatías y 4 de neuropatía craneal. En los niños con meningopoliradiculopatía el LCR mostraba pleocitosis leve (10 a 20 células), glucosa normal y proteínas ligeramente elevadas. En 4 niños hubo afección a pares craneales (VI y VII). La poliradiculoneuropatía mixta con debilidad global se presentó en 3 casos. El 70% de los pacientes requirieron asistencia ventilatoria, pero la recuperación fue completa en 75 días.
Las manifestaciones tardías se presentaron en 3 niños de 9 años de edad con artritis de rodilla, y un caso con afectación de rodilla y cadera ipsilateral. Las manifestaciones cutáneas fueron la acrodermatitis crónica atrófica y la mórfea 1 en cada caso.
Se realizaron los siguientes estudios complementarios:
Histopatología. En biopsias de casos de eritema migrans, con la tinción de hematoxilinaeosina se observó un infiltrado linfocitario perivascular en la dermis superficial y en casos de linfocitoma cutáneo un infiltrado mononuclear con centros germinales (Fig. 1).
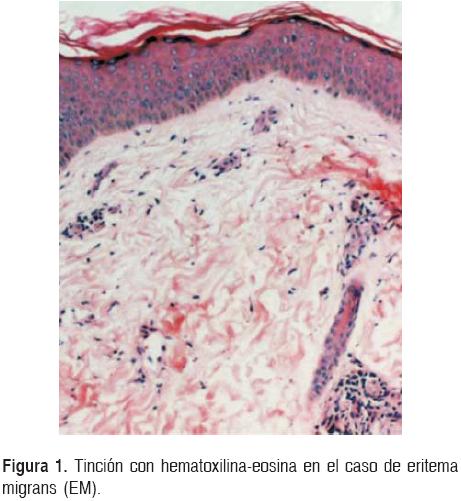
La tinción de Warthin-Starry mostró bacterias de forma espirilar en ambas patologías (Figs. 2). La inmunohistoquímica para anticuerpos monoclonales vs anti CD45 y CD20 específicos para linfocitos B y linfocitos T fue positiva, lo que muestra un infiltrado policlonal en linfocitoma cutáneo.

Serología. Los pacientes confirmados con WB para B. burgdorferi sensu lato fueron 17 con WB IgM y 3 con IgG vs B. burgdorferi. Los pacientes positivos con IgM vs B. burgdorferi sensu lato fueron reactivos a una de las siguientes especies: B. garinii 9 (45%), B. afzelii 8 (40%). Los 3 (15%) IgG positivos reaccionaron vs B. burgdorferi ss.
De los 20 niños seropositivos se obtuvo el DNA de 14 muestras clínicas (biopsias de piel 6, LCR 7 y líquido sinovial 1). La PCR clásica para el gen fla fue positiva en 8 casos (57%) y en 3 para el gen ospA. Con southern-blot, 9 DNAs fueron positivos para fla y 4 para ospA (Fig. 3).
Esta información aun no publicada muestra las características generales de los niños con enfermedad de Lyme adquirida en México. En esta muestra, Borrelia burgdorferi sensu stricto fue la especie predominante; esta genoespecie es la más frecuentemente reportada en EUA. Sin embargo, los pacientes pediátricos mexicanos presentaron mayor diversidad de manifestaciones clínicas y genoespecies semejantes a las reportadas en Europa.
Las evidencias encontradas, tanto de estudios serológicos como de casos reportados en nuestro país,9-16 deben alertar a todos los pediatras a tener dentro de los diagnósticos diferenciales a la borreliosis de Lyme, tanto en casos de enfermedad cutánea como neurológica, como se ha descrito en este trabajo.
Referencias
1. Walther PH, Wilske B, Weber K. Lyme borreliosis: basic science and clinical aspects. Lancet 1994;343:1013-1016. [ Links ]
2. Steere AC, Malawista SE. Cases of Lyme disease in the United States: locations correlated with distribution of 9. Ixodes dammini. Ann Intern Med 1979;91:730-733. [ Links ]
3. Steere AC, Taylor E, Wilson ML, Levine JF, Spielman A. Longitudinal assessment of clinical and epidemiological features of Lyme disease in a defined population. J Infect Dis 1986;154:295-300. [ Links ]
4. Guzman L, Neira O. Lyme disease in Chile. J Rheumatol 1993;20:774-775. [ Links ]
5. Ciceroni L, Bartoloni A, Guglielmetti P. Paradisi F, Barahona HG, Roselli M, et al. Prevalence of antibodies to Borrelia burgdorferi, Borrelia parkeri and Borrelia turicatae in human settlements of the Cordillera Province, Bolivia. J Trop Med Hyg 1994;97:13-17. [ Links ]
6. Rath PM, Ibershoff B, Mohnhaupt A, Albig J, Eljaschewitsch B, Jürgens D, et al. Seroprevalence of Lyme borreliosis in forestry workers from Brandenburg, Germany. Eur Clin Microb Infect Dis 1996;15:372-377. [ Links ]
7. Fahrer H, Van der LSM, Sauvain MJ, Gern L, Zhioua E, Aeschliman A. The prevalence and incidence of clinical and asymptomatic Lyme borreliosis in a population at risk. J Infect Dis 1991;163:305-310. [ Links ]
8. CDC. Lyme Disease?United States, 2003-2005. MMWR 2007;56:573-576. [ Links ]
9. Arroyave CM, Támez GR. Enfermedad de Lyme. Informe de dos casos. Bol Med Hosp Infant Mex 1994;51:117-120. [ Links ]
10. Gordillo PMG, Solórzano SF, Torres LFJ, Cedillo RR, Tapia CR, Muñóz HO. Serological evidence of Lyme disease in Mexico. Arch Med Res 1999;30:64-68. [ Links ]
11. Martinez A, Salinas A, Martínez F, Cantu Z, Miller DK. Serosurvey for selected disease agents in white-tailed deer from Mexico. J Wildlife Dis 1999;35:799-803. [ Links ]
12. Gordillo PG, Estrada G, Solórzano SF, Torres LJ. Confirmación de neuroborreliosis de Lyme por métodos serológicos y moleculares en el Valle de México. Congreso de Neurología, Los Cabos, B.C. Oct 30-Nov 1999; 2. Memorias. [ Links ]
13. García JI, Gordillo-Pérez G, Corrales L, Torres J, Solórzano-Santos F. Frecuencia de Infección por B. burgdorferi y caracterización clínica de pacientes con parálisis facial en población derechohabiente del IMSS, Zona Sur del Distrito Federal. Congreso Asoc Mex Infectol y Microbiol Clín Guadalajara, Jal. 2001; C33. [ Links ]
14. Gordillo-Pérez G, Torres J, Solórzano-Santos F, Garduno-Bautista V, Tapia-Conyer R, Muñoz F. Estudio seroepidemiológico de borreliosis de Lyme en la Ciudad de México y el noreste de la República Mexicana. Salud Publica Mex 2003;45:351-355. [ Links ]
15. Gordillo-Pérez G, Torres J, Solórzano-Santos F. De Martino S., Lipsker D., Velázquez E. et al. Borrelia burgdorferi infection and cutaneous Lyme disease, Mexico. Emerg Infect Dis 2007;13:1556-1558. [ Links ]
16. Gordillo-Pérez G, Jaulhac B, Torres J, et al. Genotipificación de Borrelia burgdorferi sensu lato de muestras clínicas de pacientes con borreliosis de Lyme adquirida en la República Mexicana por medio de la PCR en tiempo real. XXXI Congreso Anual de la Asociación Mexicana de Infectología y Microbiología Clínica, Aguascalientes, Ags. México 2007:B46. [ Links ]
17. Steere AC, Malawista SE, Hardin JA, Ruddy S, Arkenase PW, Andiman WA. Erythema chronic migrans and Lyme arthritis. The enlarging clinical spectrum. Ann Int Med 1997;86:685-698. [ Links ]
18. Pachner AR, Steere AC. The triad of neurologic manifestations of Lyme disease: meningitis, cranial neuritis, and radiculoneuritis. Neurology 1985;35:47-53. [ Links ]
19. Halperin JJ, Little WB, Coyle PK, Dattwyler RJ. Lyme disease: cause of a treatable peripheral neuropathy. Neurology 1987;37:1700-1706. [ Links ]
20. Feder HM, Zalneraitis EL, Reink L. Lyme disease: acute focal meningoencephalitis in a child. Pediatrics 1988;82:931-934. [ Links ]
21. Belman AL, Iyer M, Coyle PK, Dattwyler R. Neurologic manifestations in children with North American Lyme disease. Neurology 1993;43:2609-2614. [ Links ]
22. Shapiro DE, Steere AC, Lesser RL. Lyme disease in children, musculoskeletal and ocular manifestations of Lyme disease. Am J Med 1995;98(suppl 4A):44A-73A. [ Links ]
23. Frithz A, Lagerholm B. Acrodermatitis chronica atrophicans, erythema migrans and lymphadenosis benigna cutis; spirochetal diseases? Acta Dermatol Venereol 1983;63:432-436. [ Links ]
24. Strle F, Peterski-Rigle D, Stanek G, Pejovnik-Pustinek A, Rusie E, Cimperman J. Solitary borrelial lymphocytoma: report of 36 cases. Infection 1992;20:201-206. [ Links ]
25. Gordillo-Pérez MG, Jaulhac B, Velásquez E, Ramón G, Solórzano-Santos F, Torres LJ. Borreliosis de Lyme en niños mexicanos. Congreso de Infectología Pediátrica, Querétaro, Qro. Nov 29-Dec 2, 2007; 46. [ Links ]
26. CDC. Case definitions for infectious conditions under public health surveillance. MMWR 1997;46 (RR-10):20. [ Links ]
27. Barbour AG, Hayes SF. Biology of Borrelia species. Microbiol Rev 1986;50:381-400. [ Links ]
28. Dressler F, Whalen JA, Reinhardt BN, Steere AC. Western blotting in the serodiagnosis of Lyme disease. J Infect Dis 1993;167:392-400. [ Links ]
29. Rusell H, Sampson JS, Schmid GP, Wilkinson HW, Plikaytis B. Enzyme-linked immunosorbent assay and indirect immunofluorescence assay for Lyme disease. J Infect Dis 1984;149:465-470. [ Links ]
30. Schmidt BL. PCR in laboratory diagnosis of human Borrelia burgdorferi infections. Clin Microbiol Rev 1997;10:185-201. [ Links ]
31. Hauser U, Lehnert G, Lobentanzer R, Wilske B. Interpretation criteria for standardized Western blots for three European species of Borrelia burgdorferi sensu lato. J Clin Microbiol 1997;35:1433-1444. [ Links ]
32. Norman GL, Antig JM, Bigaignon G, Hogrefe W. Serodiagnosis of Lyme borreliosis by Borrelia burgdorferi sensu stricto, B. garinni, and B. afzelii Western blots (immunoblots). J Clin Microbiol 1996;34:1732-1738. [ Links ]
33. Wang G, Van Dam AP, Schwartz I, Dankert J. Molecular typing of Borrelia burgdorferi sensu lato: taxonomic, epidemiological, and clinical implications. Clin Microbiol Rev 1999;12:633-653. [ Links ]
34. Postic D, Assous M, Belfaiza J, Baranton G. Genetic diversity of Borrelia of Lyme borreliosis. Wien Klin Wochenschr 1996;108:748-751. [ Links ]
35. Campbell GL, Mitchell PD, Persing DH. Genetic heterogeneity of Borrelia burgdorferi in the United States. J Infect Dis 1997;175:98-107. [ Links ]
36. Wilske B, Preac-Mursic V, Göbel UB, Graf B, Jauris S, Soutschek E, et al. An OspA serotyping system for Borrelia burgdorferi based on reactivity with monoclonal antibodies and OspA sequence analysis. J Clin Microbiol 1993;31:340-350. [ Links ]
37. Wilske B, Jauris-Heipke S, Lobentanzer R, Pradel I, Preac-Mursic V, Rössler D, et al. Phenotypic analysis of outer surface protein C (OspC) of Borrelia burgdorferi sensu lato by monoclonal antibodies: relationship to genospecies and OspA serotype. J Clin Microbiol 1995;33:103-109. [ Links ]
38. Schmidt BL. PCR in laboratory diagnosis of human Borrelia burgdorferi infections. Clin Microbiol Rev 1997;10:185-201. [ Links ]
39. Picken RN. Polymerase chain reaction primers and probes derived from flagellin gene sequences for specific detection of the agents of Lyme disease and North American relapsing fever. J Clin Microbiol 1992;30:99-114. [ Links ]
40. Postic D, BelfaizaJ, Isogai E, Saint GI, Grimont PAD, Baranton G. New genomic species in Borrelia burgdorferi sensu lato isolated from Japanese ticks. Res Microbiol 1998;144:467-473. [ Links ]
41. Schneider BS, Zeidner NS, Burkot TR, Maupin GO, Piesman J. Borrelia isolates in northern Colorado identified as Borrelia bissettii. J Clin Microbiol 2000;38:3103-3105. [ Links ]
42. Baranton G, Postic D, Saint Girons I, Boerlin P, Piffaretti JC, Assous M, et al. Delineation of Borrelia burgdorferi sensu stricto, Borrelia garinii sp. nov., and group VS461 associated with Lyme borreliosis. Int J Syst Bacteriol 1992;42:378-383. [ Links ]
43. Busch U, Hizo TC, Boehmer R. Three species of Borrelia burgdorferi sensu lato (B. burgdorferi sensu stricto, B. afzelii, and B. garinii) identified from cerebrospinal fluid isolates by pulsed field gel electrophoresis and PCR. J Clin Microbiol 1996;34:1072-1078. [ Links ]
44. Liveris D, Wormser GP, Nowakowski J. Molecular typing of Borrelia burgdorferi from Lyme disease patients by PCR-restriction fragment length polymorphism analysis. J Clin Microbiol 1996;34:1306-1309. [ Links ]
45. Belfaiza J, Postic D, Bellenger E, Baranton G, Saint G. Genomic fingerprinting of Borrelia burgdorferi sensu lato by pulsed-field gel electrophoresis. J Clin Microbiol 1993;31:2873-2877. [ Links ]
46. Gautom RK. Rapid pulsed-field gel electrophoresis protocol for typing of Escherichia coli 0157:H7 and other Gram-negative organism in 1 day. J Clin Microbiol 1997;35:2977-2980. [ Links ]
47. Wang Q, Van Dam AP, Spanjaard L, Dankert J. Molecular typing of Borrelia burgdorferi sensu lato by randomly amplified polymorphic DNA fingerprinting analysis. J Clin Microbiol 1998;36:768-776. [ Links ]
48. Barbour AG. Laboratory aspects of Lyme borreliosis. Clin Microbiol Rev 1988;1:399-414. [ Links ]














