Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.67 no.2 México mar./abr. 2010
Artículo de revisión
La obesidad como un proceso inflamatorio
Obesity as an inflammatory process
Gerardo Blancas-Flores1,2, Julio César Almanza-Pérez1, Rocío Ivette López-Roa3, Francisco Javier Alarcón-Aguilar1, Rebeca García-Macedo2, Miguel Cruz2
1 Laboratorio de Farmacología, Departamento de Ciencias de la Salud, División de Ciencias Biológicas y de la Salud, Universidad Autónoma Metropolitana Unidad Iztapalapa
2 Unidad de Investigación Médica en Bioquímica, Hospital de Especialidades CMN SXXI, Instituto Mexicano del Seguro Social, México D.F.
3 Laboratorio de Investigación y Desarrollo Farmacéutico CUCEI-Universidad de Guadalajara, Jalisco, México
Autor de correspondencia:
Dr. Miguel Cruz
Correo electrónico: mcruzl@yahoo.com
Fecha de recepción: 17-08-09.
Fecha de aceptación: 03-12-09.
Resumen
La obesidad es un problema muy importante a nivel mundial que ha aumentado rápidamente, alcanzando características de pandemia. En los últimos años se ha observado que los pacientes obesos presentan un estado inflamatorio crónico de bajo grado como una consecuencia del incremento en la masa del tejido adiposo, que lleva a un aumento en la producción de mediadores proinflamatorios que son conjuntamente estimulados por señales de origen exógeno y/o endógeno. El tejido adiposo contiene fibroblastos, preadipocitos, adipocitos y macrófagos; estos últimos contribuyen de manera importante al proceso inflamatorio sistémico con la producción de mediadores proinflamatorios. Así, existe una asociación íntima, altamente coordinada, entre las vías inflamatorias y las metabólicas; destaca la coincidencia en las funciones de los macrófagos y los adipocitos en la obesidad. Dilucidar los vínculos que existen entre obesidad e inflamación es de importancia capital dentro del campo de la biología molecular; esto implica el reconocimiento de las adipocinas, moléculas sintetizadas por los adipocitos, para dar lugar al descubrimiento de nuevos blancos terapéuticos relacionados con la inmunidad y el metabolismo, y de esta manera abrir la posibilidad de frenar la evolución de los procesos inflamatorios que culminan en enfermedades degenerativas.
Palabras clave: obesidad, inflamación, citocinas, adipocinas, inmunidad, enfermedades degenerativas.
Abstract
Obesity is a major problem worldwide whose prevalence is increasing rapidly, with characteristics of a pandemic. In recent years it has become clear that obese patients present a low-grade chronic inflammation as a result of increased fat tissue and, consequently, an increased production of proinflammatory mediators by exogenous or endogenous stimuli. Fat tissue contains fibroblasts, preadipocytes, adipocytes and macrophag-es with the latter contributing to the systemic inflammatory process in the production of proinflammatory mediators. Thus, there is a highly coordinated intimate association between inflammatory and metabolic pathways, highlighting the overlap between the functions of macrophages and adipocytes in obesity. Elucidating the links between obesity and inflammation is of primordial importance within the field of molecular biology of obesity, which implies the recognition of adipokines, molecules synthesized by adipocytes, which may lead to the discovery of new therapeutic targets related to metabolism and immunity. This may open the possibility to halt the development of inflammatory processes leading to degenerative diseases.
Key words: obesity, inflammation, cytokines, adipokines, immunity, degenerative diseases.
Introducción
La obesidad es un problema sanitario importante a nivel mundial ya que su prevalencia está aumentando rápidamente, con características de pandemia. Se considera que en los próximos años la mayor parte de la población será obesa o tendrá sobrepeso.1
La obesidad es un padecimiento crónico complejo de etiología multifactorial que se desarrolla por un desequilibrio entre la energía ingerida y la energía gastada, es decir, una acumulación anormal o excesiva de energía en forma de grasa en el tejido adiposo (TA).2 El exceso de energía se almacena en los adipocitos, los cuales aumentan en tamaño y/o en número. Este desequilibrio es el resultado de la combinación de varios factores fisiológicos, psicológicos, metabólicos, genéticos, socioeconómicos, culturales y emocionales.3 Lo anterior se traduce en un incremento en el peso corporal, que es diferente para cada persona y grupo social.4
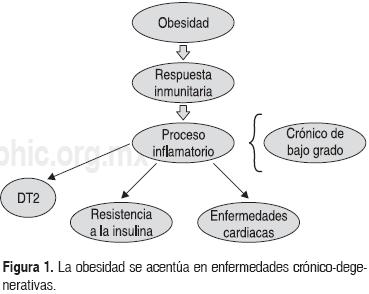
Con la aparición de la obesidad se presentan alteraciones en la respuesta inmunitaria ya que se genera un proceso inflamatorio que suele ser crónico y de bajo grado de intensidad, el cual también está presente con otras enfermedades degenerativas asociadas, tales como diabetes tipo 2 (DT2), hipertensión, dislipidemias, enfermedades cardiacas, etc.5-7 (Fig. 1). Esta condición crónica de inflamación se ha relacionado también con la generación de resistencia a la insulina.8
Para combatir infecciones, el organismo depende de su capacidad innata para reparar el daño y almacenar energía hasta que se requiera. Los sistemas metabólico e inmune son requerimientos básicos, íntimamente ligados, aunque interdependientes. Muchas hormonas, citocinas, proteínas de señalización, factores de transcripción y lípidos interaccionan tanto en el sistema inmune, como en el metabólico.9 En este sentido, el soporte metabólico juega un papel muy importante, ya que puede modificar la capacidad inmunitaria del organismo para combatir infecciones en la respuesta inflamatoria. A su vez, la respuesta inflamatoria modifica el metabolismo del organismo, favoreciendo o suprimiendo algunas vías, como es el caso de la vía de señalización de la insulina. La combinación de la respuesta inmune con un balance metabólico adecuado es benéfica para el mantenimiento de un buen estado de salud. Sin embargo, puede convertirse en deletérea bajo condiciones de alteración metabólica, como en la obesidad.10 Existen evidencias que apoyan la asociación entre el metabolismo y la inmunidad; el mantener un peso saludable conduce a un equilibrio inmunitario; por el contrario, con la desnutrición se favorece la inmunosupresión, mientras que en la obesidad se genera una inflamación crónica.9 En esta revisión se analiza la asociación entre obesidad e inflamación, particularmente aquella debida a la sobreexpresión o deficiencia de citocinas inflamatorias y sus mecanismos de señalización, buscando dilucidar si la inflamación puede ser consecuencia de la obesidad o viceversa.
Metodología
Para llevar acabo la revisión bibliográfica, se realizó una búsqueda en las siguientes bases de datos, públicas y de revistas especializadas: EBSCO, Elsevier, Free Medical Journals, PubMed, Scielo, Science Direct, Scopus y Springer Link, las cuales proporcionaron artículos relacionados con el tema. Las palabras clave utilizadas fueron: obesity, inflammation, fat tissue, macrophages and adipokines. Se consideraron publicaciones originales entre el 2001 y el 2008 en español e inglés, tomando en cuenta algunas citas de los años 1982, 1985, 1994, 1996 y 1998; todos los artículos se obtuvieron in extenso. Una vez seleccionadas las fuentes bibliográficas más importantes, se llevó acabo la revisión de las mismas. Posteriormente se clasificó la información por temas y se crearon resúmenes, donde se conjuntaron las ideas más importantes de cada artículo, para una mejor organización. Con la información clasificada se realizó el análisis de la información. Se destacaron los elementos más característicos de la obesidad y la inflamación. De igual forma, se presentaron algunos resultados actuales de nuestras investigaciones acerca de la estrecha relación entre la obesidad y la inflamación.
Respuesta inmune innata y obesidad
A partir de la obesidad se presenta un fenómeno de inflamación de bajo grado en el que participan una red de células y moléculas del sistema inmune innato, el más antiguo y conservado filogenéticamente.11
Además de ser la primera línea de defensa contra infecciones por microorganismos, daños físicos o químicos, este sistema cuenta con un grupo especializado de células, como macrófagos y células dendríticas, cuya función primordial es reconocer ligandos endógenos y exógenos; estos últimos son patrones moleculares altamente conservados de agentes patógenos.12 Dicho reconocimiento se lleva a cabo a través de receptores codificados en la línea germinal. Los más estudiados son los de tipo Toll (TLR's), que involucran una familia de más de 10 proteínas transmembranales. Los receptores Toll fueron identificados por primera vez en Drosophila melanogaster (mosca de la fruta).13 La porción citoplasmática de los TLR's tiene una gran similitud a la de la familia del receptor de interleucina-1 (IL-1) y es llamada dominio del receptor Toll/IL-1 (TIR); sin embargo, las porciones extracelulares de ambos receptores no presentan homologías y además, los TLR's se caracterizan por tener dominios ricos en leucinas (LRR's).
Los TLR juegan un papel importante en el reconocimiento específico de componentes microbianos de patógenos, entre ellos bacterias, hongos, virus y protozoarios.
El receptor tipo Toll-4 (TLR-4) reconoce un lipo-polisacárido (LPS) de bacterias Gram-negativas en asociación con moléculas accesorias como CD14 y MD-2. Así mismo, reconoce moléculas endógenas como el dominio A de fibronectina y las proteínas de choque térmico (HSP) HSP60 y HSP70. La síntesis de éstas alerta al sistema inmune de algún daño tisular. El receptor tipo Toll-2 (TLR-2) reconoce lipopéptidos y lipoproteínas de bacterias Gram-positivas, así como LPS de algunas no-enterobacterias como Helicobacter pylori. Cabe mencionar que el TLR-2 puede formar dímeros heterofílicos con otros TLR's, como TLR6/TLR2, que reconoce lipopéptidos diacilados, y TLR1/TLR2 que reconoce lipopéptidos triacilados, ampliando de esta manera su espectro de reconocimiento antigénico.
Los TLR' s activan rutas de señalización comunes que culminan con la translocación del factor de transcripción nuclear kappa B (NF-κB), el cual es una proteína clave en la cascada inflamatoria.14 El proceso inflamatorio es promovido entonces por los TLR's a través de la producción de citocinas como el factor de necrosis tumoral tipo alfa (TNF-α), interleucina-6 (IL-6), e interleucina-1 beta (IL1-β). Aunque los TLR's se expresan en su mayoría en células del linaje hematopoyético, un creciente número de estudios reporta su expresión en otros tipos celulares, como el tejido adiposo, y en particular, en los adipocitos.1516
En pacientes con obesidad y DT2, la activación de citocinas proinflamatorias correlaciona estrechamente con el NFκB. Los adipocitos secretan adiponectina, cuyas propiedades antiinflamatorias son ejecutadas a través de su acción sobre el NF-κB y, por otro lado, los niveles de adiponectina correlacionan de manera inversa en pacientes con obesidad y DT2.17 En un trabajo se observó que, en modelos murinos de obesidad inducida con una dieta alta en grasas, hay sobreexpresión del inhibidor de la cinasa kappa-B (IKKβ) de NF-κB en TA, lo que resulta en una elevada producción de citocinas inflamatorias y en el desarrollo de diabetes.18 En contraste, los hepatocitos de ratones knockout (KO) para IKKβ muestran una disminución de citocinas proinflamatorias, por lo que estos ratones no desarrollan resistencia hepática a la insulina y a la glucosa como los ratones con obesidad inducida mediante una dieta alta en grasas.19
El origen de los estímulos que persisten durante la inflamación de bajo grado presente en la obesidad no es del todo conocido. Sin embargo, se sabe que la obesidad, la DT2 y el síndrome metabólico se caracterizan por un aumento sistémico en los niveles de ácidos grasos. Estos mismos incrementan la síntesis de TNF-α en adipocitos de la línea celular murina 3T3-L1 a través de TLR-2.15 En otro trabajo se encontró que en cultivo de tejido adiposo humano, la expresión de TLR-2/TL-R4 es inducida mediante la estimulación con LPS y Pam3SCK4 (agonista de TLR), lo cual activa la translocación nuclear de NF-κB y la síntesis de citocinas proinflamatorias. Así, los depósitos de grasa contribuyen de manera importante a mantener un estado inflamatorio crónico mediante la síntesis y elaboración de citocinas a través de los TLR's; el origen de esta activación puede estar relacionado con los mecanismos propios de la disfunción cardiometabólica.16
Otra explicación de la estimulación antigénica constante a través del sistema inmune innato, en la obesidad, es que, debido a la hiperinsulinemia que presentan estos pacientes, exista una disminución en la capacidad inmunocompetente de las células de Kupffer para realizar el aclaramiento de LPS, los cuales llegan a través del tracto gastrointestinal.20 Algunos estudios han demostrado que la endotoxemia puede agravar el grado de hiperinsulinemia, ya que existe una relación directa entre el incremento sistémico de LPS y los niveles de insulina.21 Esto ocasiona la activación de un mecanismo de retroalimentación positiva que comienza con la resistencia a la insulina, la elevada síntesis y secreción de la misma y la subsecuente inflamación.17
Inflamación y obesidad
La respuesta inflamatoria comienza con el reconocimiento de las señales, que pueden ser de origen infeccioso o inflamatorio, lo que ocasiona la activación celular y la síntesis de proteínas, modificando la respuesta efectora de las células inmunitarias. En la respuesta inmune debida a infecciones, estos mediadores provocan el reclutamiento de células adyacentes a través de un proceso paracrino. Cuando la liberación de mediadores excede las fronteras locales, se diseminan y distribuyen a través de la sangre, produciendo una activación celular generalizada de tipo endocrino que se corresponde con el cuadro clínico del síndrome de respuesta inflamatoria sistémica (SIRS). El SIRS es un mecanismo de defensa del huésped que forma parte el proceso de reparación tisular. Para que esta defensa se inicie de manera eficaz, es necesaria la participación de citocinas con función fundamentalmente proinflamatoria como TNF-α, IL-1β, interleucina-12 (IL-12), interferón-γ (IFN-γ) y, posiblemente, IL-6.22 La respuesta proinflamatoria inicial está controlada por moléculas inmunorreguladoras, como los inhibidores específicos y los receptores solubles de las citocinas. Las principales citocinas antiinflamatorias son los antagonistas del receptor de la IL-1 (IL-1RA), el factor de crecimiento transformante beta (TGF-yβ) y las interleucinas 4, 6, 10, 11 y 13. Los receptores específicos para IL-1, TNF-α e interleucina-18 (IL-18) se comportan como inhibidores de sus respectivas citocinas proinflamatorias. En condiciones fisiológicas, todas estas moléculas sirven como inmunomoduladoras y, por lo tanto, limitan el efecto potencialmente dañino de la reacción inflamatoria. Sin embargo, en la obesidad, la respuesta antiinflamatoria puede ser insuficiente para contrarrestar la actividad inflamatoria, ya que en esta patología el estado de inflamación es crónico, aunque de bajo grado. Así, mientras que en una primera fase predominan los mediadores de efecto proinflamatorio, en fases posteriores predominan mediadores antiinflamatorios. Es decir, la acción de las citocinas depende del momento de su liberación, del lugar en el que actúan, de la presencia de otros elementos competitivos o sinérgicos, de la densidad de sus receptores y de la capacidad de respuesta de ese tejido a cada citocina.22
Los adipocitos estimulados por señales de origen infeccioso o inflamatorio secretan reactantes de fase aguda y mediadores de inflamación. Entre los factores de inflamación expresados en los adipocitos se incluyen TNF-α, IL-6, inhibidor del activador del plasminógeno (PAI-1), proteína quimioatrayente de monocitos-1 (MCP1), IL-1β, IL-8, 10, 15, factor inhibidor de leucemia (LIF), factor de crecimiento del he patocito (H GF), a polipoprote ína A3 (SAA3), factor inhibitorio de la migración de mac rófagos (MIMF), moduladores inflamatorios potentes como leptina, adiponectina y resistina, así como la proteína C reactiva (CRP).6,23,24
La asociación entre obesidad e inflamación se confirma con el hecho de que la pérdida de peso en mujeres obesas tras un año de dieta, ejercicio y cirugía de liposucción, está asociada con una reducción en los niveles circulantes de IL-6 y TNF-α.25 Una situación similar se ha observado después de un bypass gástrico en pacientes con obesidad mórbida, ya que la reducción de peso observada en estos pacientes se asocia con una disminución en los niveles de CRP e IL-6. Asimismo, en estos pacientes se observa una mejora en la sensibilidad a la insulina.26
Tejido adiposo, macrófagos e inflamación
Las citocinas sintetizadas en el TA, llamadas adipocinas, intervienen en la inflamación y sus niveles se encuentran modificados en la obesidad. Por consiguiente, la obesidad podría favorecer o alterar la evolución de los procesos inflamatorios. La repuesta inflamatoria en la obesidad es de bajo grado y progresa muy lentamente, por lo que incrementa el riesgo de dañar múltiples sistemas, incluyendo a aquellos involucrados en la homeostasis de la glucosa.
El tejido adiposo, además de adipocitos, contiene fibroblastos, preadipocitos y macrófagos, los cuales también residen en este tejido. Los macrófagos son contribuyentes importantes en el proceso inflamatorio sistémico general. Estos han sido implicados, también, en el desarrollo y mantenimiento de la inflamación inducida por la obesidad en el TA y contribuyen con la secreción de muchas moléculas proinflamatorias secretadas en el tejido adiposo. Existe una asociación íntima, altamente coordinada, entre las vías inflamatorias y las metabólicas, destacando la coincidencia entre la función de los macrófagos y los adipocitos en la obesidad.10 La expresión genética de ambas células es similar; los macrófagos expresan la mayoría de los productos proteicos del adipocito, como las proteínas transportadoras de ácidos grasos (FABP-aP2) y el PPAR-γ (receptor gamma activado por proliferadores de peroxisomas), mientras que los adipocitos pueden expresar muchas proteínas proinflamatorias que podrían considerarse exclusivas de los macrófagos, tales como TNF-α e IL-6. La habilidad funcional de estos dos tipos de células también coincide y se sobrepone. Los macrófagos pueden atraer, englobar y almacenar lípidos para convertirse en células espumosas ateroscleróticas. Además, bajo ciertas circunstancias (situaciones inflamatorias), los preadipocitos pueden presentar propiedades fagocíticas y antimicrobianas, con la capacidad de diferenciarse en macrófagos en un medio ambiente propicio, lo que sugiere un papel inmunológico potencial de estos preadipocitos.10,27 También se ha podido documentar que los macrófagos y los adipocitos están muy cercanos cuando existe un exceso de TA, que es distintivo de la obesidad. Lo anterior se relaciona con la génesis de la obesidad y la fuerte relación que tiene con los procesos inflamatorios, mismos que ocurren de forma simultánea en el tejido adiposo y en los macrófagos para promover resistencia a la insulina.10
El origen de los marcadores inflamatorios, como ya se mencionó, puede ser diverso e incluye además del TA, el hígado, macrófagos, endotelio y otros tejidos. Esta situación puede ser todavía más compleja al existir interacciones entre los tejidos productores. Así, la producción de la CRP circulante que procede fundamentalmente del hígado, está regulada por la IL-6 sintetizada en el TA.8 Además, se ha observado que la producción de CRP en el TA puede también contribuir a los niveles circulantes de este factor en pacientes obesos,28 aunque no se ha establecido la contribución total de cada tejido.
La correlación entre la cantidad de macrófagos residentes en el tejido adiposo y la obesidad se ha observado en varios modelos murinos de obesidad, lo mismo que en tejido adiposo subcutáneo humano.29,30 La infiltración de onocitos circulantes a los tejidos es un fenómeno complejo que involucra varios pasos; incluye la activación del endotelio capilar, la expresión aumentada de las moléculas de adhesión, como la molécula de adhesión intercelular-1 (ICAM-1), la adhesión de monocitos circulantes seguida de su trasmigración a través del endotelio, y su diferenciación en macrófagos. Los adipocitos humanos producen factores solubles que estimulan la diapédesis de los monocitos sanguíneos. Dicha diapédesis se relaciona con la activación de las células endoteliales capilares derivadas del tejido adiposo y con incremento en la expresión de ICAM-1 y molécula de adhesión endotelial plaquetaria-1 (PECAM-1). Los individuos con sobrepeso y obesidad presentan concentraciones elevadas en plasma de las moléculas celulares de adhesión como E-selectina, molécula de adhesión vascular-1 (VCAM-1), ICAM-1 y el factor de von Willebrand (FVW), sugiriendo que el incremento de la masa grasa corporal se asocia con una activación endotelial sistémica temprana.31 Los factores derivados de los adipocitos liberados a la circulación sistémica son los que desempeñan un papel primordial en la activación de las células endoteliales,32,33 promoviendo la infiltración de los macrófagos en el TA y generando así un estado de inflamación por la desregulación de las citocinas proinflamatorias y las antiinflamatorias, como se muestra en la Tabla 1.
Adipocinas y trastornos autoinmunes
Se ha documentado que existe una gran variedad de condiciones inflamatorias en las que se encuentran alterados los niveles de adipocinas, tanto a nivel sistémico como local. Sin embargo, el papel que desempeñan las adipocinas en trastornos patológicos está lejos de entenderse, incluso en la DT2, una enfermedad en la que se ha estudiado con mayor detalle la participación de estas moléculas. Tomando en cuenta lo anterior, es de gran importancia entender los mecanismos por los cuales se produce la obesidad y así poder combatir enfermedades con un proceso inflamatorio crónico degenerativo como el asma, la artritis, enfermedades cardiacas etc., enfermedades que tienen una estrecha relación con la obesidad.
Mecanismos de señalización implicados en la inflamación y la obesidad
¿Cómo se inicia la respuesta inflamatoria en la obesidad? ¿Es causada por el TA, los macrófagos o ambos? Son las preguntas que resaltan hasta el momento. Parece posible que la respuesta inflamatoria se inicie en los adipocitos, que es el primer tipo celular involucrado en la obesidad, y posteriormente haya un reclutamiento de macrófagos, con lo que se agrava el estado inflamatorio. Un mecanismo, al parecer de suma importancia, se refiere a la activación de las vías inflamatorias debidas a estrés en el retículo endoplásmico (ER). La obesidad genera condiciones que incrementan la demanda en el retículo endoplásmico y sobrecargan su capacidad funcional.34 Esto es particularmente importante en el caso del TA, el cual experimenta cambios severos en su arquitectura, incrementando la síntesis de proteínas y de lípidos, perturbando los nutrientes intracelulares y el flujo de energía. En cultivos y en animales intactos, el retículo endoplás-mico conduce a la activación de la cinasa de c-jun NH2-terminal (JNK) y del inhibidor de la cinasa del NF-κB o IKK, y estos, a su vez, activan al NF-κB. Este último, un factor de trascripción inducible, participa en la respuesta inmune y en la respuesta inflamatoria, activando un gran número de citocinas proinflamatorias y suprimiendo otras, como adiponectina y también los transportadores de glucosa tipo 4 (GLUT-4). Esto ha sugerido que el proceso inflamatorio está estrechamente asociado a la obesidad y contribuye a la resistencia a la insulina.35
Un segundo mecanismo que puede ser relevante al inicio de la inflamación en la obesidad es el estrés oxidativo. El incremento en la captura de glucosa por las células endoteliales del TA en condiciones de hiperglucemia causa un exceso de especies reactivas de oxígeno en las mitocondrias, lo cual condiciona daño oxidativo y activa señales de inflamación dentro de la célula endotelial.36 El daño endotelial en el TA causa quimiotaxis de macrófagos y exacerba aún más la inflamación local. La hiperglucemia también estimula la generación de especies reactivas de oxígeno en los adipocitos, con lo cual se incrementa la producción de citocinas proinflamatorias.37
Un tercer mecanismo se asocia con el hecho de que, en la mayoría de los individuos obesos, el principal defecto en la acción de la insulina se localiza a nivel de postreceptor.38 La acción de la insulina en el postreceptor se ve alterada por el aumento de TNF-α y los ácidos grasos libres (FFA), que inhiben la fosforilación del sustrato del receptor de insulina 1 (IRS-1) en los residuos de serina.39 A su vez, la falta de activación de serina del IRS-1 reduce la fosforilación de tirosina del IRS-1 en respuesta a la insulina, suprimiendo de esta manera la señalización molecular intracitosólica apropiada de esta hormona, causando resistencia a sus acciones. Se han investigado varios mediadores responsables de estas modificaciones, lo que ha enriquecido el conocimiento sobre las señales críticas intracelulares que determinan la resistencia a la insulina. Varias cinasas de serina/ treonina que son activadas por estímulos inflamatorios o de sobrecarga (estrés), contribuyen a la inhibición de la señalización de la insulina. Éstas incluyen a las cinasas JNK e IKK y a la proteína cinasa C- θ (PKC-θ). La activación de estas cinasas inflamatorias en la obesidad y su participación en las acciones de la insulina ilustran la estrecha relación entre las vías metabólica e inmune. En particular, las cinasas JNK e IKK controlan las vías de respuesta inflamatoria más relevantes, son activadas por una amplia variedad de señales de estrés y regulan la respuesta inmune innata.10 Tanto la JNK como el IKK son esenciales, y se requiere de su constante activación y expresión genética para que el TNF-α induzca resistencia a la insulina. La supresión de una u otra incrementa la sensibilidad a las acciones de la insulina.40 Las tres enzimas (JNK, IKK y PKC-θ) son capaces de incrementar la fosforilación de serina-IRS-1 y alterar perfiles deletéreos de expresión genética inflamatoria (Fig. 2).19

Un mecanismo que puede involucrar a los dos anteriores es el siguiente: al aumentar la ingesta de energía, la síntesis de lípidos se hace más grande y, por consiguiente, se da una mayor acumulación de grasa en los adipocitos y aumenta el número de estas células; esto trae como consecuencia la falta de oxígeno en los adipocitos más lejanos a la zona de vascularización, lo que conduce a un estrés en el retículo endoplásmico por falta de oxígeno, llamado estrés hipóxico. Este estrés genera radicales libres y daño oxidativo, el cual culminará con muerte celular por necrosis. El proceso trae consigo mecanismos de alerta de daño, entre los que destaca la secreción de citocinas proinflamatorias por los adipocitos vecinos y por los macrófagos reclutados en respuesta a la señal de alerta, estableciendo con ello el perfil inflamatorio típico de la obesidad.
Sin embargo, no se conoce con certeza cuál es la causa que determina que el TA produzca citocinas inflamatorias y proteínas de fase aguda. Una posible explicación es que el origen de este proceso sea intrínseco al propio TA, siendo la hipoxia el factor desencadenante.35 La hipoxia se produciría con el crecimiento excesivo del TA durante el desarrollo de la obesidad. En estas condiciones, se inicia un proceso inflamatorio inducido por agrupaciones de adipocitos hipóxicos que permitirían estimular la angiogénesis y aumentar el flujo sanguíneo. Esta propuesta se basa en estudios en los que se ha observado que el TA es sensible a los inhibidores de la angiogénesis,41 o en los que muestran que el TA es capaz de producir factores estimuladores de la angiogénesis, como el factor de crecimiento derivado del endotelio vascular (VEGF), el PAI-1 y la leptina.5 En todo este proceso, el factor inducible por hipoxia-1 (HIF-1), un factor de transcripción estimulado por la hipoxia que se produce en los adipocitos y cuya producción está incrementada en ratones obesos, parece jugar un papel central.41 Este factor es estimulado también por citocinas y regula la producción de VEGF y PAI-1.42
Blancos terapéuticos
Se sabe que la obesidad depende de factores ambientales y genéticos, y que repercute en alteraciones en la expresión y función de diversas proteínas, por lo que sería importante, durante los próximos años, encontrar moléculas clave como blancos terapéuticos para desarrollar tratamientos útiles para aminorar el proceso inflamatorio.
Los adipocitos, además de almacenar energía, sintetizan y secretan una gran variedad de moléculas bioactivas denominadas adipocinas, como la leptina, que reduce la ingesta de alimentos e incrementa el gasto energético,43 así como otras adipocinas inflamatorias que se expresan en mayor cantidad en condiciones de obesidad. Si bien las enfermedades metabólicas relacionadas con la obesidad se tratan con algunos fármacos específicos (sibutramina, orlistat), se ha investigado recientemente si existen alternativas para lograr disminuir los procesos inflamatorios característicos de la obesidad, como bajar de peso mediante cirugía de banda gástrica o dieta.
Entre las alternativas terapéuticas que buscan aminorar el perfil proinflamatorio, se encuentra el uso de la glicina. Se ha demostrado, tanto en experimentos in vitro, in vivo y en humanos que el tratamiento con glicina reduce la expresión de citocinas proinfla-matorias como TNF-α, IL-6 y resistina, con aumento en la expresión de adiponectina, una citocina antiinflamatoria, y de su regulador el PPAR-γ.44,45
Podemos concluir con las siguientes afirmaciones:
Los adipocitos y macrófagos presentes en el TA sintetizan moléculas semejantes que contribuyen al establecimiento del proceso inflamatorio característico de la obesidad.
En los sujetos obesos en quienes coexisten cantidades en exceso tanto de adipocitos como de ma-crófagos, se presenta un incremento en los niveles circulantes de citocinas proinflamatorias como TNF-α, IL-6, etc., los cuales favorecen de manera importante al mantenimiento de la inflamación crónica de bajo grado característica de la obesidad.
Parece entonces posible que el estado inflamatorio en la obesidad sea una consecuencia del incremento en la masa del tejido adiposo y de la hipoxia generada en el mismo.
Referencias
1. Pi-Sunyer FX. The obesity epidemic: pathophysiology and consequences of obesity. Obes Res 2002;10:97S-104S. [ Links ]
2. Mendivil ACO, Sierra AID. Avances en obesidad. Rev Fac Med Univ Nac Colombia 2004;52:270-286. [ Links ]
3. Palou A, Bonet ML, Picó C, Rodríguez AM. Nutrigenómica y obesidad. Rev Med Univ Navarra 2004;48:36-48. [ Links ]
4. Díaz M. Presente y futuro del tratamiento farmacológico de la obesidad. Rev Argent Cardiol 2005;73:137-144. [ Links ]
5. Berg AH, Scherer PE. Adipose tissue, inflammation, and cardiovascular disease. Circ Res 2005;96:939-949. [ Links ]
6. Lau DCW, Dhillon B, Yan H, Szmitko PE, Verma S. Adipokines: molecular links between obesity and atherosclerosis. Am J Physiol Heart Circ Physiol 2005;288:H2031-H2041. [ Links ]
7. Fantuzzi G. Adipose tissue, adipokines, and inflammation. J Allergy Clin Immunol 2005;115:911-919. [ Links ]
8. Yudkin JS. Adipose tissue, insulin action and vascular disease: inflammatory signals. Int J Obes 2003;27:S25-S28. [ Links ]
9. Khovidhunkit W, Kim MS, Memon RA, Shigenaga JK, Moser AH, Feingold KR, et al. Effects of infection and inflammation on lipid and lipoprotein metabolism: mechanisms and consequences to the host. J Lipid Res 2004;45:1169–1196. [ Links ]
10. Wellen KE, Hotamisligil GS. Inflammation, stress, and diabetes. J Clin Inv 2005;115:1111-1119. [ Links ]
11. Medzhitov R, Janeway CA Jr. An ancient system of host defense. Curr Opin Immunol 1998;10:12-15. [ Links ]
12. Pickup JC. Inflammation and activated innate immunity in the pathogenesis of type 2 diabetes. Diabetes Care 2004;27:813–823. [ Links ]
13. Lemaitre B, Nicolas E, Michaut L, Reichhart JM, Hoffmann JA. The dorsoventral regulatory gene cassette spätzle/Toll/cactus controls the potent antifungal response in Drosophila adults. Cell 1996;86:973-983. [ Links ]
14. Barton GM, Medzhitov R. Toll-like receptor signaling pathways. Science 2003;300:1524-1525. [ Links ]
15. Murakami K, Bujo H, Unoki H, Saito Y. High fat intake induces a population of adipocytes to co-express TLR2 and TNF-alpha in mice with insulin resistance. Biochem Biophys Res Commun 2007;354:727-734. [ Links ]
16. Vitseva OI, Tanriverdi K, Tchkonia TT, Kirkland JL, McDonnell ME, Apovian CM, et al. Inducible Toll-like receptor and NF-kappaB regulatory pathway expression in human adipose tissue. Obesity (Silver Spring) 2008;16:932-937. [ Links ]
17. Creely SJ, McTernan PG, Kusminski CM, Fisher M, Da Silva NF, Khanolkar M, et al. Lipopolysaccharide activates an innate immune system response in human adipose tissue in obesity and type 2 diabetes. Am J Physiol Endocrinol Metab 2007;292:E740-E747. [ Links ]
18. Cai D, Yuan M, Frantz DF, Melendez PA, Hansen L, Lee J, et al. Local and systemic insulin resistance resulting from hepatic activation of IKKβ and NF-κB. Nat Med 2005;11:183-190. [ Links ]
19. Arkan MC, Hevener AL, Greten FR, Maeda S, Li ZW, Long JM, et al. IKK-beta links inflammation to obesity-induced insulin resistance. Nat Med 2005;11:191-198. [ Links ]
20. Cornell RP, McClellan CC. Modulation of hepatic reticuloendothelial system phagocytosis by pancreatic hormones. J Reticuloendothel Soc 1982;32:397-407. [ Links ]
21. Cornell RP. Endogenous gut-derived bacterial endotoxin tonically primes pancreatic secretion of insulin in normal rats. Diabetes 1985;34:1253-1259. [ Links ]
22. Sánchez RP, Sanz JM, Martín AP, Martín ER, Mon Soto MA, García MS. Balance entre citocinas pro y antiinflamatorias en estados sépticos. Med Intensiva 2005;29:151-158. [ Links ]
23. Rajala MW, Scherer PE. The adipocyte: at the crossroads of energy homeostasis, inflammation, and atherosclerosis. Endocrinology 2003;144:3765-3773. [ Links ]
24. Yamagishi S, Nakamura K, Jinnouchi Y, Takenaka K, Imaizumi T. Molecular mechanisms for vascular injury in the metabolic syndrome. Drugs Exp Clin Res 2005;31:123-129. [ Links ]
25. Nicoletti G, Giugliano G, Pontillo A, Cioffi M, D'Andrea F, Giugliano D, et al. Effect of a multidisciplinary program of weight reduction on endothelial function in obese women. J Endocrinol Invest 2003;26:RC5-RC8. [ Links ]
26. Kopp HP, Kopp CW, Festa A, Krzyzanowska K, Kriwanek S, Minar E, et al. Impact of weight loss on inflammatory proteins and their association with the insulin resistance syndrome in morbidly obese patients. Arterioscler Thromb Vasc Biol 2003;23:1042-1047. [ Links ]
27. Charriere G, Cousin B, Arnaund E, André M, Bacou F, Pénicaud L, et al. Preadipocyte conversion to macrophage. Evidence of plasticity. J Biol Chem 2003;278:9850–9855. [ Links ]
28. Ouchi N, Kihara S, Funahashi T, Nakamura T, Nishida M, Kumada M, et al. Reciprocal association of C-reactive protein with adiponectin in blood stream and adipose tissue. Circulation 2003;107:671-674. [ Links ]
29. Weisberg SP, McCann D, Desai M, Rosenbaum M, Leible RL, Ferrante AW Jr. Obesity is associated with macrophage accumulation in adipose tissue. J Clin Invest 2003;112:1796-1808. [ Links ]
30. Xu H, Barnes GT, Yang Q, Tan G, Yang D, Chou CJ, et al. Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance. J Clin Invest 2003;112:1821-1830. [ Links ]
31. Kvasnicka T, Kvasnicka J, Ceska R, Grauova B, Vrablik M. Increasing plasma levels of soluble cell adhesion molecules (sE-Selectin, sP-Selectin and sICAM-1) in overweight adults with combined hyperlipidemia. Sb Lek 2001;102:473-477. [ Links ]
32. Gerhardt CC, Romero IA, Cancello R, Camoin L, Strosberg AD. Chemokines control fat accumulation and leptin secretion by cultured human adipocytes. Mol Cell Endocrinol 2001;175:81-92. [ Links ]
33. Bruun JM, Lihn AS, Madan AK, Pedersen SB, Schiott KM, Fain JN, et al. Higher production of interleukin-8 in visceral compared to subcutaneous adipose tissue: implications of non-adipose cells in adipose tissue. Am J Physiol Endocrinol Metab 2004;286:E8-E13. [ Links ]
34. Nakatani Y, Kaneto H, Kawamori D, Yoshiuchi K, Hatazaki M, Matsuoka T, et al. Involvement of endoplasmic reticulum stress in insulin resistance and diabetes. J Biol Chem 2005;280:847-851. [ Links ]
35. Trayhurn P, Wood IS. Adipokines: inflammation and the pleotropic role of white adipose tissue. Br J Nutr 2004;92:347-355. [ Links ]
36. Lowell BB, Shulman GI. Mitochondrial dysfunction and type 2 diabetes. Science 2005;307:384-387. [ Links ]
37. Lin Y, Chen Y, Cline GW, Zhang D, Zong H, Wang Y, et al. The hyperglycemia-induced inflammatory response in adipocytes: the role of reactive oxygen species. J Biol Chem 2005;280:4617-4626. [ Links ]
38. Saltiel AR, Kahn CR. Insulin signalling and the regulation of glucose and lipid metabolism. Nature 2001;414:799-806. [ Links ]
39. Hotamisligil GS, Budavari A, Murray D, Spiegelman BM. Reduced tyrosine kinase activity of the insulin receptor in obesity-diabetes. Central role of tumor necrosis factor-α. J Clin Invest 1994;94:1543-1549. [ Links ]
40. Perseghin G, Petersen K, Shulman GI. Cellular mechanism of insulin resistance: potential links with inflammation. Int J Obes Relat Metab Disord 2003;27:S6-S11. [ Links ]
41. Lolmede K, Durant de Saintfront V, Galizky J, Lanfontan M, Bouloumie A. Effects of hypoxia on the expression of proangiogenic factors in differentiated 3T3-F442A adipocytes. Int J Obes 2003;27:1187-1195. [ Links ]
42. Höpfl G, Ogunshola O, Gassmann M. HIFs and tumors. Causes and consequences. Am J Physiol Regul Integr Comp Physiol 2004;286:R608-R623. [ Links ]
43. Almanza-Pérez JC, Blancas-Flores G, García-Macedo R, Alarcón-Aguilar FJ, Cruz M. Leptina y su relación con la obesidad y la diabetes mellitus tipo 2. Gac Méd Méx 2008;144:535-542. [ Links ]
44. Alarcon-Aguilar FJ, Almanza-Perez J, Blancas G, Angeles S, García-Macedo R, Roman R, Cruz M. Glycine regulates the production of pro-inflammatory cytokines in lean and monosodium glutamate-obese mice. Eur J Pharmacol 2008;599:152-158. [ Links ]
45. García-Macedo R, Sanchez-Muñoz F, Almanza-Perez JC, Duran-Reyes G, Alarcon-Aguilar F, Cruz M. Glycine increases mRNA adiponectin and diminishes pro-inflammatory adipokines expression in 3T3-L1 cells. Eur J Pharmacol 2008;587:317-321. [ Links ]














