Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.67 no.1 México ene./feb. 2010
Artículo original
Resistencia a linezolid en Staphylococcus aureus resistente a meticilina y enterococos con elevada resistencia a aminoglucósidos en un hospital pediátrico de tercer nivel
Resistance to linezolid in methicillin-resistant Staphylococcus aureus and Enterococcus with high-level resistance to aminoglycosides in a third-level pediatric hospital
Norma Velázquez-Guadarrama1, Juan Carlos Vigueras Galindo1, Gerardo Escalona Venegas1, José Arellano Galindo1, Silvia Giono Cerezo3, Margarita Nava Frías2
1 Laboratorio de Bacteriología Intestinal
2 Departamentó de Infectología, Hospital Infantil de México Federico Gómez
3 Laboratorio de Bacteriología Médica, Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional, México D.F., México
Autor de correspondencia:
Dra. Norma Velázquez Guadarrama
Correo electrónico: normave@yahoo.com
Fecha de recepción: 04-12-2008.
Fecha de aceptación: 17-09-2009.
Resumen
Introducción: El surgimiento de resistencia a oxazolidinonas en Staphylococcus aureus resistentes a meticilina (SAMR) y Enterococcus spp con elevada resistencia a aminoglucósidos (EERA), aún cuando no han sido expuestos al antibiótico, es una de las principales razones para el control en el uso clínico de estos antibióticos.
Métodos: Se estudiaron 95 cepas de SAMR y EERA, las cuales fueron aisladas de enero 2003 a diciembre 2007 en el Hospital Infantil de México Federico Gómez; se identificaron por pruebas convencionales. Se evaluó la susceptibilidad a diversos antimicrobianos incluyendo linezolid de acuerdo al Instituto de Estándares Clínicos y de Laboratorio (CLSI). Se comprobó la elevada resistencia a aminoglucósidos al amplificar los genes aac(6')-le, aph(2")-la y ant(6') en enterococos y el tipo de cásete cromosomal estafilocócico mee (SCCmec) asociado a la resistencia a meticilina en S. aureus, por técnicas moleculares previamente descritas.
Resultados: Todas las cepas de SAMR mostraron el SCCmec tipo II. El 100% de los enterococos con fenotipo EERA mostraron genes asociados con los niveles elevados de resistencia a aminoglucósidos. El 12% (6/50) de EERA presentó valores intermedios a linezolid (concentración inhibitoria mínima (CIM) de 4 μg/mL) y sólo una cepa fue resistente (CIM 128 μg/mL); un aislamiento fue resistente a vancomicina fenotipo y genotipo van A, pero sensible a linezolid. El 2.2% (1/45) de los SAMR fue resistente a linezolid (CIM 8 μg/mL).
Conclusión: Linezolid es una opción terapéutica de gran valor clínico. Sin embargo, son necesarios monitoreos continuos para conocer el riesgo de surgimiento de cepas resistentes y establecer lineamientos en el uso apropiado del antibiótico.
Palabras clave: linezolid, Staphylococcus aureus resistentes a meticilina, Enterococcus spp, resistencia elevada a aminoglucósidos.
Abstract
Background: The emergence of resistance to the oxazolidinones by methicillin-resistant Staphylococcus aureus (MRSA) and high-level aminoglycoside-resistant (HLRA) Enterococcus spp not exposed is one of the main reasons for control of the clinical use of these antibiotics.
Methods: We studied 95 strains of MRSA and HLAR, which were isolated from January 2003 to December 2007 at the Hospital Infantil de México Federico Gómez. The strains were identified by conventional tests. Antimicrobial susceptibility was evaluated for several antimicrobial agents including linezolid according to the Clinical and Laboratory Standards Institute (CLSI). The high resistance to aminoglycosides was tested by amplification of genes aac (6')-/e, aph (2")-and ant (6') in enterococci. Staphylococcal cassette chromosomal mec (SCCmec) associated with MRSA was identified by molecular techniques described previously.
Results: All MRSA strains showed SCCmec type II, and 100% of enterococci strains with phenotype HLAR showed genes associated with high-level aminoglycoside resistance; 12% of HLAR enterococci strains showed intermediate values to linezolid (MIC 4 μg/mL) and only one strain was resistant (MIC 128 μg/mL). Of the MRSA strains, 2.2% were resistant to linezolid (MIC 8 μg/mL).
Conclusion: Linezolid is a clinically valuable option as a form of therapy. However, continuous surveillance is necessary to determine the emergent risk of resistance strains and to establish guidelines for appropriate use.
Key words: linezolid, methicillin-resistant Staphylococcus aureus, high-level-resistant aminoglycosides.
Introducción
La emergencia de bacterias Gram positivas con resistencia a los antimicrobianos es un problema de máxima importancia a nivel mundial. S. aureus resistente a meticilina (SAMR) y Enterococcus spp con elevada resistencia aminoglucósidos (EERA) son causa frecuente de infecciones nosocomiales, las cuales deterioran más la calidad de vida del paciente al elevar sustancialmente los índices de morbilidad y mortalidad, particularmente en las unidades de cuidados intensivos.1-3 Los principales factores de riesgo para adquirir este tipo de microorganismos son las largas estancias hospitalarias, los tratamientos prolongados y el ¡nmunocompromiso.2
Enterococccus faecalisy E. faecium son las especies de mayor relevancia clínica.4 En Estados Unidos de Norte América constituyen la tercera causa de infección hospitalaria y de bacteriemia.5 Por su parte, en América Latina, datos del programa SENTRY de vigilancia de resistencia los ubican en el octavo lugar como causa de bacteriemia y en el cuarto como causa de infección urinaria y de sitio quirúrgico.6 Particularmente E. faecium presenta resistencia intrínseca y/o adquirida a diversos antibióticos clínicamente importantes, tales como β-lactámicos (penicilinas y cefalosporinas), aminoglucósidos (gentamicina y estreptomicina), lincosamidas (dindamicina) y glucopéptidos (vancomicina). El tratamiento comúnmente empleado en sepsis relacionadas con enterococos, es la combinación de un inhibidor de la síntesis de pared celular como penicilina, ampicilina o vancomicina con un aminoglucósido. Sin embargo, la presencia de EERA (concentración inhibitoria mínima (CIM) de > 2000μg/ mL para estreptomicina y > 500/μg/mL para gentamicina ) hace inefectivo el sinergismo.7
Por su parte, SAMR esta presente en 30 a 50 % de los aislados intrahospitalarios alrededor del mundo; es la causa principal de brotes nosocomiales, sobretodo en adultos y en salas de cuidados intensivos.8 La resistencia a meticilina y otros β-lactám¡cos en los SAMR se debe principalmente a la presencia del gen mecA, el cual está situado en un elemento genético móvil llamado casete cromosomal estafilocócdco (SCCmec por sus siglas en inglés). A la fecha se han descrito 5 tipos de SCCmec (I-V), todos ellos portan genes que regulan mee y en el caso del los tipo SCCmec II y III contienen, además, genes de resistencia a otros antibióticos no β-lactám¡cos, por lo que se establece la multiresistenda en este tipo de cepas.9
Existen hasta el momento pocas alternativas de tratamiento para los SAMR multiresistentes, siendo vancomicina, linezolid y daptomicina algunos de ellos.10 Sin embargo, el uso frecuente e inadecuado de vancomicina pone en alerta a la comunidad médica por el daño que puede ocasionar el tratamiento, así como los eventos adversos frecuentemente reportados (diarrea, dolor de cabeza, náuseasy vómito).11-12 Además, existe la posibilidad de seleccionar clonas de enterococos y estafilococos resistentes a vancomicina, las cuales podrían diseminarse alrededor del mundo, tal como sucedió con el SAMR.12-13 A nivel mundial son cada vez más los reportes de aislamientos de Enterococcus spp vancomicina resistentes (EVR) y S. aureus con valores intermedios o susceptibilidad disminuida a vancomicina. Lo anterior limita los antimicrobianos disponibles para el tratamiento de enfermedades relacionadas a dichos microorganismos.14
Desde el año 2000, linezolid fue el primer representante de un nuevo grupo de antimicrobianos sintéticos llamadas oxazolidinonas. El linezolid recibió la aprobación de la Food and Drug Administration (FDA) para su uso en diversas patologías infecciosas (neumonía nosocomial y comunitaria, infecciones de piel y tejidos blandos, entre otras), las cuales son causadas por diversos microorganismos entre ellos el SAMR.10 Asimismo, en infecciones por Enterococcus spp resistente a vancomicina.15
Por lo anterior, el objetivo de este trabajo fue identificar la frecuencia de SAMR y EERA resistentes a linezolid.
Métodos
Material biológico
En el presente trabajo se estudiaron 45 aislamientos de SAMR y 50 de EERA (40 E. faecalis, 9 E. faecium y 1 E. casseliflavus) de una colección original de 750 aislamientos de diversos procesos infecciosos (500 de enterococos y 250 de S. aureus). Estos ocurrieron durante el periodo de enero 2003 a diciembre 2007 en el Hospital Infantil de México Federico Gómez. Las cepas se conservaron a -76 °C hasta su empleo.
Durante el estudio fueron empleadas diversas cepas de referencia ATCC:
• 51299. Enterococcus faecalis con elevada resistencia a aminoglucosidos y resistente a vancomicina con fenotipo y genotipo van B.
• 29212. E. faecalis sensible a aminoglucosidos y vancomicina.
• 25923. S. aureus sensible a meticilina para CIM por el método de dilución en agar.
• USA 300. S. aureus tipo II de SCCmec.
Identificación microbiológica
Las cepas de S.aureus y Enterococcus spp fueron identificadas por pruebas convencionales, morfología colonial y microscópica. Para el S. aureus se empleó la prueba de coagulosa y en el caso de los enterococos se realizó la prueba de crecimiento en caldo cerebro-corazón (BHI) a 6.5% de NaCI e hidrólisis de bilis-esculina; además, la identificación de especie de los dos géneros fue por su metabolismo a carbohidratos y en enterococos se empleó la prueba diferencial con telurito de potasio.16
Susceptibilidad antimicrobiana
El perfil de susceptibilidad antimicrobiana se realizó mediante la concentración inhibitoria mínima (CIM) por el método de dilución en agar de acuerdo al Instituto de Estándares Clínicos y de Laboratorio (CLSI antes NCCLS, 2005);17 En S. aureus se probó oxacilina (Sigma-Aldrich, St Louis, MO), clindamicina (Sigma-Aldrich, St Louis, MO), eritromicina (MP Biomedicals, Cleveland OH), vancomicina (MP Biomedicals, Cleveland OH) y linezolid (Pfizer, France). En el caso de los EERA se realizó la prueba de escrutinio a estreptomicina y gentamicina (2000 y 500μ/g/rml en agar Mueller Hinton respectivamente). Asimismo, en EERA se determinó susceptibilidad a ampicilina, ciprofloxacina, vancomicina y linezolid.
Extracción DNA bacteriano
Los cultivos crecidos en 5 ml de caldo BHI durante 24 h a 37 °C, se concentraron y resuspendieron en 500 ¿/L de Tris HCI PH8.0 50mM, EDTA50mM. Para la extracción de DNA de las cepas de S. ou-reus y enterococcos fue necesario un tratamiento enzimático previo: lisostafina 0.65 mg/mL (Sigma-Aldrich, St Louis, MO) para SAMR, y mutanolisina 0.1 mg/mL (Sigma-Aldrich), proteinasa K 12.5 μg/ mL (Sigma-Aldrich) y lisozima 0.25 mg/mL (Sigma-Aldrich) para enterococos. Después del tratamiento enzimático, en ambos microorganismos se extrajo el DNA por el método de extracción comercial Wizard (Promega, Madison Wl).
Identificación del SCCmec en SAMR
La amplificación de SCCmec se llevó a cabo mediante una PCR múltiple descrita previamente por Zhang y col. en 2005,18 con algunas modificaciones. En general, la reacción se realizó empleando 50 μL de una mezcla con 100 ng de DNA bacteriano, 2.5 mM de MgCI2, 0.2 mM dNTP, 1 U de Taq DNA polimerasa, 1 μL de cada iniciador (Cuadro 1) y agua libre de nucleasas. Las amplificaciones se realizaron en un termociclador bajo las siguientes condiciones: desnaturalización a 94°C por 5 minutos, 10 ciclos de 45 segundos de desnaturalización a 94°C; 45 segundos de alineamiento a 65°C, y 1.5 minutos de extensión a 72°C y 25 ciclos de 45 segundos a 94°C; 45 segundos a 55°C, y 1.5 minutos a 72°C, terminando con una extensión final de 1 0 minutos a 72°C, para SCCmec.
Identificación de los genes de resistencia a gentamicina y estreptomicina [aac(6 ')-le aph(2")-la y ant(6') respectivamente] en EERA
Para la amplificación de los genes de resistencia a gentamicina y estreptomicina se realizó una mezcla de50 μL con: lOOng de DNA bacteriano, 2.5 mM de MgCI2, 0.2 mM dNTP, 1 U de Taq DNA polimerasa, 1 μL de cada iniciador (Cuadro 1) y agua libre de nucleasas. Las condiciones de la amplificación fueron las siguientes: desnaturalización a 94°C por 5 minutos, 35 ciclos de 1 minuto de desnaturalización a 94°C, 1 minuto de alineamiento a 57°C, y 1 minuto de extensión a 72°C.19-20
Resultados
Del total de los aislamientos 62% provenían de hemocultivos, 19% de urocultivos y 19% de varios orígenes (líquido cefalorraquídeo, bronco aspirado, líquido peritoneal y punta de catéter).
Más del 50% de los aislamientos estudiados de Enterococcus spp provenían de pacientes con sepsis con o sin foco identificado, seguidos de 23 casos de bacteriemias (primaria y secundaria). El 1 00 % de los pacientes con SAMR tuvieron un dispositivo ¡ntravascular; a 40% se les retiró por colonización y 15% de ellos tuvieron infección relacionada a catéter venoso central.
En este trabajo se observó resistencia a linezolid en los microorganismos de estudio en 2.1 % (2/95).
A todas las cepas de SAMR se les identificó el casete cromosomal SCCmec tipo II (Fig. 1), 1 00% de los aislamientos fueron sensibles a vancomicina y se observó resistencia en 97.7, 82.2 y 70% a eritromicina, clindamidna y dprofloxadna, respectivamente. Del total de cepas de SAMR, 71.6 % mostraron resistencia a más de tres grupos de antibióticos. Una sola cepa mostró resistencia a linezolid (≤20 mm y CIM de 8 μg/ml) (Fig. 2).

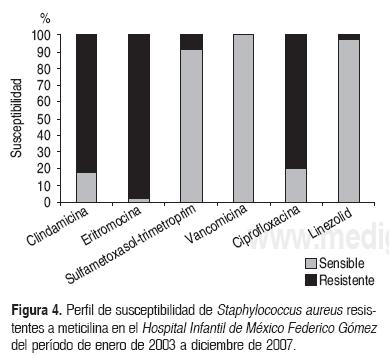
A los EERA se les identificaron los genes asociados a elevada resistencia a aminoglucosidos: aac(6')-le aph(2")-la (Gm) y ant(6') (Sm) (Fig. 3). El 48% de las cepas fue resistente además a ampidlina, 66% a dprofloxadna, una fue resistente a vancomicina con fenotipo y genotipo de Van A (CIM de 128 μg/mL a vancomicina y 64 μg/mL a teicoplanina). Sólo un aislamiento fue resistente a linezolid por valor de CIM de 128 μg/mL y seis cepas mostraron valores intermedios (21 mm por el método de Kirby-Bauerycon CIM de 4 μg/mL). La cepa resistente a vancomicina fue sensible a linezolid. La Figura 4 muestra el perfil de susceptibilidad en EERA.

Discusión
La resistencia a múltiples antibióticos especialmente en infecciones nosocomiales es un problema de salud pública mundial. Staphylococcus aureus y Enterococcus spp son microorganismos que han mostrado un aumento en la resistencia a los antibióticos de uso frecuente en infecciones nosocomiales graves, en particular en pacientes con cáncer.21 El surgimiento de resistencia o susceptibilidad disminuida a vancomicina por estos microorganismos, ha condicionado el empleo de antibióticos de nueva generación, como linezolid y daptomicina como opciones terapéuticas importantes.10,22
Linezolid ejerce su acción por inhibición de la síntesis de proteínas en forma temprana, por unión al sitio 23S del RNA ribosomal bacteriano de la subunidad 50S, previniendo la formación del complejo 70S funcional, que es un componente esencial en el proceso de síntesis.23 Debido a este único mecanismo, se consideraba hasta hace algunos años que linezolid no tenía resistencia cruzada con otros antibióticos. A la fecha, se conoce que el desarrollo de resistencia a linezolid en cocos Gram positivos se debe a la mutación puntual del gen 23S del RNA (G2576T).24
En la mayoría de las bacterias, el gen 23S del RNA está en múltiples copias, razón por la cual inicialmente se consideró baja la posibilidad de reportes de resistencia a linezolid. Además, Meka VG y cois.23 observaron que la ausencia de presión del antibiótico podría restaurar la sensibilidad a linezolid. Por su parte, Tsakris A y cois.24 demostraron que la mutación tiene un impacto mínimo cuando está en una sola copia, en el operan de rRNA, en ausencia de presión selectiva del antibiótico. Asimismo, en el trabajo realizado por Pillai y cois.25 se observó que la cepa de S. aureus A7817 resistente a linezolid, permanecía sin cambios después de 15 pases en medios sin antibiótico; lo que sugiere que la estabilidad del fenotipo de resistencia in vitro se debe principalmente a que la cepa presenta la mutación en múltiples copias del gen. En este trabajo se aislaron dos cepas resistentes a linezolid: EERA (128 μg/mL) y SAMR (8 μg/mL); sin embargo, en ningún caso se documentó el uso previo del antibiótico; el enterococo fue aislado de punta de catéter, mientras que el SAMR se asoció a bacteriemia primaria. Qan y cois.,26 en un estudio reciente, reportaron el caso de un paciente colonizado por una cepa de Enterococcus faecalis resistente a vancomicina y linezolid. Lo anterior sugiere la necesidad de un monitoreo continuo y cuidadoso de cepas colonizantes, para evitar fallas en el tratamiento y la diseminación de estos microorganismos en pacientes de riesgo.
La resistencia a linezolid de cepas, aún sin la exposición al fármaco, puede deberse al uso de antibióticos como el cloranfenicol que probablemente produce mutaciones en el gen 23S, lo que induce resistencia cruzada a linezolid.27
El Hospital Infantil de México Federico Gómez que es un hospital de tercer nivel, atiende en su mayoría pacientes con algún tipo de cáncer. Prolongadas estadías en el nosocomio, el uso de antibióticos por periodos largos y el uso de dispositivos ¡ntravasculares, son factores de riesgo para adquirir infecciones nosocomiales causadas por el SAMR y EERA, situación que puede empeorar la condición clínica del paciente; por esta razón, el uso de antibióticos como linezolid puede ayudar a estos pacientes.
En este trabajo, se observó baja frecuencia de resistencia a linezolid en los SAMR en comparación con el trabajo realizado por Ashoury cois., en pacientes con cáncer, donde se observó 15.4% de resistencia.21 En el caso de enterococos, no hubo cepas resistentes; sólo 12% mostraron valores intermedios (4 μ/mL). Sin embargo, un trabajo realizado por González y cois.,28 se reporta la disminución de la susceptibilidad a linezolid en EVR en uno de 45 pacientes tratados con el antibiótico y un trabajo realizado en Korea por 7 años, mostró un aumento en la resistencia al antibiótico de 0 a 71 % en cepas de EVR, después de la introducción de linezolid.29
Los factores que pudieran condicionar el uso de linezolid son: la emergencia de cepas multiresistentes de SAMR y EERA, el surgimiento de resistencia o susceptibilidad disminuida a vancomicina, aunado a que puede administrarse por vía oral, lo que permite tratamientos ambulatorios prolongados. Sin embargo, es importante la vigilancia del empleo de dicho antibiótico debido a la posible aparición de alteraciones hematológicas en los pacientes pediátricos, aunado al surgimiento de cepas resistentes.12,30 De la misma forma que surgió la resistencia a otros antibióticos, la resistencia a linezolid sucedió por el uso frecuente, por lo que es necesario el establecimiento de medidas para evitar el uso indiscriminado de antibióticos de nueva generación, y no promover la selección de clonas resistentes.
Agradecimientos
Los autores agradecemos a las pQBP Monica Lilian Contreras Ortiz y pQBPTania Dalet Várela Salinas por su ayuda técnica.
Referencias
1. Tenover FC. The challenges of emerging infectious diseases. Development and spread of multiply-resistant bacterial pathogens. JAMA 1996;275:300-304. [ Links ]
2. Murray BE. Vancomycin-resistant enterococcal infections. New Engl J Med 2002;342:710-721. [ Links ]
3. Smith RL, Evans HL, Chong TW, McElearney ST, Hedrick TL, Swenson BR, et al. Reduction in rates of quarterly linezolid-vancomycin cycling in a surgical intensive care unit. Surg Infect 2008:9:423-431. [ Links ]
4. Facklam RR, Sahm DF, Teixeira LM. Enterococcus. In: Murray P Baron EJ, Pfaller MA, Tenover FC, Yolken RH, eds. Manual of Clinical Microbiology. Washington, DC: ASM Press; 1999. pp. 297-300. [ Links ]
5. Moellering RC. Emergence of Enterococcus as a significant pathogen. Clin Infect Dis 1992,14:1173-1176. [ Links ]
6. Bazet C, Blanco J, Seija Y Palacio R. Enterococos resistentes a vancomicina. Un problema emergente en Uruguay. Rev Med Uruguay 2005;21:151-158. [ Links ]
7. Randhawa VS, Kapoor L, Singh V, Mehta G. Aminoglycoside resistance in enterococci isolated from paediatric septicaemia in a tertiary care hospital in north India. Indian J Med Res 2004,11 9:77-79. [ Links ]
8. Yhu-Chering H, Yi-Hong C, Lin-Hui S, Rey-ln L, Tzou-Yien L. Methicillin-resistant Staphylococcus aureus colonization and its association with infection among infants hospitalized in neonatal intensive care units. Pediatrics 2006; 118:469-474. [ Links ]
9. Deurenberg RH, Vink C, Kalenic S, Friedrich AW, Bruggeman CA, Stobberingh EE. The molecular evolution of methicillin-resistant Staphylococcus aureus. Clin Microbiol Infect 2007; 13:222-235. [ Links ]
10. Leonard SN, Cheung CM, Rybak MJ. Activities of cefto-biprole, linezolid, vancomicina, and daptomycin against community-associated and hospital-associated methicillin-resistant Staphylococcus aureus. Antimicrob Agents Chemother 2008,52:2979-2976. [ Links ]
11. Perry CM, Jarvis B. Linezolid: a review of its use in the management of serius gram-positive infections. Drugs 2001;61:525-551. [ Links ]
12. Youssef S, Hachem R, Chemaly RF, Adachi J, Ying J, Rolston K, et al. The role of vitamin B6 in the prevention of haematological toxic effects of linezolid in patients with cancer. J Antimicrob Chemother 2008,61:421-424. [ Links ]
13. Tenover FC. Development and spread of bacterial resistance to antimicrobial agents: An overview. Clin Infect Dis 2001;33(suppl 3):108-115. [ Links ]
14. Gold HS, Pillai SK. Antistaphylococcal. Agents Infect Dis Clin N Am 2009:23,99-131. [ Links ]
15. Shinabarger DL. Mechanism of action of the oxazolidione antibacterial agent. Expert Opin Investig Drugs 1999,8:1195-1202. [ Links ]
16. Facklam RR, Sahm DF, Teixeira LM. Enterococcus. In: Murray P Baron EJ, Pfaller MA, Tenover FC, Yolken RH, eds. Manual of Clinical Microbiology. Washington, DC: ASM Press; 1999. pp. 301-305. [ Links ]
17. CLSI. 2005. Performance Standards for Antimicrobial Disk Susceptibility Tests; Approved Standard-9th Edition MIDO-S 15(25)1. [ Links ]
18. Zhang K, McClure JA, Elsayed S, Louie T, Conly JM. Novel multiplex PCR assay for characterization and concomitant subtyping of staphylococcal cassette chromosome mec types I to V in methicillin-resistant Staphylococcus aureus. J Clin Microbiol 2005,43:5026-5033. [ Links ]
19. Qu TT, Chen YG, Yu YS, Wei ZQ, Zhou ZH, Li LJ. Genoty-pic diversity and epidemiology of high-level gentamicin resistant Enterococcus in a Chinese hospital. J Infect 2006,52:124-130. [ Links ]
20. Suk-Kyung L, Tanimoto K, Tomita H, Ike Y. Pheromone-responsive conjugative vancomycin resistance plasmids in Enterococcus faecalis isolates from human and chicken feces. Am Soc Microbiol 2006;72:6544-6553. [ Links ]
21. Ashour HM, El-Sharif A. Microbial spectrum and antibiotic susceptibility profile of gram-positive aerobic bacteria isolated from cancer patients. J Clin Oncol 2007,25:5763-5769. [ Links ]
22. Linden PK. Treatment options for vancomycin-resistant enterococcal infections. Drugs 2002,62:425-441. [ Links ]
23. Meka V, Gold H, Cooke A, Ventakataraman L, Eliopoulos GM, Moellering RCjr, et al. Reversion to susceptibility in a linezolid-resistant clinical isolate of Staphylococcus aureus. J Antimicrob Chemother 2004,54:818-820. [ Links ]
24. Tsakris A, Pillai SK, Gold HS, Thauvin-Eliopoulos C, Ventakataraman L, Wennersten C, et al. Persistance of rRNA operon mutated copies and rapad re-emergence of linezolid resistance in Staphylococcus aureus. J Antimicrob Chemother 2007,60:649-651. [ Links ]
25. Pillai SK, Sakoulas G, Wennersten, Eliopoulos GM, Moellering RCjr, Ferrara MJ, et al. Linezolid resistence in Staphylococcus aureus: Characterization and stability of resistent phenotipe. J Infect Dis 2002,186:1603-1607. [ Links ]
26. Cian F, Luzzati R, Dejana ML, Ferrantelli N, Tonin EA, Lagatolla C, et al. Colonisation of the tip of a thoracic catheter by Enterococcus faecalis resistant to vancomycin and linezolid. J Med Microb 2009,58:1 11 8-1 121. [ Links ]
27. Besier S, Ludwig A, Zander J, Brade V, Wichelhaus TA. Linezolid resistance in Staphylococcus aureus: Gene dosage effect, stability, fitness costs, and crossresistances. Antimicrob Agents Chemother 2008;52: 1570-1572. [ Links ]
28. Gonzalez RD, Schrecenberger PC, Graham MB, Kelkar S, Denuesten K, Quinn JP Infections due to vancomicyn-resistent Enterococcus faecium resistant to linezolid. Lancet 2001,357:1179. [ Links ]
29. Do KL, Yuna K, Kun SP, Jae WY, Kyungjae K, Nam JH. Antimicrobial activity of mupirocin, daptomycin, linezolid, quinupristin/dalfopristin and tigecycline against vancomycin-resistant Enterococci (VRE) from clinical isolates in Korea (1998 and 2005) Biochem Mol Biol 2007,40:881-887. [ Links ]
30. Acha V, Zaragüeta M, Martínez Y, Cobo F Linezolid-induced anemia. Enferm Infecc Microbiol Clin 2003,21:321-322. [ Links ]














