Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.66 no.6 México nov./dic. 2009
Artículo de revisión
Tejido adiposo intra-abdominal: crecimiento, evaluación y su asociación con el desarrollo de problemas metabólicos en niños y adolescentes
Intra-abdominal adipose tissue: growth, assessment and association with the development of metabolic alterations in children and adolescents
Norma Ramos-Ibáñez
Departamento de Atención a la Salud, Universidad Autónoma Metropolitana Unidad Xochimilco, México, D. F, México.
Autor de correspondencia:
Norma Ramos Ibáñez.
Correo electrónico: nramos@correo.xoc.uam.mx
Fecha de recepción: 08-09-08
Fecha de aprobación: 24-03-09
Resumen
La presente revisión tiene como objetivo mostrar el incremento del tejido adiposo intra-abdominal (TAIA) durante la etapa de crecimiento, los métodos de medición del TAIA, y su posible asociación con el desarrollo de problemas metabólicos durante la niñez y adolescencia. El TAIA se caracteriza por tener alta actividad lipolítica y secreción de adipocinas que favorecen el desarrollo de resistencia a la insulina, dislipidemias e hipertensión arterial. El TAIA aumenta de manera natural durante la etapa de crecimiento; sin embargo, se observa una amplia variación en la cantidad de TAIA entre niños y jóvenes. La resonancia magnética y tomografía axial computarizada (TAC) son los métodos más exactos para medir el TAIA, pero el costo de estos métodos limita su uso a nivel poblacional. No es recomendable usar la TAC para medir el TAIA en niños sanos por la exposición a radiaciones. Hasta el momento no se han establecido métodos alternativos para medir con precisión este tejido. El TAIA presenta una asociación positiva con la presión arterial, las concentraciones de insulina, de triglicéridos y de lipoproteínas de baja densidad (LDL), y con la disminución del tamaño de las partículas de LDL; además de una asociación negativa con las concentraciones de lipoproteínas de alta densidad (HDL).
Palabras clave. Tejido adiposo intra-abdominal, adipocinas, resistencia a la insulina, dislipidemias, hipertensión arterial.
Abstract
The aim of the present review is to demonstrate the increase of intra-abdominal adipose tissue (IAAT) during growth and development and to describe methods to assess IAAT and the possible association with the development of metabolic alterations during childhood and adolescence. IAAT is characterized to have a high lipolytic activity and adipocytokine secretion that favor the development of insulin resistance, dyslipidemia and hypertension. IAAT naturally increases during growth in childhood; however, there is a wide variation in the amount of IAAT between children and adolescents. Magnetic resonance imaging and computerized axial tomography (CAT) are the most accurate methods to assess IAAT, but the cost of these methods limits their use at the population level. It is not recommended to use CAT to assess IAAT in healthy children due to radiation exposure. Currently, alternative methods have not been established to accurately assess this tissue. IAAT presents a positive association with blood pressure, insulin concentration, triglycerides and low-density lipoproteins (LDL), a decrease in the size of LDL particles, and a negative association with the concentrations of high-density lipoproteins.
Key words: intra-abdominal adipose tissue, adipocytokines, insulin resistance, dyslipidemia, hypertension.
La obesidad en niños y adolescentes es un problema de salud que está aumentando día con día en países desarrollados y en vías de desarrollo.1,2 El exceso de tejido adiposo aumenta el riesgo de presentar resistencia a la insulina, dislipidemias e hipertensión arterial. Particularmente, la acumulación de tejido adiposo intra-abdominal (TAIA) (tejido ubicado alrededor de las visceras en la cavidad abdominal) tiene mayor influencia en el desarrollo de estas complicaciones metabólicas (Fig. 1).

El TAIA se divide en dos zonas: intraperitoneal y extraperitoneal o retroperitoneal.3 La zona intraperitoneal es drenada por el sistema porta y tiene una conexión directa con el hígado. El área retroperitoneal se ubica a lo largo del borde dorsal de los intestinos y la superficie ventral de los ríñones, y no tiene ninguna conexión vascular con el hígado.4
Características metabólicas del TAIA
El TAIA se caracteriza por tener alta concentración de adrenoreceptores β (β1, β2, β3) que aumentan su sensibilidad a catecolaminas. La estimulación de estos receptores favorece la lipólisis, originando con ello la liberación de ácido grasos libres del TAIA al hígado a través del sistema porta. En contraste, el TAIA presenta menor concentración de adrenoreceptores a y adenosin, que inhiben la lipólisis, y disminuye la sensibilidad al efecto antilipolítico de la insulina.4
El TAIA también presenta receptores afines a andrógenos y estrógenos. La testosterona inhibe la actividad de la lipasa lipoproteica y estimula la movilización detriglicéridos en el TAIA, lo cual propicia menor acumulación de este tejido en el hombre.5 Los estrógenos, al igual que la testosterona, tienen control en la lipasa lipoproteica y reducen el crecimiento de TAIA en mujeres.4 Este efecto de las hormonas sexuales, sugiere que una disminución en su secreción puede favorecer la acumulación del TAIA una vez que se presenta la menopausia en las mujeres y la andropausia en los hombres.
El aumento de grasa en el TAIA se vincula también con la acción del eje hipotálamo-pituitaria-adrenal. La estimulación del hipotálamo produce liberación de la hormona corticotropina, la cual estimula la secreción de cortisol en las glándulas suprarrenales. El cortisol, por su parte, favorece la acumulación de triglicéridos en el TAIA e inhibe su movilización.5 La re-esterificación de triglicéridos es aproximadamente 50% mayor en el TAIA que en el tejido adiposo subcutáneo abdominal, lo cual parece estar regulado por la proteína estimuladora deaciladón.4
El TAIA secreta una serie de adipocinas de origen peptídico y no peptídico vinculadas a problemas metabolicos como: factor de necrosis tumoral alfa (TNFa), inhibidor activador del plasminógeno-1 (PAI-1), angiotensinógeno, interleucina 6, leptina, resistina y proteína estimuladora de acilación (ASP) (Fig. 2).
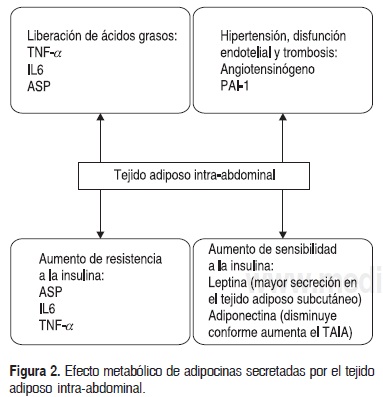
Estudios en adultos han mostrado que el TNF-a disminuye la actividad de los receptores de insulina, provocando resistencia a esta hormona.6 Esta adipocina también aumenta la actividad de la enzima lipasa hormono-sensible, que conduce a la liberación de ácidos grasos al hígado y mayor producción de lipoproteínas de baja densidad, favoreciendo con ello el desarrollo de ateroesclerosis.7 PAI-1 disminuye la actividad del sistema fibrinolítico e incrementa el riesgo de enfermedades vasculares.8 El angiotensinógeno se ha vinculado con la elevación de presión arterial, resultado de la mayor actividad del sistema renina-angiotensina.6
La interleucina 6, por su parte, regula la actividad de la lipasa lipoproteica e incrementa la liberación detriglicéridos al hígado.9
La leptina se une en el hipotálamo a receptores que estimulan péptidos anorexigénicos como el neuropéptidoY, produciendo con ello disminución del apetito y menor consumo de alimentos. Esta adipocina también inhibe el proceso de lipogénesis y aumenta la sensibilidad a la insulina.10 La leptina es secretada tanto en el área intra-abdominal como en la subcutánea. Sin embargo, la expresión del gen ob (el cual produce y secreta leptina), es menor en el TAIA que en el tejido adiposo subcutáneo.1112
La adipocina-resistina parece estar vinculada en la síntesis de glucosa hepática y del metabolismo de lípidos. Se le relaciona fuertemente con el desarrollo de resistencia a la insulina y riesgo cardiovascular en adultos.13,14 ASP aumenta la síntesis de triglicéridos, y en el TAIA propicia mayor secreción de ácidos grasos libres al hígado en comparación con el tejido adiposo subcutáneo.4,12
Por otro lado, la mayor acumulación de TAIA afecta la secreción de la adipocina denominada adiponectina. En niños con mayor cantidad de TAIA se observa baja concentración de esta adipocina, en comparación con aquellos con menor acumulación de grasa en esta zona (6.4 ± 0.6 mg/Lvs 10.2 ± 0.8 mg/L; P <0.001 ).15 La adiponectina es un regulador del sistema fribrinolítico, disminuye la formación de glucosa hepática y aumenta la sensibilidad a la insulina.16 La disminución de esta adipocina genera, por lo tanto, resistencia a la insulina, hipertensión y alteraciones en el proceso de fibrinólisis en niños y adultos.6 ,9,17 La interleucina 6 y el TNF-α son también potentes inhibidores de la secreción de adiponectina, lo que pudiera estar vinculado con el aumento de resistencia a la insulina.16
Medición directa y estimación del TAIA
La tomografía axial computarizada (TAC) y resonancia magnética son los métodos más precisos y exactos para medir el TAIA. Con estas técnicas de imagen se puede identificar con alta resolución pequeños depósitos de TAIA. Se ha observado que la medición de adiposidad realizada con estos métodos tiene una alta correlación (r =0.90) con la obtenida directamente en cadáveres.18 La TAC puede presentar un error de precisión de 4% en la medición del TAIA,19 mientras que la resonancia magnética mide el TAIA con un coeficiente de variación de 1.4 a 4.2%.20
La medición de TAIA es reportada en términos de superficie (cm2) o volumen (cm3) de un punto anatómico en el abdomen. La mayoría de los estudios reportan la medición del TAIA a nivel de las vértebras lumbares 4 y 5 (L4-L5), por ser considerada el área donde se deposita mayor cantidad de TAIA en niños.21 Sin embargo, se recomienda que la evaluación del TAIA se realice por medio de multi-imágenes desde la vértebra lumbar 1 a la 5, para aumentar la exactitud de la medición.22 No obstante, con este protocolo se aumenta el costo de la medición y, si se usa TAC para medir el TAIA, el tiempo de exposición a radiaciones. No es recomendable exponer a niños sanos a radiaciones por el riesgo de desarrollar cáncer.23 La resonancia magnética es más apropiada para medir el TAIA en niños porque con esta técnica no se emplean radiaciones ionizadas; en su lugar se utilizan campos magnéticos y ondas de radio para producir las imágenes24
La TAC y la resonancia magnética son técnicas empleadas para medir el TAIA, más frecuentemente en muestras de pocos individuos, por el alto costo que tiene el equipo (~ 1.5 millones de dólares), aunado al costo por cada imagen. Es necesario además, contar con un técnico capacitado para la toma de imágenes así como con personal entrenado, para establecer el valor de la medición del TAIA con un bajo error.
El peristaltismo intestinal o la respiración, son variables que pueden afectar la calidad de la imagen.25 Una baja resolución de la imagen puede conducir a una subestimación o sobreestimación de la medición del TAIA. En niños, además, puede resultar incómodo permanecer por algunos minutos dentro de los equipos de imagen, por lo que no se recomienda en individuos que presenten temor de estar en lugares cerrados.
Se han buscado alternativas menos costosas e invasivas para poder estimar o predecir con alta precisión el TAIA. Diferentes métodos de evaluación de la composición corporal y mediciones antropométricas como plestimografía, densitometría dual de rayos X, panículos adiposos, circunferencia de cintura y cadera han sido empleados en niños y adolescentes para estimar el área o volumen del TAIA. Estos se han utilizado en poblaciones de Estados Unidos de Norteamérica y del Reino Unido. Como se puede observar en el cuadro 1, las técnicas evaluadas presentan un alto coeficiente de variación (20-67%) para la estimación del área o volumen del TAIA en estas etapas de la vida.26,32 La circunferencia de cintura presenta el mayor coeficiente de variación para la estimación del TAIA, comparado con los métodos de laboratorio, panículos adiposos y el diámetro sagital junto con el índice cintura/cadera.
Cabe mencionar que, dentro de las mediciones antropométricas, la circunferencia de cintura se ha promovido como una herramienta para establecer la distribución de tejido adiposo en el área central y el riesgo de desarrollar problemas metabólicos en adulto.33 En niños y adolescentes, se ha empezado a recomendar su uso como una forma de prevención. En población mexicano-americana, valores de circunferencia de cintura por arriba del percentil 75 señala un cuidado especial por posibles alteraciones metabólicas y más aún si la circunferencia de cintura alcanza el percentil 90.34 Sin embargo, con esta medición no se puede establecer si el valor de la circunferencia de cintura es por la acumulación del tejido adiposo subcutáneo abdominal o por la acumulación de TAIA. Algunos estudios han mostrado que la circunferencia de cintura presenta un alto coeficiente de error en la estimación de TAIA en niños caucásicos.31,32 En una revisión de estudios, reportados en total 407 niños y adolescentes (7-16 años de edad) caucásicos e hispanos, se confirmó que la circunferencia de cintura presenta un alto coeficiente de variación (64.8%) en la estimación del área (a nivel de L4) del TAIA; ni la etnicidad y el sexo fueron variables que pudieran contribuir a incrementar la estimación del TAIA.35
Se ha establecido que el método empleado para evaluar el tejido adiposo en el área abdominal (infra-abdominal y subcutáneo) debe ser exacto y preciso, con un mínimo error en la medición.36 Tomando en cuenta estos criterios, los métodos evaluados hasta el momento no se pueden considerar alternativas exactas y precisas para sustituir el uso de la TAC y resonancia magnética en la medición del TAIA en niños y adolescentes. No obstante, algunos de los métodos evaluados podrían ser usados para tener una estimación aproximada del TAIA a un menor costo, o emplear mediciones antropométricas que son más accesible para estudios poblacionales.
Crecimiento del TAIA
Se ha estimado que la tasa de crecimiento del TAIA en niños es de 5.2 cm2 por año, a diferencia del tejido adiposo subcutáneo del área abdominal, donde el aumento es de 8 cm2 por año.37 Hasta el momento, no se ha establecido el valor promedio de TAIA a nivel poblacional por edad y sexo; tampoco el aumento de TAIA apropiado o saludable que pudiera presentarse durante la niñez y adolescencia. Algunos estudios han reportado el valor promedio de TAIA encontrado a nivel umbilical o de vértebras lumbares 4-5, en grupos de niños y adolescentes (16-175 individuos) de ambos sexos, principalmente de raza caucásica; los resultados arrojados muestran amplia variación en el aumento de TAIA a diferentes edades. A los 6 años de edad,38 el TAIA presenta una medición de 8.3 cm2 (límites: 2-24 cm2), mientras que a los 7 años, el valor promedio de la medición es de 31 cm2 (límites: 7-107 cm2).39 A los 11 años, se reporta una medición de 17.8 cm2 (límites: 6-58 cm2) en niños y 24.8 cm2 (límites: 15-50 cm2) en niñas.28 En hombres adolescentes de 13 años, el TAIA aumenta a 30.1 cm2 (límites: 25-54 cm2) y en mujeres a 38.3 cm2 (límites: 26-59 cm2).29
Los valores reportados de TAIA entre los 7 y 11 años presuponen que existe un descenso en la acumulación de éste. Sin embargo, debido a la falta de estudios sobre la medición de TAIA en estas edades, no se puede afirmar si en realidad ocurre una disminución en la etapa prepúber, o si el TAIA aumente en promedio 23 cm2 entre los 6 y 7 años de edad. El valor promedio de la medición de TAIA a los siete años se obtuvo de una población de niños (100) americanos y afroamericanos, donde la medición promedio en los primeros fue más alto que en los segundos en ambos sexos (niños: 27 vs 22 cm2; niñas: 54 vs 28 cm2).39 Esto puede mostrar que los valores de TAIA pueden varían en cada grupo étnico, independientemente de la edad. Otra posible explicación de esta aparente reducción puede ser adjudicada al equipo empleado en los estudios (TAC vs resonancia magnética) y el punto anatómico evaluado en la cavidad abdominal (entre vértebras lumbares vs a nivel umbilical). En el estudio de Goran y col.39 se utilizó la TAC, y el punto anatómico medido fue a nivel umbilical, a diferencia del estudio realizado en niños de 11 años, donde la medición del TAIA fue con resonancia magnética a nivel de vértebra lumbar 4. Si bien, la TAC y resonancia magnética son equipos exactos, pudiera presentarse diferencia en la calidad de la imagen por el modelo empleado, afectando con ello la medición exacta del TAIA. Tomar como referencia el nivel umbilical para medir el TAIA, pudiera no corresponder a la vértebra lumbar 4. Como se mencionó anteriormente, el punto anatómico más frecuentemente utilizado para medir el TAIA es entre las vértebras L4-L5.
De acuerdo a los datos anteriormente citados, durante la pubertad se observa mayor ganancia de TAIA. En los hombres, el TAIA incrementa 69% y en las mujeres 48%. En contraste, se ha observado que el tejido adiposo subcutáneo del área abdominal aumenta en menor proporción en hombres (19%), mientras que en mujeres el aumento es mayor que en el TAIA (78%).29 Esto muestra los cambios de distribución de tejido adiposo que se presentan durante la pubertad. Pese a que el hombre presenta menor valor de TAIA en esta edad, la proporción de ganancia de este tejido es mayor comparada con la mujer. En cambio, en la mujer se observa mayor ganancia de tejido adiposo subcutáneo.
Como se mencionó anteriormente, los datos reportados sobre la medición de TAIA se han realizado principalmente en poblaciones caucásicas. En poblaciones latinas, sólo tres estudios han reportado la medición de este tejido. El primero evaluó el TAIA en niños de 11 años de edad con sobrepeso (n = 175), donde se encontró que la medición fue de 47.3 cm2 en hombres y 49.6 cm2 en mujeres (no se especifican límites).40 El segundo estudio se realizó en mujeres de 12 años de edad con obesidad (n =47) y en este grupo se encontró que la medición del TAIA fue de 86.3 cm2 (límites: 32-182 cm2).41 El tercer estudio realizado en niños de 8-13 años de edad, muestra que aquellos alimentados con leche materna en su infancia, durante el período de 0-6 meses (n =33) presentaron una medición de 44.1 cm2, los alimentados durante el período de 6-11 meses (n =7) tuvieron una medición de 33.6 cm2, y en aquellos que fueron alimentados con leche materna por más de un año (n =24) presentaron una medición mayor (51.8 cm2). Los niños que no fueron alimentados con leche materna (n =53) tuvieron una medición de TAIA de 45.8 cm2.42
Dadas las características de estos estudios, no se puede establecer una comparación con los resultados encontrados en la población caucásica. En los dos primeros, el TAIA fue sólo evaluado en niños con obesidad,40,41 y en el tercer estudio, la medición del TAIA en los niños evaluados no se especifica por edad cronológica como en los anteriores.42 De ahí que no se puede establecer si los niños de origen latino presenten mayor TAIA que los caucásicos o si este valor esté influido por el sobrepeso. De acuerdo a los datos presentados en el tercer estudio, se observa que los niños alimentados con leche materna por más de un año, presentan valores altos de TAIA, comparado con los otros grupos, aunque no se muestra si estas diferencias fueron significativas. Estudios previos han analizado el posible efecto protector de la lactancia materna contra el desarrollo de la obesidad, pero los resultados no son concluyentes.43,44 Por ello surge la interrogante acerca de si la alimentación durante el primer año de vida o posteriormente, influye en la acumulación del TAIA en niños.
No se tiene la certeza de que el aumento de tejido adiposo subcutáneo del área abdominal o el incremento de la masa grasa total influyan en el aumento del TAIA en niños y adolescentes. Existe una alta correlación entre el TAIA y el tejido adiposo subcutáneo abdominal (r =0.85, P <0.01) con la masa grasa total (r =0.81 a 0.85, P <0.01) en niños.39,45 Sin embargo, después de ajustar la variable de masa grasa total, no existe una correlación significativa entre el TAIA y el tejido adiposo subcutáneo abdominal.39 En adolescentes, también se ha mostrado que la masa grasa total y el tejido adiposo subcutáneo abdominal están altamente correlacionados con el TAIA(r =0.77, r =0.74, P <0.001, respectivamente).46,47 No obstante, en adolescentes obesos no existe una relación significativa entre TAIA con la masa grasa total y tejido adiposo subcutáneo abdominal (r =0.12, P >0.05).46 A pesar de la alta correlación que se muestra entre el TAIA y la masa grasa total, no se puede afirmar si los cambios en esta última influyan de manera directa en el aumento del TAIA, o si es consecuencia de otros factores involucrados (como endocrinos o dietéticos).
TAIA y su asociación con problemas metabólicos
El TAIA se ha considerado como posible factor desencadenante de alteraciones metabólicas como: dislipidemias, hiperinsulinismoe hipertensión arterial. Tres mecanismos se han propuesto como causas del desarrollo de estos problemas metabólicos:48,51 1. Efecto mecánico. El exceso de TAIA pudiera ejercer mayor presión al hígado y a los ríñones, y de esta manera alterar la función normal de estos órganos. 2. Secreción de adipodnas. Como se mencionó anteriormente, el TAIA libera TNF-a que afecta la actividad de los receptores de insulina, favoreciendo con ello posible resistencia a ésta. La interleucina 6 pudiera ocasionar el desarrollo de hipertrigliceridemia por su vinculación con la secreción de triglicéridos al hígado. El aumento de presión arterial pudiera ser ocasionado por el angio-tensinógeno, el cual estimula la actividad del sistema renina-angiotensina, produciendo con ello la reabsorción de sodio a nivel renal. El riesgo de problemas vasculares pudiera estar asociado con la secreción de PAI-1, por inhibir el sistema fibrinolítico. 3. Liberación de ácidos grasos. El TAIA se caracteriza por tener una alta actividad lipolítica, lo cual genera mayor liberación de ácidos grasos libres al hígado. Este proceso aumenta la producción de glucosa hepática, provocando con ello intolerancia a la glucosa e hiperinsulinismo.
Se ha reportado que la medición mayor de 40 cm2 de TAIA en niños de 7 al 0 años de edad (de origen americano y afroamericano) está relacionada positivamente con las concentraciones de triglicéridos (r =0.42 a 0.56, P <0.05), y negativamente (r =-0.26 a -0.40, P <0.01) con las concentraciones de lipoproteínas de alta densidad (HDL).52,53 En adolescentes de 13-16 años de edad (de origen americano y afroamericano) sólo se observa que el TAIA presenta una relación positiva (r =0.27, P <0.05) con las concentraciones de lipoproteínas de baja densidad (LDL).54 Estos datos señalan una posible asociación del TAIA con el desarrollo de dislipidemias, principalmente por alteraciones en las concentraciones de triglicéridos y lipoproteínas. Sin embargo, falta establecer si esta posible relación causa-efecto es latente en otros grupos étnicos de niños y adolescentes.
Se ha mostrado también que el TAIA pudiera estar relacionado con el tamaño de las partículas de LDL. En adolescentes de 13-16 años con un exceso de TAIA, se observa que las partículas de LDL son más pequeñas en comparación con aquellas de niños con una menor cantidad de TAIA (250.5 vs 258.7Å, P <0.01). Se considera que las partículas más pequeñas de LDL tienen mayor potencial aterogénico.55 Asimismo, se ha observado en hombres de 13-18 años, que una cantidad mayor de 358 g de TAIA se relaciona con mayor engrasamiento de las paredes arteriales (200-400 μm) y en la densidad de macrófagos (200-600 mm2),56 condiciones que pudieran incrementar el riesgo de desarrollar ateroesclerosis.
Respecto a la relación de TAIA con la concentración de insulina, se ha estimado que el aumento de 1 cm2 por año de TAIA, incrementa la insulina en ayunas en 5% en niños.57 Por otro lado, se ha reportado que la concentración de insulina en ayunas está positivamente relacionada (r2=0.56, P <0.05) con el TAIA, pero no presenta una asociación significativa (P =0.16) con la sensibilidad a la insulina en niños.45 En adolescentes no se reporta ninguna asociación entre el TAIA y la concentración de insulina.54
El aumento de la presión arterial sistólica también presenta una asociación positiva con el TAIA (r =0.35-0.73).58 En niños con menor cantidad de TAIA, se han observado valores menores de presión arterial sistólica y diastólica, comparados con aquellos que presentan mayor cantidad de tejido adiposo en la cavidad abdominal (sistólica: 111.6 vs 125 mm Hg, P =0.006; diastólica: 59.3 vs 69.1 mmHg, P=0.006).59
El tejido adiposo, particularmente el que se encuentra acumulado en la cavidad abdominal, parece estar vinculado con el desarrollo de problemas metabólicos. Debido a los pocos estudios que han reportado la medición del TAIA durante la etapa de crecimiento, no se ha podido establecer con detalle la cantidad de TAIA saludable o de menor asociación con problemas metabólicos en niños y adolescentes por edad y sexo.
Pese a que existe una asociación entre la masa grasa total y el TAIA, no se puede afirmar que el aumento de la primera influya en la acumulación del tejido adiposo de la cavidad abdominal. Es posible que otros factores endocrinos o dietéticos tengan un efecto más directo en el aumento natural del TAIA durante la niñez y adolescencia. Es necesario llevar a cabo investigaciones que definan con mayor precisión los cambios que se van presentando en las células adiposas del TAIA. Asimismo, establecer si los adipocitos de esta área presentan los mismos puntos críticos de crecimiento identificados hasta el momento (último trimestre de gestación, primeros dos años de vida y pubertad), o tienen un crecimiento diferente.
La resonancia magnética y la TAC son métodos considerados como el estándar de oro para evaluar el TAIA, pero el elevado costo del equipo y las características de su técnica, limitan su uso a nivel poblacional. Hasta el momento no se tiene un método alternativo que nos permita evaluar con exactitud el TAIA en niños y adolescentes. La circunferencia de cintura se ha propuesto como una forma de establecer el riesgo de problemas metabólicos, pero no se puede considerar una medida precisa para estimar la cantidad de TAIA.
Sin duda, aún falta mucho por esclarecer sobre el papel que juega el TAIA en el desarrollo de problemas metabólicos en la niñez y juventud. Resulta esencial llevar a cabo estudios adicionales en niños y adolescentes mexicanos, para conocer con más profundidad los cambios que presenta el TAIA durante la etapa de crecimiento, los posibles factores vinculados al crecimiento de esta área y la relación que tiene el TAIA con el desarrollo de dislipidemias, resistencia a la insulina e hipertensión arterial.
Referencias
1. World Health Organization. The challenge of obesity in 4. the WHO European Region and the strategies for response. (Obtenido el 10 de marzo de 2009) 2007. Consulted 31/01/2009 (disponible en: http://www.euro.5.who.int/document/E90711.pdf) [ Links ]
2. Rivera J, Cuevas L, Shamah T, Villalpando S, Ávila MA, Jiménez A. Estado de nutrición. En: Olaiz G, Rivera J, Shamah T, Rojas R, Villalpando S, Hernández M, et al, editores. Encuesta Nacional de Salud y Nutrición 2006. INSP-SS; 2006. p. 85-104. [ Links ]
3. Van der Kooy K, Seidell JC. Techniques for the measurement of visceral fat: a practical guide. Inter J Obes 1993; 17:187-196. [ Links ]
4. Wajchenberg BL. Subcutaneous and visceral adipose tissue: their relation to the metabolic syndrome. Endocr Rev 2000,21:697-738. [ Links ]
5. Bjórntorp R Do stress reactions cause abdominal obesity and comorbidities? Obes Rev 2001,2:73-86. [ Links ]
6. Maeda N, Takahashi M, Funahashi T, Kihara S, Nishizawa H, Kishida K, etal. PRARgamma ligands increase expression and plasma concentrations of adiponectin, and adipose-derived protein. Diabetes 2001,50:2094-2099. [ Links ]
7. Nemet D, Wang R Funahashi T, Matsuzawa Y, Tanaka S, Engelman L, et al. Adipocytokines, body composition, and fitness in children. Pediatr Res 2003,53:148-152. [ Links ]
8. Ryo M, Nakamura X Kihara S, Kumada M, Shibazaki S, Takahashi M, et al. Adiponectin as a biomarker of the metabolic syndrome. Circ J 2004;68:975-981. [ Links ]
9. Fried SK, Bunkin DA, Greenberg AS. Omental and subcutaneous adipose tissues of obese subjects release interleukin-6: depot difference and regulation by glucocorticoid. J Clin Endocrinol Metab 1998;83:847-850. [ Links ]
10. Ronti X Lupattelli G, Mannarino E. The endocrine function of adipose tissue: an update. Clin Endocrinol 2006;64:355-365. [ Links ]
11. Fontana L, Eagon LC, Trujillo ME, Scherer PE, Klein S. Visceral fat adipokines secretion is associated with systemic inflammation in obese humans. Diabetes 2007;56:1010-1013. [ Links ]
12. Walker GE, Verti B, Marzullo R Savia G, Mencarelli M, Zurleni F, et al. Deep subcutaneous adipose tissue: A distinctive abdominal adipose depot. Obesity 2007; 15:1933-1943. [ Links ]
13. Norata GD, Ongari M, Garlaschelli K, Rasselli S, Grigore L, Catapano AL. Plasma resistin levels correlate with determinants of metabolic syndrome. Eur J Endocrinol 2007,156:279-284. [ Links ]
14. Burnett MS, Devaney JM, Adenika RJ, Lindsay R, Howard BY Cross sectional association of resistin, coronary heart disease and insulin resistance. J Clin Endocrinol Metab 2006,91:64-68. [ Links ]
15. Asayana K, Hayashibe H, Dobashi K, Uchida N, Nakane T. Kodera K, et al. Decrease in serum adiponectin level due to obesity and visceral fat accumulation in children. Obes Res 2003,11:1072-1079. [ Links ]
16. Guerre-Millo M. Adipose tissue and adipokines: for better o worse. Diabetes Metab 2004,30:13-19. [ Links ]
17. Ogawa Y, Kikuchi X Nagasaki K, Hiura M, Tanaka Y, Uchiyama M. Usefulness of serum adiponectin level as a diagnostic marker of metabolic syndrome in obese Japanese children. Hypertens Res 2005,28:51-57. [ Links ]
18. Rossner S, Bo W, Hiltbrandt E, Hinson W, Karstaedt N, Santago R et al. Adipose tissue determinations in cadavers—a comparison between cross-sectional planimetry and computed tomography. Inter J Obes 1990; 14:893-902. [ Links ]
19. Thaete FL, Colberg SR, Burke X Kelley DE. Reproducibility of computed tomography measurement of visceral adipose tissue area. Inter J Obes Relat Metab Disord 1995; 19:464-467. [ Links ]
20. Ross R, Leger L, Morris D, de Guise J, Guardo R. Quantification of adipose tissue by MRI: relationship with anthropometric variables. J Appl Physiol 1992,72:787-795. [ Links ]
21. Peters D, Fox K, Armstrong N, Sharpe P, Bell M. Estimation of body fat and body fat distribution in 11- year old children using magnetic resonance imaging and hydrostatic weighing, skinfold and anthropometry. Am J Hum Biol 1994,6:237-243. [ Links ]
22. Thomas EL, Bell JD. Influence of undersampling on magnetic resonance imaging measurements of intra-abdominal adipose tissue. Inter J Obes 2003,27:211-218. [ Links ]
23. Brenner D, Elliston C, Hall E, Berdon W. Estimated risks of radiation-induced fatal cancer from pediatric CT. Am J Roentgenol 2001,176:289-296. [ Links ]
24. Carr MW, Grey ML. Magnetic resonance imaging. Am J Nurs 2002; 102:26-33. [ Links ]
25. Ross R, Goodpaster B, Kelley D. Boada F. Magnetic resonance imaging in human body composition research. Ann NY Acad Sci 2000,904:72-78. [ Links ]
26. Goran Ml, Gower BA, Treuth M, Nagy TR. Prediction of intra-abdominal and subcutaneous abdominal adipose tissue in healthy prepubertal children. Inter J Obes 1998,22:549-558. [ Links ]
27. Owens S, Litaker M, Allison J, Riggs S, Ferguson M, Gutin B. Prediction of visceral adipose tissue from simple anthropometric measurements in youths with obesity. Obes Res 1999,7:16-22. [ Links ]
28. Fox K, Peters D, Armstrong N, Sharpe P, Bell M. Abdominal fat deposition in 11-year-old children. Inter J Obes 1993,17:11-16. [ Links ]
29. Fox K, Peter D, Sharpe P, Bell M. Assessment of abdominal fat development in young adolescents using magnetic resonance imaging. Inter J Obes 2000,24:1653-1659. [ Links ]
30. Winsley RJ, Fulford J, MacLeod KM, Ramos-Ibanez N, Williams CA, Armstrong N. Prediction of visceral adipose tissue using air displacement plethysmography in young people. Obes Res 2005; 13:2048-2051. [ Links ]
31. Ramos-lbáñez N. The relationship between intra-abdominal adipose tissue and aerobic fitness, physical activity and diet in young people. PhD Thesis. University of Exeter, UK; 2006. [ Links ]
32. Bensfield LL, Fox KR, Peters DM, Blake H, Rogers I, Grant C, et al. Magnetic resonance imaging of abdominal adiposity in a large cohort of British children. Int J Obes 2008,32:91-99. [ Links ]
33. World Health Organization. Obesity: preventing and managing for the global epidemic. Report of a WHO Consultation. 3-5 Jun 1997. Geneva: WHO; 1998. p. 12. [ Links ]
34. Fernández JR, Redden DT, Petrobelli A, Allison DB. Waist circumference percentiles in nationally representative samples of African-American, European-American, and Mexican-American children and adolescents. J Pediatr 2004; 145:439-444. [ Links ]
35. Brambilla P, Bedogni G, Moreno LA, Goran Ml, Gutin B, Fox KR, et al. Cross validation of anthropometry against magnetic resonance imaging for the assessment of visceral and subcutaneous adipose tissue in children. Int J Obes 2006,30:23-30. [ Links ]
36. Sopher A, Shen W, Pietrobelli A. Pediatric body composition. En: Heymsfield SB, Lohman TG, Wang ZM, Going S, editores. Human body composition. Champaign, IL, USA: Human Kinetics; 2005. p. 129-140. [ Links ]
37. Huang TTK, Johnson MS, Figueroa-Colón R, Dwyer JH, Goran Ml. Growth of visceral fat, subcutaneous abdominal fat, and total body fat in children. Obes Res 2001,-9:283-289. [ Links ]
38. Goran Ml, Kaskoun M, Shuman WP Intra-abdominal adipose in young children. Inter J Obes 1995; 19:279-283. [ Links ]
39. Goran Ml, Nagy TR, Treuth MS, Trowbridge C, Dezenberg C, McGloin A, et al. Visceral fat in white and African American prepubertal children. Am J Clin Nutr 1997,65:1703-1708. [ Links ]
40. Shaibi G, Cruz ML, Weigensberg MJ, Toledo-Corral CM, Lane CJ, Kelly LA, et al. Adiponectin independently predicts metabolic syndrome in overweight Latino youth. J Clin Endocrinol Metab 2007;92:1809-1813. [ Links ]
41. Neri A, Espinoza A, Bravo A, Rebollo MJ, Moraga F, Mericq Y et al. Adiposidad visceral y su asociación con lípidos séricos e insulinemia en adolescentes obesas. Rev Med Chile 2007,135:294-300. [ Links ]
42. Davis JN, Weigensberg MJ, Shaibi GQ, Crespo NC, Kelly LA, Lane CJ, et al. Influence of breastfeeding on obesity and type 2 diabetes risk factors in Latino youth with family history of type 2 diabetes. Diabetes Care 2007,30:784-789. [ Links ]
43. Hediger ML, Overpeck MD, Kuczmarski RJ, Rúan WJ. Association between infant breastfeeding and overweight in young children. JAMA 2001,285:2453-2460. [ Links ]
44. Grummer-Strawn ML. Does breastfeeding protect against pediatric overweight? Analysis of longitudinal data from the Centers for Disease Control and Prevention Pediatric Nutrition Surveillance System. Pediatrics 2004; 113:81-86. [ Links ]
45. Goran Ml, Bergman RN, Gower BA. Influence of total vs visceral fat on insulin action and secretion in African American and white children. Obes Res 2001,9:423-431. [ Links ]
46. Brambilla P Manzoni P, Sironi S, Simone P, del Maschio A, di Natale B, et al. Peripheral and abdominal adiposity in childhood obesity. Inter J Obes Relat Metab Disord 1994; 18:795-800. [ Links ]
47. Winsley RJ, Armstrong N, Middlebrooke AR, Ramos-Ibañez N, Williams CA. Aerobic fitness and visceral adipose tissue in children. Acta Paediatr 2006,95:1435-1438. [ Links ]
48. Frayn KN. Visceral fat and insulin resistance-causative or correlative? Br J Nutr 2000;83 (suppl):S71-77. [ Links ]
49. Ding J, Visser M, Kritchevsky SB, Nevitt M, Newman AB, Sutton-Tyrrell K, et al. The association of regional fat depots with hypertension in older person of white and African American ethnicity. Am J Hypertens 2004; 17:971-976. [ Links ]
50. Ryo M, Nakamura T, Kihara S, Kumada M, Shibazaki S, Takahashi M, et al. Adiponectin as a biomarker of the metabolic syndrome. Circ J 2004,68:975-981. [ Links ]
51. Nunes A, Ribeiro F, Gouveia S, Zanella M. Impact of visceral fat on blood pressure and insulin sensitivity in hypertensive obese women. Obes Res 2002; 10: 1203-1206. [ Links ]
52. Gower BA, Nagy TR, Trowbridge CA, Dezenberg C, Goran Ml. Fat distribution and insulin response in prepu-bertal African American and white children. Am J Clin Nutr 1998,67:821-827. [ Links ]
53. Owens S, Gutin B, Ferguson M, Allison J, Karp W, Le NA. Visceral adipose tissue and cardiovascular risk factors in obese children. J Pediatr 1998; 133:41-45. [ Links ]
54. Owens S, Gutin B, Barbeau P, Litaker M, Allison J, Humphries M, et al. Visceral adipose tissue and markers of the insulin resistance syndrome in obese black and white teenagers. Obes Res 2000,8:287-293. [ Links ]
55. Kang HS, Gutin B, Barbeau P Litaker MS, Allison J, Le NA. Low-density lipoprotein particle size, central obesity, cardiovascular fitness, and insulin resistance syndrome markers in obese youths. Inter J Obes 2002;26: 1030-1035. [ Links ]
56. Kortelainen ML, Sarkioja T. Visceral fat and coronary pathology in male adolescents. Inter J Obes Relat Metab Disord 2001 ,25:228-232. [ Links ]
57. Huang TT, Johnson MS, Gower BA, Goran, Ml. Effect of changes in fat distribution on the rates of change of insulin response in children. Obes Res 2002,10:978-984. [ Links ]
58. Nishina M, Kikuchi T, Yamazaki H, Kameda K, Hiura M, Uchiyama M. Relationship among systolic blood pressure, serum insulin and leptin, and visceral fat accumulation in obese children. Hypertens Res 2003,26:281-288. [ Links ]
59. Bacha F, Saad R, Gungor N, Janosky J, Arslanian SA. Obesity, regional fat distribution, and syndrome X in obese black versus white adolescents: race differential in diabetogenic and atherogenic risk factors. J Clin Endocrinol Metab 2003,88:2534-2540. [ Links ]














