Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.66 no.4 México jul./ago. 2009
Artículo original
Patrón de la enfermedad y sobrevida en niños y adolescentes infectados por VIH manejados con terapia antirretroviral altamente activa
Trends and survival in HIV-infected children and adolescents management with highly active antiretroviral therapy
Claudia Patricia Villalobos-Acosta1, Elsy Consuelo Plascencia-Gómez1, Luis Romano-Mazzotti2, Noris Pavía-Ruz1
1 Clínica de Inmunodeficiencias/VIH (CLINDI), Departamento de lnfectología;
2Departamento de Infectología, Hospital Infantil de México Federico Gómez, México, D.F., México.
Autor de correspondencia:
Dra. Noris Pavía Ruz.
Correo electrónico: norpavruz@yahoo.com.mx
Fecha de recepción: 23-03-2009.
Fecha de aprobación: 23-04-2009.
Resumen
Introducción. Después de la introducción del tratamiento antirretroviral altamente activo (TARAA), la sobrevida y la calidad de vida de las personas infectadas por el virus de inmunodeficiencia humana (VIH), incluyendo los niños y adolescentes, han mejorado sustancialmente.
Métodos. El presente estudio se realizó en una cohorte de niños infectados por VIH, menores de 18 años de edad, que asistieron a la Clínica de Inmunodeficiencias/VIH del Hospital Infantil de México Federico Gómez de abril de 1989 a diciembre de 2008. De los expedientes clínicos se obtuvieron: datos sociodemográficos, eventos infecciosos, hospitalizaciones y defunciones.
Resultados. Se incluyeron 202 pacientes infectados por el VIH con o sin TARAA. El promedio de edad al diagnóstico de síndrome de inmunodeficiencia adquirida fue de 37.3 meses. La transmisión perinatal fue la más frecuente con 96%. Al diagnóstico de VIH la mayoría cursaba con enfermedad avanzada. La tasa de incidencia de infecciones oportunistas antes del diagnóstico fue de 30.2/100 pacientes/año, mientras que posterior al TARAA disminuyó a 3.3; 95% de los pacientes que recibieron TARAA tuvieron una sobrevida de 10 años en promedio.
Conclusiones. Con la administración del TARAA se observó disminución de eventos infecciosos, hospitalizaciones y mortalidad en la población estudiada.
Palabras clave: Síndrome de inmunodeficiencia adquirida; niños; adolescentes; virus de inmunodeficiencia humana; sobrevida; tratamiento antirretroviral altamente activo.
Abstract
Introduction. Since the introduction of highly active antiretroviral therapy (HAART), quality of life and survival of those persons infected by HIV, including children and adolescents, have improved substantially.
Methods. This case study focuses on children <18 years old who were seen from April 1989 to December 2008 at the Immunodeficiency Clinic of the Hospital Infantil de Mexico Federico Gomez. Demographic data, infections, admissions and deaths were gathered.
Results. 202 HIV-infected children and adolescents were seen under HAART or without HAART (>6 months). Of all patients, the time since diagnosis of acquired immunodeficiency syndrome (AIDS) was on average 37.3 months. Perinatal transmission was the most frequent mode in 96%. At diagnosis of AIDS, most patients were in an advanced stage of illness. The incidence rates of opportunistic infections decrease from 30.2 episodes per 100 person-years before HAART to 3.3 after initiation of HAART. Of patients receiving HAART, 95% had a survival >10 years.
Conclusions. Management with HAART decreased incidence rates of infectious diseases, admissions and death in the population studied.
Key words: Acquired immunodeficiency syndrome; HIV, infections; child; adolescents; survival; highly active antiretroviral therapy.
Introducción
La pandemia del síndrome de inmunodeficiencia adquirida (SIDA) se presenta actualmente como uno de los problemas más serios de salud pública a nivel mundial, con múltiples repercusiones que rebasan el ámbito sanitario. A la par de los primeros casos reportados en adultos, en 1982 se describieron los primeros casos de infección pediátrica por el virus de inmunodeficiencia humana (VIH) de transmisión perinatal.1 Desde entonces a la fecha, la epidemia del VIH en niños ha alcanzado grandes proporciones; el Programa conjunto de las Naciones Unidas sobre el VIH (ONUSIDA) reporta a finales del año 2007 que del total de casos que viven con VIH (33 millones), cerca de dos millones son menores de 15 años, y de los 2.7 millones de casos nuevos de infección por VIH, 370 000 corresponden a niños menores de 15 años. Se estiman dos millones de muertes, de las cuales 290 000 corresponden al grupo pediátrico (<15 años).2 En México, hasta el 14 de noviembre del 2008 se habían reportado alrededor de 150 705 pacientes seropositivos y casos de SIDA, de los cuales, 2.4% (3 687) correspondía a menores de 15 años y 92.6% fue de transmisión perinatal.3
Antes de la disponibilidad de medicamentos antirretrovirales (ARV), el manejo de los pacientes se centraba en la prevención y tratamiento de las complicaciones relacionadas a VIH, principalmente como un cuidado paliativo. Los estudios iniciales con el uso de monoterapia en niños, a principios de los años noventa, demostraron mejoría clínica e inmunológica con el tratamiento,4,9 lo cual no persistía con el tiempo e incrementaba la resistencia a ARV. Investigaciones adicionales demostraron que la terapia combinada incrementaba la respuesta clínica, inmunológica y virológica.10,12 Actualmente, los esquemas combinados altamente activos (al menos tres medicamentos ARV) o terapia antirretroviral altamente activa (TAARA) se han asociado a supervivencia prolongada, a disminución en las infecciones oportunistas y de otras complicaciones relacionadas a SIDA, a mejoría en el crecimiento y el desarrollo neurocognitivo, así como en una mejor calidad de vida.13-17
Tanto en Estados Unidos de Norteamérica como en el Reino Unido se reportó una disminución significativa en la mortalidad (81-93%) entre 1994 y 2006, concomitante al uso creciente del TARAA.15-18 También se reportó una disminución significativa en la morbilidad relacionada a VIH, así como en las hospitalizaciones durante el mismo período.16,18-20 Por lo que después de la introducción del TARAA, la sobrevida y la calidad de vida de los niños y adultos infectados por VIH mejoró sustancialmente.21,23 Sin embargo, no todos los pacientes reciben terapia ARV y no todos evolucionan satisfactoriamente debido a una alta proporción de fallas en la terapia ARV, principalmente por falta de apego,24 tanto a los ARV como a las terapias de profilaxis;25 por lo que las infecciones y otras complicaciones relacionadas a SIDA continúan siendo un problema.
En una cohorte de pacientes infectados con VIH mayores de 16 años, reportaron que la incidencia para las infecciones oportunistas disminuyó de 15.1 por 100 personas-años antes del tratamiento a 7.7 en los primeros tres meses después del inicio de los ARV, a 2.6 en los siguientes seis meses, y a 2.2 entre 9 y 15 meses posteriores;26 asimismo, en estudios multicéntricos realizados en Estados Unidos de Norteamérica14,27,28 y en Brasil,29 también en niños, se demostró la disminución de las infecciones oportunistas.
La efectividad del TARAA en disminuir la mortalidad en niños está basada principalmente en estudios observacionales. En tres estudios se ha cuantificado el efecto del TARAA en mortalidad, y se ha observado una reducción en esta tasa de 67-77%, lo que demuestra la transición de una infección aguda y mortal a una enfermedad crónica.14,18
El objetivo del presente estudio es describir las infecciones oportunistas, hospitalizaciones y mortalidad en una cohorte de niños y adolescente infectados con VIH/SIDA, con seguimiento en la clínica para niños con VIH/SIDA, antes y después de la introducción del TARAA.
Métodos
Estudio realizado en una cohorte de niños infectados por VIH/SIDA menores de 18 años de edad que recibieron atención médica en la Clínica de Inmunodeficiencias/VIH (CLINDI) del Hospital Infantil de México Federico Gómez de abril de 1989 a diciembre de 2008. CLINDI es una de las principales clínicas de referencia en México para niños y adolescentes con sospecha o diagnóstico de infección por VIH/SIDA, y es en donde se realizó el reporte del primer caso de SIDA pediátrico en México.30 Los niños incluidos en esta cohorte tenían seguimiento clínico y por laboratorio en forma regular por médicos pediatras e infectólogos pediatras.
La información fue obtenida en forma retrospectiva de los expedientes clínicos. Se registro la siguiente información: datos demográficos, edad al diagnóstico de VIH, edad de inicio de síntomas, género, clasificación clínica e inmunológica al ingreso, mecanismo de transmisión del VIH, eventos infecciosos y hospitalizaciones antes y después del inicio del tratamiento, defunción; también se registraron las cuentas de CD4+ y carga viral para VIH. Las categorías clínica e inmunológica se definieron de acuerdo a la clasificación de los Centros para el Control y la Prevención de Enfermedades (CDC).31
No se incluyeron expedientes con información de pacientes en los que se desconocía el desenlace final del mismo (pérdida de seguimiento, transferencia a clínica de adultos) o del que no fuera posible obtener la información necesaria para el estudio. De las infecciones oportunistas se incluyeron las que pertenecían a la clasificación clínica B y C. Los tipos de infecciones se obtuvieron basándose en el diagnóstico establecido en el expediente clínico.
Para fines del análisis, los pacientes se dividieron en dos grupos, dependiendo de la administración o no de TARAA.
a) Grupo sin TARAA: pacientes que no recibieron tratamiento ARV o que sólo recibieron monoterapia o terapia doble.
b) Grupo con TARAA: pacientes que recibieron al menos tres ARV durante seis o más meses: dos inhibidores de la transcriptasa reversa análogos a nucleósidos (ITRAN) combinados con inhibidores de proteasa o combinados con inhibidores de la transcriptasa reversa no nucleósidos (ITRNN). Este grupo de pacientes se subclasificó dependiendo si habían recibido ITRAN como primer esquema o si habían recibido dos o más esquemas de ARV.
Análisis estadístico
Se analizó la tasa de incidencia a través de paciente-años, dato que fue obtenido dividiendo el número de eventos observados entre la suma de años que el paciente contribuyó al estudio (última visita, muerte). Las variables evaluadas fueron: infecciones en general, infecciones por gérmenes oportunistas, hospitalización y muerte.
La mortalidad de los niños infectados con VIH/ SIDA fue determinada por el análisis de sobrevida de Kaplan-Meier para comparar el tiempo hasta la muerte en niños sin tratamiento y con TARAA.
Resultados
Se revisaron los expedientes clínicos de 380 pacientes, incluyendo 202 niños y adolescentes infectados con VIH/SIDA, en los que los expedientes contenían la información que se requería.
No se incluyeron 139 pacientes que perdieron el seguimiento (abandono a su control, reubicados en otra clínica o trasladados a instituciones de adultos), 31 pacientes fallecieron (recibieron seis meses o menos de ARV, o la información era incompleta), y ocho activos que tuvieron menos de seis meses de seguimiento.
El diagnóstico de infección por VIH/SIDA se efectuó en promedio a los 37 meses de edad, cursando la mayoría con enfermedad avanzada; 88.6% de los pacientes recibían TARAA al momento del estudio (Cuadro 1).

De acuerdo a la utilización de medicamentos ARV, se dividió la cohorte en: grupo que no recibió TARAA (pacientes sin tratamiento ARV o que sólo se manejaron con uno o dos medicamentos, es decir, sin terapia altamente activa); y grupo con TARAA.
Del total de la cohorte, los pacientes cursaron con 2 346 episodios infecciosos previos al diagnóstico de infección por VIH/SIDA, con una incidencia de 331.82/100 pacientes/año, con un promedio de 11.6 infecciones/paciente, siendo las más frecuentes en vías respiratorias y las gastrointestinales. Las infecciones por gérmenes oportunistas correspondieron a 11.9% del total de las infecciones, predominando candidiasis oral, herpes zoster y tuberculosis (Cuadro 2).
Con respecto a las hospitalizaciones, se observaron 414 ingresos, con una incidencia de 58.55/10 pacientes/año, con un promedio de dos hospitalizaciones/paciente; del total de hospitalizaciones, 41 (10%) fueron por infecciones oportunistas, ocupando el primer lugar de éstas la tuberculosis, con una incidencia de 2.68/100 pacientes/año (Cuadro 3). También es importante mencionar que la desnutrición fue una de las condiciones nosológicas concomitantes más frecuentes (10.4%).
Los eventos infecciosos observados en el grupo que recibió TARAA disminuyeron en más de 60%, predominando las infecciones respiratorias y gastrointestinales. Con respecto al impacto de la terapia ARV en las infecciones por gérmenes oportunistas, se observó una disminución en la tasa de incidencia de 39.88/100 pacientes/año en la era pre-TARAA, a una incidencia de 3.3/100 pacientes/año en la era post-TARAA, y en hospitalizaciones, de una incidencia de 46.3 a 7.59/100 pacientes/año, respectivamente (Cuadros 4 y 5).
Del total de pacientes se realizó una curva de sobrevida, la cual demostró que sin TARAA, 50% de los pacientes fallecieron a los 24 meses de seguimiento. Es interesante el hallazgo de que los niños que tenían antecedentes de haber recibido dos o más esquemas de TARAA durante su seguimiento, tuvieron una sobrevida equiparable a aquellos que lo recibieron como primera opción (Fig. 1).
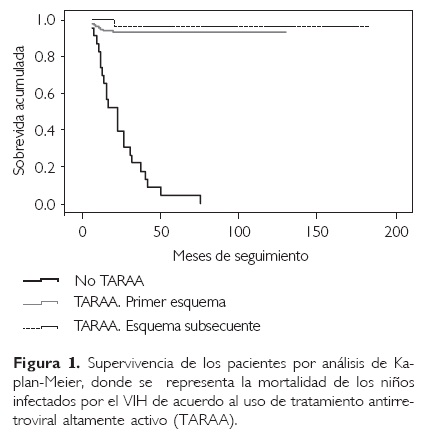
Los pacientes incluidos en el estudio (170), y que actualmente se encuentran en seguimiento bajo tratamiento, tienen un promedio de edad de 121 meses (variación 22-216 meses), y el grupo de pacientes que no recibió TARAA, tuvo una edad promedio de 68 meses al momento de la defunción (Cuadro 6).

Es importante resaltar que 100% de los pacientes que no recibieron TARAA murieron durante el seguimiento; situación que se modificó con la introducción de la TARAA (Cuadro 6).
Discusión
La infección por VIH en niños tiene un comportamiento distinto al de los adultos, ya que la progresión de la enfermedad es más rápida (de 20 a 30% de los pacientes desarrollan SIDA durante el primer año de vida), y los marcadores de laboratorio son menos predictivos de riesgo.32
En nuestro estudio, al igual que en la literatura internacional, el diagnóstico de infección por VIH se realizó en promedio a los tres años de edad, y en cerca de 50% de los pacientes antes de los 23 meses; 80% se encontraron sintomáticos al momento del diagnóstico, clasificándose de acuerdo al CDC en categoría clínica B y C, y con inmunosupresión grave. Esto refuerza la no existencia de marcadores clínicos específicos que en forma temprana apoyen el diagnóstico de infección por VIH.33
Al igual que lo reportado en la literatura, no existió diferencia en cuanto al género (mujer 1.1 :hombre 1). La transmisión perinatal fue la responsable de la infección en 96% de los casos, probablemente porque no se identificó ésta durante el embarazo y por lo tanto no se realizaron estrategias para evitarla. Desde 1994, en el estudio Pediatric AlDS Clinical Trials Group (PACTG) 076, se documentó que la administración de zidovudina como monoterapia en el embarazo, logró disminuir la transmisión en 67%34,35 y con las estrategias de prevención actuales, como identificación de la infección por VIH materna durante el embarazo, administración de TARAA desde la semana 14 de gestación, resolución obstétrica por cesárea, suspensión del seno materno y profilaxis al recién nacido, la transmisión perinatal de VIH ha disminuido a menos de 2%.36,37 Aunque, si bien, esta disminución de la transmisión de VIH se ha observado principalmente en países industrializados, en nuestro país el Instituto Nacional de Perinatología Isidro Espinosa de los Reyes lleva un programa de atención obstétrica a mujeres infectadas por VIH, ofreciéndose TARAA, cesárea y profilaxis al recién nacido, reportando que a partir del año 1998, que se iniciaron estas estrategias, 160 mujeres han recibido la intervención y sus hijos nacieron libres de la infección por VIH.38 lo cual desafortunadamente no es un reflejo de lo que ocurre en nuestro país, dado que aún continúan naciendo niños infectados con VIH.
Desde el punto de vista clínico, los procesos infecciosos como antecedente al momento del diagnóstico se documentaron con una tasa de incidencia de 333.66/100 pacientes por año, siendo las causas más frecuentes: infección de vías respiratorias superiores, diarrea y neumonía.
Las infecciones oportunistas representaron 12% de todas la infecciones; ocupando el primer lugar la candidiasis oral con una incidencia de 26.44/ 100 pacientes/año, similar a lo reportado por Gona y col.14 en su estudio realizado entre los años 2000 y 2004, en niños infectados por VIH/SIDA. Llama la atención que la neumonía por Pneumocystis jirovecii ocupó la quinta causa entre las infecciones oportunistas, con una incidencia de 1.69/100 pacientes/año, y la candidiasis esofágica la sexta causa, con una incidencia de 1.41/100 pacientes/ año; entidades que se reportan como sintomatología grave en la clasificación del CDC, y que en un estudio prospectivo del PACTG 219C con 1 927 pacientes, reportaron incidencias más bajas (0.23 y 0.48, respectivamente),39 a diferencia del estudio de Gona y col.,14 y Nesheim y col.,28 ya que para neumonía por P. jirovecii se reportan incidencias más altas de 2.9 y de 5.8/100 personas/ año en la era pre-TARAA.
De las 414 hospitalizaciones que ocurrieron, previo al inicio de tratamiento o al diagnóstico de SIDA, 10% fueron por eventos oportunistas; siendo las causas más frecuentes: tuberculosis, herpes zoster y candidiasis esofágica. Los pacientes se hospitalizaron en promedio en dos ocasiones.
La neumonía representó 50% como motivo de hospitalización, con una incidencia de 24.75/100 personas/año; en el estudio de Kourtis y col.27 se reportó como la segunda causa de hospitalización, precedida por la candidiasis oral, observándose en el estudio de Candiani y col.,29 en Brasil, que la neumonía también fue la primera causa de hospitalización.
A partir de los reportes históricos de Palíela y col.,40 en 1998, y de Ledergerber y col.,26 en 1999, donde demostraron una reducción dramática en la morbi-mortalidad en los pacientes adultos con VIH, claramente relacionada con el uso de la TARAA, diversos autores han descrito investigaciones en la misma línea en niños, demostrando una disminución tanto en la morbilidad como en la mortalidad. Los resultados de nuestro estudio demostraron una reducción importante (62%) de los eventos infecciosos posterior al uso de la terapia ARV. La disminución de la frecuencia de infecciones fue variable, dependiendo de cada patología; sin embargo, para las infecciones oportunistas en general se observó una disminución en la incidencia de 39.88/100 personas/año en la era pre-TARAA a 3.3/100 personas/año en la post-TARAA, disminución espectacular, similar a lo reportado por Nesheim y col.28 (de 14-4 a 1.1/100 personas/año). Específicamente, en algunas infecciones se observó que la reducción en la tasa de incidencia en eventos/100 personas/año fue más importante para los eventos de candidiasis oral (de 26.44 a 1.76), tuberculosis (de 3.32 a 0.11) y neumonía por P. jirovecii (de 1.69 a 0.11).
Con respecto a las hospitalizaciones, se observó una reducción de 79% cuando recibieron tratamiento, y una disminución en la incidencia de 46.3/100 pacientes/año de la era pre-TARAA a 7.59/100 pacientes/año en la post-TARAA.
Aún con la utilización de TARAA, los niños siguen desarrollando infecciones por gérmenes oportunistas; en algunos de ellos, secundario a resistencia viral, pobre apego o incapacidad de tolerar esquemas complejos. Además, el tratamiento profiláctico no es totalmente efectivo y la falta de apego podría reducir su eficacia.
Con relación a la mortalidad en niños, se reporta en diversos estudios la disminución de 5.3% en 1996 a 0.7% en 1999;13,14,41 por Puthanakit y col.,42 en Tailandia, de 5.7% en las primeras 24 semanas de la terapia versus 0.6% en las siguientes 24 semanas y, en el estudio de Judd y col.18 en el Reino Unido, una mortalidad de 13.3 casos/100 personas año antes de 1997 a 2.5 casos/100 personas año en 2003-2006. En México, la introducción de la TARAA fue alrededor de 1998, y en nuestro estudio se observó que la mortalidad disminuyó de 33% en la época pre-TARAA a 7% en la era TARAA, con una reducción de la mortalidad de 78%, similar a lo reportado por diversos autores.15-18
En la curva de sobrevida se puede apreciar el impacto de la TARAA en los pacientes, lo cual apoya los reportes ya existentes, principalmente en países en desarrollo. La mortalidad que encontramos en nuestro estudio es baja en comparación a lo reportado en Brasil (12%), Argentina (23%) y África (39%), donde el uso de ARV aún no es lo habitual29-43,45 En la actualidad, 95% de los pacientes de esta cohorte y que recibieron TARAA están vivos y en seguimiento en la clínica para niños con VIH/SIDA, con un promedio de edad de 10 años. Debido a la cronicidad de la enfermedad, los niños nacidos con infección por VIH están alcanzando la adolescencia y adultez, por lo que temas como revelación del diagnóstico, participación en la toma de decisiones de su tratamiento, sexualidad, proyecto de vida, entre otros, son de vital importancia para una buena calidad de vida, así como el manejo de la transición a hospitales de adultos.46
Además del acceso a ARV, la utilización de quimioprofilaxis y el manejo multidisciplinario ha permitido en México el incremento de la sobrevida y la disminución de infecciones oportunistas y de hospitalizaciones en niños infectados con VIH/ SIDA.
Aún con las limitaciones por ser éste un estudio retrospectivo, se puede apreciar claramente el efecto de la TARAA en morbilidad, hospitalizaciones y mortalidad en niños y adolescentes mexicanos infectados con VIH/SIDA.
Referencias
1. Centers for Diseases Control: unexplained immunodeficiency and opportunistic infections in infants. MMWR Morb Mortal Wkly Rep. 1982; 31: 665-7. [ Links ]
2. UNAIDS. Report on the global HIV/AIDS epidemic; 2007 December. [ Links ]
3. Secretaría de Salud. Dirección General de Epidemiología. Registro Nacional de Casos de SIDA. Datos al 14 de Noviembre del 2008. México: Centro Nacional para la Prevención del VIH/SIDA (CENSIDA); 2008. [ Links ]
4. Pizzo PA, EddyJ, Falloon J, et al. Effect of continuous intravenous infusion of zidovudine (AZT) in children with symptomatic HIV infection. N Engl J Med. 1988: 319: 889-96. [ Links ]
5. McKinney RE, Maha MA, Connor EM, et al. A multicenter trial of oral zidovudine in children with advanced human immunodeficiency virus disease. The Protocol 043 Study Group. N Engl J Med. 1991; 324: 1018-25. [ Links ]
6. Butler KM, Husson RN, Balis FM, et al. Dideoxyinosine in children with symptomatic human immunodeficiency virus infection. N Engl J Med. 1991; 324: 137-44. [ Links ]
7. Lewis LL, Venzon D, Church J, et al. Lamivudine in children with human immunodeficiency virus infection: a phase I/II study. The National Cancer Institute Pediatric Branch-Human Immunodeficiency Virus Working Group. J Infect Dis. 1996; 174: 16-25. [ Links ]
8. Kline MW, Culnane M, van Dyke RB, et al. A randomized comparative trial of stavudine (d4T) versus zidovudine (ZDV, AZT) in children with human immunodeficiency virus infection. AIDS Clinical Trials Group 240 Team. Pediatrics. 1998; 101:214-20. [ Links ]
9. Kline MW, Dunkle LM, Church JA, et al. A phase I/II evaluation of stavudine (d4T) in children with human immunodeficiency virus infection. Pediatrics. 1995; 96 (2 Pt 1): 247-52. [ Links ]
10. Paediatric European Network for Treatment of AIDS (PENTA). A randomized double-blind trial of the addition of lamivudine or matching placebo to current nucleoside analogue reverse transcriptase inhibitortherapy in HIV-infected children: the PENTA-4 trial. AIDS. 1998; 12: F151-60. [ Links ]
11. McKinney RE, Johnson GM, Stanley K, et al. A randomized study of combined zidovudine-lamivudine versus didanosine monotherapy in children with symptomatic therapy-naive HIV-1 infection. The Pediatric AIDS Clinical Trials Group Protocol 300 Study Team. J Pediatr. 1998; 133: 500-8. [ Links ]
12. Resino S, Resino R, Micheloud D, et al. Long-term effects of highly active antiretroviral therapy in pretreated, vertically HIV type I-infected children: 6 years of follow-up. Clin Infect Dis. 2006; 42: 862-9. [ Links ]
13. Gortmaker S, Hughes M, Cervia J, et al. Effect of combination therapy including protease inhibitors on mortality among children and adolescents infected with HIV-1. N EnglJ Med. 2001; 345: 1522-8. [ Links ]
14. Gona P, van Dyke R, Williams PL, et al. Incidence of opportunistic and other infections in HIV-infected children in the HAART era. JAMA. 2006; 296: 292-300. [ Links ]
15. Selik RM, Lindegren ML. Changes in deaths reported with human immunodeficiency virus infection among United States children less than thirteen years old, 1987 through 1999. Pediatr Infect DisJ. 2003; 22: 635-41. [ Links ]
16. Gibb DM, Duong T, Tookey PA, et al. National Study of HIV in Pregnancy and Childhood Collaborative HIV Paediatric Study. Decline in mortality, AIDS, and hospital admissions in perinatally HIV-1 infected children in the United Kingdom and Ireland. BMJ. 2003; 327: 1019. [ Links ]
17. McConnell MS, Byers RH, Frederick T, et al. Trends in antiretroviral therapy use and survival rates for a large cohort of HIV-infected children and adolescents in the United States, 1989-2001. J Acquir Immune Defic Syndr. 2005; 38: 488-94. [ Links ]
18. Judd A, Doerholt K, Tookey PA, et al. Morbidity, mortality, and response to treatment by children in the United Kingdom and Ireland with perinatally acquired HIV infection during 1996-2006: planning forteenage and adult care. Clin Infect Dis. 2007; 45: 918-24. [ Links ]
19. Viani RM, Araneta MR, Deville JG, Spector SA. Decrease in hospitalizaron and mortality rates among children with perinatally acquired HIV type I infection receiving highly active antiretroviral therapy. Clin Infect Dis. 2004; 39: 725-31. [ Links ]
20. Sánchez JM, Ramos-Amador JT, Fernández-de Miguel S, et al. Impact of highly active antiretroviral therapy on the morbidity and mortality in Spanish human immunodeficiency virus-infected children. Pediatr Infect Dis J. 2003; 22: 863-7. [ Links ]
21. De Martino M, Tovo PA, Balducci M, et al. Reduction in mortality with availability of antiretroviral therapy for children with perinatal HIV-1 infection. JAMA. 2000; 284: 190-7. [ Links ]
22. Mocroft A, Ledergerber B, Katlama C, et al. Decline in the AIDS and death rates in the EuroSIDA study: an observational study. Lancet. 2003; 362: 22-9. [ Links ]
23. Fleishman JA, Hellinger FJ. Recent trends in HIV-related inpatient admission, 1996-2000. Epidemiol Soc Sci. 2003; 34: 102-10. [ Links ]
24. Danker WM, Lindsey JC, Levin MJ, et al. Correlates of opportunistic infections in children infected with the human immunodeficiency virus managed before highly active antiretroviral therapy. Pediatr Infect Dis J. 2001; 20: 40-8. [ Links ]
25. Jones JL, Hanson DL, Dworkin MS, et al. Surveillance for AIDS. Defining opportunistic illnesses, 1992-1997. MMWR Surveill Summ. 1999; 48: 1-22. [ Links ]
26. Ledergerber B, Egger M, Erard V, Weber R, et al. AIDS-Related opportunistic illnesses occurring after initiation of potent antiretroviral therapy. The Swiss HIV Cohort Study. JAMA. 1999; 282: 2220-6. [ Links ]
27. Kourtis AP, Bansil P, Posner SF, Jonson C, et al. Trends in Hospitalizations of HIV-infected children and adolescents in the United States: Analysis of data from the 1994-2003 nationwide inpatient sample. Pediatrics. 2007; 120: e236-e43. [ Links ]
28. Nesheim SR, Kapogiannis BG, Soe MM, Sullivan KM, et al. Trends in opportunistic infections in the pre- and post-highly active antiretroviral therapy eras among HIV-infected children in the perinatal AIDS. Collaborative Transmission Study, 1986-2004. Pediatrics. 2007; 120: 100-9. [ Links ]
29. Candiani TMS, Pinto J, Araújo CA, Carvalho IR, et al. Impact of highly active antiretroviral therapy (HAART) on the incidence of opportunistic infections, hospitalizations and mortality among children and adolescents living with HIV/AIDS in Belo Horizonte, Minas Gerais State, Brazil. Cad Saude Publica. 2007; 23: S414-S23. [ Links ]
30. Pérez GLF, Moran MA, Santos PJI. Síndrome de inmunodeficiencia adquirida (SIDA) en pediatría. Informe del primer caso en México. Bol Med Hosp Infant Mex. 1986; 43: 729. [ Links ]
31. Centers for Diseases Control and Prevention. 1994 revised classification system for human immunodeficiency virus infection in children less than 13 years of age. MMWR RecommRep. 1994; 43: 1-10. [ Links ]
32. Mofenson LM, Korelitz J, Meyer WA, et al. The relationship between serum human immunodeficiency virus type I (HIV-1) RNA level, CD4 lymphocyte percent, and long-term mortality risk in HIV-1 -infected children. National Institute of Child Health and Human Development Intravenous Immunoglobulin Clinical Trial Study Group. J Infect Dis. 1997; 175: 1029-38. [ Links ]
33. Palumbo PE, Raskino C, Fiscus S, et al. Predictive value of quantitative plasma HIV RNA and CD4+ lymphocyte count in HIV-infected infants and children. JAMA. 1998; 279: 756-61. [ Links ]
34. Coonor EW, Sperling RS, Gelber R, et al. Reduction of maternal-infant transmission of human immunodeficiency virus type I with zidovudine treatment. N Engl J Med. 1994; 331: 1173-80. [ Links ]
35. Wade NA, Zielinsky MA, Butsashvili M, et al. Decline in perinatal HIV transmission in New York State (1997-2000). J Acquir Immune Defic Syndr. 2004; 36: 1075-82. [ Links ]
36. Cooper ER, Charurat M, Mofenson L, et al. Combination antiretroviral strategies for the treatment of pregnant HIVI infected women and prevention of perinatal HIV-transmission. J Acquir Immune Defic Syndr. 2002; 29: 484-94. [ Links ]
37. Wade NA, Magder LS, Mofenson L, Paul ME, et al. Risk factors for in utero and intrapartum transmission of HIV. J Acquir Immune Defic Syndr. 2005; 38: 87-95. [ Links ]
38. Ortiz-Ibarra FJ, Cashat-Cruz M. Prevención de la transmisión perinatal del VIH: Una meta alcanzable. Bol Med Hosp Infant Mex. 2003; 60: 643-54 [ Links ]
39. Ylitalo N, Brogly S, Hughes M, Nachman S, et al. Risk factors for opportunistic illnesses in children with human immunodeficiency virus in the era of highly active antire-troviral therapy. Arch Pediatr Adolesc Med. 2006; 160: 778-87. [ Links ]
40. Pallella FJ, Delaney KM, Moorman AC, Loveless MO, Fuhrer J, Satten GA, et al. Declining morbidity and mortality among patients with advanced human immunodeficiency virus infection. N Engl J Med. 1998; 338: 853-60. [ Links ]
41. Resino S, Larrú B, Bellón JM, Resino R, et al. Effects of highly active antiretroviral therapy with nelfinavir in vertically HIV-1 infected children: 3 years of follow-up. Long-term response to nelfinavir in children. BMC Infect Dis. 2006; 6: 107. [ Links ]
42. Puthanakit T, Aurpibul L, Oberdorfer, Akarathum N, et al. Hospitalizaron and mortality among HIV-infected children after receiving highly active antiretroviral therapy. Clin Infect Dis. 2007; 44: 599-604. [ Links ]
43. Nachman S, Gona P, Dankner W, Weinberg A, et al. The rate of serious bacterial infections among HIV-infected children with immune reconstitution who have discontinued opportunistic infection prophylaxis. Pediatrics. 2005; 115: e488-e94. [ Links ]
44. Fallo AA, Dobrzanski-Nisiewics W, Sordelli N, Cattaneo MA, et al. Clinical and epidemiologic aspects of human immunodeficiency virus-1-infected children in Buenos Aires, Argentina. Int J Infect Dis. 2002; 6: 9-16. [ Links ]
45. Spira R, Lepage P, Msellati P, van de Perre, et al. Natural history of human immunodeficiency virus type I infection in children: a five-year prospective study in Rwanda. Motherto-Child HIV-1 Transmission Study Group. Pediatrics. 1999; 104: e56. [ Links ]
46. Muñoz HR, Villalobos ACP, Pavía RN. SIDA en pediatría. En: Estrategias globales para la prevención y tratamiento de la transmisión del VIH/SIDA: Resultados de las intervenciones. México: Ed. Elsevier; 2007. p. 75-89. [ Links ]














