Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Boletín médico del Hospital Infantil de México
versão impressa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.66 no.3 México Mai./Jun. 2009
Caso clínico
Adenoma cortical suprarrenal, hipercortisolismo, cardiomiopatía y bazo accesorio intrapancreático en un lactante
Cortical adrenal adenoma, hypercortisolism, cardiomyopathy, and intra-pancreatic accessory spleen in a 3-month-old infant
Norberto Sotelo-Cruz1, Guillermo López-Cervantes2, Luis Antonio González-Ramos3, Rodrigo Ibarra-Silva1, Jaime G. Hurtado-Valenzuela1, Abraham Fernández-Gámez4
Autor de correspondencia:
Dr. Norberto Sotelo Cruz.
Correo electrónico: norbertosotelo5@hotmail.com
1 Servicios de Medicina Interna, Hospital Infantil del Estado de Sonora, Hermosillo, Sonora, México.
2 Patología, Hospital Infantil del Estado de Sonora, Hermosillo, Sonora, México.
3 Cardiología, Hospital Infantil del Estado de Sonora, Hermosillo, Sonora, México.
4 Pediatría Médica, Hospital Infantil del Estado de Sonora, Hermosillo, Sonora, México.
Fecha de recepción: 30-04-2008.
Fecha de aprobación: 30-01-2009.
Resumen
Introducción. El síndrome de Cushing es el resultado de concentraciones elevadas de glucocorticoides en la circulación, su presentación en lactantes es poco común.
Caso clínico. Presentamos un caso de hipercortisolismo endógeno en un niño de 3 meses de edad, secundario a un adenoma suprarrenal congénito. El paciente manifestó polifagia, aumento de peso y alteraciones en el patrón del sueño; al examen físico se observó hirsutismo frontal, cara en "luna llena", abultamiento visible en región cervico-dorsal ("giba de búfalo"), hipertensión arterial; el cortisol plasmático fue de 163 pg/dL, y el ultrasonido abdominal reveló tumoración suprarrenal izquierda. Durante el período de hospitalización, el niño cursó con dificultad respiratoria y taquicardia; la radiografía de tórax mostró cardiomegalia. Después de un procedimiento quirúrgico simple (venodisección), el paciente desarrolló choque cardiogénico y falleció. En la autopsia se encontró, además de la tumoración suprarrenal, cardiomiopatía hipertrófica y bazo accesorio intrapancreático.
Conclusión. La causa más común del síndrome de Cushing en todos los grupos de edad, excepto en lactantes, es hipercortisolismo exógeno; la asociación de patologías aquí presentadas es muy raro.
Palabras clave: Adenoma suprarrenal; hipercortisolismo; cardiopatía hipertrófica; bazo accesorio intrapancreático.
Abstract
Introduction. Cushing syndrome is associated with high levels of glucocorticoids in the circulation and is infrequently in infants.
Case report. We present a case of congenital cortical adrenal adenoma-associated endogenous hypercortisolism in a 3-month-old infant. The patient manifested polyphagia, weight gain, and changes in sleep patterns. During physical examination we found a full-moon face, bulkiness in the cervico-dorsal "buffalo-hump" region, high blood pressure, and serum cortisol of 163 pg/dL. Abdominal ultrasound revealed left adrenal tumor. During hospitalization, the patient experienced respiratory difficulty and tachycardia, and thoracic X- ray revealed cardiomegaly. After a simple surgical procedure (venous dissection), the patient developed cardiogenic shock and died. At autopsy, adrenal tumor was found in addition to hypertrophic cardiomyopathy and intrapancreatic accessory spleen.
Conclusion. The most common cause of Cushing syndrome in all age groups is exogenous hypercortisolism, except in infants. The associated pathologies described in this article are rare.
Key words: Adrenal cortical, adenoma; adrenal gland hyperfunction; hypercortisolism; cardiopathy, hypertrophic; spleen, intrapancreatic accessory.
Introducción
Se define como síndrome de Cushing el conjunto de manifestaciones biológicas y clínicas, derivadas de la presencia de concentraciones circulantes anormalmente elevadas, y sostenidas, de glucocorticoides, ya sean éstos de producción endógena o exógena. El diagnóstico clínico, ante un caso de hipercortisolismo congénito, es realmente un desafío, ya que esta entidad nosológica es poco común en lactantes.1-3
La causa más común de este síndrome en todos los grupos de edad, excepto en lactantes, es la administración exógena de corticoides sintéticos. En etapas ulteriores de la vida, el síndrome de Cushing es frecuentemente secundario a hipersecreción de hormona adrenocorticotrópica (ACTH).2 El 80-90% de los niños mayores de siete años con hipercortisolismo presentan un adenoma hipofisiario secretor de ACTH.1-3
Eventualmente, la ACTH se encuentra elevada como consecuencia de secreción ectópica; se encontró relacionada con paragangliomas, tumor de Wilms, neuroblastomas, y tumores pancreáticos.3 En los niños menores de tres años, los tumores suprarrenales son la causa más frecuente de síndrome de Cushing.1,4 Procesos no tumorales, conocidos como hiperplasia suprarrenal bilateral, pueden generar también hipercortisolismo endógeno.1-5
Hay una serie de manifestaciones clínicas muy importantes que sugieren, en conjunto, el diagnóstico de hipercortisolismo; éstas son: detención del crecimiento en 100% de los casos, necrosis avascular de la cabeza del fémur en 4%, obesidad o aumento progresivo de peso en 95%, astenia y debilidad en 65%, hirsutismo y acné en 55%, cara en "luna llena" y giba cervical.1-5
El exceso de esteroides tiene efectos en otros aparatos y sistemas, siendo evidente: hiperglucemia, alteraciones del calcio, osteopenia, hipopotasemia, aumento en la formación de renina, atrofia de fibras musculares, deterioro de la función inmunitaria y alteraciones psicógenas. Se han descrito también cambios en el músculo cardiaco como consecuencia de la acción del cortisol durante el embarazo, y los efectos del mismo sobre el corazón a otras edades, observándose que favorece el desarrollo de miocardiopatía hipertrófica obstructiva.6-9
El hallazgo de bazo accesorio intrapancreático es una anomalía poco frecuente; se detecta en niños escolares y adolescentes, y más frecuentemente en adultos, simulando infección abdominal, confundiéndose también con tumores pancreáticos.10,11
El tratamiento del origen del hipercortisolismo en los casos de adenoma suprarrenal, es la suprarrenalectomía, al establecer el diagnóstico; el pronóstico suele ser bueno, excepto cuando se trata de lactantes menores con tumoraciones de gran tamaño, y que exhiben hipertensión, hiperglucemia e inmunodeficiencia, así como infecciones respiratorias.1-5
En este informe se presenta el caso de un lactante menor con adenoma suprarrenal, hipercortisolismo y cardiomiopatía hipertrófica, con evolución fatal, en quien como hallazgo de autopsia se encontró bazo accesorio intrapancreático.
Presentación del caso clínico
Se trata de paciente masculino de tres meses de edad, con los siguientes antecedentes heredo-familiares: madre de 21 años, aparentemente sana, padre de 20 años de edad, toxicómano, usuario de cocaína, marihuana y tabaco. Originarios y residentes de Hermosillo, Sonora.
Antecedentes perinatales: producto de la primera gesta, control prenatal adecuado, obtenido por parto eutócico, con datos de asfixia perinatal; peso al nacer 3 300 g; alimentado al seno materno y sucedáneos de la leche tipo maternizada.
Inició su padecimiento actual al mes de edad, al notar la madre que el niño manifestaba polifagia, alimentación cada 5-10 minutos, con incremento progresivo de peso, experimentando cambios en cara con aumento de volumen en la región malar bilateral, posteriormente disomnia, y finalmente dificultad para respirar, por lo que fue llevado a facultativo particular, de donde es enviado al hospital para estudio por posible síndrome de Cushing.
A su ingreso se recibió con datos de dificultad respiratoria leve, frecuencia respiratoria de 48 x min, y frecuencia cardiaca de 148 x min, tensión arterial 149/87, 113/79, 125/58 mm Hg (sistólica y diastólica superior al percentil 95 para la edad), palidez + + , peso 6 400 g (percentil 90), talla 55 cm (percentil 5), perímetro cefálico 38 cm; activo, reactivo, llamando la atención que presentaba "cara de luna llena", así como hirsutismo y lesiones acneiformes en tórax anterior y brazos. Además de abultamiento visible en la región cervico-dorsal ("giba de búfalo") (Fig. 1).
Por los datos clínicos, y el diagnostico de envío, entre otros estudios (Cuadro 1) se solicitó cortisol sérico, el cual se reportó en 163 ug/dL.

Se detectó hepatomegalia, el reborde hepático se encontraba a 4-4-4 cm abajo del borde costal derecho. A la auscultación se encontró un soplo cardiaco, con frecuencia de 150 latidos por minuto; fue valorado por el Servicio de Cardiología, sospechándose estenosis pulmonar, sin realizarse ecocardiograma. La radiografía de tórax mostraba cardiomegalia, y en el área pulmonar se observó infiltrado neumónico apical derecho; se le realizó ultrasonido abdominal y renal bilateral, el cual mostró una imagen adyacente a riñón izquierdo, redonda, de 4.l x 3.7 cm de diámetro, con regiones hipoecoicas, bien delimitada y con escasa vascularidad, que fueron consideradas compatibles con una tumoración suprarrenal (Fig. 2).
En la valoración por el Servicio de Oncología, se solicitó una serie ósea metastásica, la cual fue normal; se programó estudio de tomografía axial computada de área suprarrenal, solicitándole al Servicio de Cirugía practicarle venodisección para un acceso venoso seguro, durante el procedimiento, que resultó difícil por las características del cuello, la manipulación del área fue prolongada, observándose aumento de la frecuencia cardiaca a 158 x min y de la frecuencia respiratoria, por tal motivo se decidió intubar con cánula endotraqueal y colocarlo en ventilación asistida, trasladándolo al Servicio de Terapia Intensiva.
En el Servicio de Terapia evolucionó con fiebre de 38.8 °C, taquicardia, con oximetría de 70%; recibió antibióticos (amikacina, ceftriaxona) y nebulizaciones para el proceso neumónico, sin mejoría; posteriormente, presentó paros cardiacos, irreversible a maniobras de reanimación en el tercero de éstos.
Hallazgos de necropsia
La autopsia se realizó tres horas después del fallecimiento, corroborando los hallazgos morfométricos mencionados en la historia clínica. La herida quirúrgica de la venodisección mostró algunas zonas de hemorragia en los tejidos blandos periféricos.
El tumor suprarrenal izquierdo se observó de forma esférica, con peso de 50 g, midiendo 5 cm en su diámetro mayor, su superficie externa era lisa, vascularizada y de consistencia ahulada (Fig. 3). Al corte, la superficie era sólida, blanquecinagrisácea, con varios focos irregulares de hemorragia y cápsula menor de 0.1 cm (Fig. 4).

El tumor, histológicamente (400 X) presentaba aspecto trabecular sinusoidal con poco pleomorfismo nuclear en 60% de éste, y en 40% tenía aspecto pseudonodular, o de amplios sinusoides que produjeron pseudopapilas (Fig. 4).
El panículo adiposo en general era muy grueso, hasta de 1.5 cm en la pared abdominal, e histológicamente mostraba todavía aspecto magro.
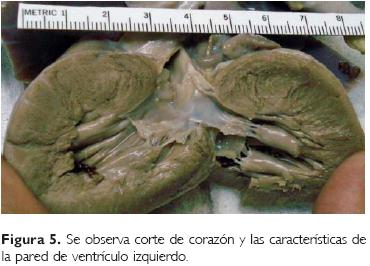
El corazón se apreció con aumento de peso (95 g vs un esperado de 27 g) y de tamaño; el ápex se observó redondeado. Mostraba aumento en el grosor de las paredes, tanto del ventrículo izquierdo (1.2 vs 0.3 cm) como en el derecho (0.8 vs 0.2 cm), así como también del septum ventricular, disminuyendo el tamaño de la cavidad con restricción del tracto de salida; en el ventrículo derecho se observó obstrucción del infundíbulo por abombamiento del septum a esta cavidad (Fig. 5).
En páncreas se encontraron incluidos nódulos que histológicamente correspondían a tejido esplénico (40 X); en el acercamiento (400X) se observaron ambos tejidos (páncreas y bazo) (Fig. 6).
Discusión
La causa de hipercortisolismo, con manifestaciones clínicas de síndrome de Cushing, se presenta más frecuentemente como consecuencia de la administración de glucorticoides sintéticos;1-3 las causas endógenas de hipercortisolismo pueden obedecer a hipersecreción de ACTH por la hipófisis, o por secreción excesiva de las glándulas suprarrenales. En el caso que aquí se informa, la sobreproducción de cortisol fue consecuencia de la tumoración suprarrenal, entidad poco frecuente en niños menores de cinco años, y muy rara en lactantes.10,11
Las manifestaciones clínicas en pacientes de edad escolar pueden ser muy floridas, con presentación característica, y no ofrecen duda en el diagnóstico; sin embargo, en otros pacientes, los signos clínicos pueden evidenciarse por falla en el crecimiento y obesidad, retardando el diagnóstico.1-5
En el caso de este paciente, la principal manifestación fue polifagia; el lactante prácticamente se mantenía demandando alimentación las 24 horas del día, la madre manifestaba fatiga, ya que durante cuatro semanas, previas al ingreso al hospital, casi no descansaba durante la noche, porque, además, el niño dormía poco tiempo y lo observaba polipneico. Su peso era de 6 400 g, dentro del percentil para su edad, con talla en percentil más bajo; los cambios de facies (pletórica) y engrosamiento del tórax y extremidades superiores, la madre los percibía como obesidad por la sobrealimentación al pecho. En este paciente de tres meses de edad, a su ingreso al hospital, a la exploración física podía advertirse fácilmente un síndrome de Cushing, con la característica cara en "luna llena", hirsutismo, lesiones acneiformes en tórax y brazos, además de "giba" y abultamiento del segmento superior (tronco) en región cervico-dorsal (Fig. 1); todos los cambios físicos encontrados fueron consecuencia de la acción persistente e intensa de los glucorticoides, los cuales además de favorecer el acúmulo de grasa en abdomen, tórax y cara, condicionan obesidad central. Por otro lado, al facilitar la acción de otros compuestos como hormona del crecimiento y antagonistas de receptores beta adrenérgicos, induce lipólisis, facilitando el incremento de triglicéridos y ácidos grasos libres. Habitualmente se observa adelgazamiento de las extremidades, con debilidad proximal; la disminución de la síntesis proteica conduce a atrofia de las fibras musculares, circunstancia que se acentúa por la disminución de potasio.1-5
Otros cambios en piel, que también suelen presentarse, como fragilidad capilar, equimosis y hematomas, y estrías rojas en abdomen y muslos, no ocurrieron en este lactante, apreciándose sólo piel marmórea.
En el curso de la evolución del paciente se detectó hipertensión arterial; dicho incremento en la presión arterial obedece a la secreción de renina y mineralocorticoides. En el hipercortisolismo se incrementa el sustrato de la renina, dando como resultado una respuesta presora de angiotensina y catecolaminas, reteniendo además sodio, facilitando la expansión de volumen extracelular.1-5
Existe una serie de estudios de laboratorio para establecer el diagnóstico. y que ayudan a discernir entre el origen hipofisiario o suprarrenal; en éstos se incluyen la determinación de cortisol sérico, cortisol libre en orina y 17 hidroxicorticoesteroides, la cual ha sido substituida por la prueba de cortisol libre en orina, para tener mejor sensibilidad; la prueba de supresión con dexametasona nocturna, ritmo circadiano del cortisol, ACTH plasmático, pruebas de estímulo de metopirona, estímulo con vasopresina y análogos, prueba de estímulo con hormona liberadora de corticotropina, y cateterismo de senos pretosos inferiores; algunos sólo disponibles en hospitales de tercer nivel en nuestro país. Los estudios de gabinete son: ultrasonido, tomografía axial computada, resonancia magnética; de estas pruebas, se hace la selección según la edad y las evidencias clínicas. Todas son de probada utilidad.1-6,12,13
En el caso que nos ocupa se hicieron los siguientes exámenes: biometría hemática, prueba de función hepática, electrolitos, colesterol, triglicéridos, urea y creatinina, de los cuales los que se encontraron alterados fueron: glucosa de 141 mg/dL, triglicéridos con 316 mg/dL y cortisol sérico de 163 μg/dL.
De los estudios de gabinete, la radiografía de cráneo fue normal, la de tórax con infiltrado bronconeumónico apical derecho y cardiomegalia global, el ultrasonido de área suprarrenal mostró tumoración en la región de riñón izquierdo, con diámetro de 4.1 x 3.7 cm, de escasa vascularidad y con zonas hipoecoicas; con los auxiliares de diagnóstico y el cuadro clínico, se estableció el diagnóstico de tumor suprarrenal funcionante. La evolución del paciente no permitió la realización de otro tipo de pruebas.
Se solicitó al servicio de cirugía la realización de venodisección para la programación de tomografía y resonancia magnética, previos a intervención quirúrgica; sin embargo, posterior a la manipulación del área cervical con intenciones de la colocación de catéter de venodisección, se acentuó la polipnea observada desde el ingreso, y en las horas siguientes hubo necesidad de colocar al niño en ventilación asistida.
La hipertensión arterial sistémica, los niveles elevados de cortisol y los cambios cardiacos, evidenciados por la radiografía de tórax, seguramente estaban relacionados con lesión miocárdica, que en el estudio de necropsia mostró cambios en el músculo cardiaco con gran hipertrofia, predominantemente de ventrículo izquierdo. El daño miocárdico estuvo relacionado con el exceso de cortisol, teniendo efecto local directo sobre el crecimiento miocárdico, ya que se produce incremento en la relación proteína/DNA, y que en este caso tal vez inició desde la etapa intrauterina; esto suele conducir a una disfunción sistólica y mayormente diastólica del corazón que lleva a insuficiencia cardiaca, como aconteció en este paciente. Por otro lado, la hipertrofia del músculo cardiaco también obedeció a la hipertensión arterial, presente desde la etapa intrauterina; la misma hipertrofia del músculo cardiaco produce alteración en la organización de las fibras miocárdicas, lo que conduce también a hipertrofia miocárdica hipertensiva. De esta patología se conocen dos variantes, la dilatada y la hipertrófica, como aconteció en este caso.6-8 Tomando en cuenta la edad de este lactante, la notable masa tumoral suprarrenal (50 g), además del posible inicio de hipercortisolismo desde la etapa intrauterina, aunado a la propia hipertensión arterial, en conjunto se pudo contribuir a una lesión de la fibra miocárdica, que originó a su vez cardiomiopatía hipertrófica obstructiva; todo lo anterior, sumado al estrés generado por el procedimiento quirúrgico, y el neumónico preexistente, pudieron ser factores propicios para desencadenar un choque cardiogénico, que llevó al fallecimiento del niño diez días después de su ingreso al hospital.
Por otro lado, se ha publicado que los tumores suprarrenales con peso mayor de 100 g, son un factor de mal pronóstico en etapas tempranas de la vida, correspondiendo a un estadio I de adenoma suprarrenal de acuerdo a la clasificación de Sandrini.1,2,4,9,10,12-16
Respecto al hallazgo de autopsia, con relación a la presencia de bazo accesorio intrapancreático, éste constituye una observación del desarrollo embrionario, que en etapas posteriores de la vida suele confundirse con tumores de páncreas, y algunas veces con infecciones abdominales y episodios de pancreatitis aguda; en este caso fue un hallazgo accidental que no influyó en la evolución.8,11,17
Referencias
1. Diez JJ, Rodríguez-Aranao M, Gómez-Pan A. Hiperfunción suprarrenal: síndrome de Cushing e hiperaldosteronismo primario. En: Pombo M, editor. Tratado de endocrinología pediátrica. 3ª ed. España, SAU: McGraw-Hill Interamericana; 2002. p. 1006-17. [ Links ]
2. Orth DN. Cushing's syndrome. N Engl J Med. 1995; 332: 791-803. [ Links ]
3. Lafferty AR. Pituitary tumors in children and adolescents. J Clin Endocrinol Metab. 1999; 43 17-23. [ Links ]
4. Chorousos GP. Cushing's syndrome. En: Rosenfel RL, editor. A current review of pediatric endocrinology. San Diego, CA, USA: Serono Symposia Inc.; 1995. p. 123-38. [ Links ]
5. Trainer PJ, Grossman A. The diagnosis and differential diagnosis of Cushing syndrome. Clin Endocrinol. 1991; 34: 317-30. [ Links ]
6. Farol L, Masson P. Mollet V, Simeoni V. Cushing's syndrome in pregnancy and neonatal hypertrophic obstructive cardiomiopathy. Acta Paediatr. 2004; 93: 1400-2. [ Links ]
7. Muesan ML, Lupia M, Salvetti M, Girigoletto C, Sonino N, Boscaro M, et al. Left ventricular structural and functional characteristics in Cushing's syndrome. Am Coll Cardiol. 2003; 41: 2275-9. [ Links ]
8. Zevitz EM, Sander EG. Cardiomyopathy hypertophic. (serial on internet) 2006 jul, section 1-1 1. Available from: http//www.emedicine.com/med/topic290htm126k. [ Links ]
9. Sandrini R, Ribeiro RC, de la Cerda L. Childhood adrenocortical tumors. J Clin Endocrinol Metab. 1997; 82: 2027-31. [ Links ]
10. Gayer G, Zissin R, Apter S, Atar E, Portnoy O, Itzchak Y. Pictorial review. CT findings in congenital anomalies of the spleen. BJR. 2001; 74: 767-72. [ Links ]
11. Kanazowa H, Kamya J, Nagino M, Vesaka KI, Yuasa N, Odak A, et al. Epidermoid cyst in on intrapancreatic accessory spleen: A case report. J Hepatobiliary Pancreat Surg. 2004; 11: 61-3. [ Links ]
12. Michalkiewicz E, Sandrini R, Figuereido B, Miranda ECM, Caran E, Oliveira-Filho A, et al. Clinical and outcome characteristics of children with adrenocorticol tumors: A report from the international pediatric adrenocortical tumor registry. J Clin Oncol. 2004; 22: 838-45. [ Links ]
13. Forga L, Anda E, Martínez-de Esteban JP. Síndromes paraneoplásicos. An Sist Sanit Navar. 2005; 28: 21 3-26. [ Links ]
14. Diez JJ, Gómez-Pan A. Diagnóstico del síndrome de Cushing. En: Novaendo, editor. Barcelon: Ed. EDIKA Med.; 2002. p. 1-10. [ Links ]
15. Tzanela M, Zianni D, Stylianidou Ch, Karavitaki N, Tsagarakis S, Thalassinos C. Evaluation of GH reserve in patients with adrenal incidentalomas and biochemical evidence of subclinical autonomous glucocorticoid hypersecretion. Clin Endocrinol. 2005: 62: 597-602. [ Links ]
16. Lindholm J, Juul S, Jorgensen JO, Astrup J, Bjerre P, Feldt-Rasmussen V, et al. Incidence and late prognosis of Cushing's syndrome: A population based study. J Clin Endocrinol Metab. 2001; 86: 1 17-24. [ Links ]
17. Fink AM, Kulkarni S, Crowley P, Crameri JA. Epidermoid cyst in a pancreatic accessory spleen mimicking and infected abdominal cyst in a child. AJR Am J Roentgenol. 2002; 79: 206-8. [ Links ]














