Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.66 no.1 México ene./feb. 2009
Artículo de revisión
Asma
Asthma
Blanca Estela del Río-Navarro, Emilia María Hidalgo-Castro, Juan José Luis Sienra-Monge
Departamento de Alergia, Hospital Infantil de México Federico Gómez, México, D. F., México.
Solicitud de sobretiros:
Dra. Blanca Estela del Río Navarro, Depto.
de Alergia, Hospital Infantil de México Federico Gómez,
Calle Dr. Márquez Núm. 162, Col. Doctores,
Deleg. Cuauhtémoc, C.P. 06720, México, D. F., México.
Fecha de recepción: 21-04-2008.
Fecha de aprobación: 25-11-2008
Resumen
El asma es una enfermedad inflamatoria crónica de las vías aéreas en la cual muchas células y productos celulares juegan un papel importante. La inflamación crónica produce un incremento en la reactividad de la vía aérea y episodios recurrentes de sibilancias, dificultad respiratoria, tiraje intercostal, tos y opresión torácica, especialmente en la noche y en la mañana. Estos episodios se asocian con obstrucción del flujo aéreo, reversible espontáneamente o con tratamiento. La inflamación también causa un aumento en la respuesta bronquial a una gran variedad de estímulos. Es la enfermedad crónica más común en la infancia, los estudios epidemiológicos en América Latina han revelado diferencias en prevalencia del asma con cifras de 5.7 a 16.5% en la población pediátrica. En los últimos años se han realizado estudios en la Ciudad de México aplicando la metodología del ISAAC, determinando que la prevalencia es de 8 a 12%. Varios factores de riesgo se asocian con el desarrollo de esta enfermedad, a continuación se exponen éstos, así como la fisiopatología de la enfermedad, manifestaciones clínicas, estrategias de diagnóstico y opciones terapéuticas.
Palabras clave. Asma; hiperreactividad bronquial; enfermedad crónica; niños.
Abstract
Asthma is a chronic inflammatory disorder of the airways in which many cells and cellular elements play a role. The chronic inflammation is associated with airway hyperresponsiveness that leads to recurrent episodes of wheezing, breathlessness, chest tightness, and coughing, particularly at night or in the early morning. These episodes are usually associated with widespread, but variable, airflow obstruction within the lung that is often reversible either spontaneously or with treatment. It is the most common respiratory disease in childhood, epidemiologic studies in Latin America report prevalence varying from 5.7 to 16.5%. Recent studies using ISAAC methodology in Mexico City have reported prevalence from 8 to 12%. Numerous risk factors have been associated with this disease. This factors, physiopathology, clinical presentation, diagnosis and therapeutics options are reviewed.
Key words. Asthma; bronchial hyperreactivity; chronic disease; child.
El asma es la enfermedad crónica más común de la infancia; representa la primera causa de ausentismo escolar, consultas urgentes al pediatra o al servicio de urgencias y hospitalización. En el Hospital Infantil de México Federico Gómez, de las 5 200 consultas anuales de 2007 en el servicio de alergia, 80% fue por asma.1
El impacto de esta enfermedad es tremendo, no solo por su alta morbilidad, sino por el efecto económico y social asociado a ella. Frecuentemente, la enfermedad y los síntomas nocturnos acompañados con las alteraciones del sueño, tanto en los niños como en sus padres, dan como resultado un desempeño escolar pobre y días de trabajo perdidos.
Es más prevalente en niños con historia familiar de alergia, y los síntomas y exacerbaciones son provocados por una gran variedad de disparadores como infecciones virales, alergenos intra y extradomiciliarios, humo de cigarro y contaminación del aire ambiente. Muchos lactantes y preescolares presentan episodios recurrentes de síntomas bronquiales, especialmente sibilancias y tos que inician desde los primeros meses de vida y acompañan a infecciones respiratorias.
Actualmente se considera que las principales causas que contribuyen a la morbimortalidad del asma son el subdiagnóstico y el manejo inadecuado; factores que muy probablemente sean la causa de una educación médica inadecuada. Nuestro objetivo en la presente revisión es mostrar las principales evidencias científicas para su diagnóstico y manejo de este padecimiento.
Definición
Debido a su etiología multifactorial, a las alteraciones funcionales respiratorias y a sus diversas expresiones clínicas, de acuerdo a la edad de presentación, no hay una definición que describa completamente a esta entidad. Por lo tanto, definir asma es complejo, ya que es una enfermedad multifactorial (etiología, características morfológicas, cambios funcionales y manifestaciones clínicas), en la cual existe una interacción entre el sistema inmunológico y el sistema nervioso autónomo. Sin embargo, la definición más completa es la que toma en cuenta tanto el punto de vista funcional como el celular, es por eso que la definición que mejor se adapta es la propuesta por la Iniciativa Global para el Asma (GINA 2006),2 que propone al asma como una enfermedad inflamatoria crónica de las vías aéreas, en la cual muchas células y productos celulares juegan un papel importante. La inflamación crónica produce un incremento en la reactividad de la vía aérea y episodios recurrentes de sibilancias, dificultad respiratoria, tiraje intercostal, tos y opresión torácica, especialmente en la noche y en la mañana.
Estos episodios se asocian con obstrucción del flujo aéreo, reversible espontáneamente o con tratamiento. La inflamación también causa un aumento en la respuesta bronquial a una gran variedad de estímulos.3 Así entonces, en todos los casos se hace énfasis de que el asma es una alteración inflamatoria crónica de las vías aéreas, que puede asociarse en forma aguda o crónica con limitación del flujo aéreo como resultado de broncoconstricción, edema, secreción mucosa (Cuadro 1), inflamación y, en algunos pacientes, remodelación de las vías aéreas. La remodelación de la vía aérea corresponde a aquellos cambios estructurales caracterizados por engrosamiento de la lámina reticular con depósitos de fibrina subepitelial y perivascular, hiperplasia de las glándulas mucosas, músculo liso y vascular. Esto determina el engrosamiento de la pared de los bronquios de conducción mayor (accesibles a su estudio por biopsia de mucosa) y también en la pequeña vía aérea (accesibles por lavado broncoalveolar).4 El engrosamiento de la pared bronquial y su mayor rigidez, la disminución del área de sección transversal y el acortamiento de la vía aérea (por la disposición en doble hélice del músculo), determina la pérdida de la función pulmonar observada en algunos pacientes asmáticos en estudios longitudinales.5 Este mayor grosor y rigidez de la vía aérea condiciona en parte la hiperreactividad bronquial (HRB) inespecífica (10 a 20 de los asmáticos tendrán remodelación).

La atopia es el factor predisponente identificable más importante de esta enfermedad. Ésta es la predisposición genética para producir inmunoglobulina E (IgE) como una respuesta antígeno-específica a alergenos comunes inocuos para la mayoría, como polvo, epitelios de animales o pólenes.
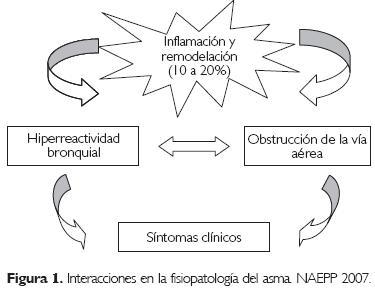
El asma es una enfermedad crónica de las vías aéreas producida por una compleja interacción entre obstrucción de la vía aérea, HRB e inflamación, y se caracteriza por síntomas variables y recurrentes.6 La interacción de estas tres características determina las manifestaciones clínicas, la gravedad del asma y su respuesta al tratamiento (Fig. 1).
Epidemiología
La prevalencia de asma varía de acuerdo con la zona geográfica, el clima, el estilo de vida y el desarrollo económico de cada región.7 La Organización Mundial de la Salud (OMS) estima que afecta a 300 millones de personas y aún en la actualidad es causa de muerte en todo el mundo, estimando 250 000 muertes por asma al año.8 En las últimas cuatro décadas la prevalencia aumentó de forma importante, principalmente en las ciudades industrializadas.9 Sin embargo, en los últimos 10 años se ha establecido una meseta, en donde a pesar de permanecer alta, no se han reportado incrementos.
En todo el mundo se están realizando estudios epidemiológicos, predominantemente de tipo transversal, con la finalidad de determinar la prevalencia de asma y su tendencia. Así, se creó, en 1991, el International Study of Asthma and Allergies in Childhood (ISAAC =Estudio internacional de asma y alergias en niños) que junto con la European Community Respiratory Health Survey (ECR-HS =Comunidad europea de salud respiratoria), que estudia población adulta joven, han determinado que países como Estados Unidos de Norteamérica, Canadá, Reino Unido, Nueva Zelanda y Australia tienen prevalencias más altas, mientras que las más bajas se encuentran en China, India, Etiopia, Indonesia y Europa del Este.
El ISAAC y la ECRHS ponen de manifiesto una gran variabilidad en la distribución espacial del asma. Los estudios epidemiológicos en América Latina han revelado diferencias en prevalencia del asma, con cifras de 5.7 a 16.5% en la población pediátrica. Valores que pueden deberse al uso de distintas metodologías o a la influencia de diversos factores geográficos, demográficos y ambientales.10
En México no se ha estimado la prevalencia del asma en la población general del país o en grupos definidos de edad y sexo. Sin embargo, se han publicado estimaciones de la prevalencia del asma en varias zonas del país. Por ejemplo, en Villahermosa, Tabasco, una encuesta realizada en 1986 mostró una prevalencia de 8.7% en la población escolar,11 en Guadalajara, Jalisco, en 1990 se reportó una prevalencia en escolares de 12.8%, con un predominio del sexo masculino.12 En 1991 en Monterrey, Nuevo León, reportaron 2.7%.13 En 1997 en Mérida, Yucatán, una encuesta en escolares reportó 12%.H Con la metodología del ISAAC, existen en México tres estudios: el primero fue realizado en Cuernavaca, Morelos, en 1997,15 donde se estableció una prevalencia de asma de 5.8% (5.2-6.4). En 1998-1999, en Ciudad Juárez, Chihuahua,16 se determinó que la prevalencia de asma era similar a la de Cuernavaca, desafortunadamente la muestra en ambos estudios tuvo una variación de edad más amplia que el que recomienda el ISAAC (seis a ocho años y 11 a 14 años). En el estudio de Hermosillo, Sonora, la tasa de contestación del cuestionario fue muy baja (49%) para valorar adecuadamente la prevalencia y hacer comparaciones significativas.17 En los últimos años se han realizado estudios en la Ciudad de México, aplicando la metodología del ISAAC, determinando que la prevalencia es de 8 a 12%. El grupo de adolescentes de 13 a 14 años es el más afectado, con una prevalencia de 9.9%, mientras que en el grupo de escolares de seis a siete años es de 6.8%. A lo largo de este estudio, se observó mayor frecuencia y gravedad de asma en las mujeres adolescentes,18 valorando el número de crisis, la presencia de tos y disturbios del sueño.19 La prevalencia de asma en México es muy similar a la observada en Europa del este y Asia; sin embargo, comparada con los países de América latina es de los países con menos prevalencia.20
En cuanto a la mortalidad, se ha observado que es más frecuente en invierno, con predominio discreto en las mujeres, y México es uno de los países con tasas más elevadas.21
Etiología y clasificación
Se ha intentado clasificar el asma según sus causas, intensidad y obstrucción de la vía aérea valorada por el volumen espiratorio máximo al final del primer segundo (VEF1) o el pico espiratorio máximo (PEF) y su respuesta al manejo. Esto no es apropiado, ya que el asma es multifactorial y contribuyen tanto factores genéticos como ambientales.
Anteriormente, el asma se clasificaba en extrínseca, la cual tenía un componente alérgico, y en asma intrínseca, que representaba a un grupo de pacientes donde no se encontraba una causa justificada y con pruebas de laboratorio para alergia negativas.
El asma puede clasificarse por los factores etiológicos, la gravedad o el tipo de limitación en el flujo aéreo. Dado que es una enfermedad heterogénea, existen múltiples factores causales tanto para su inducción como para su exacerbación, desde infecciones virales en la infancia hasta exposición ocupacional en los adultos. La gravedad se estima por una evaluación combinada de los síntomas, cantidad de agonistas broncodilatadores beta dos (β2) para controlar los síntomas y la función pulmonar.22
Clasificación etiológica
La clasificación etiológica (Fig. 2) divide al asma en:

Asma extrínseca: se presenta en edades tempranas, con carga familiar de atopia, con pruebas cutáneas (PC) positivas a múltiples alergenos e IgE total elevada.
Asma intrínseca: se presenta en su mayoría después de los 35 años de edad, no hay carga familiar de atopia, con PC negativas e IgE total normal. Se presenta como consecuencia de infecciones, por ejercicio, cambios hormonales, estímulos psicológicos, etc.
Asma mixta: combinación de características de ambas.
Sin embargo, esta clasificación se ve limitada por la existencia de pacientes asmáticos, en quienes el ambiente no tiene causa identificada. De todas formas, en todo paciente asmático es necesario identificar exacerbantes ambientales como parte inicial de la investigación clínica, ya que esto ayudará posteriormente en la estrategia terapéutica.
Clasificación con base a la gravedad
En este tipo se agrupa una serie de variables que incluyen: a) la frecuencia de los síntomas durante el día y la noche, b) su repercusión en las actividades cotidianas realizadas durante el día y la noche, c) el uso, número de veces y la dosis en que se utiliza β2 agonista para tratar los síntomas, y d) la función pulmonar. Esta clasificación es útil, ya que relaciona la inflamación de la vía aérea con la clínica y con los índices de gravedad de síntomas según la intensidad del asma. Además, vincula los datos clínicos con el grado de obstrucción de la vía aérea y la variabilidad de los parámetros paraclínicos que miden esta obstrucción (VEF 1 ó PEF).
De esta forma, se ha subdividido el asma crónica en: leve intermitente, leve persistente, moderada persistente y grave persistente. La ventaja de este tipo de clasificación es que de manera práctica permite iniciar tratamiento basado en la gravedad y establecer, posteriormente, un plan de tratamiento de acuerdo al control y estabilización de síntomas. Ha sido propuesta por el Programa Nacional de Educación para Asma (NAEPP). Así, la gravedad de los pacientes con asma puede clasificarse en uno de estos cuatro escalones antes del tratamiento y durante la vigilancia de éste. Si el control de asma se mantiene, el grado de asma se reclasifica y se instala otro manejo de acuerdo a la intensidad. Otra forma para clasificar el asma es con base a los parámetros de función pulmonar que se correlacionan con obstrucción de la vía aérea, así, con base al grado de obstrucción obtenido mediante el VEF1 ó el PEF se cataloga la intensidad del asma. Este tipo de clasificación ayuda al manejo adecuado, que aunado a los síntomas matutinos y nocturnos es más útil.
Como veremos en los siguientes párrafos, GINA tiene esta misma clasificación pero para fines de investigación, ya que actualmente se propuso otra, de acuerdo al control de los síntomas (mal controlada, regularmente y bien controlada), para su manejo más práctico.
Factores que influyen en la expresión y desarrollo de asma
La atopia es el factor de riesgo más importante para desarrollar asma. La respuesta inmune está enfocada al desarrollo de IgE antígeno-específica como esencial en la atopia. Los factores ambientales y el estilo de vida se han sugerido como moduladores en el desarrollo de atopia. La importancia de los agentes del medio ambiente en los procesos atópicos, es conocer cómo influyen éstos en la gestación y en la edad temprana en niños, períodos de la vida donde ejercen mayor efecto.
Los factores que incrementan el riesgo de asma pueden dividirse en los que causan el desarrollo del asma y los que disparan o provocan los síntomas de ésta. Los primeros son factores propios del huésped (genéticos) y los segundos son factores, principalmente, del medio ambiente (Fig. 3).23 Sin embargo, los mecanismos que influyen en la expresión y desarrollo del asma son complejos e interactivos.
I. Factores del huésped
Una característica común de la enfermedad atópica es el desarrollo de susceptibilidad individual con la exposición significativa al medio ambiente, esto estimulado por su estilo de vida. La susceptibilidad para desarrollar enfermedad atópica parece tener asociación familiar y componentes genéticos.24
a) Genética (Cuadro 2). Las evidencias de los componentes genéticos en el asma están fundamentadas en estudios de enfermedades fenotípicas en gemelos. Esta significativa concordancia se ve en gemelos monocigotos (MZ) comparada con los dicigotos (D2) asmáticos. Un estudio reportó que los gemelos MZ tienen 19.8% riesgo de asma y los D2 4.8%. Un segundo estudio de 2 902 gemelos reveló 30 vs 12% para MZ y D2, respectivamente.25 Estos estudios indican que hay un componente genético para asma y la atopia. Sin embargo, esto no es para todas las personas atópicas que tienen una misma enfermedad, y se han identificado genomas que no tienen 100% de relación con el desarrollo de asma o enfermedad atópica. Las técnicas de mapeo genético y el código genético son importantes en el estudio de asma y atopia (por los fenotipos similares y características de la enfermedad en asma y atopia). Numerosos estudios en laboratorio sugieren que las regiones del cromosoma 5q 31-33 son importantes en asma y atopia,26,27 los genes de las IL-3, IL4, IL5, IL13 y GM-CSF se agrupan en el cromosoma 5. Estos estudios técnicos indican que la subunidad B de los receptores de alta afinidad de IgE está localizada en el cromosoma 11q. Todos estos estudios de genética consideran una conexión importante dentro de las diferentes regiones: 5q (niveles de IgE y de eosinófilos, IL-4, 5 y 13), 6p (HLA-DR) 11q (subunidad B FceRI, factor de necrosis tumoral [FNT]), 12q (interferón alfa), 13q (atopia y asma) y 14q (TCR). Recientemente, el gene ADAM 33, que codifica el procesamiento de la enzima metaloproteinasa, se encontró asociado con el desarrollo de asma.

Algunos estudios sugieren que, probablemente, el asma o la atopia están determinados en las regiones 2q, 5p, 11p, 17p, 19p y 21q.28
b) Obesidad. La obesidad también ha demostrado ser un factor de riesgo para asma, algunos mediadores como las leptinas pueden afectar la función de la vía aérea y aumentar el desarrollo de asma.29 La asociación entre obesidad y asma ha sido particularmente fuerte en mujeres y en jóvenes postpuberales.30 Aún faltan mayores estudios controlados de buena calidad, para evaluar si hay asociación causal de la obesidad y el asma.
c) Sexo. Ser del género masculino es un factor de riesgo para asma en los niños. Antes de los 14 años de edad, la prevalencia de asma es el doble en niños, comparado con las niñas. A medida que se incrementa la edad, la prevalencia se equipara entre sexos, pero en la edad adulta afecta más al sexo femenino. Las diferencias entre sexos no están claras; sin embargo, se sabe que el tamaño de los pulmones es menor en el sexo masculino que en el femenino al nacimiento pero mayor en la edad adulta.
II. Factores ambientales
a) Influencia del medio ambiente en el desarrollo de atopia y asma. Se han observado los factores primarios que influyen en el desarrollo de asma y atopia en la vida fetal, y probablemente en niños mayores; éstos son la exposición a alergenos, la exposición materna a la dieta con alergenos y la expresión inmune, determinada genéticamente en la vida fetal. Algunos estudios examinan el papel específico de la influencia del medio ambiente (incluyendo enfermedades de transmisión sexual [ETS], escape de diesel, exposición a endotoxinas y criterios de contaminación del aire) en el desarrollo de la expresión inmune de alergia.
b) Tabaquismo pasivo. El tabaco aumenta inespecíficamente la reactividad bronquial, puede ser por aumento de la inflamación bronquial. El que una madre sea fumadora, aumenta el riesgo de comienzo de asma y de exacerbaciones. La exposición intrauterina al humo de tabaco puede afectar la reactividad bronquial y producir una alteración inicial de la función pulmonar al nacimiento.31
c) Influencia del estilo de vida en el desarrollo de atopia. Un gran número de estudios epidemiológicos han sostenido el papel importante del estilo de vida como factor modulador de la expresión de la atopia en individuos susceptibles. Un ejemplo intrigante son los efectos del estilo de vida en el estudio de prevalencia del asma y atopia en niños del occidente de Alemania, después de la reunificación política del estado. Inmediatamente después de la reunificación en 1990, estudios de prevalencia de atopia y asma en niños al este y oeste de Alemania revelaron que los niños del este tuvieron más diagnósticos de bronquitis y más bajo para atopia, con PC positivas y más bajo para asma que en el occidente. Esto establece que el factor estilo de vida tiene influencia en el desarrollo de atopia, siendo éste un candidato para esta entidad. Pocos años después, la velocidad de atopia en el oriente de Alemania se ha ido incrementando progresivamente. Esto está muy asociado con su nuevo estilo de vida, incluyendo la disminución del uso del carbón industrial, incremento del uso del automóvil y de la ingesta de alimentos altos en grasa. La disminución en el ejercicio y los cambios en el estilo de vida son asociados al desarrollo de atopia y asma. Con todo esto, es probable que la urbanización sea la característica principal en el desarrollo de asma y atopia. Es posible que la combinación de la respuesta a la alteración producida por el medio ambiente y la expresión genética importante, produzca como resultado un fenotipo atópico.
Un ambiente "no higiénico" puede proteger contra padecimientos alérgicos induciendo una respuesta TH1, así como una regulación inmunológica adicional. No solo los parásitos helmintos, que se caracterizan por producir infecciones crónicas, sino también otros patógenos, y algunos comensales, son capaces de promover una respuesta reguladora antiinflamatoria, incluyendo células T que secretan IL-10 y TGF beta (citoquinas antiinflamatorias que inhiben respuestas inmunopatológicas dañinas). La evidencia sugiere que los receptores Toll (TLR) expresados sólo en las células dendríticas y en los macrófagos, pueden tener un papel crucial en esta regulación. Estudios longitudinales en Alemania y en África, sobre tamaño de la familia y cuidado en guarderías, sugieren que los factores ambientales son más importantes para el desarrollo de atopia y rinitis alérgica que de asma. Son necesarios más estudios, pues aunque hay muchos datos en la literatura sobre la asociación inversa entre la exposición a helmintos y microorganismos y el desarrollo de enfermedad atópica, aún no se pueden sacar conclusiones seguras sobre la causalidad de esta asociación.
d) Infecciones y antibióticos. Efectos de las citocinas expresadas por TH1 vs TH2. La función inmune fetal inicial es de tipo TH2. Adicional a esto, se sugiere que el medio ambiente acentúa la supresión de la respuesta de TH1 en los niños en que persiste la función inmune fetal, así se incrementa el potencial para desarrollar enfermedad alérgica como el asma. Entre más frecuente sea esta característica inmunológica se mantendrá la enfermedad atópica. El interferón alfa juega un papel importante en la expresión de TH1 y antagoniza la acción de la IL4, permitiendo la producción de IgE. Factores externos agonistas tienen un papel importante para modificar la respuesta de TH1 (vacunas,32 infecciones, antibióticos). Quizás, una de las observaciones más interesantes en el rol de TH1 es limitar la expresión de TH2, lo que fundamenta los efectos de la vacuna antituberculosa (BCG) en el desarrollo de la atopia. Japoneses escolares fueron vacunados rutinariamente con BCG, observando una relación inversa entre retardo de la hipersensibilidad a Mycobacterium tuberculosis y la incidencia de asma y elevación de IgE. Estudios en Inglaterra fallaron en relacionar la vacuna de BCG y la atopia, mientras que un estudio en Alemania sí demostró menor incidencia de asma en los niños vacunados.33 Sin embargo, estudios en ratas, han demostrado que la vacunación con BCG bloquea el desarrollo de alergenos específicos a IgE, y la respuesta eosinofílica a alergenos después del contacto con éstos, lo que sustenta la idea de que la vacuna BCG es un potente estimulador de TH1.
La disminución de la incidencia a infecciones, y el uso frecuente de antibióticos, ya está bien documentado que contribuyen al desarrollo de atopia.34 La hipótesis se basa en la disminución del estímulo a TH1 (probablemente por alteración de la colonización bacteriana que estimula la respuesta inmune a TH1), y una respuesta TH2 que se presenta desde la vida fetal, y se mantiene dependiendo del fenotipo inmune. El uso de antibióticos en edades tempranas de la vida se relaciona con la aparición de atopia. En sociedades donde el uso de antibióticos disminuye y la infección natural es más frecuente, la atopia ocurre menos.
Sin embargo, se ha observado que no todas las infecciones tienen efectos teóricamente protectores contra el asma con factor atópico. Las infecciones de las vías respiratorias causadas por virus y microorganismos atípicos como Chlamydia y Mycoplasma están involucradas en el desarrollo de asma. El virus sincitial respiratorio (VSR) es el que más se ha asociado con las infecciones de vías respiratorias inferiores en niños y el desarrollo posterior de asma.35 El aumento en la frecuencia de infecciones que producen síntomas de las vías respiratorias inferiores se debe a la interacción entre la sensibilización alérgica, la exposición en el medio ambiente a factores irritantes y contaminantes, y las infecciones virales o microorganismos atípicos que actúan como factores asociados.36 No podemos confirmar que las infecciones respiratorias virales favorezcan el desarrollo de asma, pero sí que son desencadenantes de los cuadros agudos.37
e) Contaminantes específicos y sus efectos en la inflamación por TH2. Un buen número de contaminantes del aire contribuyen a la exacerbación del asma. Por cierto, contaminantes como NO2 y O3 se han asociado con exacerbaciones de asma en estudios epidemiológicos y en animales, teniendo un incremento inmediato en la respuesta de fase tardía a alergenos inhalados en individuos sensibilizados. Sin embargo, en algunos animales sucede lo contrario, estos contaminantes aparentemente no tienen un rol importante en el desarrollo actual del fenotipo TH2. En contraste, algunos estudios sugieren que las partículas de diesel (DEPs) favorecen la inflamación bronquial en asma, producen HRB sin desviar la respuesta inmune hacia TH238 y tienen la capacidad de activar a los basófilos, tanto en los sujetos alérgicos como en los no alérgicos, lo que sugiere su papel importante en el aumento de las enfermedades alérgicas.39,40
f) Humo de cigarrillo. Fumar cigarrillo se ha asociado con disminución acelerada de la función pulmonar en pacientes asmáticos, con aumento de la gravedad del asma, puede hacer que los pacientes respondan menos al tratamiento con esteroides inhalados41 y sistémicos,42 y reduce el control del asma. La exposición al humo del cigarrillo en el período prenatal y después del nacimiento, se asocia con efectos dañinos, incluyendo mayor riesgo de presentar síntomas parecidos al asma en la infancia. Sin embargo, no existe evidencia certera sobre su efecto directo en el incremento de enfermedades alérgicas.
Estudios han demostrado que los hijos de madres fumadoras tienen cuatro veces más riesgo de desarrollar enfermedades sibilantes en el primer año de vida.43
La exposición ambiental al humo del cigarrillo (fumador pasivo) aumenta el riesgo de infecciones del tracto respiratorio en la infancia y en la niñez.44
g) Alergenos. Los alergenos intra y extradomiciliarios son bien conocidos como causantes de exacerbaciones de asma; sin embargo, su papel en el desarrollo de esta enfermedad no está bien conocido. Estudios de cohorte al nacimiento han observado que la sensibilización a ácaros, gato, perro y Aspergillus son factores independientes para síntomas de asma en niños de hasta tres años de edad.45,46 Sin embargo, la asociación entre sensibilización y desarrollo de asma no es directa y depende del alergeno, la dosis, tiempo de exposición, edad del niño y la herencia.
En la fisiopatología del asma se debe tener en cuenta: inflamación bronquial (con o sin factor alérgico), obstrucción del flujo aéreo e HRB (Fig. 1).
En la inflamación intervienen células, mediadores químicos y neurotransmisores:
Células. La presencia de eosinófilos y mastocitos activados en el epitelio y en la luz bronquial, se traducen en el aumento de las concentraciones de los productos elaborados por estas células (histamina, prostaglandinas D2 y leucotrienos).
Mediadores químicos. Los eosinófilos y mastocitos liberan numerosas sustancias químicas capaces de ocasionar edema y broncoconstricción de la mucosa respiratoria: histamina, eicosanoides (derivados del ácido araquidónico) y factor activador de las plaquetas (FAP).
Neurotransmisores. Las vías aéreas están reguladas por el sistema nervioso autónomo (SNA), que actúa sobre la musculatura lisa bronquial y las glándulas secretoras. El SNA está formado por el sistema adrenérgico o simpático (broncodilatador) y el colinérgico o parasimpático (broncoconstrictor). Los neurotransmisores son la noradrenalina y la acetilcolina, respectivamente.
Alergia. En ésta interviene la IgE, cuya formación depende de los linfocitos B, y es regulada por la IL4 y el interferón gamma, sintetizados por los linfocitos TH2 y TH1, respectivamente. La inflamación alérgica se encuentra sólo en el paciente sensible que se expone a un alergeno, éste se pega a su IgE específica que se posa sobre la membrana celular del mastocito con liberación de mediadores inflamatorios como histamina, tromboxanos, prostaglandinas y leucotrienos que ocasionan las manifestaciones clínicas del asma. La síntesis de esta IgE se inicia después de la exposición repetida a un alergeno, para ser llevada a los nódulos linfáticos, que es donde se imprime la memoria inmunológica.47
En la fase temprana hay espasmo del músculo liso bronquial, y en la fase tardía la inflamación es lo más importante.
Muchas células participan en este proceso y liberan sustancias proinflamatorias o enzimas proteolíticas que dañan directamente el epitelio bronquial. El inicio de la respuesta origina la activación y liberación de mediadores, este proceso ha sido denominado como "cascada alérgica" (Fig. 4).48
El patrón característico de la inflamación encontrada en las enfermedades alérgicas es la del asma, con mastocitos activados, número incrementado de eosinófilos activados, células naturales asesinas (natural killer [NK]) y linfocitos TH2 que provocan la liberación de mediadores inflamatorios. Otras células participantes son: a) mastocitos, que tienen un papel muy importante en la fase temprana alérgica, la cual depende de la presencia de IgE específica en su superficie, que se une al alergeno y condiciona la liberación de histamina, ácido araquidónico y sus metabolitos, interleucinas como la IL-1, IL-2, IL-3, IL-4, IL-5, factor estimulante de colonias de granulocitos y macrófagos, interferón gamma y FNT alfa.49 El daño producido sobre el epitelio de la vía aérea estimula la generación de factores de crecimiento fibrolinfoproliferativos y profibrogenéticos, los cuales promueven la proliferación y diferenciación de fibroblastos a miofibroblastos para secretar colágeno intersticial y son mitógenos para músculo liso y células endoteliales, causando remodelación pulmonar; b) eosinófilos, se producen en la médula ósea, contienen en su interior gránulos con enzimas pro teolíticas, como la proteína básica mayor, que daña el epitelio de la vía aérea de manera directa y estimula la degranulación de basófilos y mastocitos. Produce leucotrienos, especialmente C4, que contrae el músculo liso, aumenta la permeabilidad vascular y puede reclutar más eosinófilos. Su ciclo de vida está regulado por IL-5, RANTES, proteína inflamatoria de macrófago la y la eotaxina;50 c) macrófagos, captan, procesan y presentan los alergenos a los linfocitos T, activándolos para que liberen citocinas inflamatorias. Los macrófagos de la vía aérea eliminan los detritus celulares, fagocitan microorganismos y poseen la capacidad de migrar a los sitios de la reacción inflamatoria, donde secretan leucotrienos, FAP, óxido nítrico y nitritos. Esto produce daño directo sobre el epitelio e inflamación crónica; d) neutrófilos, son células polimorfonucleares que contienen en su interior gránulos de proteasas, hidrolasas, mieloperoxidasas y enzimas. Son capaces de secretar citocinas pro inflamatorias (FNT alfa, IL-1, IL-6), hematopoyéticas (IL-3, GM-CSF) y quimiocinas (IL8), las cuales reclutan células inflamatorias y promueven una respuesta en cascada.51
Mediadores inflamatorios
Aproximadamente, han sido reconocidos 100 mediadores diferentes como involucrados en asma y como mediadores de compleja respuesta inflamatoria de la vía aérea.52
Las citocinas son moléculas glucoproteicas solubles, secretadas por diferentes tipos de células, las cuales se unen a los receptores de membrana en las células blanco, iniciando la activación celular. Esta actividad requiere de factores de transcripción y activación, algunos de los cuales son de la familia de Janus Kinasa (JAK) y STAT (signal transducers and activators of transcription). STAT5 y STAT6 son responsables de las respuestas celulares de IL-4 e IL-5, regulando la transcripción genética y su producción.
Fisiopatología del asma
El estrechamiento de la vía aérea es la vía final común que desemboca en los síntomas y cambios fisiopatológicos del asma. Las principales alteraciones ana tomo-funcionales del asma son la obstrucción del flujo aéreo, la HRB y la inflamación y remodelación de la vía aérea.
Obstrucción del flujo aéreo
Las vías aéreas de los asmáticos presentan aumento de la masa de músculo liso bronquial, causado por hipertrofia e hiperplasia celular. Los miofibroblastos, fibroblastos y pericitos del endotelio vascular son células que poseen la capacidad de convertirse en células musculares a través de un proceso de diferenciación.
El broncoespasmo es la respuesta súbita que tiene como vía efectora el músculo liso bronquial y genera contracción del mismo ante diversos estímulos, ocasionando el estrechamiento de la vía aérea con disminución del flujo. Varios factores regulan el tono del músculo liso bronquial, destacando las células residentes (mastocitos, células epiteliales, macrófagos y células endoteliales) y las células inflamatorias (eosinófilos, linfocitos, neutrófilos, basófilos) capaces de liberar sustancias proinflamatorias (histamina, cisteinilleucotrienos, prostaglandina D2, FAP), las cuales producen contracción del músculo liso y liberación de una mayor cantidad de mediadores. El estímulo neural del músculo liso bronquial y los estímulos directos, liberan acetilcolina que causa broncoespasmo. La sustancia P y neurocinina A son también reguladores del tono muscular.
HRB
La HRB es la respuesta exagerada que induce un broncoespasmo mucho más intenso del que se observa en los individuos normales que son expuestos a estímulos que afectan directamente al árbol bronquial (contaminantes, ejercicio).
Inflamación y remodelación
La inflamación es una de las principales características del asma y contribuye de manera significativa a la expresión de la enfermedad.
El patrón inflamatorio dependerá del estado de la enfermedad. Algunos factores que contribuyen a la inflamación y a la remodelación son las infecciones virales, sensibilización alérgica y la contaminación ambiental. El proceso inflamatorio produce edema de la submucosa con infiltrado celular, angiogénesis de los vasos con dilatación y congestión, hipertrofia e hiperplasia del músculo liso.2 El aumento del número y tamaño de los vasos contribuye al engrosamiento de la pared bronquial y favorece la obstrucción de la vía aérea.
El daño que produce la inflamación sobre el epitelio respiratorio se traduce en una pérdida de la barrera epitelial. La extensión del daño epitelial parece ser el resultado de la disfunción del receptor del factor de crecimiento epidérmico (EFGR), el cual regula al factor de crecimiento epidérmico (FCE) necesario para una reepitelización adecuada. Los FCE estimulan la proliferación epitelial y producción de metaloproteasas (MMP) que degradan la matriz extracelular (MEC) y mantienen un balance con el TGF-(3 que incrementa la síntesis de los componentes de la MEC e inhibe la producción de MMP.
El fibroblasto es una célula clave en el proceso de remodelación del asma, produce una gran cantidad de citocinas y factores de crecimiento e induce la síntesis de ácido hialurónico y otros proteoglicanos de la MEC.
En la remodelación de la vía aérea coexisten fenómenos que tienden a agravar la obstrucción y la HRB (incremento de la masa de músculo liso, reorganización de la elastina y cartílago), junto con mecanismos compensadores del daño inflamatorio bronquial (regeneración epitelial, depósito de colágeno subepitelial y entre las capas musculares). Hay angiogénesis durante la reconstrucción de la vía aérea, infiltración vascular y vasodilatación, cambios que pueden ser resultado del daño directo sobre el epitelio y producir remodelación. Estos cambios pueden ser el resultado del daño directo sobre el epitelio y producir remodelación.53
Mecanismos neuroefectores
Los neurotransmisores producen cambios en el calibre bronquial, afectando la reactividad bronquial y pueden inducir o aumentar el grado de inflamación. El sistema colinérgico (acetilcolina) es el principal estímulo neural broncoconstrictor, cuyo sistema broncodilatador es el inhibidor no adrenérgico no colinérgico (iNANC), siendo sus principales neurotransmisores el péptido intestinal vasoactivo (VIP) y el óxido nítrico.
Existe además un sistema excitatorio no adrenérgico no colinérgico (eNANC), con efectos broncoconstrictores; sus principales mediadores son la sustancia P (SP) y la neurocinina A (NKA).
Los neuropéptidos son también producidos por eosinófilos, monocitos, macrófagos, linfocitos y células dendríticas.54
Historia natural del asma en niños
Está bien establecido que el asma es una enfermedad variable que puede presentarse de forma diferente entre individuos, y cuya progresión y síntomas varían dentro de la experiencia de un mismo paciente a través del tiempo.
El curso natural de esta enfermedad, ya sea hacia la remisión o al agravamiento, es lo que comúnmente se conoce como historia natural de la enfermedad. El rumbo que toma esta enfermedad puede variar, principalmente entre los niños pequeños, niños mayores, adolescentes y adultos, y esta variación es más dependiente de la edad que de los síntomas.
El asma inicia frecuentemente en la infancia, diferentes estudios se han realizado al respecto, siendo uno de los más importantes el de Melbourne,55 en el cual se incluyeron niños de siete años de edad, en 1964, con historia pasada de sibilancias, y otro grupo de niños con sibilancias severas se seleccionó de esta misma cohorte a la edad de 10 años. Estos paciente llevaron un seguimiento prospectivo en intervalos de siete años, con una última revisión en 1999, cuando su edad promedio era de 42 años. Este estudio mostró que la mayoría de niños que sólo tuvieron pocos episodios de sibilancias asociados con infecciones respiratorias, tuvieron un curso benigno, con cese de sibilancias en la edad adulta. Contrariamente, los niños con asma en la infancia continuaron con sibilancias significativas en la edad adulta, y mientras más graves habían sido sus síntomas en la infancia, más sintomáticos continuaban en la adultez. Hubo una pérdida de la función pulmonar a la edad de 14 años en los pacientes con asma grave, pero sin progresión a la edad adulta. Cabe aclarar que el asma en la infancia se trató antes de que estuvieran disponibles los corticosteroides inhalados. En los pacientes con síntomas leves no hubo pérdida de la función pulmonar. Se observó además que los niños con atopia tuvieron síntomas más graves y asma persistente, comparados con los niños cuyos episodios habían sido provocados por infecciones respiratorias.
El Estudio Respiratorio de Niños de Tucson, iniciado en 1980, es otra investigación prospectiva, longitudinal, que ha proporcionado información importante sobre la historia natural del asma con inicio en la infancia.56 Se siguieron a 826 pacientes por más de 20 años, desde su nacimiento hasta la fecha, y se concluyó que 39% de los asmáticos cursan con su primera crisis antes del primer año de edad, 50% de los casos de asma persistente iniciaron antes de los tres años de edad, y 80% antes de los seis años.57 De este estudio se identificaron tres diferentes tipos de niños con sibilancias recurrentes (Fig. 5).
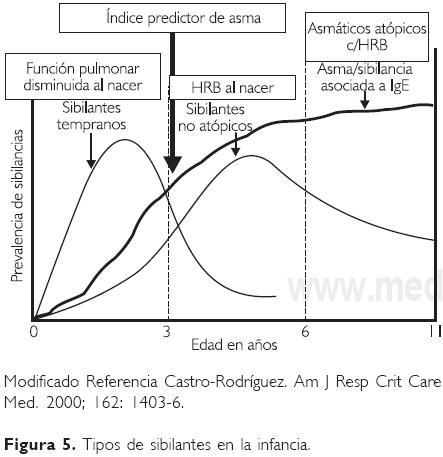
a) Sibilantes transitorios. Son niños que presentan sibilancias durante el primer año de vida, y pueden continuar hasta el tercer año. En más de 60% la sintomatología remitirá entre los tres y seis años de edad, y estos niños suelen tener sibilancias casi exclusivamente al cursar con infecciones virales. En este grupo, la intensidad de los cuadros durante los primeros años de vida es un factor predictor de persistencia y gravedad de los episodios en su vida futura.
b) Sibilantes persistentes (no atópicos). Cerca de 40% de los sibilantes transitorios continuarán con episodios a los seis años de vida. Sólo la mitad de estos niños estarán sensibilizados a aeroalergenos y la otra mitad serán no atópicos. Los episodios se presentarán, sobre todo, en invierno y asociados a infecciones virales. Se ha observado que la mayoría de ellos presentó bronquiolitis en el primer año de vida y esta entidad fue ocasionada por el VSR; el riesgo de presentar sibilancias a los seis años se incrementa tres veces más en estos casos.
Las sibilancias en este grupo de niños se deben a una alteración en la regulación del tono muscular de la vía aérea, no causado por aeroalergenos, lo cual explica por qué con la edad disminuyen los síntomas. Este dato se corroboró en estudios de función pulmonar con reto de metacolina, que demostraron que en pacientes con niveles de IgE bajos o PC negativas, la HRB disminuyó con la edad. Por el contrario, en pacientes sensibilizados no hubo modificación en el grado de HRB con la edad.
c) Sibilantes persistentes (atópicos). Este grupo de niños generalmente comienzan durante el segundo o tercer año de vida, los cuadros son más graves que en los otros dos grupos, y pueden o no tener relación con el ambiente e infecciones de las vías aéreas. Estos niños tienen de tres a cuatro veces más historia familiar de asma y dos a tres veces más historia de dermatitis atópica. Además se ha observado que estos niños presentan eosinofilia mayor de 4% con aumento de los productos liberados por estas células.
En estos niños, la función pulmonar estará más alterada que la de cualquier otro grupo, pero es una alteración reversible con broncodilatador y esteroides, y el grado de HRB está asociado con el pronóstico. Además, a los seis años de vida la obstrucción de la vía aérea y el grado de HRB aumentan. Aproximadamente, desde los tres años de vida se observan cambios de aumento de la resistencia de la vía aérea. Todo esto es producto de la inflamación y precede al desarrollo de asma.58
El patrón de sensibilización muestra que a los seis años de edad, 33% de los asmáticos tienen una PC positiva, 38% comenzaron con síntomas antes de los tres años, y más de 50% lo hicieron después de los tres años.59 En el cuadro 3 se muestra el índice predictivo de acuerdo a este estudio, para determinar quiénes de los niños que tengan sibilancias en la infancia tendrán asma.
Otro estudio llevado a cabo en Poole, Reino Unido, incluyó a 100 niños que tuvieran al menos un padre asmático o rinitis alérgica y fueron seguidos hasta los seis años de edad. Las conclusiones principales de este estudio fueron que el desarrollo de asma estaba asociado con sensibilización temprana e HRB, y también con sibilancias que persistieron durante la infancia o que iniciaron después de los cinco años de edad.32
Un análisis que incluyó a 18 156 pacientes en el Estudio de Salud Respiratoria de la Comunidad Europea,60 observó que la tasa de remisión de asma que inició antes de los 10 años de edad fue de 43%, cayendo a 30% para asma que inició entre los 10 y 20 años de edad, y a 15% para asma con inicios entre los 20 a 40 años.
En resumen, las sibilancias leves ocasionales en la infancia rara vez persisten para convertirse en asma para la edad escolar. La gravedad del asma crónica persistente queda generalmente estable durante la adolescencia, rara vez se incrementa, pero frecuentemente remite. Hay factores que predicen la persistencia y gravedad del asma en la infancia, como son: episodios de sibilancias frecuentes y graves durante la edad preescolar, inicio durante la edad escolar, historia familiar de asma y alergia, IgE sérica elevada, positividad a temprana edad de PC, desarrollo temprano de HRB, frecuencia de infecciones respiratorias, ausencia de contacto con niños mayores, mayor riesgo psicológico en la infancia, y mala relación entre los padres.32
Diagnóstico
El diagnóstico se basa en la historia clínica del paciente, en donde es importante interrogar, además de los síntomas, sobre el entorno social y ambiental, antecedentes familiares, aunado al examen físico. Los estudios de función pulmonar sirven como apoyo al diagnóstico clínico y son confirmatorios.
El cuadro clínico característico es tos, sibilancias, opresión torácica y, en cuadros graves, dificultad respiratoria. Es de carácter episódico, cursa con exacerbaciones que ceden espontáneamente o mediante tratamiento farmacológico. En los períodos entre exacerbaciones, el paciente puede estar asintomático, y la exploración física suele estar normal. Usualmente, los síntomas aparecen progresiva y lentamente durante varios días (cuadro crónico), pero a veces pueden iniciar súbitamente y de forma aguda y rápida (cuadro agudo), requiriendo el uso inmediato de broncodilatadores y antiinflamatorios.
El cuadro crónico del asma tiene síntomas constantes con exacerbaciones esporádicas. El paciente suele referir tos intermitente exacerbada por factores como el aire frío, el humo del cigarro, el ejercicio físico y exposición a alergenos del ambiente. La tos es más común en la mañana al despertar y por las noches antes de dormir, o en el transcurso de la noche, es de intensidad baja y usualmente los padres la consideran como "tos normal". Hay otros síntomas que traducen gravedad del cuadro, como son: sibilancias, disnea y opresión torácica.
El asma crónica se clasifica según las guías GINA y del Instituto de Corazón, Sangre y Pulmón de Estados Unidos de Norteamérica, en asma controlada, parcialmente controlada y no controlada (Cuadro 4), pero para fines de investigación sigue en pie la clasificación antigua de asma intermitente, leve persistente, moderada persistente y grave persistente (Cuadro 5). Estas clasificaciones se hacen con base a la frecuencia de síntomas clínicos de asma, frecuencia de crisis y pruebas de función pulmonar (PEF y VEF1).
Síntomas clínicos
a) Tos. Es el síntoma más frecuente y persistente, suele ser seca e irritativa al inicio para volverse posteriormente productiva, se presenta durante el día, de predominio nocturno, o ambas, y usualmente se incrementa con el ejercicio, al exponerse a irritantes ambientales o alergenos.
b) Sibilancias. La presencia de sibilancias es uno de los síntomas más característicos pero no indispensables para hacer diagnóstico de asma. Además, es importante recordar que existen otras entidades que pueden ocasionar sibilancias, por lo que es importante hacer diagnóstico diferencial.
c) Disnea. Se presenta de forma episódica y variable, normalmente está relacionada con la intensidad del cuadro y acompaña al resto de los síntomas. Usualmente se presenta en forma tardía y es un indicador de gravedad. En ocasiones se acompaña de dolor u opresión torácica que acompañan a la sensación de falta de aire.
Estudios de laboratorio y gabinete
El diagnóstico del asma es clínico, los estudios de laboratorio y gabinete sirven para descartar entidades agregadas o complicaciones, y buscar posibles causas.
Uno de los estudios de laboratorio que se realiza es la biometría hemática para buscar eosinofilia (eosinófilos > 600/mm3), sugestiva de un proceso alérgico, aunque no hay que olvidar que puede ser ocasionada por parásitos que invaden los tejidos, algunos fármacos, causas autoinmunes, endocrinopatías y malignidad.
La determinación de IgE puede ser útil, pues altas concentraciones de IgE total están comúnmente presentes en enfermedades alérgicas; sin embargo, es inespecífica y no es un indicador de asma. La búsqueda de IgE específica a alergenos de ambiente o alimentos es de utilidad en los casos de asma alérgica. El método que más se utiliza son las PC por Prick, administradas por un alergólogo; si éstas no se pueden realizar hay que medir anticuerpos IgE específicos in vitro por técnicas de inmunoensayo enzimático (ELISA) o radioalergoabsorbencia (RAST).
Las PC pueden realizarse a cualquier edad, ya que los elementos fundamentales para una respuesta de hipersensibilidad temprana están presentes desde el primer mes de vida, aunque la sensibilización a aeroalergenos se presenta entre el primero y tercer año de vida.61 Es importante aclarar que unas PC positivas no establecen diagnóstico de asma, pero sí confirman el factor alérgico e identifica a los alergenos responsables de los síntomas.
Radiografía de tórax: como parte de la evaluación inicial es necesario tomar radiografías anteroposterior y lateral de tórax; los hallazgos pueden variar dependiendo de la etapa de la enfermedad en que esté el paciente al momento de la toma del estudio. Cuando el paciente está asintomático, la radiografía puede estar normal, mientras que en crisis hay datos de atrapamiento de aire (abatimiento de diafragma, incremento en el diámetro anteroposterior, horizontalización de los arcos costales).
En el asma crónica pueden observarse cambios inflamatorios peribronquiales y puede ser común la presencia de atelectasias que afecten el lóbulo medio del pulmón derecho.
Pruebas de función pulmonar
Las pruebas de función pulmonar sirven como medición objetiva, ya que pueden demostrar la existencia de una alteración anatómica o funcional. Sin embargo, este tipo de pruebas sólo se realizan comúnmente en niños mayores de cinco años, pues en los menores de esta edad se necesitan equipos especiales para poder efectuarlos y no se hacen de rutina.
Es importante señalar que los síntomas y los signos al examen físico se relacionan con la gravedad y la variabilidad de la obstrucción bronquial, parámetros que sirven también para clasificar al asma bronquial.
La variabilidad es la diferencia que existe entre el VEF1 ó el PEF al realizar la prueba con diferencia de horario (valores de la mañana contra valores de la noche).
La reversibilidad es la capacidad de la vía aérea de mejorar el flujo aéreo después de usar un broncodilatador, es decir, es el porcentaje de cambio que existe entre el VEF1 ó PEF pre broncodilatador y post broncodilatador. Éste es un parámetro importante para establecer el diagnóstico de asma. Para realizar esta prueba se hace una espirometría basal, luego se aplica salbutamol inhalado (por un inhalador de dosis medida o nebulizado) y después de 15-20 min se realiza otra espirometría. Se valora así el porcentaje de cambio, siendo la prueba positiva cuando hay una mejoría igual o mayor a 15% ó 200 mL entre la espirometría basal y la post broncodilatador.
Las anormalidades de la función pulmonar se pueden dividir en restrictivas u obstructivas, los defectos restrictivos se asocian con padecimientos del parénquima pulmonar o limitación del movimiento de la caja torácica, mientras que el patrón obstructivo se debe a una dificultad para el paso del flujo del aire a través de la tráquea y los bronquios, como es el caso del broncoespasmo, pérdida del tejido de sostén y edema de la pared bronquial.
Flujometría
El PEF es una forma más sencilla de monitorear la función pulmonar, no requiere de aparatos sofisticados para medirlo, se recomienda en mayores de cuatro años de edad, y su interpretación dependerá de los predichos para cada paciente. La maniobra es dependiente de esfuerzo y medirá específicamente la obstrucción de la vía aérea de grueso calibre.
Una característica del asma es la variación cíclica de sus valores durante el día. Los más bajos se presentan en las primeras horas de la mañana y los más altos por la tarde. Para observar este patrón se debe medir como mínimo dos veces al día. Los pacientes asmáticos sin tratamiento, generalmente muestran diferencias de al menos 15% entre los valores promedio de la mañana y de la tarde.
La variabilidad del PEF se calcula mediante la siguiente fórmula: [(PEF nocturno d PEF matutino)/(0.5 x PEF nocturno + PEF matutino)] x 100.
La mayoría de guías sugieren que una variabilidad del flujo espiratorio de 12 a 15% (200 a 250 mL en adultos) en el VEF1 ó un cambio de 15 a 20% en el PEF apoya el diagnóstico de asma.62 Su medición es útil, accesible, fácil de realizar y permite una valoración objetiva en el control de este padecimiento.
Espirometría
La espirometría es un estudio completo que mide volúmenes y capacidades pulmonares (capacidad vital forzada [CVF], VEF1, y flujo espiratorio forzado [FEF] a 25, 50, 75% y a 25-75% de la CVF-FEF25, FEF50, FEF75, FEF25/75). Estas medidas reflejan de forma reproducible la función pulmonar del paciente, aunque la mayoría de pacientes pediátricos sólo pueden hacer maniobras espirométricas hasta después de los seis años de vida. Cuando la reversibilidad del VEF1 es de 12%, se considera un dato sugestivo de asma, pero el cambio debe ser igual o mayor de 15% para que sea significativo.38 Se recomienda realizar una espirometría a todos los niños mayores de seis años de reciente diagnóstico, así como evaluaciones una o dos veces al año, dependiendo de la intensidad de la enfermedad, para valorar evolución de la enfermedad y respuesta al tratamiento. La espirometría también valora el índice de Tiffaneau (FEV1/CVF), el cual refleja un patrón obstructivo cuando es menor a 90% (Fig. 6).

Pletismografía
La pletismografía es un instrumento mucho más preciso que la espirometría, permite el cálculo de otros volúmenes pulmonares como el volumen residual (VR), la capacidad pulmonar total (CPT), el volumen de gas intratorácico, el radio volumen residual/CPT, que mide el atrapamiento de aire y es sensible a la disfunción que puede estar presente en niños con asma leve intermitente, la conductancia específica y la resistencia de la vía aérea. Es un instrumento más preciso que el espirómetro, permite determinar de manera más objetiva si el tratamiento administrado da resultados y permite hacer intervenciones tempranas, ya que detecta cambios mínimos de la función pulmonar.63
Pruebas de reto
Ejercicio
La broncoconstricción puede diagnosticarse empleando diferentes ejercicios: pruebas de carrera libre, bicicleta fija y correr sobre banda sinfín, los cuales han sido estandarizados.
El reto en una banda sinfín motorizada se realiza con una inclinación de 5.5%, incrementando la velocidad hasta alcanzar una frecuencia cardiaca de 95% de la máxima calculada y mantenida durante cuatro minutos, a una temperatura ambiente de 20 °C y una humedad relativa de 40%. La frecuencia cardiaca se calcula restando la edad del paciente a la constante 220. La función pulmonar se mide antes e inmediatamente después de la prueba de ejercicio, y a los 3, 6, 10, 15 y 20 min. La medición del VEF1 es el parámetro más utilizado, una caída de 10 a 15% indica el diagnóstico. La definición más aceptada es cuando existe una caída del VEF1 mayor de 15% con espirometría o una disminución mayor de 20% del PEF. Si el VEF1 alcanza su nadir, la prueba puede darse por terminada a los 20 min; en la mayoría de los casos el nadir ocurre dentro de 5 a 10 min.
Para la realización de estas pruebas hay que suspender el uso de broncodilatadores inhalados seis horas antes, los orales o de liberación prolongada deben suspenderse por lo menos 24 horas antes. Los corticosteroides inhalados (CI) reducen la respuesta al ejercicio, pero usualmente no se suspenden antes de la prueba.
Fármacos
Se usan agentes como la metacolina, histamina, solución hipertónica y la exposición al aire frío para inducir hiperreactividad. Es importante resaltar que la respuesta a los estímulos químicos es indicativa de HRB, y aunque ésta sea una característica de los pacientes asmáticos, no es un diagnóstico específico para asma. Así, un reto negativo a metacolina es más útil para descartar asma que una prueba positiva para establecer el diagnóstico.64 Esta prueba se realiza incrementando la dosis de metacolina hasta que el VEF1 caiga por debajo de 80% de los valores predichos para el paciente. La respuesta generada está relacionada con la gravedad de la enfermedad y la hiperrespuesta de las vías respiratorias.
En conclusión, el diagnóstico de asma no es tan fácil como parece, el médico debe apoyarse en la historia clínica y en los estudios de laboratorio y gabinete. Con todos estos elementos se podrá hacer un diagnóstico presuncional y diferenciarlo de otras entidades que causan síntomas parecidos al asma.
Diagnóstico-diferencial (Cuadro 6)
Las sibilancias son un síntoma que puede presentarse en el lactante y el niño, en la mayoría de los casos relacionado con episodios de infecciones virales respiratorias. Otras causas posibles de sibilancias son la fibrosis quística, anomalías anatómicas, aspiración de cuerpo extraño y reflujo gastroesofágico. Se ha clasificado a los niños como sibilantes transitorios (sólo en los primeros tres años de vida), persistentes (más allá de los tres años) y tardíos (comienzo de los síntomas entre los tres y los seis años). Los primeros dependerían de disminución de la función pulmonar (posiblemente por tamaño pulmonar reducido), los persistentes suelen tener padres asmáticos, y los tardíos se relacionan con aumento de la sensibilización alérgica. Se ha diseñado un índice de riesgo de asma para niños con sibilancias recurrentes (más de tres episodios en el último año), con criterios mayores (antecedentes paternos de asma, dermatitis atópica o sensibilidad a aeroalergenos) y menores (eosinofilia >4%, sensibilidad a alimentos, sibilancias no relacionadas con infecciones); aquellos con un criterio mayor o dos menores tienen 65% de posibilidades de ser asmáticos a los seis años de edad.
Tratamiento
En el asma crónica se describen objetivos de tratamiento, aunque no son alcanzados en todos los pacientes: ausencia de síntomas crónicos, reducción de frecuencia de exacerbaciones, mínima necesidad de tratamiento de rescate, estilo de vida normal, sin limitaciones de ejercicio, función pulmonar normal y mínimos o ausentes efectos adversos del tratamiento (Cuadro 7). Se propone un enfoque por etapas, que consiste en aumentar el número, frecuencia y dosis de los medicamentos hasta alcanzar la remisión; luego se realiza una cuidadosa reducción de la terapéutica para mantener la remisión con la menor cantidad posible de medicamentos. El tratamiento debe ser individualizado y modificado para obtener y mantener el adecuado control de los síntomas.65

El curso crónico inflamatorio hace que la base del tratamiento sea la terapia antiinflamatoria temprana, más que sintomática, siendo indispensable evitar los factores de riesgo.
Para instaurar un tratamiento adecuado es necesario clasificar su intensidad.
El tratamiento de niños pequeños es complicado, debido a que existen pocas recomendaciones en cuanto a qué y por cuánto tiempo pueden ser útiles los medicamentos. Hay escasos estudios sobre seguridad y eficacia, además que la medición de la función pulmonar es poco útil. Las estrategias de manejo están determinadas de acuerdo a la gravedad (Cuadro 8).1,66
La intervención terapéutica la dividimos en: control ambiental, educación al paciente y sus familiares, el manejo farmacológico e inmunoterapia.
Control ambiental
Evitar la exposición a aeroalergenos y otras modificaciones ambientales, tienen impacto en el desarrollo y curso clínico de la enfermedad.
Alergenos: los alergenos difieren dependiendo de la comunidad, clima, estación del año y factores sociales, algunos pacientes son más susceptibles que otros. La sensibilización más frecuente es con ácaros del polvo casero, cucaracha, Alternaria y gato. Paradójicamente hay datos recientes que sugieren que la exposición al gato o perro desde el nacimiento puede proteger contra el desarrollo de asma.
El polvo casero es la fuente más importante de alergenos intradomiciliarios, está constituido por una gran variedad de sustancias orgánicas e inorgánicas como: caspa de animales, esporas de hongos, excremento y desechos de ácaros y cucarachas. En climas templados la concentración media de ácaros (Der p1) puede ser hasta de 20 a 40 ¡ig/g de polvo, un gramo de polvo contiene de 1 000 a 3 000 ácaros; la exposición a 2 mg de alergeno aumenta el riesgo de sensibilización, y con sólo 500 se incrementa el riesgo de síntomas agudos.67 Los ácaros se encuentran en interiores donde existe presencia humana, ya que su principal nutriente son células epidérmicas de descamación y flora micótica, se reproducen a temperatura entre 20 y 25 °C.
Las cucarachas también provocan sensibilización, cerca de 80% de sus alergenos están asociados con partículas mayores a 10 um. Habitan áreas húmedas, calurosas, hacinadas y sin higiene, son omnívoras y hasta 57% de los escolares alérgicos de áreas urbanas, son sensibles a ellas.68 Para su control se han utilizado procedimientos, tanto químicos como físicos; hay diferentes pesticidas, sin embargo, la limpieza de la casa es fundamental antes de aplicar algún insecticida; los alergenos se adhieren a pisos, paredes, superficies de la cocina (vasos, adornos y utensilios), por lo que todos ellos deben ser lavados con agua y jabón.
Las mascotas domésticas contribuyen con una gran variedad de alergenos encontrados en el pelo, plumas, escamas de la piel, orina, saliva y secreciones lagrimales entre otras. La más frecuente es la sensibilización al gato doméstico (9 a 41%) y las personas sensibles pueden presentar síntomas al ponerse en contacto con más de 8 mg de alergeno de gato por gramo de polvo.
El crecimiento de hongos en el interior de las casas es otro factor, existen en dos formas: levaduras y micelios. Las primeras encontradas en interiores, como Aspergillus, Fusarium, Penicillium y Rhizopus; el incremento de la humedad relativa se ha asociado con el mayor número de colonias de hongos por metro cúbico de aire (por ejemplo, cocinas, saunas, baños, etc.).69 Los filtros de aire son útiles para removerlas, pero hay que recordar que los sistemas de aire acondicionado pueden estar contaminados con esporas, por lo que se recomienda estar atentos a su mantenimiento.
Otros contaminantes ambientales como humo de tabaco, sustancias químicas (perfumes, pinturas, solventes, gasolina, etc.) y oxidantes, se han asociado a disminución de la función pulmonar e incremento de la HRB.
La mejor opción terapéutica en una persona alérgica es evitar la exposición al alergeno una vez que se ha identificado, se proponen para esto algunas medidas:
a) El aspirado de alfombras, sofás, colchones y base de la cama, puede resultar infructuoso ya que los ácaros se adhieren a las fibras del colchón y la aspiradora sólo retira algunas partículas fecales y el resto se mantienen en el aire.
b) Cubrir el colchón y su base, para retirar el polvo gradualmente.
c) No usar almohadas de plumas.
d) Sustituir los muñecos de peluche por juguetes de plástico o que tengan este tipo de cubierta.
e) Eliminar los objetos que acumulen o generen polvo, lavar cada semana las fundas de las almohadas, sábanas y cobijas, con agua caliente (más de 55 °C) puede ser efectivo.
f) Los purificadores de aire ayudan pero no sustituyen las otras medidas; los más efectivos son los que tienen filtros de aire de alta eficacia, aunque también pueden colonizarse con mohos.
g) Los acaricidas, por ejemplo benzoato de bencilo, matan ácaros y son efectivos in vitro; sin embargo, ponerlos sobre alfombras es impráctico, ya que consumen mucho tiempo y hay que aplicarlos cada dos o tres meses. El principal problema es que penetran las capas profundas de muebles y alfombras, y permiten la recolonización de ácaros.
h) El ácido tánico es un producto que desnaturaliza proteínas y ha sido recomendado para disminuir los niveles de alergenos dentro de la casa; sin embargo, los altos niveles de proteínas (por ejemplo, alergeno de gato) bloquean este efecto. Está indicada una intensa aspiración antes de usar este producto, y no es recomendable usarlo en casas con mascotas, además sólo destruye alergenos pero no mata ácaros.70
i) La mejor vía para reducir la exposición a alergeno de perro y gato es no tener uno. Las mascotas deben permanecer fuera de casa y, de preferencia, bañar a los perros con jabón dos veces por semana; no obstante es poco probable que mejore el asma en pacientes sensibilizados.
Manejo farmacológico
La eficacia clínica depende en gran medida de la adherencia al tratamiento. Los fármacos utilizados para el manejo del asma los podemos dividir en: medicamentos de rescate y medicamentos para el control a largo plazo.
Broncodilatadores. Los agonistas adrenérgicos beta dos (β2) son broncodilatadores rápidos y potentes. Están disponibles en múltiples formas y diversos sistemas de administración. Además de relajar el músculo liso, aumentan el aclaramiento mucociliar, disminuyen la permeabilidad vascular y modulan la liberación de mediadores por los mastocitos. Los efectos adversos son poco frecuentes cuando se administran por vía inhalatoria. Son de los medicamentos de rescate que más se usan en el manejo del asma, existen dos tipos de broncodilatadores: los (β2 agonistas de acción rápida son los de elección en los eventos agudos de asma. Revierten de forma casi inmediata y por tiempo limitado el espasmo del músculo liso bronquial; su mecanismo de acción está relacionado con la interacción del receptor (β2 agonista, que se encuentra en la membrana celular, y al acoplarse impide la entrada de calcio intracelular.
El salbutamol es el más representativo, su inicio es de acción rápida y tiene un efecto máximo a los 15 min; su vida media es de seis horas. Se administra por vía oral, por inhalador de dosis medida o IDM, en soluciones para nebulizar e intravenoso. Los efectos secundarios que se reportan son: taquicardia, alteraciones del comportamiento, del sueño o temblor.
Es preferible siempre usar la vía inhalada a dosis de 150 μg/kg/día hasta un máximo de 5 mg. Los efectos secundarios siempre están en relación con las dosis altas.71 Para el tratamiento de rescate pueden usarse cada cuatro a seis horas, en forma de aerosol IDM o nebulizados.
Para el tratamiento de rescate de las exacerbaciones se sugieren los agonistas (β2 de acción rápida (albuterol, terbutalina, pirbuterol) en aerosol; en el caso de que la necesidad de administración supere las dos veces semanales, debe considerarse que el proceso inflamatorio subyacente necesita un tratamiento más intensivo.
Los (β2 agonistas de acción prolongada (LABA), son de elección para el control a largo plazo, previenen los síntomas nocturnos y el asma inducido por ejercicio. Su vida media es de 12 horas, no se recomiendan solos, hay que asociarlos a un antiinflamatorio. Tanto salmeterol como formoterol (de acción prolongada) son eficaces para el tratamiento del asma persistente moderada a grave, pero no deben usarse como monoterapia en los pacientes que requieren medicaciones de control en forma diaria. Sin embargo, en los pacientes que reciben corticosteroides por vía inhalatoria con resultados subóptimos, el agregado de estos agentes permite mejor control que cuando se duplica la dosis de corticosteroides. Una vez que se ha mejorado el control, el corticosteroide puede reducirse, aunque no eliminarse, en la mayoría de los enfermos, sobre todo adultos. No está aceptado su uso para las crisis agudas. Recientemente, la FDA emitió una alerta que indica que el uso de salmeterol como monoterapia, puede exacerbar el asma grave y se ha asociado a riesgo de muerte.72 No está comprobada su eficacia y seguridad en niños y se recomiendan a partir de los cuatro años de edad.
Anticolinérgicos. Se han utilizado para controlar las crisis; el prototipo de este grupo es la atropina; produce múltiples efectos secundarios (secreciones espesas, visión borrosa, estimulación cardiaca y de sistema nervioso central), lo que limita su empleo. El bromuro de ipratropio es un anticolinérgico que produce pocos efectos secundarios y sinergiza con los (β2 agonistas.
El mecanismo de acción está relacionado con el SNA, la broncoconstricción/broncodilatación, secreción de moco y posiblemente la degranulación de la célula cebada. La liberación de acetilcolina activa a los receptores muscarínicos M3 del músculo liso, causando broncoconstricción e hipersecreción de moco. Los receptores M2 localizados sobre los nervios post ganglionares, limitan la liberación de acetilcolina y la disfunción de éstos puede causar hiperreactividad mediada por el nervio vago (inducida por exposición a aeroalergenos, infecciones virales y contaminantes). Los anticolinérgicos disponibles no son selectivos, antagonizan tanto receptores M3 como M2, lo que puede causar broncodilatación y broncoconstricción.73
Antiinflamatorios (corticosteroides). Los corticoesteroides son los agentes antiinflamatorios más potentes disponibles. En el asma, inhiben la respuesta inflamatoria evitando la liberación de fosfolipasa A2 y de citocinas inflamatorias.74 Funcionan bajo la influencia de transcripción genética de moléculas que se encuentran involucradas en el inicio y mantenimiento de la respuesta inflamatoria. Son transportados hacia las células, y una vez en ellas, en el citoplasma se unen reversiblemente al receptor específico de glucocorticoides, de esta manera ingresan al núcleo para unirse con el DNA.
Los glucocorticoides endógenos son importantes reguladores del metabolismo, incluyendo el metabolismo de la glucosa, homeostasis del hueso, balance electrolítico y función inmune. Dentro de los efectos adversos secundarios a la administración exógena de dosis superiores a las fisiológicas, se encuentran: supresión del eje hipotálamo-hipófisis-glándulas adrenales, osteoporosis e inmunosupresión.75 Debido a que las vías aéreas y los pulmones representan adecuados accesos de administración tópica mediante la vía inhalada, los esteroides inhalados disminuyen la HRB, previenen la respuesta tardía y mejoran la función pulmonar. Los esteroides sistémicos están recomendados en ciclos cortos (cinco a siete días) en los casos agudos graves y pueden administrarse diariamente a la menor dosis si el asma es grave y no se ha logrado su control con el manejo instituido (esteroide inhalado a dosis alta más (β2 de acción prolongada más otro fármaco) en asma grave persistente. Las complicaciones por el uso de esteroides sistémicos por tiempos prolongados incluyen: disminución de la mineralización ósea, cataratas, equimosis, atrofia cutánea, supresión del eje hipotálamo hipofisario, aumento de peso, diabetes, hipertensión, retardo en el crecimiento, inmunosupresión y alteraciones psicológicas.
Seguridad de los CI en niños.76 El esteroide ideal debe tener actividad local a nivel pulmonar, con pocos o ningún evento adverso sistémico, permanecer en pulmón el tiempo necesario, ya sea a través de la formación de conjugados lipídicos o como resultado de una baja difusión, unirse altamente a proteínas, y tener una eliminación rápida, para minimizar la posibilidad de interactuar con los receptores que se encuentran a nivel extrapulmonar, además de baja biodisponibilidad para evitar la absorción al máximo. Debe ser activado a nivel local mediante una prodroga para que reduzca los efectos en orofaringe.
Los CI son antiinflamatorios tópicos cuya ventaja es actuar en el sitio de aplicación, a dosis bajas y con efectos adversos mínimos. Son la primera línea de tratamiento en los casos de asma crónica, y se debe tener en cuenta su vida media, la potencia y biodisponibilidad (Cuadro 9).
Los efectos adversos están directamente relacionados a la susceptibilidad individual, tipo de CI, dosis, forma de administración, biodisponibilidad sistémica y local. Los efectos adversos pueden dividirse en locales (orofaríngeos) y sistémicos.
Los efectos locales corresponden a disfonía, candidiasis orofaríngea, tos e irritación orofaríngea. Éstos usualmente son más frecuentes con CI inhalados en forma de polvo y cuando no se realiza un adecuado enjuague bucal. La disfonía se puede encontrar hasta en 33% de los pacientes tratados. Usualmente revierte con la suspensión del medicamento. Debe tenerse especial cuidado en personas que realicen actividades de canto o locución, en las cuales este efecto adverso puede llegar a ser invalidante. La candidiasis orofaríngea es más frecuente en ancianos, pero puede observarse en 4 a 10% de los niños que utilizan esteroides inhalados.77 La incidencia de candidiasis orofaríngea reportada con dosis de 160 y 320 μg/día fue de 4.1%.78
Los efectos adversos sistémicos están determinados por la biodisponibilidad sistémica de los CI. Lo anterior es la suma del CI absorbido a nivel pulmonar, más el porcentaje del CI que es deglutido, absorbido y que finalmente pasa a la circulación sistémica. Los efectos adversos sistémicos potenciales de los CI son múltiples; destacando entre los más importantes los efectos en la talla, supresión del eje hipo tálamohipófisis-suprarrenal (HHS), efectos en el metabolismo óseo, como los de mayor relevancia. Otras complicaciones potenciales son las alteraciones en el tejido conectivo y en el sistema nervioso central (psicosis), que son muy poco frecuentes.79 Los CI a dosis terapéuticas no serían causantes de cataratas80 o alteraciones metabólicas significativas.81 La alteración del crecimiento ha sido hasta la fecha el efecto adverso más temido por los familiares de los pacientes y médicos tratantes. Los corticoides en general pueden afectar el crecimiento por múltiples vías, como la estimulación de somatostatina, que inhibe la secreción de hormona de crecimiento (GH), disminución de la expresión del receptor de GH al nivel hepático, disminución de la proteína ligante de GH en el plasma, disminución de mitosis de condrocitos y síntesis de colágeno en la placa de crecimiento. A la fecha sólo se ha demostrado que los CI en dosis terapéuticas determinan una disminución en la velocidad de crecimiento con dosis moderadas y altas.82 Este efecto se va atenuando con los años de uso. Las dosis bajas de FP no determinan una disminución en la velocidad de crecimiento de los pacientes tratados.83 No se ha demostrado que la talla final se altere con el uso de CI a dosis terapéuticas.84-86
La supresión del eje HHS es el efecto adverso secundario al uso prolongado de los CI más temido. Se ha demostrado en laboratorio que dosis de FP superiores a 750 μg/día producen supresión adrenal.87 La experiencia nacional publicada por Milinarsky y col.88 demostraron que 15% de los niños asmáticos que recibían BUD a 800 μg/día en forma de inhalador de polvo, tenían pobre respuesta del cortisol, posterior al estímulo con ACTH, compatible con una insuficiencia suprarrenal de laboratorio. Es difícil saber si estos hallazgos de laboratorio podrían ser predictores de una crisis adrenal aguda en una situación de estrés, pero claramente los ponen en un grupo de riesgo. Existen, descritos en la literatura, casos de insuficiencia suprarrenal clínica, asociada al uso de CI en dosis elevadas, por sobre las recomendaciones pediátricas.89 Las dosis habituales de uso de CI no han demostrado afectar la densidad ósea en niños.90,91 Éste es un tema que requiere mayor análisis, ya que en ancianos se han descrito aumentos leves en las tasas de fracturas de caderas y extremidades superiores con dosis altas de CI,92 pero no en aquellos que utilizan dosis bajas.93
Los sistemas de deposición del medicamento incluyen los IDM o aerosoles, soluciones para nebulizar o inhaladores en polvo seco.
Uno de los más recientes en el mercado es el ciclesonide y la mometasona, en el cuadro 994 están las características, y en el cuadro 10 las dosis recomendadas de esteroides de acuerdo a GINA 2006.
Para minimizar el riesgo de efectos adversos se recomienda:
1. Usar la menor dosis posible.
2. Aumentar la frecuencia y disminuir la dosis.
3. Optimizar el apego.
4. Mejorar la forma de administración (uso de espaciadores).
5. Evaluar y tratar las complicaciones del asma.
6. Maximizar el tratamiento no farmacológico (control ambiental).
7. Asegurar la ingesta diaria de calcio (800 a 1 500 mg/día) y de vitamina D (400 UI/día).
Cromonas. Cromolin y nedocromil son antiinflamatorios estructuralmente diferentes, con propiedades similares, que se absorben rápidamente y son muy seguros. Actúan fosforilando una proteína tipo miosina en la membrana celular, que es la responsable de la liberación de mediadores de los mastocitos, e inhiben la activación del cloro intracelular. Esto es importante, ya que preceden a la apertura de los canales de calcio y degranulación del mastocito. Su alto perfil de seguridad los hacen una droga ideal para lactantes y niños menores de dos años. Sin embargo, en una revisión sistemática, no se demostró utilidad en el control a largo plazo.95 Se ha comparado con CI, sin ofrecer tantos beneficios.
Inhibidores de los receptores de leucotrienos. Son miembros de una nueva clase de medicamentos controladores, los cisteinil leucotrienos (LTC4, LTD4, LTE4) son potentes broncoconstrictores, así como agentes proinflamatorios y mucorreicos.
Existen tres clases de antagonistas de leucotrienos, entre estos agentes el montelukast está aprobado por la FDA en Estados Unidos de Norteamérica en niños mayores de seis meses, zafirlukast en mayores de cinco años y pranlukast en mayores de dos años. Comparado con placebo, el montelukast ha demostrado ser efectivo para mejorar los síntomas de asma, disminuir el uso de beta-agonistas y esteroides sistémicos en niños de dos a cinco años con asma leve persistente o intermitente.96 Comparados con los CI, pueden ser igual de efectivos para disminuir los síntomas clínicos, pero no disminuyen el grado de inflamación, el número de recaídas, dosis de esteroides sistémicos extras, ni los días de hospitalización. Los inhibidores de los receptores de los leucotrienos mejoran el VEF1 matutino, disminuyen el número de dosis de medicamentos de rescate en comparación con cromoglicato o placebo en niños que reciben corticosteroides inhalados.97
Metilxantinas. Actualmente se usa la teofilina, que es una metilxantina broncodilatadora, su mecanismo de acción está relacionado con la inhibición no selectiva de la fosfodiesterasa, el antagonismo sobre el receptor de adenosina, la translocación del calcio intracelular y el aumento de la secreción de catecolaminas endógenas, lo cual probablemente en conjunto sea lo que causa la relajación del músculo liso de las vías respiratorias. Puede agregarse al tratamiento con corticosteroides, pero en estos casos es menos eficaz que los agonistas (β2 de acción prolongada. Su metabolismo está muy condicionado a variables como edad, dieta e interacciones medicamentosas, y entre sus efectos adversos se destacan los gastrointestinales. Su uso en el control del asma en niños ha disminuido a nivel mundial y, de acuerdo con las guías internacionales de manejo del asma, es una terapia de tercera o cuarta línea en pacientes mal controlados. Su empleo se ha limitado debido a sus efectos secundarios a corto y largo plazo, se recomienda vigilar los niveles séricos (valores entre 5 y 15 μi/mL), además no está aprobada en menores de seis años.
Inmunomoduladores. El omalizumab es un anticuerpo monoclonal recombinante humanizado contra IgE, que ha sido desarrollado para el tratamiento de enfermedades mediadas por esta inmunoglobulina. Su uso ya está aprobado en Estados Unidos de Norteamérica para mayores de 12 años, se aplica por vía subcutánea mensualmente en asmáticos moderados a graves con PC positivas y con IgE elevada y con escaso control de síntomas con CI. Es una opción más para pacientes con asma grave que no responden al tratamiento habitual o que sufren los efectos secundarios de los medicamentos.
Inmunoterapia. La inmunoterapia no forma parte del tratamiento del asma, sólo será de utilidad cuando un proceso alérgico sea el gatillo disparador del cuadro. El NAEEP2 recomienda la inmunoterapia bajo los siguientes criterios: evidencia clara de la relación entre los síntomas y la exposición a un alergeno inevitable al que el paciente es sensible, los síntomas ocurren todo el año o durante la mayor parte de él, y existe dificultad en el control de síntomas con el manejo farmacológico.
La evaluación de la sensibilización es un prerrequisito del tratamiento. Se consideran de tres a seis años como el tiempo mínimo indispensable para que el tratamiento sea efectivo.
La respuesta inicial se presenta entre los 3 y 12 meses. Los riesgos incluyen reacciones locales leves, comezón, ardor y pápulas en el sitio de aplicación, hasta respuestas generalizadas como urticaria, edema laríngeo, broncoespasmo, y otras potencialmente fatales como anafilaxia (uno por un millón de aplicaciones). Por lo que se debe tener el equipo necesario para atender estas emergencias.
Diversos meta-análisis han demostrado que la inmunoterapia es efectiva en el tratamiento de las enfermedades alérgicas. En un meta-análisis realizado en 1995 y revisado en 200398 por los mismos autores, se muestran grandes beneficios en la mejoría de los síntomas, pero no en la HRB.
Conceptos para reflexionar
¿Exageramos al hablar de una epidemia de asma en niños y adolescentes?
Hay datos incontestables como son:
• La prevalencia del asma (número de casos que hay) convierte a esta enfermedad en la entidad crónica más frecuente de la infancia y adolescencia. Con grandes variabilidades entre países, la media se estima en 10% (es decir 10 de cada 100 niños tienen asma).
• Esta prevalencia parece ir en aumento, aunque existe discusión si se trata de un aumento real de la prevalencia o es que ahora se diagnostica más y mejor a los niños con asma.
• El asma es la primera causa de ingreso hospitalario en niños.
• El asma es la primera causa de ausentismo escolar por enfermedad crónica.
Por lo tanto, en el siglo 21 todos los países, sus gobernantes, sus instituciones sanitarias y los ciudadanos, debemos plantearnos, como una prioridad social y sanitaria, la mejora de la atención y cuidados a los niños que tienen asma.
¿Qué factores influyen en la epidemia?
La investigación de los factores de riesgo para tener asma está en pleno desarrollo. Algunos ya se conocen, otros son objeto de controversias. No existe ninguna duda que el asma está determinado genéticamente, pero los factores que hacen que unos desarrollen su asma antes que otros es un tema apasionante y abierto.
De este modo, las líneas actuales de investigación se encaminan en dos direcciones, y en casi todos los trabajos complementarios:
1. La búsqueda de los genes que determinan el asma.
2. La valoración de los factores de riesgo que determinan cuándo y de qué manera se desarrolla el asma.
Para más información puedes ir a la sección de factores de riesgo en donde se detallan estos aspectos.
Otros factores que se están asociando al aumento del asma son los relacionados con la contaminación ambiental, de difícil evaluación, y con el aumento del hábito tabáquico en el hogar, especialmente en el cuidador principal del niño, que suele ser la madre.
Factores de riesgo para tener asma
Mientras la genética no pueda identificar con exactitud qué niños van a ser propensos a desarrollar asma, se hace necesario jugar con una serie de factores que miden el riesgo o probabilidad de presentar la enfermedad.
El número de episodios de asma es clave
Parece evidente que a mayor número de episodios de asma tenga un niño, más probable es que sea asmático. Lo mismo que parecería una locura etiquetar de asmático a un niño que ha presentado una única crisis de sibilancias, no es de esperar que tenga que presentar más de 20 episodios para que alguien le diga que tiene asma, como evidenció un clásico estudio realizado en Inglaterra.
Hoy en día, se está generalizando considerar asmático a un niño cuando ha presentado tres o más episodios de asma. Consideraríamos un episodio de asma a aquel en el que el niño presenta sibilancias (pitos, jija, silbidos...), generalmente asociadas a tos, con sensación de ahogo o fatiga, dolor o sensación de ardorquemazón en el pecho. No obstante, el asma en episodios no es la única forma de presentación de ésta: algunos niños sólo tienen tos crónica, otros hacen una crisis de sibilancias al realizar deporte, etc.
¿Por qué si un niño presenta un único episodio de broncoespasmo no se le debe considerar asmático?
Porque las sibilancias pueden presentarse acompañando otras enfermedades. En los lactantes (menores de 24 meses) es muy común que coincidiendo con un catarro invernal los niños presenten sibilancias. De todos los lactantes a los que les ocurre esto, sólo un tercio tendrá asma de mayores (asma persistente), por lo que los dos tercios restantes habrían tenido un "asma" transitorio.
Además, existen enfermedades graves, aunque raras, que pueden dar sibilancias, y otras muy comunes, como es el reflujo gastroesofágico, que a veces por sí mismo provoca sibilancias.
Aunque el criterio de tres crisis es muy razonable, tampoco es infalible (niños que presentan tres o más episodios de pronto dejan de tener síntomas para siempre).
Otros factores de riesgo a tener en cuenta
Cuando nos encontramos ante un lactante o niño mayor que comienza a presentar síntomas de asma, existen otros datos que nos permiten realizar un pronóstico sobre si el niño será asmático o no. Ante un niño con al menos tres episodios de afección respiratoria de vías bajas con sibilancias (ARVB-CS) en los seis meses previos más la asociación de alguno de los siguientes factores, seguramente estemos ante un futuro niño con asma persistente:
• Historia familiar (padres, hermanos) de asma.
• Los síntomas que presenta son lo suficientemente severos como para precisar ingreso.
• El niño tiene dermatitis atópica.
• Sexo masculino.
• Eosinofilia.
• Rinorrea persistente o sin catarro.
• Sibilancias no asociadas a resfriados.
Otros factores de riesgo que se apuntan son:
• Madre fumadora durante el embarazo.
• Cuidador principal fumador (en general también la madre).
• IgE en sangre elevada.
Referencias
1. Archivo del Hospital Infantil de México Federico Gómez. Datos de 2007. [ Links ]
2. The Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention; 2006. [ Links ]
3. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, NHLBI/WHO Workshop report. Bethesda: National Institutes of Health; National Heart, Lung and Blood Institute; 2002. [ Links ]
4. Jeffery P. Inflammation and remodeling in the adult and child with asthma. Pediatr Pulmonol. 2001; 32 S21: 3-16. [ Links ]
5. Rasmussen F, Taylor R, Flannery E. Risk factors for air-way remodeling in asthma manifested by a low post bronchodilator FEV1/vital capacity ratio. Am J Respir Crit Care Med. 2002; 165: 1480-8. [ Links ]
6. NAEPP 2007. [ Links ]
7. Liu A, Szefler S. Advances in childhood asthma: Hygiene hypothesis, natural history and management. J Allergy Clin Immunol. 2003; 111: 787-92. [ Links ]
8. The Global Initiative for Asthma. Global strategy for asthma management and prevention. Definition and Overview; 2006. p. 2-13. [ Links ]
9. Braman SS. The global burden of asthma. Chest. 2006; 30 Suppl 1: 45-125. [ Links ]
10. Mallol, et al. Prevalence of asthma symptoms in Latin America: The International Study of Asthma and Allergies in Childhood. Pediatr Pulmonol. 2000; 30: 263-4. [ Links ]
11. Baeza BMA, Graham ZLF. Prevalencia del asma: encuesta en una población escolar de Villahermosa, Tabasco, México. Alergia. 1992; 39: 32-6. [ Links ]
12. González-Gómez JG, Barrera-Gómez LE, Arévalo-Orozco MA. Prevalencia del asma bronquial en población escolar en la ciudad de Guadalajara, Jalisco, México. Alergia. 1992; 32: 3-7. [ Links ]
13. Canseco-González C, Leal-de Hernández L, Mora-Zepeda H, Galindo-de Jaime G. Epidemiología de las enfermedades alérgicas en el área metropolitana de Monterrey. Alergia. 1991; 38: 95-101. [ Links ]
14. Baeza-Bacab MA, Albertos-Alpuche NE. Prevalencia del asma en niños escolares de Mérida, Yucatán. Rev Panam Salud Publica. 1997; 2: 299-302. [ Links ]
15. Tatto-Cano MI, Sanín-Aguirre LH, González V, Ruiz-Velasco S, Romieu l. Prevalencia de asma, rinitis y eczema en escolares de la ciudad de Cuernavaca, Morelos. Salud Publica Mex. 1997; 39: 497-506. [ Links ]
16. Barraza-Villarreal V, et al. Prevalencia de asma y otras enfermedades alérgicas en niños escolares de Ciudad Juárez, Chihuahua. Salud Publica Mex. 2001; 43: 433-43. [ Links ]
17. Mendoza A, Romero J, Peña H, Vargas M. Prevalencia de asma en los niños escolares de la ciudad mexicana de Hermosillo. Gac Med Mex. 2001; 137: 397-401. [ Links ]
18. Del Río BE, del Río JM, Berber A, Rosas MA, Sienra-Monge JJL. Asthma prevalence in children living in north Mexico City and comparison with other Latin America cities and world regions. Allergy Asthma Proc. 2006; 27: 334-40. [ Links ]
19. Del Río BE, del Río JM, Rosas MA, Sienra MJJL. Prevalencia de asma al norte de la ciudad de México. México: Archivos del Hospital Infantil de México, Tesis; 2004. [ Links ]
20. Del Río-Navarro B, et al. Prevalence of asthma in nine cities of Mexico in the ISAAC survey. Allergy. 2007; 62: S425-6. [ Links ]
21. Neffen H, Baena-Cagnani C. Asthma mortality in Latin America. ACI International. 1999; 11: 171-5. [ Links ]
22. Lemanske RF Jr, Busse WW. Asthma. J Allergy Clin Immunol. 2003; 111: S502-S19. [ Links ]
23. Busse WW, Lemanske RF Jr. Asthma. N Engl J Med. 2001; 344: 350-62. [ Links ]
24. Sengler C, Lau S, Whan U, Nickel R. Interactions between genes and environmental factors in asthma and atopy: New developments. Respir Res. 2002; 3: 1-15. [ Links ]
25. Warnes JJ. Prenatal sensitization in human. Pediatr Allergy Immunol. 2000; 13: S6-8. [ Links ]
26. Walley AJ, Bhattacharyya S, Leaves N. Linkage and allelic association of chromosome 5 microsatellites markers with atopic asthma phenotypes in general population sample. Am J Resp Crit Care Med. 1997; 155: A257. [ Links ]
27. Blanco QC. Genética de la alergia. Genes reguladores de la respuesta alérgica. Alergol Inmunol Clin. 2000; 15: 40-62. [ Links ]
28. Heinzman A, Deichmann. Genes for atopy and asthma. Curr Opin Allergy Clin Immunol. 2001; 1: 387-92. [ Links ]
29. Shore SA, Fredberg JJ. Obesity, smooth muscle, and air-way hyperresponsiveness. J Allergy Clin Immunol. 2005; 115: 925-7. [ Links ]
30. Huang SL, Shiao G, Chou P. Association between body mass index and allergy in teenage girls in Taiwan. Clin Exp Allergy. 1999; 29: 323-9. [ Links ]
31. Ibañez SL. Evolution of childhood asthma. Alergol Immunol Clin. 2000; 15: 53-8. [ Links ]
32. Rowe J, Macaubas C, Monger T, Holt BJ, Harvey J, Poolman JT, et al. Heterogeneity in diphtheriatetanusacellular vaccine-specific cellular immunity during infancy: relationship to variations in the kinetics of postnatal maturation of systemic Th 1 function. J Infect Dis. 2001; 184: 80-8. [ Links ]
33. Grüber CC, Meinlschmid GT, Bergmann R, Wahn U, Stark K. Is early BCG vaccination associated with less atopic disease? An epidemiologic study in German preschool children with different ethnic backgrounds. Pediatr Allergy Immunol. 2002; 13: 177-81. [ Links ]
34. Hopkin JM. The rise of atopy and links to infection. Allergy. 2002; 57: S5-9. [ Links ]
35. Sirgas N, Guastafsson PM, Jarnason B, Lundberg F, Schmidth S, et al. Severe respiratory syncitial virus broncholitis in infancy and asthma and allergy at age 1 3. Am J Respir Crit Care Med. 2005; 171: 137-41. [ Links ]
36. Johnston NW, Johnston SL, Duncan JM, Greene JM. The September epidemic asthma exacerbation in children: A search for etiology. J Allergy Clin Immunol. 2005; 115: 132-8. [ Links ]
37. Herz U, Lacy P, Renz H, Erb K. The influences of infections on the development and severity of allergic disorders. Current Opin Allergy Clin Immunol. 2000; 12: 632-4. [ Links ]
38. Hao M, Comier M, Wang M, Lee JJ, Nel A. Diesel exhaust particles exert acute effects on airway inflammation and function in murine allergen provocation models. J Allergy Clin Immunol. 2003; 112: 905-14. [ Links ]
39. Devouassoux G, Saxon A, Metcalfe DD, Prussin C, Colomb MG, Brambilla C, et al. Chemical constituents of diesel exhaust particles induces IL-4 production and histamine release by human basophils. J Allergy Clin Immunol. 2002; 109: 847-53. [ Links ]
40. Romieu I, Sienra J, Ramírez M, Moreno H, Reyes N, del Río B, et al. Genetic polymorphism of GSTM 1 and antioxidant supplementation influence lung function in relation to ozone exposure in asthmatic children in Mexico City. Thorax. 2004; 59: 8-10. [ Links ]
41. Chalmers GW, Macleod KJ, Little SA, Thomson LJ, McSharry CP, Thomson NC. Influence of cigarette smoking on inhaled corticosteroid treatment in mild asthma. Thorax. 2002; 57: 226-30. [ Links ]
42. Chaudhuri R, Livingston E, McMahon AD, Thomson L, Borland W, Thomson NC. Cigarette smoking impairs the therapeutic response to oral corticosteroids in chronic asthma. Am J Respir Crit Care Med. 2003; 168: 1308-11. [ Links ]
43. Dezateux C, Stocks J, Dundas I, Fletcher ME. Impaired airway function and wheezing in infancy: the influence of maternal smoking and a genetic predisposition to asthma. Am J Respir Crit Care Med. 1999; 159: 403-10. [ Links ]
44. Environmental tobacco smoke: A hazard to children. American Academy of Pediatrics Committee on Environmental Health. Pediatrics. 1997; 99: 639-42. [ Links ]
45. Wahn U, Lau S, Bergmann R, Kulig M, Forster J, Bergmann K, et al. Indoor allergen exposure is a risk factor for sensitization during the first three years of life. J Allergy Clin Immunol. 1997; 99: 763-9. [ Links ]
46. Sporik R, Holgate ST, Platts-Mills TA, Cogswell JJ. Exposure to house-dust mite allergen (Der p I) and the development of asthma in childhood. A prospective study. N Engl J Med. 1990; 323: 502-7. [ Links ]
47. Pearlman DS. Pathophysiology of the inflammatory response. J Allergy Clin Immunol. 1999; 104: S1 32-7. [ Links ]
48. Lemanske RF. Inflammatory events in asthma: An expanding equation. J Allergy Clin Immunol. 2000; 105: S633-6. [ Links ]
49. Prussin C, Metcalfe D. IgE, mast cell, basophils, and eosinophils. J Allergy Clin Immunol. 2003; 111: S486-94. [ Links ]
50. Boris L, Steinkes JW. Cytokines and chemokines. J Allergy Clin Immunol. 2003; 111: S460-75. [ Links ]
51. Rosenwasser LJ. New immunopharmacologic approaches to asthma: Role of cytokine antagonism. J Allergy Clin Immunol. 2000; 105: S586-92. [ Links ]
52. Barnes PJ, Chung KF, Page CP. Inflammatory mediators of asthma: An update. Pharmacol Rev. 1998; 50: 515-96. [ Links ]
53. Holgate ST, Davies DE, Lacke PM, Wilson SJ, Puddicombe SM, Lordan JL. Epithelial-mesenchymal interactions in the pathogenesis of asthma. J Allergy Clin Immunol. 2000; 105: 193-204. [ Links ]
54. Joos GF. The role of neuroeffector mechanisms in the pathogenesis of asthma. Curr Allergy Asthma Reports. 2001; 1: 134-43. [ Links ]
55. Phelan PD, Robertson CF, Olinsky A. The Melbourne Asthma Study: 1964-1999. J Allergy Clin Immunol. 2002; 109: 189-94. [ Links ]
56. Reed C. The natural history of asthma. J Allergy Clin Immunol. 2006; 118: 543-8. [ Links ]
57. Taussing L, Wright A, Holberg C, Jalonen M, Martinez F. Tucson Children's Respiratory Study: 1980 to present. J Allergy Clin Immunol. 2003; 111: 66 1 -75. [ Links ]
58. Martínez F, Godfrey S. Epidemiology of wheezing in infants and preschool children. En: Martínez F, Godfrey S, Dunitz M, editores. Wheezing disorders in the preschool child. New York: Tylosr and Francis Group; 2003. p. 1-19. [ Links ]
59. Castro-Rodriguez JA, Wright AL, Taussig LM. A clinical index to define risk of asthma in young children with recurrent wheezing. Am J Respir Crit Care Med. 2000; 162: 1403-6. [ Links ]
60. De Marco R, Pattaro C, Locatelli F, Svanes C, ECRHS Study Group. Influence of early life exposures on incidence and remission of asthma throughout life. J Allergy Clin Immunol. 2004; 1 13: 845-52. [ Links ]
61. ETAC Study Group. Allergic factors associated with the development of asthma and the influence of cetirizine in a double blind, randomized, placebo controlled trial: first results of ETAC. Early treatment of atopic child. Pediatr Allergy Immunol. 1999; 9: 1 16. [ Links ]
62. American Lung Association Medical Section: Standardization of spirometry: 1994 update. Am J Respir Crit Care Med. 1995; 152: 1107-14. [ Links ]
63. American Thoracic Society/European Respiratory Society: Respiratory function measurements in infants: measurement conditions. Am J Respir Crit Care Med. 1995; 152: 1 107. [ Links ]
64. Godfrey S, Springer C, Bar-Yishay E. Cut-off points de-fining normal and asthmatic bronchial reactivity to exercise and inhalation challenges in children and young adults. Eur Respir J. 1999; 14: 659. [ Links ]
65. Lemanske RF Jr, Busse WW. Asthma. J Allergy Clin Immunol. 2003; 111: S502-19. [ Links ]
66. National Heart, Blood and Lung Institute Expert Panel Report 2. Guidelines for the diagnosis and management of asthma: update on selected topics 2002. NIH publication No. 02-5074. 2002. [ Links ]
67. Lau S, Illi S, Sommerfeld C, Niggermann B. Early exposure to house dust mite and cat allergens and development of allergy in childhood a cohort study. Multicentric Allergy Study Group. Lancet. 2000; 356: 1 392-7. [ Links ]
68. Arruda LK, Vailes LD, Ferriani VPL, Santos ABR. Cockroach allergens and asthma. J Allergy Clin Immunol. 2001; 107: 419-28. [ Links ]
69. Wijnands LM, Deisz WDC, van Leusden FM. Marker antigens to asses exposure to moulds and their allergens. Aspergillus fumigatus. Allergy. 2000; 55: 65-8. [ Links ]
70. Gotzsche PC, Johanssen HK, Schmidt LM, Burr ML. House dust mite control measures for asthma. Cochrane data-base Syst Rev. 2004; 4: 357-69. [ Links ]
71. Conner WT, Dolovich MB, Frank RA. Reliable salbutamol administration from 6 to 36 month old children by means of a metereddose inhaler and aerochamber with facemask. Pediatr Pulmonol. 1989; 6: 263-71. [ Links ]
72. Becker AB, Simons FE. Formoterol, a new long-acting selective beta 2-adrenergic receptor agonist: double blind comparison with salbutamol and placebo in children with asthma. J Allergy Clin Immunol. 1989; 84: 891 -8. [ Links ]
73. Beakes DE. The use of anticholinergics in asthma. J Asthma. 1997; 34: 357-68. [ Links ]
74. Szefl SJ. Glucocorticoid therapy for asthma: clinical pharmacology. J Allergy Clin Immunol. 1991; 88: 147-56. [ Links ]
75. Bazzy-Asaad A. Departamento de Medicina Respiratoria Pediátrica, Universidad de Medicina Yale, Connecticut, EUA. Curren Opin Pediatr. 2001; 13: 523-7. [ Links ]
76. Bisgaard H, Allen D, Milanowski J. Twelve-month safety and efficacy of inhaled fluticasone propionate in children aged 1 to 3 years with recurrent wheezing. Pediatrics. 2004; 1 13: 87-95. [ Links ]
77. Bisgaard H, Gillies J, Groenewald M, Maden C. The effect of inhaled fluticasone propionate in the treatment of young asthmatic children. Am J Respir Crit Care Med. 1999; 160: 126-31. [ Links ]
78. Berger W. Ciclesonida: un novedoso corticosteroide inhalatorio para el tratamiento del asma persistente-perfil farmacológico y clínico. Therapy. 2005; 2: 167-78. [ Links ]
79. Barnes PJ, Pedersen S. Efficacy and safety of inhaled corticosteroids in asthma: report of a workshop held in Eze, France, October 1992. Am Rev Respir Dis. 1990; 148: 1-26. [ Links ]
80. Simons FE, Persaud MP, Gallespie CA, Cheang M, Shuc-kett EP. Absence of posterior subcapsular cataracts in young patients treated with inhaled glucocorticoids. Lancet. 1993; 324: 776-8. [ Links ]
81. Turpeinen M, Sorva R, Juntunen-Backman K. Changes in carbohydrate and lipid metabolism in children with asthma inhaling budesonide. J Allergy Clin Immunol. 1991; 88: 384-9. [ Links ]
82. Pawles R, Pedersen S, Busse W, Tan C, Chew YZ. Early intervention with budesonide in mild persistent asthma: A randomized, double-blind trial. Lancet. 2003; 361: 1071-6. [ Links ]
83. Price J, Russell G, Hindmarsh P, Weller P. Growth during one year of treatment with fluticasone propionate or sodium cromoglycate in children with asthma. Pediatr Pulmonol. 1997; 24: 78-186. [ Links ]
84. Silverstein M, Yunginger J, Reed C, Petterson T. Attained adult height after childhood asthma: Effect of glucocorticoid therapy. J Allergy Clin Immunol. 1997; 99: 466-74. [ Links ]
85. Agertoft L, Pedersen S. Effect of long term-treatment with inhaled budesonide on adult height in children with asthma. N Engl J Med. 2000; 343: 1064-9. [ Links ]
86. Pedersen S. State of the art. Do inhaled corticosteroid inhibit growth in children? Am J Respir Crit Care Med. 2001; 164: 521-35. [ Links ]
87. Sim D, Griffiths A, Armstrong D, Clarke C. Adrenal suppression from high dose inhaled fluticasone in children with asthma. Eur Respir J. 2003; 21: 633-6. [ Links ]
88. Milinarsky A, Fischer S, Giadrosich V, Lezana S, Torres MA. Efecto de dosis altas de budesonida y función suprarrenal de niños asmáticos severos. Rev Med Chile. 2006; 134: 60-4. [ Links ]
89. Patel L, Wales JK, Kibirige MS, Massarano AA, Couriel JM, Clayton PE. Symptomatic adrenal insufficiency during inhaled corticosteroid treatment. Arch Dis Child. 2001; 85: 330-4. [ Links ]
90. Agertoft L, Pedersen S. Bone mineral density in children with asthma receiving longterm treatment with inhaled budesonide. Am J Respir Crit Care Med. 1998; 157: 178-83. [ Links ]
91. Griffiths A, Sim D, Strauss B, Rodda C. Effect of high-dose fluticasone propionate on bone density and metabolism in children with asthma. Pediatr Pulmonol. 2004; 37: 116-21. [ Links ]
92. Hubbard R, Smith C, Smeeth L, Harrison T, Tattersfield A. Inhaled corticosteroids and hip fracture. A population-based case-control study. Am J Respir Crit Care Med. 2002; 166: 1563-6. [ Links ]
93. Suissa S, Baltzan M, Kremer R, Ernst P. Inhaled and nasal corticosteroid use and the risk of fracture. Am J Respir Crit Care Med. 2004; 169: 83-8. [ Links ]
94. Gelfand EW, Georgitis JW, Noonan M, Ruff ME. Once daily ciclesonide in children: efficacy and safety in asthma. J Pediatr. 2006; 148: 377-83. [ Links ]
95. Tasche MJ, Uijen JH, Bernsen RM. Inhaled disodium cro-moglycate (DSCG) as maintenance therapy in children with asthma: a systematic review. Thorax. 2000; 55: 913-20. [ Links ]
96. Bisgaard H, Zielen S, Garcia-Garcia ML. Montelukast reduces asthma exacerbations in 2 to 5 year old children with intermittent asthma. Am J Respir Crit Care Med. 2005; 171: 315-22. [ Links ]
97. Phipatanakul W, Greene C, Downes SJ. Montelukast improves asthma control is asthmatic children maintained on inhaled corticosteroids. Ann Allergy Asthma Immunol. 2003; 91: 49. [ Links ]
98. Abramson MJ, Puy RM, Weiner JM. Allergen immuno-therapy for asthma. Cochrane Database Syst Rev. 2003: CD001 186. [ Links ]














