Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.65 no.5 México sep./oct. 2008
Artículo original
Reacciones adversas asociadas a la vacunación con bacilo de Calmette y Guérin en una población infantil de la ciudad de Zacatecas, México
Adverse reactions in association with Bacillus Calmette–Guerin immunization in Mexican children
Juan Manuel Ortiz–Trejo1, Marisela Guerrero–González2, Manuel Presno–Bernal2, Cosme Alvarado–Esquivel3, Alejandro Torres–Valenzuela3
1 Unidad de Medicina Familiar No. 1
2 Hospital General de Zona No. 1, Instituto Mexicano del Seguro Social, Zacatecas, Zacatecas
3 Facultad de Medicina, Universidad Juárez del Estado de Durango, Durango, México
Solicitud de sobretiros:
Dr. Juan Manuel Ortiz Trejo
Unidad de Medicina Familiar No. 1 IMSS,
Zacatecas. Av. Universidad No. 102,
Col. del Patrocinio, C.P. 98600, Zacatecas, Zac., México.
Fecha de recepción: 19–05–2008.
Fecha de aprobación: 30–07–2008.
Resumen
Introducción. La vacuna BCG (bacilo de Calmette y Guérin) previene formas graves de tuberculosis, los efectos adversos son poco frecuentes: abscesos locales, linfadenopatías, lesiones músculo–esqueléticas y enfermedad diseminada; manifestándose meses posteriores y persistiendo varias semanas, asociados con la técnica de aplicación, dosis, edad del niño y estados de inmuno–supresión.
Métodos. Mediante un estudio retrospectivo, se evaluó la frecuencia de manifestaciones clínicas secundarias a BCG en niños atendidos durante el período de 8 años y 5 meses en una clínica pública de la ciudad de Zacatecas, México. Además, se determinaron las características demográficas, clínicas, perinatales y antropométricas.
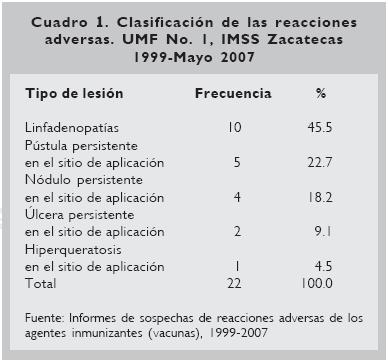
Resultados. Se identificaron 22 casos, con una frecuencia de eventos adversos de 1.47 x 10–3 (intervalo de confianza de 95% [IC95%): 0.8, 2.1 x 0–3); 12 fueron del sexo masculino. La manifestación más común fue linfadenopatía (10 casos), seguido por pústula persistente (5), nódulo persistente (4) y úlcera (2 casos), en 4 casos se identificaron factores de inmunosupresión.
Conclusiones. La prevalencia de reacciones secundarias es baja, no hubo asociación con sexo, peso y talla al nacimiento, ni con antecedentes maternos. La mayor frecuencia fue de linfadenopatías (IC95%: 22.4, 68.5%). La secuela postratamiento más importante fue la hiperqueratosis. Se observaron bajos eventos adversos, y cuando éstos se presentaron fueron bien resueltos, médica y quirúrgicamente, sin secuelas de importancia.
Palabras clave: Reacciones adversas; inmunización; BCG.
Abstract
Introduction. The vaccine BCG (bacillus Calmette and Guerin) prevents severe forms of tuberculosis. Adverse effects are rare and such as local abscesses, lymphadenopathy, skeletal muscle injury and disseminated disease; they usually occur months later and persist for several weeks. Adverse effects are related to technical implementation, doses, age and state of immunosuppression.
Methods. A retrospective study assessed the frequency of clinical manifestations secondary to BCG, in children attended over 5 years and 8 months in a government clinic in the city of Zacatecas, Mexico. Demographic, clinical, perinatal, and anthropometric characteristics were determined.
Results. Twenty–two cases were identified with an adverse event frequency of 1.47 x 10–3 (IC95%: 0.8, 2.1 x 10–3), 12 male/ 10 female children. The most frequent event was lymphadenopathy (10 cases), followed by persistent pustules (5), persistent nodule (4) and ulcer (2 cases). Immunosuppression was identified in 4 cases.
Conclusions. The prevalence of adverse effects is low. There was no association with sex, height or weight at birth, neither with maternal background. The most frequent event was lymphadenopathy (IC95%: 22.4). Hyperkeratosis was the most important post–treatment sequela. BCG is a vaccine with few adverse events; they are clinically well resolved with no important sequelae.
Key words: Adverse effects; immunization; BCG vaccine.
Introducción
La vacunación con BCG (bacilo de Calmette y Guérin) es recomendable para reducir el riesgo de meningitis tuberculosa y la forma diseminada (miliar) de tuberculosis; según estudios en recién nacidos y menores de un año, tiene un efecto protector de 0.83 (intervalo de confianza de 95% [IC95%]: 0.58 a 0.93), con evidencias de eficacia a través de 10 años.1
En algunos países desarrollados, donde el riesgo de contraer la tuberculosis es bajo; en lugar de utilizar la vacuna como estrategia de control rutinario, se da prioridad a la detección de personas con la enfermedad activa y la infección latente.2,3 El peligro del daño a los recién nacidos secundario a la vacunación con BCG, se considera mayor que el riesgo de la enfermedad.4
En aquellos países donde la frecuencia de la enfermedad es alta, la Organización Mundial de la Salud recomienda se administre una dosis única de BCG lo antes posible después del nacimiento, con protección máxima cuando se administra antes de un año de edad.5
La vacuna puede provocar reacciones adversas, con una frecuencia y riesgos dependientes de las condiciones en las que se aplique la vacuna y el lugar donde se estudien.6–9 Las diferentes presentaciones de la vacuna que existen en el mercado, no tienen diferencias estadísticas en su eficacia cuando se aplican a recién nacidos; la incidencia de reacciones adversas y la seguridad de las cepas fuertes o débiles muestran correlación. Sin embargo, parecen estar más relacionados con los errores en la inoculación o aplicación de segundas dosis.10–12 La evolución de las lesiones vacunales es tórpida e indolora, y la recomendación general es que no se debe interferir en su proceso; sólo es conveniente mantener la limpieza de la región.13–15
Las reacciones indeseables pueden ser locales, regionales o generales. Están asociadas a la edad del niño, dosis aplicada, vía y técnica de administración, cepa utilizada, enfermedades concomitantes y los requisitos del laboratorio productor sobre reconstitución y administración.16–19
De las reacciones indeseables más frecuentes, documentadas en otros países, son las úlceras grandes o persistentes, abscesos locales, linfadenitis supurada como no supurada,20,21 osteomielitis, artritis y otras complicaciones óseas,22 cicatriz queloide y lupus vulgaris.23 La vacunación está contraindicada en niños con trastornos inmunológicos, como es el caso de niños recién nacidos gravemente comprometidos portadores del síndrome de inmunodeficiencia adquirida,24,25 niños y niñas en tratamiento con medicamentos inmunosupresores (corticosteroides, antimetabolitos, agentes alquilantes o radiaciones), en recién nacidos con peso inferior a 2 000 g, desnutrición avanzada, procesos febriles y otras enfermedades anergizantes.26–28
De primera intención, usualmente el manejo de las reacciones adversas es con tratamiento conservador.29 La cirugía previene complicaciones y reduce el tiempo de curación;30 sin embargo, el manejo es controversial.31,32
Con el objetivo de evaluar la frecuencia de eventos adversos asociados a la vacunación con BCG en nuestro medio, se realizó un estudio de casos en forma retrospectiva, determinando la incidencia, tipo de efectos indeseables y manejo de cada caso, integrado en el programa de fármaco–vigilancia en un primer nivel de atención médica de una población urbana de una provincia de la República Mexicana.
Métodos
En el período comprendido de 1999 a mayo de 2007, en el Departamento de Medicina Preventiva de la Unidad de Medicina Familiar No. 1, y en los servicios de Cirugía Pediátrica y Anatomopatología del Hospital General de Zona No. 1 del Instituto Mexicano del Seguro Social (IMSS) en la ciudad de Zacatecas, México, se identificaron antecedentes sobre los niños con eventos adversos posteriores a la aplicación de la vacuna contra la tuberculosis con BCG.
De cada uno de los casos, se identificaron antecedentes perinatales, peso y talla al nacimiento, sexo, fecha de aplicación de la vacuna, tipo de vacuna, intervalo de tiempo entre la aplicación de la vacuna y la aparición de lesiones sugestivas del evento indeseable, cuadro clínico, tiempo transcurrido desde la aplicación del biológico y alta por curación.
En los casos que se practicó desbridación quirúrgica, las muestras anatómicas fueron enviadas al Departamento de Anatomopatología para caracterizar las lesiones y con la técnica de Ziehl–Neelsen demostrar bacilos ácido alcohol–resistentes.
La información se procesó en el paquete estadístico SPSS, calculando frecuencias simples, porcentajes y tasas por 1 000 nacidos vivos en el período estudiado, se estimaron IC al 95%, mismo nivel utilizado para las diferencias de medias y de proporciones.
Resultados
En el Hospital General de Zona No.1 de la Delegación Zacatecas, México, del IMSS, durante el período correspondiente del año 1999 al mes de mayo de 2007, se registraron 31 055 nacimientos; 14 906 niños nacidos en el período de estudio (48%) están adscritos a la Unidad de Medicina Familiar No.1, ubicada en el área urbana de mayor densidad poblacional, donde se tiene una cobertura de vacunación con este biológico de 99.9% en menores de un año de edad.
Durante ocho años y cinco meses, se identificaron 22 niños con efectos indeseables asociadas a la vacunación contra la tuberculosis con BCG; lo que da una frecuencia de presentación de efectos adversos de 1.47 x 10–3 (IC95%: 0.8, 2.1 x 10–3) niños (Cuadro 1).
Habitualmente, la madre del niño fue quien señaló que la aplicación de la vacuna no evolucionaba hacia la cicatrización, persistiendo con algunas de las reacciones previamente informadas por la vacunadora como normales.
De los casos identificados, 12 fueron del sexo masculino, no existió diferencia estadística (P =0.7630) con el sexo femenino; el peso al nacimiento promedio ± desviación estándar (DE) fue de 3 058 ± 439.4 g (IC95%: 2 863.2, 3 252.8 g); el valor mínimo fue de 2 300 g y el máximo fue de 4 075 g (el único con alto peso al nacer). La talla al nacimiento en promedio ± DE fue de 49.80 ± 3.9 cm (IC95%: 48.1, 51.5 cm); el único niño con talla baja coincidió con el valor mínimo de 42 cm y el valor máximo fue de 57 cm.
Con relación a los antecedentes perinatales referidos, en 15 casos no existieron antecedentes de importancia, en dos se utilizó dexametasona antes del parto por inmadurez pulmonar, en un caso la mamá, durante la gestación, ingirió prednisona apartirdelos16 años de edad para el control de lupus eritematoso sistémico, un paciente presentaba múltiples malformaciones congénitas, otro con antecedente de amenaza de aborto a los tres meses, con tratamiento a base de reposo, sin más complicaciones durante el resto de la gestación, uno de los casos fue producto de parto prolongado con neumonía in utero, otro con antecedente de amenaza de parto prematuro manejándose con reposo.
El intervalo de tiempo transcurrido entre la aplicación de la vacuna y la identificación, por los padres, de las lesiones persistentes fue en promedio ± DE de 48 ± 30 (IC95%: 34.7, 61.2) días, siendo el mínimo de 12 días y el máximo de 120 días. El tiempo entre la identificación de la lesión y la primer consulta médica fue en promedio a los 137 (DE 152) días, el límite fue de 35 hasta 630 días; la mediana fue de 77 días.
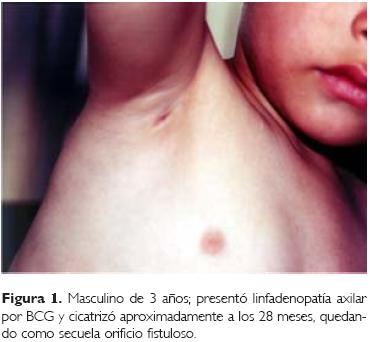
Las reacciones adversas más frecuentes fueron las linfadenopatías (n =10) (IC95%: 22.4), la localización anatómica de cinco de ellas fue en la región axilar, dos de las cuales estuvieron complicadas con adenitis supurada; es importante resaltar que una de ellas fue de un niño con una evolución prolongada, ya que fue captado con la incidencia a la edad de 15 meses, no tenía antecedentes de importancia con relación a las contraindicaciones del biológico, el tamaño de la tumoración axilar fue de aproximadamente 1.5 x 2.0 cm, el tratamiento inicial fue conservador, pero al presentar anorexia y adelgazamiento se le dio tratamiento con rifampicina (15 mg/kg de peso/ día), durante el período en tratamiento el nódulo presentó escrofulosis, iniciando la cicatrización y dejando un orificio fistuloso, tardando 28 meses (840 días) hasta su resolución (Fig. 1); el segundo captado a los 96 días de edad se le dio tratamiento conservador, observando un orificio fistuloso y cicatrizando en un período similar al primero.
Debido al crecimiento progresivo y la presencia de síntomas generales de cuatro casos, se optó por la intervención quirúrgica, con la que se resolvió la complicación a los 116, 124, 197 y 270 días posteriores a la aplicación de la vacuna, respectivamente. Al aplicar el criterio quirúrgico, se evidenció la reducción del tiempo de evolución sin secuelas de cada uno de los casos, mencionándose a continuación las características y el comportamiento correspondiente:
Caso 1. Fue una paciente del sexo femenino, que a los 86 días de aplicada la vacuna se le detectó linfadenopatía axilar de crecimiento paulatino, a la edad de 9 meses, en los estudios de rayos X de la región, presentaba imagen de bordes irregulares con ecogenicidad heterogénea por calcificación de 2.6 x 2.0 cm; el reporte histopatológico fue de masa de 1.5 x 2.0 cm con proceso inflamatorio crónico granulomatoso, con calcificación distrófica. La curación con la intervención quirúrgica fue en 116 días.
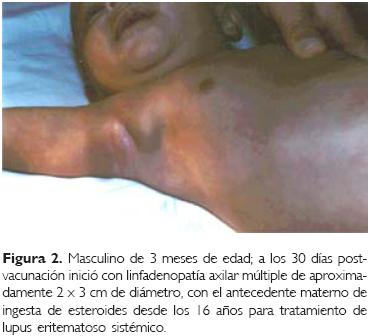
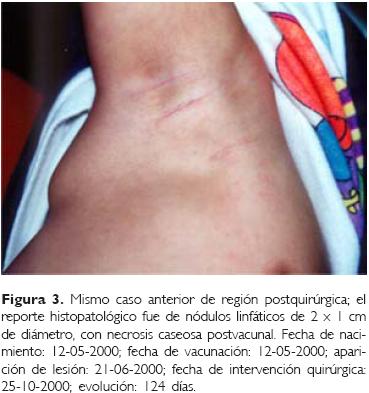
Caso 2. Se trató de un infante masculino de tres meses de edad (Fig. 2) que contaba con el antecedente materno de ingesta de esteroides desde los 16 años de edad para tratamiento de lupus eritematoso sistémico; a los 30 días de la vacunación inició con linfadenopatía axilar múltiple de aproximadamente 2.0 x 3.0 cm, el reporte histopatológico fue de nódulos linfáticos múltiples de 1.0 x 2.0 cm, con necrosis caseosa postvacunal; la resolución postquirúrgica siguió el mismo curso del caso anterior (Fig. 3) y la complicación se resolvió a los 124 días.
Caso 3. En el caso resuelto a los 197 días el diagnóstico histopatológico reportó la presencia de dos nódulos axilares múltiples, el mayor de 1.4 x 1.0 x 1.0 cm, su superficie era lisa amarilla–rosada, al corte café–rojizo, con zonas nodulares blanquecinas de aspecto caseoso, el análisis microscópico mostró proceso granulomatoso crónico y células gigantes multinucleadas de tipo Langhans, la técnica de Ziehl–Neelsen fue positiva; a la edad de ocho meses persistía con hiperqueratosis en el sitio de aplicación de la vacuna, tratado con isoniazida a dosis de 10 mg/kg/día, cicatrizando a los 45 días.
Caso 4. Masculino sin contraindicaciones a la aplicación de BCG, a las dos semanas presentó nódulo en el sitio de aplicación de la vacuna, al mes éste drenó exudado purulento; bajo manejo conservador persistió el efecto indeseable durante cinco meses, desarrollando linfadenopatía única de aproximadamente 1.0 x 1.0 cm en región supraclavicular derecha, en forma concomitante presentó baja de peso, anorexia y síntomas generales. Se optó por tratamiento quirúrgico y administración de rifampicina vía oral, resolviéndose la complicación a los 270 días.
De las adenopatías satélites, dos se presentaron en la región supraclavicular derecha, una en región retroauricular derecha y una más que presentaba lesión pustulosa en el sitio de la vacuna, con linfadenopatía contralateral en el cuello, todas involucionaron paulatinamente a la curación, excepto los que presentaron hiperqueratosis (lesión no observada en años previos), vacunados con la cepa Hong Kong® sometidos a tratamiento con rifampicina combinado con isoniacida por presentar edema local, baja de peso y síntomas generales; uno de estos niños con linfadenopatía axilar, sometido a desbridación, persistió con hiperqueratosis por 46 días más.
Discusión
En México, como actividad del Programa Nacional de Control de la Tuberculosis, la aplicación de BCG se administra en las primeras horas del nacimiento,26 esta actividad universal, frecuentemente omite cuestionar sobre las posibles contraindicaciones y, por ser una actividad de rutina, reincidentemente se excluyen procedimientos según los manuales con relación a las precauciones sobre el uso del biológico y el hecho de proporcionar información sobre la evolución de la lesión vacunal.14,15
Es posible que la información que se esté brindando a los padres sobre la aparición de eventos adversos, no sea lo suficientemente efectiva, ya que 50% de los padres tardaron más de dos meses y medio en llevar a su hijo a consulta médica por la presencia de eventos adversos.
Toda aplicación de medidas farmacológicas curativas y preventivas lleva la probabilidad de producir eventos adversos, que en la experiencia documentada de los 14 906 niños registrados, sólo 22 presentaron un evento adverso, lo que se estima que, en las condiciones de Unidades de Medicina Familiar con características similares a donde se realizó el trabajo, puede presentarse en 8 a 21 niños por cada 10 000 niños vacunados.
En este evento preventivo, lo esperado de la reacción es la evolución espontánea hacia la cicatrización, teniendo como evidencia diagnóstica del evento adverso el antecedente de la aplicación de la vacuna registrada en la Cartilla Nacional de Vacunación y la relación existente con la respuesta inmunológica celular mediada por linfocitos, que al no tener un efecto local, la diseminación en los tejidos adyacentes generalmente se caracteriza por linfadenitis;20,21 donde la estimación, deacuerdo a nuestros resultados, puede ser desde 22.4 hasta 68.5% dentro de los eventos adversos. Sin embargo, por ser un evento crónico, resulta interesante preguntar cuántos de los niños que se detectan con tuberculosis ganglionar son infecciones latentes por BCG,33 y cuántos de ellos son causadas por inhalación de material infectante o ingestión de leche contaminada.
El problema causa inquietud en los padres de los niños y trabajadores de la salud, con la necesidad de manejar la situación con información adecuada, destacando el hecho de que a pesar de no conocer con seguridad la eficacia de la vacuna y el tiempo real de protección, sí se sabe que se cuenta con una vacuna con posibilidades de evitar formas diseminadas,1 por lo que es mayor el beneficio en nuestro medio que los posibles efectos adversos que se pudieran tener.5 Es indudable que se requiere de una mejor vacuna, con el propósito de garantizar un beneficio claro y sin riesgos de efectos adversos.34 El tratamiento quirúrgico en las linfadenopatías es una opción de manejo que acorta la evolución y evita complicaciones crónicas como la fistulización.31
En los casos de niños con linfadenopatías, donde por la edad avanzada no se piensa en un efecto adverso a la vacunación con BCG, la extirpación quirúrgica es obligada para identificar la etiología35 y descartar problemas oncológicos. Sobre la utilización de fármacos, no se encuentran evidencias que modifiquen la historia natural del efecto adverso, sin embargo, cuando se determina un tratamiento quirúrgico por el mal estado general y la baja de peso, es necesario valorar la utilización de antifímicos a las dosis convencionales.36,37
Es claro que, de acuerdo a nuestra experiencia, la resolución quirúrgica es eficiente y permite el control total del problema, quedando en el peor de los casos con hiperqueratosis; sin embargo, la prevención que ofrece la vacuna es por demás muy superior a la probabilidad de eventos adversos y de sus secuelas, por lo que el uso de ella es altamente recomendable, sin embargo, es necesario seguir buscando vacunas que originen un menor porcentaje de eventos adversos y además seguir investigando factores asociados a éstos con el fin de evitarlos. En este estudio no se pudieron encontrar asociaciones a factores tales como el bajo peso o baja talla al nacer, o la presencia de baja actividad inmunológica de los niños. Sólo una tercera parte de las mamás de los niños tuvieron antecedentes prenatales de importancia, los cuales fueron variados, y son factores que debieron haber tenido muchas madres de niños que no presentaron esos eventos adversos, sin embargo, esto no se pudo corroborar debido al tipo de estudio empleado.
De primera intención, ante cualquier evento adverso asociado a vacunación, es necesario la identificación de antecedentes relacionados a las indicaciones y contraindicaciones de la vacuna, con el objetivo de identificar los posibles factores que desencadenaron el efecto indeseable de cada uno de los casos en particular; de esta manera se estará en condiciones de optar por establecer un manejo conservador, uso de fármacos, la intervención quirúrgica o la combinación, no existiendo en nuestro medio un manejo estandarizado de las mismas, tal como se aplica en el tratamiento de la tuberculosis estrictamente supervisado.36
Como conclusiones podemos mencionar que la incidencia de eventos adversos fue baja: 1.47 x 10–3 (IC95%: 0.8, 2.1 x 10–3) niños; no se encontraron factores asociados tales como: sexo, peso al nacer, talla al nacer, o antecedentes perinatales de importancia. El intervalo de tiempo transcurrido entre la aplicación de la vacuna y la identificación del evento adverso por los padres varió de 34.7 a 61.3 días. Las linfadenopatías fueron las reacciones adversas más frecuentes, presentándose de 22.4 a 68.5%, dentro del total de los eventos adversos. El tratamiento óptimo, si se considera necesario, es quirúrgico, observándose un buen resultado. Se propone el siguiente algoritmo (Fig. 4) para el manejo de los eventos temporalmente asociados a la vacunación y complicaciones más frecuentes en sus formas no graves y graves.37
Referencias
1. Colditz GA, Berkey CS, Mosteller F, Brewer TF, Wilson ME, Burdick E, et al. The efficacy of bacillus Calmette–Guerin vaccination of newborns and infants in the prevention of tuberculosis: meta–analyses of the published literature. Pediatrics. 1995; 96: 29–35. [ Links ]
2. ACIP. Use of BCG vaccines in the control of tuberculosis: A joint statement by the ACIP and the Advisory Committee for Elimination of Tuberculosis. MMWR Morb Mortal Wkly Rep. 1988; 37: 664–75. [ Links ]
3. Starke JR, Dooley SW. The role of BCG vaccine in the prevention and control of tuberculosis in the United States: A joint statement by the Advisory Council for the Elimination of Tuberculosis and the Advisory Committee on Immunization Practices. Public Health Service. CDC. 1995; 1–22. [ Links ]
4. Hengster P, Schnapka J, File M, Menardi G. Occurrence of suppurative lymphadenitis after a change of BCG vaccine. Arch Dis Child. 1992; 67: 952–5. [ Links ]
5. Fine PEM, Carneiro IAM, Milstien JB, Clements CJ. Issues relating to the use of BCG in immunization programmes. World Health Organ. 1999; 77: 5–12. [ Links ]
6. Turnbull FM, McIntyre PB, Achat HM, Wang H, Stapledon R, Gold M, et al. National study of averse reactions after vaccination with bacille Calmette–Guerin. Clin Infect Dis. 2002; 34: 447–53. [ Links ]
7. El Ouazzani H, Lamsyah H, Alioua Z, Rhorfi I, Rguibi M, Ghfir M, et al. Adverse effects of BCG revaccination: 12 cases. Ann Dermatol Venereol. 2007; 134: 129–32. [ Links ]
8. Awad R. BCG vaccine and post–BCG complications among infants in Gaza Strip. Health J .2001; 7:211–20. [ Links ]
9. Bellet JS, Prose NS. Skin complications of bacillus Calmette–Guerin immunization. Clin Infect Dis. 2005; 18: 97–100. [ Links ]
10. Milstien JB, Gibson JJ. Quality control of BCG vaccine by World Health Organization: A review of factors that may influence vaccine effectiveness and safety. Bull World Health Organ. 1990; 68: 93–108. [ Links ]
11. Dourado I, Ríos MH, Pereira SM, Cunha SS, Ichihara MY, Goes JCL, et al. Rates of adverse reactions to first and second doses of BCG vaccination: results of a large community trial in Brazilian schoolchildren. Int J Tuberc Lung Dis. 2003; 7: 399–402. [ Links ]
12. Ferrerira AA, Ferreira MC, Macedo EA, Cunha I, Santos SL, Reis AR, et al. BCG revaccination in school, children: Evolution of the lesion at the vaccination site between 48 hours and 10 weeks. J Pediatr (Rio J). 2002; 74: 289–94. [ Links ]
13. Centers for Disease Control. Update on adults immunization. Recommendations of the Immunization Practices Advisory Committee (ACIP). MMWR Morb Mortal Wkly Rep. 1991; 40: 45–6. [ Links ]
14. Consejo Nacional de Vacunación. Manual de procedimientos técnicos de vacunación. Programa de Vacunación Universal. México, DF: CONAVA; 2005. [ Links ]
15. Pacheco CR, Vázquez–Rinza V, Badillo N. Vacuna del bacilo de Calmette y Guérin (BCG). En: Escobar–Gutiérrez A, Valdespino–Gómez JL, Sepúlveda–Amor J, editores. Vacunas, ciencia y salud. México, D. F.: Secretaría de Salud; 1992. p. 187–201. [ Links ]
16. Gross S, Kahan E, Vesterman L, Havkin O, Leventhal A. Adverse reactions to accidental forearm injection of bacille Calmette–Guerin vaccine in school children: 12–month cohort follow–up. Clin Infect Dis. 2004; 38: 1495–7. [ Links ]
17. Teulieres L, Diouf MA, Chaud P, Saint–Cyr A, Saliou P. Comparative trial of administration of half (0.05 mg) and quarter (0.025 mg) dose of intradermal Pasteur BCG on 291 infants from birth to 1 year French Guyana.Vaccine. 1991; 9: 521–4. [ Links ]
18. Bricks LF. Percutaneous or intradermal BCG vaccine. J Pediatr (Rio J). 2004; 80: 93–8. [ Links ]
19. Moss WJ, Clements CJ, Halsey NA. Immunization of children at risk of infection with human immunodeficiency virus. World Health Organ. 2003; 81: 61–70. [ Links ]
20. Praveen KN, Smikle MF, Prabhakar P, Pande D, Johonson B, Ashley D. Outbreak of bacillus Calmette–Guerin–associated lymphadenitis and abscesses in Jamaican children. Pediatr Infect Dis. 1990; 9: 890–3. [ Links ]
21. Goraya JS, Virdi VS. Bacille Calmette–Guerin lymphadenitis. Postgrad Med J. 2002; 78: 327–9. [ Links ]
22. Khotaei GT, Sedighipour L, Fattahi F, Pourpak Z. Osteomyelitis as a late complication of bacille Calmette–Guerin vaccination. J Microbiol Immunol Infect. 2006; 39: 169–72. [ Links ]
23. Wozniacka A, Schwarts RA, Jedrzejowska AS, Borun M, Arkuszewska C. Lupus vulgaris: report of two cases. Intern J Dermatol. 2005; 44: 299–301. [ Links ]
24. Antaya RJ, Gardner ES, Bettencourt MS, Dianes M, Yamo D, Uthaisangsook S, et al. Cutaneous complications of BCG vaccination in infants with immune disorders: Two cases and a review of the literature. Pediatr Dermatol. 2001; 18: 205–9. [ Links ]
25. Recommendations of the Advisory Committee on Immunization Practice (ACIP): Use of vaccines and immune globulins for persons with altered immunocompetence. MMWR Morb Mortal Wkly Rep. 1993; 42:1–18. [ Links ]
26. López–Antuñano FJ. Usos y efectos del bacilo Mycobacterium bovis Calmette – Guérin (vacunación con BCG). Salud Publica Mex. 1997; 39: 156–61. [ Links ]
27. Thayyil–Sudhan S, Kumar A, Singh M, Paul VK, Deorari AK. Safety and effectiveness of BCG vaccination in preterm babies. Arch Dis Child Fetal Neonatal Ed. 1999; 81: 64–6. [ Links ]
28. Tavares EC, Ribeiro JG, Oliveira LA. Active and passive immunization in the extremely preterm infant. J Pediatr (Rio J). 2005; 81: 89–94. [ Links ]
29. Fitz–Gerald JM. Management of adverse reaction to bacille Calmette–Guerin vaccine. Clin Infect Dis. 2000; 3 1: 75–6. [ Links ]
30. Hengster P, Solder B, Fille M, Menardi G. Surgical treatment of bacillus Calmette–Guerin lymphadenitis. World J Surg. 1997; 21: 520–3. [ Links ]
31. Goraya JS, Virdi VS. Treatment of Calmette–Guerin bacillus adenitis: A meta–analysis. Pediatr Infect Dis. 2001; 20: 632–4. [ Links ]
32. Nazir Z, Qazi SH. Bacillus Calmette–Guerin (BCG) lymphadenitis–changing trends and management. J Ayub Med Coll Abbottabad. 2005; 17:16–8. [ Links ]
33. Kashino SS, Ovendale P, Izzo A, Campos–Neto A. Unique model of dormant infection for tuberculosis vaccine development. Clin Vaccine Immunol. 2006; 13: 1014–21. [ Links ]
34. Ginsberg AM. What's new in tuberculosis vaccines? Bull World Health Organ. 2002; 80: 1–12. [ Links ]
35. Hacimustafaoglu M, Okan M, Yerci O, Gedikoglu S, Kristioglu I, Ildirim I. Generalized BCG lymphadenitis in an infant: diagnostic dilemma lepromatous leprosy and Gaucher disease on needle aspiration. Trop J Med Sci. 1999; 29: 285–9. [ Links ]
36. Norma Oficial Mexicana. NOM–006–SSA2–I993. Para la prevención y control de la tuberculosis en la atención primaria a la salud. México; 2005. [ Links ]
37. Secretaría de Salud. Guía práctica para la atención de la Tuberculosis en niños, niñas y adolescentes. Programa Nacional de Tuberculosis ISBN 970–721–334–5; 2007: 30–7. [ Links ]














